Method Article
FSL Construye: Un método simple para la modificación de células / virión superficies con una serie de marcadores biológicos sin afectar su viabilidad
En este artículo
Resumen
Función de los lípidos-Spacer (FSL) construye permiten las características superficiales de las células vivas y los viriones que ser modificado sin la pérdida de vitalidad. El método requiere un contacto sólo una solución simple de construir una célula con FSL / virión y la incorporación de la superficie se produce espontánea y estable.
Resumen
La capacidad de modificar / visualizar superficies biológicas, y luego estudiar la célula modificada / virión en una serie de in vitro e in vivo en los entornos es esencial para ganar una mayor comprensión de la función de moléculas específicas o toda la entidad. Los estudios de modificación de la superficie biológica se limitan generalmente a la ingeniería genética del organismo o la unión covalente de grupos químicos a los 1,2 de la superficie celular. Sin embargo, estas técnicas tradicionales de exponer las células a los reactivos químicos, o que requieren la manipulación importantes para lograr el resultado deseado, por lo que engorroso, y también pueden inadvertidamente afectar la viabilidad / funcionalidad de la célula modificada. Un método simple de modificar sin causar daño de la superficie de las células es necesaria.
Recientemente una nueva tecnología, tecnología KODE ha introducido una serie de nuevas construcciones que consta de tres componentes: un grupo de cabeza funcionales (F), un espaciador (S) y una cola de lípidos (L) y que se conoce como función-espaciador-lípidos o FSL constructs3. El separador (S) es seleccionada para proporcionar una estructura que se dispersa en el agua, sin embargo, se espontáneamente y de forma estable incorporar en una membrana.
FSL construir mitades funcionales (F) hasta ahora incluyen una gama de sacáridos incluyendo los grupos sanguíneos con factores determinantes relacionados, ácido siálico, los polisacáridos de ácido hialurónico, fluoróforos, biotina, radioactivas, y una serie de péptidos 3-12. Construye FSL se han utilizado en la modificación de los embriones, espermatozoides, el pez cebra, las células epiteliales / endometrial, las células rojas de la sangre, y los viriones para crear controles de calidad y sistemas de paneles de diagnóstico, para modificar la adhesión celular / interacción / separación / inmovilización, y para in vitro e in imágenes in vivo de células / viriones 12.03.
El proceso de modificación de las células / viriones es genérico y extremadamente simple. El procedimiento más común es la incubación de las células (lípidos en medios de comunicación libres) con una solución de FSL construye durante 1-2 horas a 37 ° C 4.10. Durante la incubación de la FSL construye espontáneamente incorporar en la membrana, y se completa el proceso. El lavado es opcional. Células modificadas por las construcciones que se conoce como FSL kodecytes 6-9, mientras que los viriones son kodevirions 10.
FSL construye como infusiones directas y kodecytes / kodevirions se han utilizado en modelos animales experimentales 7,8,10. Todos los kodecytes / kodevirions parecen conservar su vitalidad normal y funcionalidad a la vez ganando la nueva función de la fracción F 7,8,10,11.
La combinación de la dispersión en los medios de comunicación biocompatible, la incorporación espontánea en las membranas celulares, y baja toxicidad aparente, hace FSL construcciones valiosas herramientas de investigación para el estudio de las células y los viriones.
Protocolo
El siguiente protocolo describe el procedimiento genérico para la inserción de las construcciones de FSL (Figura 1) en las membranas biológicas. Para simplificar el protocolo sólo hace referencia a las células (kodecytes), que se encuentran en una concentración del 100%. Sin embargo, las células término es intercambiable con los viriones (kodevirions) o de los organismos o estructuras celulares y su concentración en el diluyente no es importante, siempre que sea siempre coherente entre las pruebas, controles, y los experimentos. Con los glóbulos rojos el hematocrito es típicamente 80%, pero con viriones, los embriones y otras células que normalmente es menos del 1%. El método es muy robusto y se producen las membranas modificadas cuando es utilizado por cualquiera de sus variantes, pero el refinamiento se requieren para optimizar y estandarizar el grado de modificación requerida para aplicaciones específicas.
1. Preparación de la FSL Construye
- Para preparar la FSL acciones construcción reconstituir la primera solución del producto seco FSL (Tabla 1) con la adición de 1.0 mL de diluyente (o como se especifica en el prospecto del producto) para el vial del producto. En pocas palabras ultrasonidos (30 segundos). Esto permitirá preparar una solución de 1mg/ml, que puede ser alícuotas en 100 contenedores estériles l y se almacena a 2-8 ° C durante un máximo de una semana, o congelar hasta por 3 meses.
- Para preparar el trabajo FSL construir soluciones para la inserción, justo antes de usar brevemente ultrasonidos (30 segundos) la solución de reserva para homogeneizar cualquier micelas. Diluir la construcción de FSL en tampón (preferentemente que no contengan lípidos o material altamente hidrofóbicas) a la concentración requerida o en un rango si se desea.
Notas:
- FSL construye por lo general se inserta en las células que contienen lípidos en los medios de comunicación, pero por lo general se requieren hasta 50 veces mayores concentraciones FSL de trabajo que si en PBS u otro medio libre de lípidos.
- Las diluciones área de trabajo dependerá de la aplicación, la sensibilidad de detección del método, el tipo de construcción de FSL, y el grado de modificación requerida. Normalmente, el rango de dilución será de entre 10 a 500 mg de FSL por ml de diluyente para los hidratos de carbono construye FSL y 100-100 mg / ml para otras construcciones de FSL como fluoróforos y biotina.
- Si la preparación de diluyentes de inserción que contiene múltiples construir FSL, sólo tiene que añadir las construcciones en conjunto en el mismo diluyente en su concentración normal de trabajo. Si una construcción está en una concentración mucho más alta que otra, algún tipo de ajuste (aumento) de la concentración puede ser necesario para la construcción menor. Por otra parte las construcciones se pueden añadir de forma secuencial, de preferencia con la mayor concentración de construir en primer lugar, seguido por el menor.
- FSL concentraciones de construir por encima de 1000 mg / ml puede introducir importantes cantidades de lípidos en la membrana celular, y puede cambiar la forma de la célula o los hacen más susceptibles a la lisis.
- FSL construir soluciones de trabajo deben ser almacenados a 2-8 º C y utilizarse dentro de unos días.
- Construye FSL se puede diluir en agua, pero se han reducido y la estabilidad debe ser utilizado en cuestión de horas. Si el prospecto especifica el agua como diluyente de la reconstitución del producto en el vial también contiene sales (como se especifica en el prospecto).
2. La inserción de FSL Construir (s) en las membranas
- Primero se deben lavar las células de FSL libre modificación de lípidos no unido por centrifugación y el uso de PBS o lípidos medios libres de células como la solución de lavado.
- Paquete de las células o suspender en 100 l de diluyente.
- Al mismo tiempo, preparar los controles que idealmente debería ser a la vez las células no modificadas (incubadas con PBS en lugar de solución FSL) y / o células modificadas con un tumor benigno, pero relacionados con la construcción de FSL.
- Añadir 100 ml de una dilución apropiada de FSL solución (que contiene una o más construcciones FSL) a las células e incubar durante 1-2 horas a 37 º C. Un resultado similar se puede conseguir por 6 horas de incubación a 25 ° C o durante la noche (18 horas) a 4 ° C - la mezcla se recomienda cada pocas horas, si las suspensiones de células grandes se utilizan.
- Lavado (opcional) dos veces con PBS o medios para eliminar las construcciones libres FSL y preparar una suspensión apropiada.
Notas:
- El diluyente utilizado para suspender las células pueden ser medios de cultivo celular, PBS, las soluciones de células de almacenamiento, etc, pero de preferencia sin lípidos (por ejemplo, el suero bovino fetal) o detergentes (por ejemplo, Tween).
- Diferentes volúmenes (de 100 l) ratios (de 1:01 células / solución FSL) o las condiciones de incubación de la hora y la temperatura se podrán utilizar siempre la misma proporción, la concentración y el volumen se utilizan para obtener resultados reproducibles.
3. Manejo y visualización
- Una vez que el proceso de modificación de FSL se ha completado la kodecytes puede ser almacenado a 4-8 ° C en los lípidos de los medios de comunicación libres o usado.
- Kodecytes y kodevirions general, se comportan igual que las células no modificadas / viriones y puede ser Handled y se observa bajo sistemas de prueba normal (microscopía, serología, citometría de flujo, etc.) Por lo general, no tienen requisitos especiales, excepto para la prevención de solventes / detergentes / lípidos que pueden eluir las construcciones de los lípidos de las membranas.
Notas:
- Construcciones permanecerán en la membrana de las células inactivas, tales como glóbulos rojos, si se almacena en los lípidos medios de comunicación libres para la vida de la célula. En las células con membranas activas de las construcciones será interiorizado y se metaboliza, a una velocidad dependiente de la actividad de la membrana celular.
- Las células muertas por lo general contienen altos niveles de las construcciones de FSL, lo que puede ser usado para separar las células no viables a partir de células viables.
- Si kodecytes se almacenan (o su uso en vivo) en los lípidos que contienen los medios de comunicación / medios, como el suero / plasma la construcción poco a poco se eluyen de la membrana durante un período de horas o días, dependiendo de la temperatura y las concentraciones de lípidos / composiciones.
4. Los resultados representativos:
- Los resultados representativos siguientes dependen de la construcción utilizada (Tabla 1), su concentración insertado y la sensibilidad y especificidad del sistema de detección (s). En general todas las construcciones FSL se insertará en las células después de 1 hora, pero las condiciones óptimas que deben establecerse para cada situación.
- Construye FSL puede ser utilizada para etiquetar el exterior de una variedad de células vivas 3-9,11,14. En los ejemplos mostrados en la Figura 2 embriones en diferentes etapas se utiliza (ya que son una célula frágil), pero otras células (Figura 3) o viriones envueltos (Figura 4) también se pueden etiquetar. FSL-fluoresceína permite el marcado directo de las superficies (figuras 2-4), mientras que FSL-biotina y otras construcciones FSL pueden requerir el uso de un sistema de detección de secundaria (por lo general avidina / anticuerpos / lectinas) para mostrar su presencia (Figura 5) .
- Marcadores de grupo sanguíneo de la especificidad humana o animal puede ser conectado a las células, incluyendo células rojas de 4-9 (Figura 6). Como la cantidad de FSL construir en un kodecyte es controlable y reproducible por 4-6, para la cuantificación de anticuerpos kodecytes se puede hacer (Cuadro 2 y Gráfico 6). La fuente real de las células no es importante, que puede ser cualquier especie, o incluso del mismo origen como fuente de anticuerpos, lo que garantiza en el antígeno sólo es incompatible es el establecido por la FSL 7,8 (Figura 6).
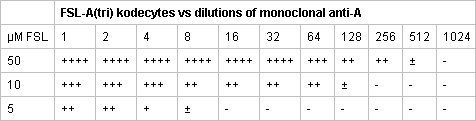
Tabla 2. Representante de las reacciones serológicas de tres diferentes FSL-A (tri) kodecytes de glóbulos rojos a prueba en contra de las diluciones de anticuerpo monoclonal anti-A. La solución de 50 mM de FSL-A (tri) cuando se incubó con un volumen igual de grupo O glóbulos rojos producido un fuerte células antígeno positivo, lo que podría ser detectado por una dilución 1:512 de anticuerpo monoclonal anti-A. El 5 - y 10 veces menor FSL-A (tri) las soluciones producidas kodecytes con grupo sanguíneo A menos la expresión del antígeno.

Figura 1. FSL construcción general. Como una flor construye FSL consta de tres componentes principales. El jefe funcional (F) en el caso de la construcción FSL puede ser una variedad de diferentes grupos biológicamente funcionales, un espaciador (S) diseñada para inducir el espaciamiento de los F de la membrana, mejorar la capacidad de dispersión de agua y que no son reactivos con suero, mientras que los lípidos diacil permite la construcción de incorporar de manera espontánea en la superficie. (I) FSL-GB3 con un grupo sanguíneo Gb 3 (o P k) trisacárido Galα4Galβ4Glcβ epítopo. (II) FSL-A (de tres) con un grupo sanguíneo A, trisacárido epítopo GalNAcα3 (Fucα2) Galβ. (III) FSL-fluoresceína. (IV) FSL-biotina con una fracción F solo biotina. El grupo funcional de las estructuras de I-III se conjugan con un derivado activado de adipato dioleoylphosphatidylethanolamine (DOPE), mientras que el separador de la estructura IV es carboxymethylglycine-adipato de base.
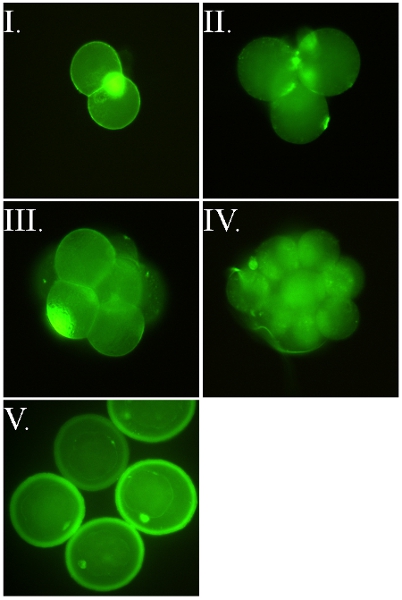
Figura 2. FSL-fluoresceína embriones murinos. Todas las imágenes son de embriones vivos que fueron etiquetados en su zona pelúcida (ZP) estaba intacto (es decir, la construcción de FSL pasa a través de la ZP a la etiqueta del embrión en el interior). Imágenes I-IV son de ZP sin embriones liberados de sus ZP con el etiquetado mensaje ácido Tyrodes con FSL-fluoresceína. Tinción idéntico se produce independientemente de si los embriones se FSL modificado con ZP intacta o sin ZP. Los embriones son directamente etiquetados con FSL-fluoresceína, por el de 2 horas 37 ° C en el método de medio libre de suero de cultivo de células, se lavan y luego se observan bajo el microscopio de fluorescencia. (I) ZP libre de dos células de embriones murinos, que también muestra clásica de una intensa coloración del cuerpo polar. (II-III) ZP libre de cuatro células y embriones de ocho células murinas, tanto mostrando manchas oscuras de las células que son salidaside el microscopio plano de enfoque. (IV) ZP 16 libre de células murinas embrión. (V) ZP intacta embriones murinos blastocisto (d4-d5), donde se marcan tanto el embrión y la zona.

Figura 3. FSL-fluoresceína y el pez cebra 14. (I) Microangiography en larvas de pez cebra 52 HPF (fertilización horas después) se inyecta directamente en la circulación con FSL-fluoresceína. El pez cebra vasculatura está manchada. (II) FSL-fluoresceína heterogéneo pez cebra las células del tejido del riñón (ZK kodecytes) fueron creados ex vivo después de la micro-inyectados en la circulación de un pez cebra 52 HPF destinatario. En las observaciones in vivo de la kodecytes ZK se hizo hace 2 horas después de la inyección por la imagen de la vasculatura en fluorescencia con microscopía lapso de tiempo. Se muestra un fotograma de vídeo con células grandes de lento movimiento o inmóvil (se indica con flechas de color naranja) y células que se mueven rápido (imágenes borrosas debido al movimiento - se indica con flechas verdes). Etiquetado permite en tiempo real en la observación in vivo de la conducta y la biodistribución kodecytes ZK. (III) la absorción oral de la FSL-fluoresceína logra mediante la inmersión en embriones de pez cebra FSL-fluoresceína que contiene los medios de comunicación para un máximo de 5 días. El lavado se logra mediante la transferencia de embriones en los medios de comunicación que no contiene construcciones FSL (por lo menos 6 horas es necesario, pero puede ser por varios días). (IIIa) microscopía de campo brillante del pez cebra FSL-fluoresceína tratado correspondiente a la imagen al lado de fluorescencia (IIIb). La fluorescencia se encuentra preferentemente en el tracto intestinal. No se observó tinción en los embriones de control sin tratamiento (IVa y IVb).

Figura 4. FSL-fluoresceína etiquetado de los viriones 10 VSV y H1N1. (I) el virus de la estomatitis vesicular (VSV) fue etiquetado directamente con 10 mg / ml FSL-fluoresceína durante 2 horas a 37 ° C, seguido de la fijación con paraformaldehído al 4% y citometría de flujo. No purificación de la VSV kodevirion mensaje FSL etiquetado era necesario. (II) La citometría de flujo de cerdos infectados con células testiculares humanas A Rico/8/1934 / Puerto A (H1N1) kodevirions etiquetados con FSL-fluoresceína. Las células no infectadas se ven como negro, mientras que la línea de fusión de las kodevirion H1N1 con los resultados de las células ST en una celda de fluorescentes (línea roja).
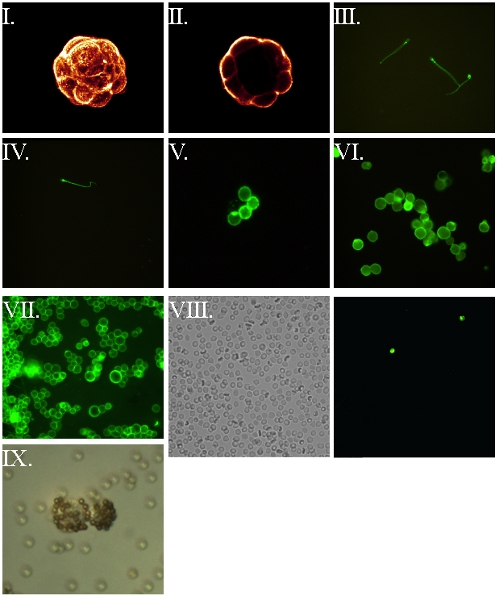
Figura 5. FSL-biotina células marcadas y posterior visualización a través de la etiqueta avidina 7,8. Todas las células se marcaron primero con FSL-biotina durante 1 hora a 37 ° C, lavados reaccionó con fluoróforo marcado avidina, lavado y húmedo montadas para microscopía de fluorescencia. (I) Elaboración de imagen confocal de un blastocisto embrionario murino. (II) Central confocal parte del embrión a partir de la imagen anterior. (III) en vivo espermatozoides móviles humanos - desenfoque se produce como consecuencia de su movimiento. (IV) Fijo (paraformaldehído al 4% después de la inserción) los espermatozoides humanos. (V) de eritrocitos humanos. (VI) fija (4% paraformaldehído pre-inserción) RL95 carcinoma endometrial humano. (VII) no fijadas RL95 endometrial carcinoma de líneas de células humanas. (VIII) Biotina RBC kodecytes observado en una muestra de sangre tomada 2 horas después de la infusión intravenosa de kodecytes con (VIII), que representan un campo se observa bajo microscopio de luz, mientras que (VIIIb) es el mismo campo se observa bajo la fluorescencia, la identificación de los dos kodecytes presentes en el campo de vista. El cálculo del coeficiente de kodecytes a las células sin etiqueta se puede utilizar como un indicador de la supervivencia. (IX) en vivo humanos kodecytes biotina endometrial visualizarse mediante la unión a cuentas avidinylated.

Figura 6. FSL-hidratos de carbono para agregar marcadores de grupo sanguíneo de perfiles serológicos. (I) de glóbulos rojos humanos kodecytes Galili fueron creados con una concentración conjunto de FSL-Galili (500 mg / mL) y se verifica a diluciones de suero humano. Glóbulos rojos humanos no ocurren de manera natural con el antígeno xenoantigen Galili. Kodecytes tales se pueden utilizar para los niveles cuantitativos de anticuerpos en el suero. En este ejemplo, el donante se determinó que un título de anti-Galili de 1:32. (II) Mediante la creación de kodecytes con niveles decrecientes de FSL ("los títulos de antígeno"), un nivel óptimo de antígeno para la detección de anticuerpos se puede determinar (en este ejemplo, Le a). Las células se pueden crear con sólo dar un resultado positivo cuando el nivel de anticuerpos superior a un título específico. El nivel de antígeno FSL para dar un resultado positivo depende de la calidad y el nivel de anticuerpos que se detectan. Para los antígenos de hidratos de carbono, una solución FSL de 100 mg / ml por lo general se traducirá en una reacción positiva fuerte. (III) humanos del grupo O glóbulos rojos fueron modificados para tener un nivel específico de una hormigaigen (estandarizado A kodecytes), y se utiliza para cuantificar con precisión y reproducibilidad anti-A en el suero humano. En este ejemplo, el anti-A título en el grupo O de suero analizadas es 01:32 y la kodecytes fueron preparados a partir de las propias células rojas del donante. (IV) Grupo sanguíneo A y B simultáneamente antígenos se inserta en un único grupo de muestras de células rojas O se utilizan para crear un kodecytes B débil débil. Estos kodecytes puede ser utilizado para fines de control de calidad ABO. Este resultado muestra el análisis de una formula específicamente un kodecyte B débil débil probado con reactivos anti-A y anti-B y da espera que las reacciones débiles.
Discusión
Modificación de las células y los viriones con las construcciones de FSL es una técnica muy simple y robusto 3.11. Para describir y distinguir FSL construir células modificadas y los viriones de las células no modificadas, se les llama kodecytes y kodevirions respectivamente 6.10, pero sólo cuando el grupo presentó funcional puede ser demostrado que está presente en su membrana. Cuando kodecytes se hacen con diferentes concentraciones de construcciones de FSL, que pueden hacer referencia a la concentración de la solución de FSL construcción utilizada para crearlos, por ejemplo, 15 mg / ml A kodecytes, o si más de un FSL se utiliza entonces un término combinado, por ejemplo, A + biotina kodecytes 7,8. Cuando las células diferentes se van a comparar, incluyendo el tipo de célula en la descripción se recomienda, por ejemplo, rojo kodecytes celular biotina o biotina kodecytes endometrial 7,8.
Aunque el proceso de inserción es muy robusto y de inserción (aunque con diferentes ritmos) se producirá en un amplio rango de temperatura 4-37 ° C y en cuestión de minutos a horas, para obtener un control estricto de la inserción reproducible tiempo de contacto, temperatura, concentración de FSL ( incluida la formulación de diluyente), y una concentración menor medida células son obligatorios. Hasta la fecha, todas las construcciones FSL se puede utilizar para modificar las células con la misma técnica 4.11, sin embargo se espera que ciertas condiciones serán más favorables para el flujo de trabajo y / o los requisitos de manejo óptimo de las células / viriones que ser modificado . La hora exacta de la concentración de FSL para lograr el efecto deseado debe ser determinada por el usuario 4. La resultante FSL construir células modificadas / viriones generalmente se pueden utilizar en la misma forma que una célula sin modificar / virión en los sistemas biológicos o de análisis 11.4. A medida que la construye poco a poco FSL elución de superficies modificadas en contacto con soluciones de lípidos 7,8, o ser consumido por las células activas 11, estas cuestiones deben considerarse en relación con el nivel de señal o de actividad obtenidos en períodos de tiempo. Kodecytes puede ser fija (por ejemplo, glutaraldehído / formalina) después de la inserción siempre que el fijador no contiene lípidos liberador de solventes y el grupo funcional es compatible con el fijador. Por otra parte las células fijas se pueden modificar con las construcciones de FSL.
Además de la modificación de la superficie celular y virión construye FSL también puede ser infundida directamente en la circulación de animales de laboratorio que causa en la modificación in vivo de células circulantes 7 y para inhibir el virus 12, toxinas, 12 y anticuerpos 7. Construye FLS también se han utilizado para decorar los liposomas y se pueden imprimir en 13 superficies de papel, donde se inmovilizan, y puede ser utilizado en ensayos de diagnóstico.
La capacidad de modificar fácilmente las células vivas con un número creciente de construcciones FSL debe ser una investigación útil y una herramienta de desarrollo para el estudio de la biología de la superficie celular.
Divulgaciones
Deborah A. Blanco y Stephen M. Henry son los empleados y los accionistas de la biotecnología KODE limitado el titular de la patente de la tecnología de KODE. Dan Bess es un empleado de Sigma-Aldrich, que ha patrocinado la producción de este video-artículo.
Agradecimientos
Los autores agradecen a Dan Bess de Sigma-Aldrich para la presentación del video. También queremos agradecer a Don Branch, Cherny Evgenii, Chesla Scott, Hadac Elizabeth Harrison Amanda, Heathcote Damien, Hult Annika, Lan Chuan-Ching, McIntosh Susannah, Komarraju Sarvani, Korchagina Elena, Caroline Oliver, Martin Olsson, Stephen Parker, Rodinov Igor, Alexander Tuzikov, y Eleanor Williams por sus resultados y sus contribuciones al diseño, la síntesis de las construcciones de FSL y la determinación de la actividad biológica.
Materiales

Tabla 1. Construye FSL disponibles en el mercado se describe en este documento.
Referencias
- Waehler, R., Russell, S. J., Curiel, D. T. Engineering targeted viral vectors for gene therapy. Nat. Rev. Genet. 8, 573-587 (2007).
- Strable, E., Finn, M. G. Chemical modification of viruses and virus-like particles. Curr. Top. Microbiol. Immunol. 327, 1-21 (2009).
- Henry, S., Bovin, N. The development of synthetic peptidolipids, glycolipids and other lipid-linked structures to create designer red cells. Transfusion. 48, Suppl 2S. 194A-194A (2008).
- Frame, T., Carroll, T., Korchagina, E., Bovin, N., Henry, S. Synthetic glycolipid modification of red blood cell membranes. Transfusion. 47, 876-882 (2007).
- Hult, A. K., Frame, T., Henry, S., Olsson, M. L. Flow cytometry evaluation of red blood cells transformed with variable amounts of synthetic A and B glycolipids. Vox Sang. 95, Suppl 1. 180-180 (2008).
- Henry, S. Modification of red blood cells for laboratory quality control use. Curr. Opin. Hematol. 16, 467-472 (2009).
- Oliver, C., Blake, D., Henry, S. In vivo neutralization of anti-A and successful transfusion of A antigen incompatible red cells in an animal model. Transfusion. , Forthcoming (2011).
- Oliver, C., Blake, D., Henry, S. Modeling transfusion reactions and predicting in vivo cell survival with kodecytes. Transfusion. , Forthcoming (2011).
- Heathcote, D., Carroll, T., Wang, J. J., Flower, R., Rodionov, I., Tuzikov, A., Bovin, N., Henry, S. Novel antibody screening cells, MUT+Mur kodecytes, created by attaching peptides onto erythrocytes. Transfusion. 50, 635-641 (2010).
- Hadac, E. M., Federspiel, M. J., Chernyy, E., Tuzikovb, A., Korchagina, E., Bovin, N. V., Russell, S. J., Henry, S. M. Fluorescein and radiolabeled Function-Spacer-Lipid constructs allow for simple in vitro and in vivo bioimaging of enveloped virions. J Virol Meth. 10, Forthcoming (2011).
- Blake, D., Lan, A., Love, D., Bovin, N., Henry, S. Fluorophore-kodecytes - fluorescent function-spacer-lipid (FSL) modified cells for in vitro and in vivo analyses. FEBS J.. 277, Suppl 1. 199-199 (2010).
- Harrison, A. L., Olsson, M. L., Brad Jones, R., Ramkumar, S., Sakac, D., Binnington, B., Henry, S., Lingwood, C. A., Branch, D. R. A synthetic globotriaosylceramide analogue inhibits HIV-1 infection in vitro by two mechanisms. Glycobiology. 27, 515-524 (2010).
- Barr, K., Diegel, O., Parker, S., Bovin, N., Henry, S. Function-Spacer-Lipid (FSL) constructs enable inkjet printing of blood group antigens. FEBS J. 277, Suppl 1. 235-235 (2010).
- Lan, C. -C. Modeling inflammatory bowel disease [dissertation]. , University of Auckland. Auckland. (1988).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados