Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La cuantificación de la colonización por hongos, esporogenesis y producción de micotoxinas mediante bioensayos del núcleo
* Estos autores han contribuido por igual
En este artículo
Resumen
La devastación de los cultivos de cereales de semillas por los hongos que infectan ha llevado a los numerosos esfuerzos de investigación para comprender mejor las interacciones planta-patógeno. Para estudiar las interacciones entre las semillas de hongos en un entorno de laboratorio, hemos desarrollado un método robusto para la cuantificación de reproducción de los hongos, la biomasa y la contaminación por micotoxinas mediante bioensayos del kernel.
Resumen
La descomposición de granos por semilla-hongos que infectan plantea uno de los mayores desafíos económicos a la producción de cereales en todo el mundo, por no hablar de los riesgos graves para la salud humana y animal. Entre la producción de cereales, el maíz es sin duda el cultivo más afectado, debido a patógenos inducida por pérdidas en la integridad del grano y la contaminación de las semillas de micotoxinas. Los dos micotoxinas más comunes y problemáticas de los productores de maíz y de alimentos y procesadores de alimentos son las aflatoxinas y las fumonisinas, producida por Aspergillus flavus y Fusarium verticillioides, respectivamente.
Recientes estudios moleculares de las interacciones planta-patógeno han demostrado promesa en la comprensión de los mecanismos específicos asociados con la respuesta de las plantas a la infección por hongos y la contaminación por micotoxinas 1,2,3,4,5,6. Debido a que muchos laboratorios están utilizando ensayos del núcleo para estudiar patógenos de plantas interacciones, existe una necesidad de un método normalizado para la cuantificación de diferentes parámetros biológicos, asíresultados de distintos laboratorios se puede interrogar a interpretar. Para un método eficaz y reproducible para el análisis cuantitativo de las semillas, se han desarrollado ensayos de laboratorio en el núcleo y los métodos siguientes para cuantificar el crecimiento de hongos, la biomasa y la contaminación por micotoxinas. Cuatro esterilizados granos de maíz se inoculan en viales de vidrio con una suspensión fúngica (10 6) y se incubaron durante un período predeterminado. Viales de muestras se seleccionan entonces para la enumeración de los conidios por análisis de biomasa hemocitómetro, ergosterol basada por cromatografía líquida de alta resolución (HPLC), la cuantificación de aflatoxinas utilizando un método AflaTest fluorómetro, y cuantificación fumonisina por HPLC.
Protocolo
1. Bioensayo grano de maíz
- Dos semanas antes, la cultura de los hongos patógenos en Agar Papa Dextrosa (PDA) a 28 ° C.
- Seleccione granos con un tamaño y forma similar, preferentemente plana por lo que estaba a nivel con la parte inferior de los viales de bioensayo, y el lugar en 50 ml tubos Falcon. Granos seleccionados deben haber sido producidos simultáneamente en un mismo entorno para asegurarse de edad de la semilla o composición similar metabolito.
- Surface esterilizar núcleos agitando los tubos a temperatura ambiente durante 5 minutos con 70% de etanol, 1 minuto con agua estéril, y 10 minutos con hipoclorito de sodio al 6%. Enjuague tres veces, durante 5 minutos cada vez, con agua estéril y agitando continua. Séquelos con toallas esterilizadas de granos.
- Para facilitar la infección de Aspergillus flavus, crear una pequeña herida en el embrión del lado con una aguja de 18 G a la profundidad de 0,5 cm. Sin embargo, en nuestra experiencia una herida más grande es necesario para la infección por Fusarium verticillioides. Therefore, utilizar una hoja de afeitar para cortar en el embrión del lado a una profundidad de 0,5 mm.
- Preparar suspensión del inóculo raspando placas cultivadas en aproximadamente 5 ml de autoclave 0,01% de Tween-20 solución para liberar las esporas y eliminar micelio por filtración a través de la gravedad por lo menos 4 capas de gasa autoclave. Calcular la concentración de esporas con hemocitómetro y ajustar a 10 6 esporas / ml para A. flavus o F. verticillioides. Si se utiliza otra especie de patógeno o huésped, es importante para evaluar las concentraciones de inóculo para la infección apropiado.
- Crear una cámara de humedad en un recipiente de plástico (29,2 cm X 18,7 cm X 8,3 cm) forrada con cinco hojas de toallas de papel y 100 ml de agua estéril. Sala no es de agua o hermético y el agua se debe agregar todo experimento para mantener las toallas de papel húmedo.
- Coloque los cuatro núcleos en un autoclave 20 ml vial de centelleo de vidrio y registrar su masa. Se inoculan con 200 l suspensión de esporas,la tapa, y agitar a los huesos de cubrir bien con la suspensión. Afloje las tapas para permitir el libre intercambio de aire y el lugar en la cámara de humedad.
Nota: Para las semillas u hongos distintos de los descritos en estos métodos, la cantidad de inóculo requerida puede ser diferente y debe ser establecido de forma experimental.
- Incubar los granos bajo un fotoperíodo 12-h-light/12-h-dark a 28 ° C durante 7 días o hasta que se desee.
2. Enumeración conidios
- Después del período de infección, añadir 5 ml de autoclave 0,01% de Tween-20 a viales de centelleo que contienen granos infectados y mezclar bien durante 1 minuto.
- Usando una punta de gran calibre pipeta, inmediatamente diluir mediante la transferencia de dos separadas 200 ml de alícuotas de la suspensión de esporas en 2,0 ml tubos Eppendorf conteniendo 1,8 ml de 0,01% de Tween-20 (o diluir como sea necesario dependiendo de la infección).
- Enumerar cada una alícuota de 200 l dos veces con un hemocitómetro 4y comparar los niveles de conidios entre los tratamientos.
3. La cuantificación de aflatoxinas
- Añadir núcleos a partir de 1 muestra a 50 ml de taza mezcladora con 20 ml de 80% de metanol y 0,05 g de NaCl, la cubierta y la mezcla a alta velocidad durante 1 minuto.
- Colocar un filtro plegado sobre un recipiente de recogida limpia y se vierte en extracto de filtro.
- Transferir 10 ml de filtrado a un recipiente limpio y añadir 20 ml de H 2 O destilada y mezclar bien.
- Filtro de la muestra a través de un filtro de microfibra de vidrio de 1,5 m en una taza limpia.
- Aplicar 1 ml de extracto se filtró a la columna de prueba Afla y, utilizando aire comprimido, forzar el extracto se filtró a través de la columna a una velocidad de 1-2 gotas por segundo hasta vaciados.
- Lavar la columna dos veces con 1 ml de H 2 O destilada y pasar a través de la columna a 1.2 gotas / segundo hasta que el aire llega a través de.
- La columna se eluye con 1 ml de metanol al 100% grado HPLC en una caída de 2.1 / segunda tasa recogida en una cubeta de vidrio.
- Añadir1 ml de desarrollador de pruebas Afla de eluido y mezclar bien. Coloque la cubeta en fluorómetro calibrado y leído en 60 seg.
Nota: Cuando se utiliza el protocolo de Aflatest FGIS, la medición de la fluorómetro se calcula en base a un período inicial de 50 gramos de muestra extraída en 100 ml. Si se tiene en cuenta la dilución de la muestra con agua, 1 ml de la aplica a una columna representa 0,166 gramos de muestra. Por lo tanto, al modificar el protocolo, es necesario tener en cuenta las diferencias en el tamaño de la muestra y la solución de extracción inicial. Por ejemplo, 2 gramos de granos se extraen en 20 ml de metanol 80%. Esto es de 0,1 gramos por ml. Cuando 1 ml de esta muestra se mezcló con 2 ml de agua, la proporción de la muestra en el líquido es ahora 0,033 gramos por ml. Si esta muestra da una lectura fluorómetro de 100 ppb, la concentración real se basa en la proporción de la muestra a 0,166, es decir, ppb = (0,166 gramos X 100 ppb) / gramo 0,1), o ppb 166. Para las aflatoxinas alternativa cuantificaciónmétodos de cationes, véase la referencia 7.
4. Fumonisina B1 (FB1) Análisis
- Cuando hongo se cultiva en granos de maíz, extraer muestras durante la noche con 10 ml de acetonitrilo / agua (50/50, v / v) a temperatura ambiente sin agitación. Posteriormente, mezclar el extracto (2 ml) con agua desionizada (6 ml), y aplicar esta mezcla (8 ml) directamente a la extracción en fase sólida C-18.
- Antes de cargar la muestra, la columna condición de extracción en fase sólida C-18 de un enjuague con 2 ml de acetonitrilo seguido por 2 ml de agua.
- Después de cargar la muestra, la columna se lavó con 2 ml de agua seguido por 2 ml de acetonitrilo / agua (15/85, v / v). Muestra para análisis por HPLC (que contenía FB1) se eluyó con 2 ml de acetonitrilo / agua (70/30, v / v).
- Derivatizar FB1 con o-ftaldehído (OPA) mediante la transferencia de 0,1 ml de eluato de la columna a un vial que contiene 0,1 ml de tampón borato (0,05 M bórico acid/0.05 M de borato de sodio [50/50, v / v], pH 8,5) y 0,1 OPA ml (0,1 mg / ml en acetonaitrile con 0,5% - mercaptoetanol).
- Se detiene la reacción después de 10 minutos mediante la adición de 0,5 ml de acetonitrile/0.01 M de ácido bórico (40/60, v / v).
- Analizar FB1 en un HPLC Shimadzu LC-20AT sistema equipado con una columna analítica Zorbax ODS (4,6 150 mm) y una longitud de onda variable Shimatzu RF-10Axl detector de fluorescencia (excitación 335 nm / emisión 440 nm).
- Un gradiente lineal se utiliza (disolvente A: acetonitrile/0.1 M de fosfato sódico (40/60), pH 3,3; disolvente B: acetonitrilo / fosfato sódico 0,1 M (60/40), pH 3,3) y el programa de gradiente es como sigue: 100% de A. a 100% de B en 10 min, B 100% durante 5 min
- Analizar FB1 estándares por HPLC, y las mediciones de área de los picos se utilizan para generar la curva estándar. Posteriormente, cuantificar FB1 nivel en una muestra mediante la comparación de áreas de los picos con FB1 curva estándar.
5. Análisis de ergosterol
- Cultura del hongo en los granos de maíz durante 7-14 días.
- Después de que el período de incubación, agregar 10 ml de cloroformo: methanol (2:1, v / v) en cada vial. Una vez añadido, agitar bien y luego las muestras se incuban los frascos en la oscuridad a temperatura ambiente durante 24 horas.
- Después de 24 horas, centrifugar las muestras, y recoger el sobrenadante y filtrar a través de una membrana de nylon 0,45 um.
- Inyectar la muestra directamente en un HPLC Shimadzu LC-20AT sistema equipado con un 4,6 U SAO columna C18 (200 A y 250 ± 4,6 mm) y un Shimadzu SPD-20A detector UV / VIS configurado para monitorear a 282 nm.
- El uso de metanol (100%) a un caudal de 1,5 ml / min como fase móvil. Determinar la cuantificación de ergosterol en las muestras mediante la comparación de áreas de los picos de las muestras a una curva estándar generada a partir de grado HPLC ergosterol.
6. Los resultados representativos
Después de la inoculación y la incubación en una cámara de humedad durante dos a tres días, el crecimiento de hongos debe comenzar a aparecer en los granos. Siete días después del tratamiento, el crecimiento vegetativo en las plantas tratadas deben ser claramente visibles, rodeado pocontroles electrónicos falsos que no está infectada (Figura 1B, arriba). Los períodos de incubación más largo son propicias para el crecimiento vegetativo más abundante (Figura 1B, abajo). En las condiciones descritas en este documento (Figura 2G), A. flavus de tipo salvaje NRRL 3357 se muestran los valores máximos de la colonización, la acumulación de aflatoxina, y la producción de conidios a las 8, 6 y 8 días, respectivamente (Figura 2, CA). Sin embargo, cuando la contaminación por micotoxinas y la formación de conidios fueron comparados por unidad de ergosterol, los mayores niveles se observaron a las 4 y 6 días, respectivamente (Figura 2, DE). Figura 2F resumen de estos hongos que dependen de la biomasa de valor máximo de las observaciones. Curiosamente, entre los 4-6 días después de la inoculación, los granos sufren una degradación de ácidos nucleicos, como se ve por el ARN total de muestras en el tiempo de duración (Figura 2H, abajo).
Varios estudios, incluyendo la nuestra, tienen exaed F. verticilliodies infección en granos de maíz y utilizado con éxito 2,8,9,10,11,12 7-13 días como los puntos de tiempo para las observaciones. Utilizando los métodos descritos en este documento, las fumonisinas niveles van de 3,500-8,000 ng / g de gama kernel 4,13 y los niveles de ergosterol de 5.000-10.000 ng / g del núcleo 14,13. La Figura 3 muestra los picos representativos de las fumonisinas (arriba) y el ergosterol (parte inferior ) de cromatogramas de HPLC. Medición de ergosterol también puede llevarse a cabo a través de espectros de absorbancia 15.
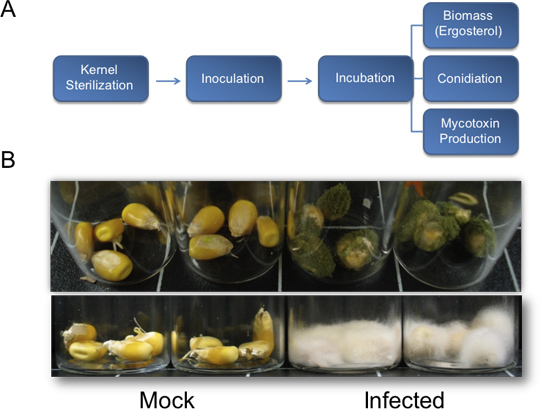
Figura 1. Diagrama de flujo para la cuantificación de la biomasa de hongos, esporogenesis, y la producción de micotoxinas y los resultados representativos para el crecimiento vegetativo de los bioensayos del kernel. A) Diagrama de flujo esbozar el método descrito para la cuantificación de los parámetros biológicos fundamentales utilizados para evaluar la patogénesis de hongos en los granos de maíz. B) Representanteresultados de los bioensayos del kernel. Arriba, A. flavus (NRRL3357) el crecimiento vegetativo de los granos de maíz en el fondo B73 genética. Las semillas se inocularon con 200 l de 10 6 esporas / ml y se tomaron fotografías 7 días post inoculación. En pocas palabras, F. verticillioides inocularon granos en el fondo de la infección por B73 13 días después. Los granos se inocularon con 200 l de 10 6 esporas / ml.
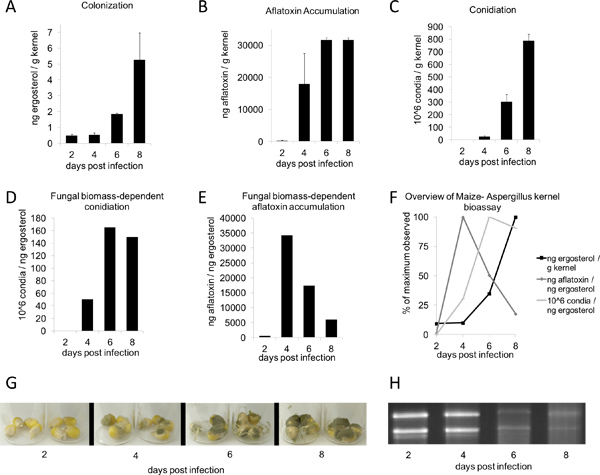
Figura 2. Aspergillus flavus bioensayo sistema de tiempo-por supuesto. B73 granos fueron inoculados con 200 l de 10 6 esporas / ml Aspergillus flavus suspensión de conidios y se incubaron durante 2-8 días (G). Todos los valores se determinaron a partir de la media de peso en seco de 4 núcleos (n = 3-4, con una media ± DE). A) La colonización (basado en ergosterol), aflatoxinas (B), y conidiación (C) se cuantificaron utilizando métodos descritos anteriormente. E) La aflatoxina y la formación de conidios (F) se muestrancomo una función de la biomasa fúngica, medido a través de ergosterol h. F) Los valores máximos de ergosterol, la acumulación de aflatoxina, y conidios en función de la biomasa de hongos: los valores máximos para cada cantidad se observó a 100%. (H) 1 g por carril de RNA total de tiempo-curso.
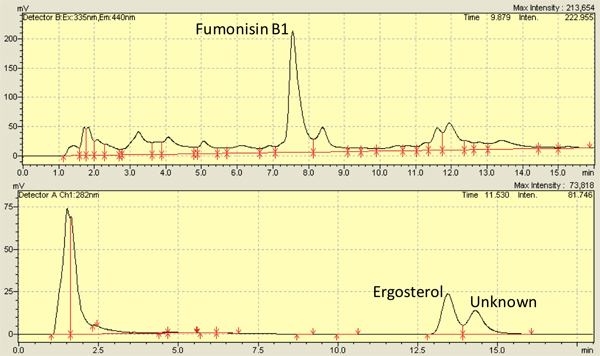
Figura 3. Alto Representante cromatografía líquida (HPLC) cromatogramas de las fumonisinas B1 (arriba) y el ergosterol (abajo) aisladas a partir de granos infectados con Fusarium verticillioides (M3125).
Discusión
Los métodos descritos aquí se ha probado extensamente y ha demostrado ser robusta en la generación de resultados cuantificables para la colonización por hongos, esporogenesis, y la producción de micotoxinas. Por otra parte, estos métodos deben ser aplicables a las semillas de otras especies de plantas que son susceptibles a la contaminación con hongos micotoxigénicos (por ejemplo, los cacahuetes, trigo, algodón, pistachos, etc.) Para competentes los análisis de interacción planta-patógeno, es imperativo q...
Divulgaciones
No tengo nada que revelar.
Agradecimientos
Nos gustaría dar las gracias a Brandon Hassett y Carlos Ortiz por su asistencia técnica. Este trabajo fue apoyado por la NSF subvenciones IOB-0544428, el IOS-0951272, 0925561 y IOS-con el Dr. Michael Kolomiets, y por el Instituto Nacional del USDA de Alimentos y Agricultura (NIFA), Mejoramiento Vegetal y AFRI Educación Grant # 2010-85117 -20539 a los Dres. Seth Murray, Isakeit Thomas y Michael Kolomiets.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Catálogo # | |
| Agar Patata Dextrosa | Fisher científico se | S71659A | |
| Tween-20 al | Fisher científico se | BP337-100 | |
| Recipiente de incubación de plástico | Sterilite | 1713LAB06 | |
| Licuadora | Vicam | 20200 | |
| 24 cm filtro plegado documentos | Vicam | 31240 | |
| 1,5 m de microfibra de vidrio | Vicam | 31955 | |
| Afla columna de prueba | Vicam | G1024 | |
| Afrla prueba para desarrolladores | Vicam | 32010 | |
| El metanol | Vicam | 35016 | |
| Acetonitrilo | Fisher científico se | AC14952-0025 | |
| Etanol | Fisher Scientifc | AC39769-0025 | |
| C-18 de fase sólida columna de extracción (Prep septiembre Columna SPE C18) | Fisher científico se | 60108-304 | |
| O-ftalaldehído (OPA) | Sigma Chemical Co | 79760-5g | |
| El ácido bórico | Fisher científico se | BP168-500 | |
| Borato de sodio | Fisher científico se | RDCS0330500 | |
| Mercaptoetanol | Fisher científico se | 45-000-231 | |
| HPLC Shimadzu LC-20AT (bomba) | Shimadzu Scientific Instruments, Inc. | LC-20AT | |
| Zorbax ODS columna (4.6x150mm) | Agilent Technologies | 443905-902 | |
| Shimatzu RF-10Axl detector de fluorescencia | Shimadzu Scientific Instruments, Inc. | RF-10AXL | |
| Fosfato sódico | Fisher científico se | AC38987-0010 | |
| FB1 normas | Sigma Chemical Co. | F1147-1mg | |
| Cloroformo | VWR | MK444410 | |
| 13 mm de filtro jeringa con membrana de nylon 0,45 um (HPLC) | Pall Life Science | 4426 | |
| Ergosterol | Sigma-Aldrich | 45480-50G-F | |
| Centelleo viales | VWR | 66021-602 | |
| Cloruro de Sodio | Vicam | G1124 |
Referencias
- Tsitsigiannis, D. I., Keller, N. P. Oxylipins as developmental and host-fungal communication signals. Trends Microbiol. 15, 109-118 (2007).
- Gao, X., Shim, W. -. B., Göbel, C., Kunze, S., Feussner, I., Meeley, R., Balint-Kurti, P., Kolomiets, M. Disruption of a maize 9-lipoxygenase results in increased resistance to fungal pathogens and reduced levels of contamination with mycotoxin fumonisin. Mol. Plant-Microbe Interact. 20, 922-933 (2007).
- Brodhagen, M., Tsitsigiannis, D. I., Hornung, E., Goebel, C., Feussner, I., Keller, N. P. Reciprocal oxylipin-mediated cross-talk in the Aspergillus - seed pathosystem. Mol. Microbiol. 67, 378-391 (2008).
- Gao, X., Brodhagen, M., Isakeit, T., Brown, S. H., Göbel, C., Betran, J., Feussner, I., Keller, N. P., Kolomiets, M. V. Inactivation of the lipoxygenase ZmLOX3 increases susceptibility of maize to Aspergillus spp. Mol. Plant-Microbe Interact. 22, 222-231 (2009).
- Gao, X. Q., Kolomiets, M. V. Host-derived lipids and oxylipins are crucial signals in modulating mycotoxin production by fungi. Toxin Rev. 28, 79-88 (2009).
- Mukherjee, M., Kim, J. -. E., Park, Y. -. S., Kolomiets, M. V., Shim, W. -. B. Regulators of G protein signaling in F. verticillioides mediate differential host-pathogen responses on non-viable versus viable maize kernels. Mol. Plant Pathol. 12, 479-491 (2011).
- Zheng, M. Z., Richard, J. L., Binder, J. A review of rapid methods for the analysis of mycotoxins. Mycopathologia. 161, 261-273 (2006).
- Bacon, C. W., Bennett, R. M., Hinton, D. M., Voss, K. A. Scanning electron microscopy of Fusarium moniliforme within asymptomatic maize kernels and kernels associated with equine leukoencephalomalacia. Plant Dis. 76, 144-148 (1992).
- Munkvold, G. P., Hellmich, R. L., Rice, L. G. Comparison of fumonisin concentrations in kernels of transgenic Bt maize hybrids and nontransgenic hybrids. Plant Dis. 83, 130-138 (1999).
- Sagaram, U. S., Shaw, B. D., Shim, W. -. B. Fusarium verticillioides GAP!, a gene encoding a putative glycolipid-anchored surface protein, participates in conidiation and cell wall structure but not virulence. Microbiol. 153, 2850-2861 (2007).
- Shim, W. -. B., Flaherty, J. E., Woloshuk, C. P. Comparison of Fumonisin B1 biosynthesis in maize germ and degermed kernels by Fusarium verticillioides. J. Food Protect. 66, 2116-2122 (2003).
- Shim, W. -. B., Woloshuk, C. P. Regulation of fumonisin B1 biosynthesis and conidiation in Fusarium verticillioides by a cyclin-like (C-type) gene, FCC1. Appl. Environ. Micrbiol. 67, 1607-1612 (2001).
- Christensen, S. A. . Conversation with: Won-Bo Shim. , (2011).
- Shin, J. -. H., Shim, W. -. B. Characterization of PPR1 and PPR2, genes encoding regulatory subunits of protein phosphatase 2A in Fusarium verticillioides. Phytopathol. 99, S119 (2009).
- Breivik, O. N., Owades, J. L. Spectrophotometric Semimicrodetermination of Ergosterol in Yeast. Yeast. Agric. and Food Chem. 5, 360-363 (1957).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados