Method Article
Aislamiento y cultivo de fibras individuales y sus células satélite del músculo esquelético adulto
En este artículo
Resumen
Aislamiento y cultivo de fibras musculares es el estándar de oro In vitro para estudiar la transición de las células satélite a través de quiescencia, la activación y la diferenciación. Es importante destacar que el sistema de miofibra sola cultura conserva la asociación celular miofibra / vástago, que es un componente esencial del nicho de células madre musculares.
Resumen
La regeneración muscular en el adulto se lleva a cabo por las células madre residentes llamadas células satélite. Las células satélite se definen por su posición entre la lámina basal y el sarcolema de cada miofibras. El conocimiento actual de su comportamiento depende en gran medida el uso del protocolo de aislamiento miofibra sola. En 1985, Bischoff se describe un protocolo para aislar las fibras individuales en vivo desde el flexor digitorum brevis (FDB) de ratas adultas con el objetivo de crear un sistema in vitro en el que se conserva la asociación física entre la miofibra y sus células madre 1. En 1995, el protocolo Rosenblattmodified Bischoff de tal manera que las miofibras se recogió por separado y manipular por separado después de la digestión con colagenasa en lugar de quedar aislada mediante sedimentación por gravedad 2, 3. El Rosenblatt o protocolo Bischoff ha sido adaptado a los diferentes músculos, edad o condiciones 3-6. La técnica miofibra aislamiento individual es indispensableherramienta debido a sus ventajas únicas. En primer lugar, en el único protocolo de miofibras, células satélite se mantiene por debajo de la lámina basal. Esta es una característica única del protocolo como otras técnicas tales como la clasificación de células activadas por fluorescencia requieren química y tejido disociación mecánica 7. Aunque el sistema de cultivo miofibra no pueden sustituir a los estudios in vivo, sí ofrece una excelente plataforma para abordar importantes propiedades biológicas de las células madre musculares. Miofibras individuales pueden ser cultivadas en condiciones estándar o enchapado en condiciones flotantes. Las células satélite en miofibras flotantes están sometidas a prácticamente ninguna otra influencia que el medio ambiente miofibras. Rigidez sustrato y el revestimiento se ha demostrado que influyen en la capacidad de las células satélite 'para regenerar los músculos 8, 9 así ser capaz de controlar cada uno de estos factores de forma independiente permite la discriminación entre nicho-dependiente y respuestas independientes. Diferentes concentraciones de suero tienenTambién se ha demostrado que tienen un efecto sobre la transición de la inactividad de la activación. Para preservar el estado de quiescencia de sus células satélite asociadas, las fibras se deben mantener en un medio bajo en suero 1-3. Esto es particularmente útil cuando se estudian los genes implicados en el estado de quiescencia. En medio rico suero, las células satélite activar rápidamente, proliferar, migrar y diferenciarse, imitando así el proceso de regeneración in vivo 1-3. El sistema se puede utilizar para realizar una variedad de ensayos tales como el ensayo de inhibidores químicos; expresión ectópica de los genes de virus de entrega; gen oligonucleótido basado knock-down o imágenes en directo. En este artículo se describe el protocolo de vídeo se utiliza actualmente en nuestro laboratorio para aislar miofibras individuales del extensor digitorum longus (EDL) de ratones adultos (6-8 semanas).
Protocolo
Todos los experimentos fueron manejados de acuerdo a la Universidad de Ottawa regulaciones para cuidado de los animales y la manipulación.
Consulte la Tabla 1 para una visión general del protocolo.
1. Antes de arrancar el aislamiento
- Prepare las siguientes soluciones:
0,2% de colagenasa tipo I en DMEM (medio de Dulbecco modificado de Eagle; alto de glucosa, L-glutamina con 110 mg / ml de piruvato de sodio). Durante dos músculos EDL preparar 2 ml de 0,2% Collagenease en DMEM. Filtrar la solución a través del filtro de 0,22 micras. 10 min antes del aislamiento, precalentamiento a 37 ° C en un baño de agua. Alícuotas adicionales de colagenasa sin diluir se puede congelar a -20 ° C para su uso posterior.
Nota: utilizar DMEM con piruvato de sodio a lo largo de todo el procedimiento. Las fibras no sobreviven en piruvato de sodio libre de soporte.- Medios de lavado (utilizar para llevar a cabo todos los lavados). Suplemento DMEM con 1% penicilina / estreptomicina. Filtrar a través de 0.22 Micras filtro antes de su uso.
- Miofibra medios de cultivo. Suplemento DMEM con FBS al 20%, extracto de embrión de pollo al 1% y 1% de penicilina / estreptomicina. Filtrar a través de filtros de 0,22 micras antes de su uso.
- Matrigel platos recubiertos. Para las fibras de la cultura por un largo período de tiempo, le recomendamos que utilice Matrigel como sustrato de recubrimiento. Para preparar placas revestidas con Matrigel, descongelar una alícuota de Matrigel en 4 ° C durante la noche. El día después, diluir Matrigel 1:10 en DMEM. Mantener Matrigel en 4 ° C en todo momento y evitar los cambios bruscos de temperatura ya que esto crea cristales microscópicos dentro de la solución resultante en Matrigel recubrimiento desigual. Coloque los platos a ser recubierto sobre hielo. Platos capa con volumen suficiente para cubrir la superficie. Dejar reposar durante 1 min. Retire completamente el Matrigel sobrante. Vamos platos seco a 37 ° C durante al menos 3 horas antes de su uso o durante la noche.
Nota: alícuotas de Matrigel diluido se puede volver a utilizar varias veces para fines de recubrimiento si se almacena a 4 y deg; C. - Por último, asegúrese de limpiar la estación de microscopio de disección y herramientas con un 70% de etanol.
- Durante dos aislamientos EDL (un ratón) preparar cinco placas Petri de plástico (60 * 15mm) de la siguiente manera:
- Cuatro platos para el aislamiento (1 para el músculo disociación, 3 para lavados de serie). Todos los platos deben estar recubiertos con suero de caballo (HS) para evitar que se adhiera a las miofibras de plástico. Para recubrir, pipeta de 3 ml de suero de caballo en cada plato, remolino para permitir incluso la capa, eliminar el suero de caballo y dejar que el plato seco durante al menos 30 min. Añadir 4 ml de DMEM a cada placa. Mantener los platos a 37 º C en un 5% de CO 2 incubadora antes de su uso.
Nota: suero de caballo se puede volver a utilizar varias veces, si se mantiene estéril. Alternativamente, una solución de 10% en DMEM HS se puede usar para platos de la capa. Use platos recubiertos SA a lo largo de todo el protocolo y cuando miofibras sobre las condiciones de cultivo flotantes.- Un plato se utilizará para miofibras de cultivo después del aislamiento. Alttamaños o formatos ernative plato puede ser utilizado para el cultivo final de las miofibras en función de las aplicaciones posteriores. Sin embargo, no recomendamos tamaños de plato de más de 60 * 15 mm. Miofibras puede ser mantenido en suspensión por no más de 96 h antes de la contracción se produce hiper. Para los tiempos de cultivo más largas, se recomienda utilizar Matrigel platos recubiertos o placas.
- Para el aislamiento de fibra de uno (2 EDL), prepare dos pipetas Pasteur estériles: una pipeta de gran diámetro para el manejo de los músculos y una pequeña pipeta de orificio para la manipulación miofibras. Utilice una pluma de diamante para cortar cada pipeta de vidrio a la longitud deseada y pulimento de calor para suavizar los bordes pipeta. Mediante el uso de la llama, la curva de la punta de la pipeta de pequeño diámetro. Esto le ayudará a manejar las fibras individuales. Llama a esterilizar. Cubra cada pipeta con HS antes de su uso.
2. Disección del músculo y digestión
- Para el propósito de estos experimentos, 8 semanas de edad SV129, Pax7 Créer Cklr; Rosa26TdTomato (Pax7Cre-TdTomato) y Myf5 Cre-; Rosa26YFP se utilizaron.
- Pulverizar extremidades traseras con 70% de etanol. Pin del animal (boca arriba) a un tablero de apoyo para tener una mejor comprensión de la extremidad posterior durante el procedimiento.
- Con la ayuda de tijeras, corte a través de toda la longitud de la extremidad y exponer el músculo subyacente. Retire la piel, así como cualquier pelo o la piel (Figura 1A).
- Con una tijera fina, cortar la fascia delgada sin dañar los músculos subyacentes. Visualmente localizar la EDL. La EDL se encuentra en el compartimento anterior de la extremidad posterior, justo debajo del tibial anterior (TA) muscular.
- Con la ayuda de dos pinzas, exponer los tendones distales.
- Cortar los tendones distales (tanto de la TA y EDL) con afiladas tijeras Vannas Cohann-primavera.
- Con la ayuda de fórceps mantener tanto TA y músculos EDL por sus tendones y delicadamente tirar de los músculos hacia arriba hacia el extremo proximal. En este punto usted debería ser capaz de ver con claridadel músculo EDL justo debajo del músculo TA. Ahora, separar el EDL desde el músculo TA tirando de los dos tendones en direcciones opuestas (Figura 1B). Evite estirar el músculo EDL al realizar esta operación ya que podría dañar las fibras musculares.
- Exponer el tendón EDL. Para visualizar mejor el tendón proximal que puede ayudar en este punto para eliminar el músculo TA. También puede ayudar a cortar un poco de tejido conectivo que rodea la rodilla (fig. 1C).
- Cortar el tendón proximal y retire con cuidado el EDL (Figura 1D).
- Al mantener el músculo a través de sus tendones, la transferencia a 2 ml de solución de colagenasa previamente preparado. Incubar a 37 ° C en un baño de agua.
Nota: para el aislamiento de fibra de éxito, es importante aislar el EDL de tendón a tendón para que la integridad de miofibras se mantiene. Pasos 2,3 a 2,9 se puede realizar bajo un microscopio de disección. Alternativamente, el uso de un magnidentificación externa de vidrio también puede ayudar a tener una mejor visión de los músculos. - Repita los pasos 2,3 a 2,9 por aislar a la EDL segundo. Transferir el EDL segundos en el mismo tubo. Para evitar la digestión irregular, el aislamiento de la EDL segundo debe ser completado no más de 5 minutos después de la primera.
Nota 1: tiempo de incubación puede ser necesario ajustar en función de la actividad de colagenasa. De incubación más largo o más corto puede ser necesario, dependiendo del tamaño, edad y / o condición muscular (por ejemplo, músculos fibróticos necesitar más tiempo en la digestión).
Nota 2: Si se examina el comportamiento de las células satélite en condiciones de reposo, durante el tiempo de agitación muscular digestión puede activar las células satélite 10. - Durante el tiempo de digestión, compruebe periódicamente el músculo para evitar el exceso de digestión. Detener la digestión cuando los músculos comienzan a relajarse y fibras musculares son visibles. Para detener la digestión, transferir cuidadosamente ambos músculos precalentado a una placa de Petri con 4 ml de DMEM (dissociatien el plato). Con la pipeta gran tamaño de diámetro para realizar esta operación.
Nota: evite overdigestion músculo, ya que provoca, inevitablemente, en el aislamiento de las fibras musculares hiper contratados.
3. La disociación individual miofibras y Cultura
- Para liberar fibras musculares, use la pipeta de vidrio de gran diámetro para vaciar el músculo con el medio caliente hasta que las fibras naturales comienzan a ser puesto en libertad. No triturar el músculo ya que inevitablemente dará lugar a dañar las fibras. Realizar este y los siguientes pasos bajo un microscopio de disección.
- Continuar liberando fibras musculares hasta que el número deseado. Si el plato se requiere a temperatura ambiente durante más de 10 min permitir una min 5 (mínimo) de la incubación a 37 ° C, 5% de CO 2 a re-equilibrar el medio.
Nota: si el medio alcanza temperaturas inferiores fisiológica (37 º C) durante un tiempo prolongado miofibras morirán. - Usando el tamaño pequeño orificio pipeta, transfer vivir fibras musculares individuales para un nuevo plato precalentado (el primero de tres lavados consecutivos). Manejar cada miofibra individualmente en lugar de transferir mayor parte de las miofibras todos a la vez. Si es necesario, se incuba a 37 ° C, 5% de CO 2 durante 10-15 min a re-equilibrar el medio.
- Repita el paso 2 para 3,3 veces más o hasta que todas las fibras musculares muertas y los desechos son eliminados. Se recomienda por lo menos tres lavados consecutivos para una correcta limpieza.
Nota: miofibras muertos aparecerán como corto e hiper contratado bajo la luz del microscopio. - Incubar las miofibras individuales a 37 ° C, 5% de CO 2 en el plato último lavado (DMEM solo) durante al menos un hora antes de cambiar a medio de cultivo. Esto permite miofibras para adaptarse a las condiciones in vitro en ausencia de suero. Se encontró que la cultura inmediata de miofibras en medio sin suero rico aumenta contracción de la fibra.
- Después de una hora, traslado miofibras a un plato precalentado nueva o para el formato de cultivo apropiadodependiendo de la aplicación de aguas abajo. Fibras de cultivo en medio de suero alto para permitir la activación de células satélite. Alternativamente, diferentes concentraciones de suero o extracto de embrión de pollo también se puede utilizar. Cambio de medio cada dos días.
4. Aplicaciones posteriores
- La inmunotinción. Miofibras en vivo se pueden fijar y teñir en cualquier punto de tiempo durante el aislamiento. La inmunofluorescencia se puede realizar en miofibras tanto flotantes como adjunto sustrato. Si la tinción miofibras flotantes, utilizar una pipeta de vidrio de pequeño diámetro para transferir miofibras de una solución a otra. Alternativamente, es posible mantener las miofibras en el mismo pozo a lo largo de todo el procedimiento y añadir / quitar las soluciones utilizando una pipeta de vidrio. Evitar la aspiración estándar ya que esto resultará en la eliminación de las miofibras así. En pocas palabras, eliminar completamente el medio de cultivo; miofibras fijos en paraformaldehído al 4% precalentado (PFA) durante 5 min. Ampliamente lavar en PBS varias veces. Incubamiofibras TE en 1% de glicina en PBS o en otras soluciones de temple estándar para minimizar las manchas PFA fondo. Si es necesario, permeabilizar las miofibras con 0,1% Triton X-100 en PBS durante 10 min seguido de un lavado de 5 min en PBS. Incubar las fibras en solución de bloqueo (10% de suero de caballo, 0,1% de Triton X-100, 1% NaN) durante 1 hora a temperatura ambiente o preferiblemente durante la noche a 4 ° C. Soluciones alternativas de bloqueo pueden ser utilizados, dependiendo del anticuerpo de interés. Lavar una vez en PBS durante 5 min. Incubar con el anticuerpo apropiado primario diluido en solución de bloqueo durante 1 hora a temperatura ambiente o durante la noche a 4 ° C. Lavar las fibras 3 veces en 5 min por lavado en PBS para eliminar cualquier anticuerpo no unido. Se incuba con el anticuerpo secundario apropiado durante 45 min a 1 hora a temperatura ambiente. Lavar 3 veces en 5 min por lavado en PBS. Contrateñir núcleos con 1 mg / ml DAPI. Si la tinción fibras flotantes, transferir cada fibra a un portaobjetos de vidrio para microscopio adecuado. Eliminar cualquier exceso de PBS o medio. Aplicar montaje medium y luego añadir el cubreobjetos. Proceder a visualizar miofibras bajo un microscopio de fluorescencia. Ver Figura 4 para inmunofluorescencia representante en miofibras EDL. Procedimientos alternativos para la tinción de fuertes fijadores se describen en Verma, M. et al. 11 y Wosniak, AC et al. 12.
- Oligonucleótido o transfección transitoria del plásmido. Miofibras en directo pueden ser transfectadas con siRNA plásmido o para el gen específico / s de interés. Cuando se utiliza siRNA, transfección doble se recomienda para gen desmontables eficiente. Se sugiere realizar la primera transfección después de las 8 horas de la aislamiento. Seis horas después de la transfección, reemplazar con medio fresco. Para la transfección siRNA, sugerimos de partida mediante el uso de una concentración final de 50 nM. Knockdown de la expresión génica pueden ser analizados por extracción de RNA o preferiblemente mediante inmunotinción.
- La infección viral. Infección de las miofibras en vivo es posible, aunque la incidencia de la célulamuerte es mayor que la transfección con oligo y la eficacia de la infección puede ser variable dependiendo de las condiciones musculares y la edad. Por ejemplo, intactos miofibras musculares adultas no son particularmente sensibles a la infección viral debido a la presencia de la lámina basal que se ha demostrado que proporcionan una barrera protectora contra la infección de acogida 13, 14. Vectores lentivirales se prefieren sobre los vectores retrovirales, ya que pueden infectar células quiescentes (no mitótico). Para la infección viral, es aconsejable que las fibras de cultivo sobre un plato o placa recubierta de Matrigel y dejar miofibras ajustarse a las condiciones de medios para el primero 24 hr.
- Vivo Imaging. Formación de imágenes en vivo de las miofibras es particularmente mucho tiempo y requiere un microscopio equipado con una 37 ° C, 5% de CO 2 cámara. Es útil para evaluar el comportamiento de las células satélite individuales. El trabajo realizado con esta técnica ha sido fundamental para el descubrimiento de la heterogeneidad de las células satélite y estudiar su comporvior en fibras (15 y 16).
Resultados
Aquí se describe el aislamiento de miofibras individuales del músculo EDL de ratones adultos. Miofibras exitosos producir dependerá de varios factores, como la actividad de la colagenasa o afecciones musculares o de edad. Lo más importante, el aislamiento del músculo a partir de tendón a los resultados del tendón en miofibras largos, intactos de músculo EDL. Figura 1 muestra un paso a paso la representación gráfica de la "tendón a tendón" aislamiento. Una vez que el músculo está completamente digerido, las miofibras se liberan mediante la aplicación de una presión suave al músculo. Figura 2A muestra una imagen representativa de un experimento de aislamiento miofibras después del primer lavado. En este punto, el cultivo contiene una mezcla de haces de fibras musculares individuales que aparecen como estructuras tubulares largas y brillante, hiper contraído miofibras que son oscuras y corto y los residuos del proceso de digestión. Al final de al menos tres lavados consecutivos, sólo miofibras vivos individuales deben permanecer en el diSH para el cultivo o análisis de aguas abajo (Figura 2B). Figura 2C muestra una fibra larga, en vivo, en comparación con una fibra de hiper contraído (C '). En el momento del aislamiento, las células satélite aparecen como protuberancias diminutas en la superficie de miofibras (Figura 3A). Si se mantiene en medio rico suero, las células satélite activar, proliferar, migrar y, finalmente, se funden en miotubos (B). Después de 15 días en cultivo, todos los miotubos expresar el reportero YFP Myf5 (C) lo que sugiere que la regeneración muscular en el adulto se lleva a cabo por las células que en algún momento durante su desarrollo había expresado el factor determinante miogénica Myf5. Todas las células satélite expresar el factor de transcripción asociado Pax7 casilla 17. La línea de ratón reportero Pax7Cre-TdTomato puede ser utilizado para rastrear las células satélite a través de la expresión de la señal fluorescente TdTomato (Figuras 3D y E). Figura 4 muestra un representante inmunidadesnofluorescence de doble Pax7 + / células satélite MyoD. Clásicamente doble Pax7 + / + MyoD células satélite son consideradas progenitoras musculares comprometidos proliferativas que, o bien completar el programa de diferenciación por abajo de la regulación Pax7 manteniendo al mismo tiempo la expresión de MyoD o regresar a la quietud por abajo de la regulación y el mantenimiento de Pax7 MyoD expresión 18
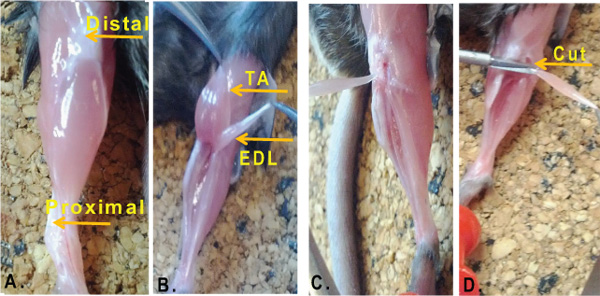
Figura 1. Aislamiento del músculo EDL de ratón miembro posterior. Un miembro posterior. De un ratón adulto 8 semanas de edad. Las flechas indican el distal (rodilla) y el tendón tendón proximal (pie). B. Posición anatómica del tibial anterior (TA) muscular y el extensor digitorum longus (EDL). C. Al mantener el EDL a través del tendón proximal, el músculo se tira hacia la rodilla para exponer el tendón distal. D. El tendón distal escortar y la EDL se libera.
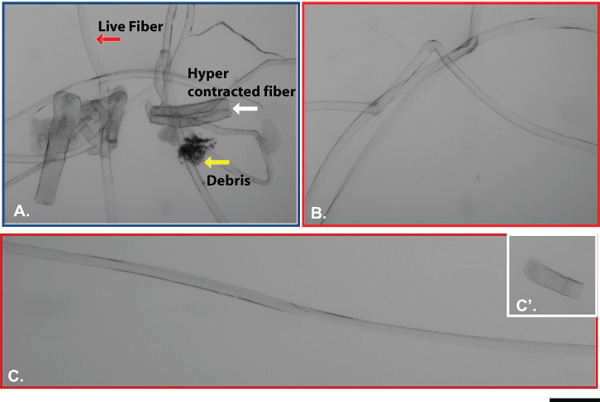
Figura 2. Los resultados representativos de un experimento de aislamiento miofibra sola. Un cuadro. Campo brillante de un experimento de aislamiento de miofibras en la primera etapa de lavado. Flecha roja indica miofibras en vivo, flecha blanca indica hiper miofibras contratados y la flecha amarilla indica las células, o miofibras escombros ECM. B. Después de lavados consecutivos en DMEM, sólo miofibras permanecer vivos. C y C '. Imagen representa un largo miofibra intacta vivo (C) y una hiper corto contraído miofibras (C '). Bar 10 micras. Las fotografías fueron tomadas con un microscopio Zeiss Axio Observer Z1 equipado con AxioCam HR.
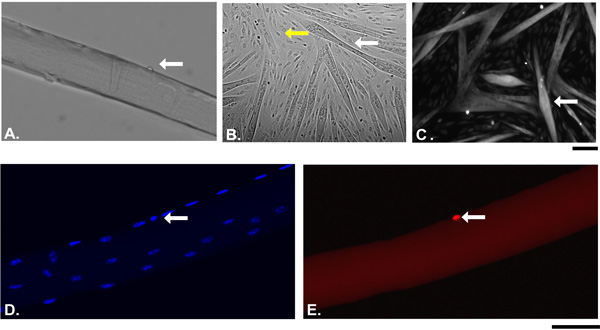
Figur e 3. Los resultados representativos de un experimento miofibra sola cultura. Un cuadro. Campo brillante de una miofibra sola, vivo con su célula satélite asociado (flecha) a la derecha después del aislamiento (Tiempo 0). B. Miofibras individuales se sembraron en Matrigel y se cultivaron en medio rico suero durante 15 días. Flecha blanca indica miotubos diferenciados en comparación con las células individuales (flecha amarilla) c. Miofibras individuales desde un Myf5Cre; RosaYFP ratón se cultivaron como en B. La flecha indica Myf5 miotubos derivados. D y E. Miofibras individuales desde Pax7Cre; TdTomato se aislaron y se fija inmediatamente después. Las flechas indican Pax7 célula positiva satélite en reposo, (E, rojo). Los núcleos se tiñeron con DAPI (D). Bar: 50 m. Las fotografías fueron tomadas con un microscopio Zeiss Axio Observer Z1 equipado con AxioCam HR.
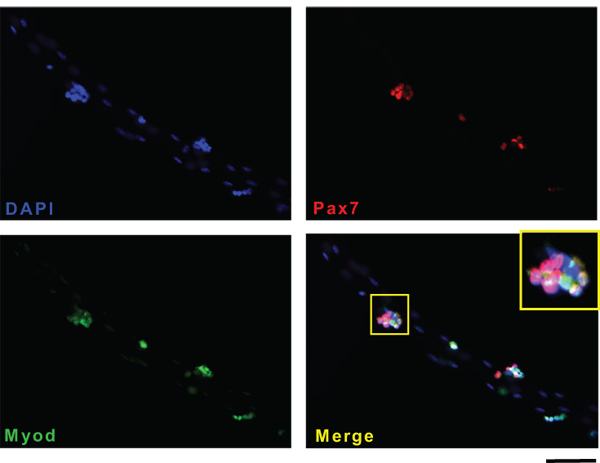
Figura 4. Ejemplo de tinción de inmunofluorescencia de células de satélite en las miofibras. Miofibras individuales se aislaron y cultivaron durante 72 horas en condiciones flotantes. Las células satélite en miofibras se tiñeron para el marcador específico de células satélite Pax7 (B, rojo) y el MyoD myogenic factor regulador (C, verde). Los núcleos se tiñeron con DAPI (A). Bares: 50 m. Las fotografías fueron tomadas con un microscopio Zeiss Axio Observer Z1 equipado con AxioCam HR.
| Disección del músculo (5 min cada músculo) |
|
| Digestión músculo (30-45 min) |
|
| Fibra de aislamiento |
|
| Cultura de fibra (hasta 3-4 semanas) |
|
Tabla 1. Descripción general del protocolo de aislamiento de miofibras. El protocolo de aislamiento de miofibras consta de 4 pasos principales. Para cada paso, el tiempo aproximado y los principales puntos críticos se discuten. Para un análisis detallado de cada paso, consulte el texto del protocolo.
Discusión
El aislamiento y cultivo de fibras musculares individuales de los músculos intactos proporciona un excelente modelo in vitro para estudiar el proceso de regeneración muscular. Una característica única de este sistema es la preservación de las células satélite en su entorno fisiológico debajo de la lámina basal. Lo más importante, la técnica se puede utilizar para investigar el comportamiento de células estaminales musculares, tanto en reposo y estados activados. En los últimos 20 años, el sistema de cultivo miofibra ha proporcionado una perspectiva interesante sobre la biología de la población de células satélite con respecto a los determinantes intrínsecos y extrínsecos. Por fibras individuales de cultivo, la heterogeneidad celular por satélite con respecto a las miofibras, tipo muscular o potencial regenerativo se ha abordado 15. Elaborar estudios utilizando imágenes en directo de las fibras individuales cultivados permitió la obtención de información en el patrón de migración de las células satélite 16. La adquisición de datos cuantitativos es unalso posible. Aunque mucho tiempo, proporciona información importante sobre la distribución y ocurrencia de eventos específicos (células madre relación asimétrica división, proliferación y diferenciación, etc.) Junto con las aplicaciones descritas anteriormente, la proteína o la extracción de ARN a partir de fibras individuales es también posible, aunque el aislamiento de la población pura de células satélite por FACS u otros medios puede proporcionar una mejor plataforma para investigar los cambios de expresión de proteína o gen a un nivel molecular. En nuestra experiencia, el paso más crítico para el aislamiento de fibra de éxito es el "tendón tendón" aislamiento (pasos 2,5 a 2,9 en el texto del protocolo). Esto garantiza que después de la digestión del músculo, las fibras se liberan de la EDL con un daño mínimo o no aumentando así su rendimiento en los pasos siguientes.
Divulgaciones
No hay intereses en conflicto.
Agradecimientos
Nos gustaría dar las gracias a Sarah Dick para proporcionar la lectura crítica y comentarios. MAR titular de la Cátedra de investigación de Canadá en Genética Molecular y es un becario internacional de investigación del Instituto Médico Howard Hughes. Este trabajo fue apoyado por becas a MAR de los Institutos Nacionales de Salud, el Instituto Médico Howard Hughes, los Institutos Canadienses de Investigación en Salud, la Asociación de la Distrofia Muscular y el Programa de Investigación de Canadá Presidencia.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo / Material | |||
| La colagenasa | Sigma-Aldrich | C0130-1g | Prepare frescos todo el tiempo para obtener resultados óptimos. Alícuotas adicionales de colagenasa sin diluir se puede almacenar a -20 ° C. |
| DMEM alto en glucosa + NaPyr | Invitrogen | 11995073 | Además de Pen / Strep es necesario reducir al mínimo las contaminaciones del aire |
| Caracterizado suero bovino fetal | Hyclone | SH30396.03 | Lote # KUJ35152 |
| El suero de caballo | Hyclone | SH300.74.03 | Lote # AVJ82494 |
| Extracto de embrión de pollo | Accurate Chemical | CE-650-T, Lote B7035010 | Evite la congelación-descongelación ciclos. |
| Matrigel | BD | Tienda de alícuotas a -20 ° C. Evite la congelación-descongelación ciclos. Guarde alícuotas diluidas a 4 ° C. | |
| Equipo | |||
| Cohann-Vannas Spring Scissor Blades-6mm Straight-Sharp | Herramientas Artes Ciencias | 15000-02 | |
| Extra fino Tijeras Iris-10.5cm | Herramientas Artes Ciencias | 14088-10 | |
| Moria-Iris pinzas curvas | Herramientas Artes Ciencias | 11373-12 | |
| Pipetas Pasteur | VWR | 14672-380 | 14672-200 |
| Diamond Pen | VWR | 52865-005 | |
| 60 * 15m m Petri Dish | VWR | 25384-092 | |
| Acrodisc 0,22 micras Filtro | VWR | CA28-145-477 | |
| Microscopio de disección StemiV6 | Zeiss | Una fuente de luz adicional puede ser necesaria para tener una vista mejor enfoque |
Referencias
- Bischoff, R. Proliferation of muscle satellite cells on intact myofibers in culture. Dev. Biol. 115 (1), 129-139 (1986).
- Rosenblatt, J. D., Lunt, A. I., Parry, D. J., Partridge, T. A. Culturing satellite cells from living single muscle fiber explants. In Vitro Cell Dev. Biol. Anim. 31 (10), 773-779 (1995).
- Anderson, J. E., Wozniak, A. C., Misunoya, W. Single muscle fiber isolation and culture for cellular molecular, pharmacological, and evolutionary studies. Methods Mol. Biol. 798, 85-102 (2012).
- Shefer, G., Yablonka-Reuveni, Z. Isolation and culture of skeletal muscle myofibers as a means to analyze satellite cells. Methods Mol. Biol. 290, 281-304 (2005).
- White, R. B., Biérinx, A. S., Gnocchi, V. F., Zammit, P. S. Dynamics of muscle fibre growth during postnatal mouse development. BMC Developmental Biology. 10 (21), 1-11 (2010).
- Siegel, A. L., Kuhlmann, P. K., Cornelison, D. D. Muscle satellite cell proliferation and association: new insights from myofiber time-lapse imaging. Skeletal Muscle. 2 (1), 1-7 (2011).
- Pasut, A., Oleynik, P., Rudnicki, M. A. Isolation of muscle stem cells by fluorescence activated cell sorting cytometry. Methods Mol. Biol. 798, 53-64 (2012).
- Engler, A. D., Griffin, M. A., Sen, S., Bonnemann, C. G., Sweeney, H. L., Discher, D. E. Myotubes differentiate optimally on substrates with tissue-like stiffness: pathological implications for soft or stiff microenvironments. J. Cell. Biol. 166 (4), 877-887 (2004).
- Boonen, K. J., Post, M. J. The muscle stem cell niche: regulation of satellite cells during regeneration. Tissue Eng. Part B Rev. 14 (4), 419-431 (2008).
- Wozniak, A. C., Anderson, J. E. Single-fiber isolation and maintenance of satellite cell quiescence. Biochem. Cell Biol. 83 (5), 674-676 (2005).
- Verma, M., Asukura, A. Efficient Single Muscle Fiber Isolation from Alcohol-Fixed Adult Muscle following β-Galactosidase Staining for Satellite Cell Detection. J. Histochem. Cytochem. 59 (1), 60-67 (2001).
- Wosniak, A. C., Pilipowics, O., et al. C-Met expression and mechanical activation of satellite cells on cultured muscle fibers. J. Histochem. Cytochem. 51 (11), 1437-1445 (2003).
- Huard, J., Feero, W. G., Watkin, S. C., Hoffman, E. P., Rosenblatt, J. D., Glorioso, J. C. The basal lamina is a physical barrier to herpes simplex virus-mediated gene delivery to mature muscle fibers. J. Virol. 70 (11), 8117-8123 (1996).
- Feero, W. G., Rosenblatt, J. D., et al. Viral gene delivery to skeletal muscle: insights on maturation-dependent loss of fiber infectivity for adenovirus and herpes simplex type 1 viral vectors. Hum. Gene Ther. 8 (4), 371-380 (1997).
- Kuang, S., Kuroda, K., grand, F. L. e., Rudnicki, M. A. Asymmetric self-renewal and commitment of satellite stem cells in muscle. Cell. 129 (5), 999-1010 (2007).
- Siegel, A. L., Atchison, K., Fisher, K. E., Davis, G. E., Cornelison, D. D. 3D timelapse analysis of muscle satellite cell motility. Stem Cells. 27 (10), 2527-2538 (2009).
- Seale, P., Sabourin, L. A., Girgis-Gabardo, A., Mansouri, A., Gruss, P., Rudnicki, M. A. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Zammit, P., Golding, J. P., Nagata, Y., Hudon, V., Partridge, T. A., Beauchamp, J. R. Muscle satellite cells adopt divergent fates: a mechanism for self-renewal. J. Cell Biol. 166 (3), 347-357 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados