Method Article
Trasplante de células musculares normales y malignas en inmunológico comprometido adultos de pez cebra
En este artículo
Resumen
Here, we present a protocol for cell transplantation of zebrafish skeletal muscle and embryonal rhabdomyosarcoma (ERMS) into adult immune compromised rag2E450fs homozygous mutant zebrafish. This protocol allows for the efficient analysis of regeneration and malignant transformation of muscle cells.
Resumen
El pez cebra se han convertido en una herramienta poderosa para evaluar el desarrollo, la regeneración, y el cáncer. Más recientemente, los protocolos de trasplante de células de aloinjerto se han desarrollado que el injerto permiso de células normales y malignas en irradiado, singénico, y adultos de pez cebra inmune comprometido. Estos modelos cuando junto con los protocolos de trasplante de células optimizados permiten la rápida evaluación de la función de células madre, la regeneración después de una lesión, y el cáncer. A continuación, presentamos un método para el trasplante de células de pez cebra adultos músculo esquelético y rabdomiosarcoma embrionario (SGDEA), un sarcoma pediátrico que comparte características con el músculo embrionario, en inmunológico comprometido adulto rag2 E450fs homocigotos pez cebra mutante. Es importante destacar que estos animales carecen de células T y han reducido la función de células B, facilitar el injerto de una amplia gama de tejidos de animales donantes no relacionados. Nuestros protocolos optimizados muestran que marcaron fluorescentemente prepar célula muscularciones de pez cebra transgénico α-actina-RFP injertan robusta cuando se implanta en la musculatura dorsal de rag2 peces mutantes homocigotos. También demostramos injerto de SGDEA fluorescentes transgénico donde la fluorescencia se limita a las células basadas en el estado de diferenciación. Específicamente, SGDEA se crearon en AB-deformación myf5-GFP; mylpfa-mCherry animales transgénicos dobles y tumores inyectados en el peritoneo de peces adultos inmune comprometido. La utilidad de estos protocolos se extiende a injerto de una amplia gama de células normales y malignas donantes que se puede implantar en la musculatura dorsal o el peritoneo de adultos de pez cebra.
Introducción
El pez cebra son un excelente modelo para estudios de regeneración, ya que pueden regenerar aletas amputados, así como un cerebro dañado, retina, médula espinal, corazón, músculo esquelético y otros tejidos 1. De células madre y regenerativas estudios en adultos de pez cebra se han centrado en gran medida en la caracterización de la regeneración en respuesta a una lesión, mientras que la identificación de las células madre y progenitoras de diversos tejidos de trasplante de células sólo recientemente se ha explorado 2. El pez cebra también se han convertido en cada vez más utilizado para el estudio del cáncer a través de la generación de modelos de cáncer de transgénicos que imitan la enfermedad humana 3-10.
En el caso del cáncer, los enfoques de trasplante de células se han vuelto ampliamente adoptado y permitir la evaluación dinámica de los procesos de cáncer importantes, incluyendo la auto-renovación 11, la heterogeneidad funcional 12,13, neovascularización 14, la proliferación,respuestas de terapia 15, y la invasión 16,17. Sin embargo, las células injertadas a menudo son rechazadas de peces receptores debido a la acogida defensas inmunitarias que atacan y matan el injerto 18. Varios métodos se han utilizado para superar el rechazo de las células injertadas. Por ejemplo, los animales receptores del sistema inmune pueden ser transitoriamente ablación por una baja dosis de irradiación gamma antes del trasplante 18,19. Sin embargo, el sistema inmune del destinatario se recuperará por 20 días después de la irradiación y matar a las células del donante 18. Alternativamente, el tratamiento de dexametasona se ha utilizado para suprimir la función de las células T y B, proporcionando más tiempo de supresión inmune acondicionado y facilitar el injerto de una amplia gama de tumores humanos de hasta 30 días 14. Estos experimentos requieren la dosificación del fármaco constante y se limitan al estudio de los tumores sólidos. Ensayos de injerto a largo plazo han utilizado líneas singénicas genéticamente idénticos 20 a 22, en donde el donante y recipicélulas tes son inmunes emparejado. Sin embargo, estos modelos requieren líneas transgénicas de interés que se cruzaron en el fondo singénica durante más de cuatro generaciones para producir líneas totalmente singénicas. Para obviar los problemas de rechazo inmunológico en los peces receptor, nuestro grupo ha desarrollado recientemente un comprometida rag2 E450fs homocigotos mutantes de línea (ZFIN designación alelo rag2 FB101) que han reducido la función de células T y B y que permiten el injerto de una amplia gama de tejidos 23 inmunológico. Modelos de ratón inmunocomprometidos similares se han utilizado ampliamente para el trasplante de células de ratón y de 24 tejidos humanos.
Aquí, se presentan métodos para el trasplante del músculo esquelético y rabdomiosarcoma embrionario (ERMS), un sarcoma pediátrico que comparte características con el músculo esquelético, en el rag2 recién descrito homocigotos pez cebra mutante. La disponibilidad de un pez cebra adultos inmune comprometidoamplía nuestra capacidad para llevar a cabo estudios de trasplante de células a gran escala para visualizar directamente y evaluar células madre auto-renovación dentro de los tejidos normales y malignos. Con este método, la etiqueta fluorescente preparaciones de células del músculo adulto de α-actina-RFP 25 pez cebra transgénico injertar robustamente en rag2 pez cebra mutante homocigótica después de la inyección en la musculatura dorsal. Por otra parte, se demuestra el injerto y la expansión de GFP myf5 primaria; mylpfa- mCherry SGDEA transgénicos después de la inyección intraperitoneal en rag2 E450fs homocigotos pez cebra mutante. La utilidad de estos protocolos va más allá de los ejemplos que se muestran y se puede aplicar fácilmente a los tejidos regenerativos de pez cebra adicionales y cánceres.
Protocolo
Todos los animales procedimientos fueron aprobados por el Hospital General de Massachusetts Subcomité de Investigación Animal Care, bajo protocolo # 2011N000127.
Sección 1. músculo esquelético Trasplante de células en rag2 Adulto E450fs Homocigótica pez cebra mutante
1. Preparación de adultos de pez cebra donantes células del músculo esquelético
- Obtener adultos de pez cebra transgénico que han marcado con fluorescencia muscular. En este experimento, 30 α-actina de pescado donante-RFP 25 se utilizaron para trasplantar 1 x 10 6 células por pez destinatario.
- Sacrificio de pez cebra de donantes en 1,6 mg / ml tricaína metanosulfonato (MS222) durante 10 min o hasta que no hay movimiento opérculo es evidente.
- Coloque el pescado donante en una toalla de papel absorbente y los impuestos especiales del músculo dorsal usando una hoja de afeitar limpia. El corte debe hacerse cerca del ano en un ángulo de 45 ° para maximizar la recogida de tejidos (como se indica en la Figura 1A ). Coloque el tejido diseccionado en un lugar limpio 10 cm placa de Petri.
- Añadir 500 l tampón de suspensión (0.9x pre-enfriada de tampón fosfato salino (PBS) suplementado con 5% de suero bovino fetal (FBS)) para el tejido diseccionado. Hasta el 10 de pez cebra donante se pueden colocar juntos en este volumen.
- Picar el tejido con una cuchilla de afeitar> 20 veces hasta que las células están en una suspensión uniforme. La musculatura dorsal entero se homogeneiza incluyendo la piel, los huesos y las aletas. Añadir 2 ml de tampón de suspensión. Usando una pipeta de 5 ml, se tritura la suspensión celular ≥20 veces para disociar las células.
- Se filtra la suspensión celular a través de un colador de malla 40 micras en un tubo cónico de 50 ml se colocó en hielo.
- Lavar la placa de Petri con un adicional de 2,5 ml de tampón de suspensión para recoger el tejido restante y filtrar a través de la misma filtro y tubo cónico, a un volumen final de 5 ml (10 peces donante puede ser utilizado por aislamiento).
NOTA: la piel, los huesos y aletas serán excluidos después de la filtración. - Si procede, se combinan suspensiones similares en el mismo tubo cónico.
- Cuente el número total de células viables utilizando colorante azul de tripano y un hemocitómetro.
- Reserva 500 l para citometría de flujo, si se desea (opcional, paso 2).
- Suspensión de células Centrifugar a 1000 xg, durante 10 min, a 4 ° C.
- Deseche las células sobrenadante y resuspender en 3,33 x 10 5 células / l (0.9x PBS + 5% FBS). En total, 3 l se inyectará por pez destinatario para un total de 1 x 10 6 células por destinatario (paso 3).
NOTA: Menos de 3 l de suspensión celular deben ser trasplantados a los peces receptor. Si el número de células es limitante, tan bajos como 5 x 10 4 células por beneficiario puede llevar a éxito del injerto (Tabla 1).
2. Análisis de citometría de flujo de Donantes del esqueleto de la célula muscular Preparación (Opcional)
- Aislar muscular de un tipo salvaje, pescado no transgénica como se indica in paso 1.1. Esta muestra sirve como el control negativo y es útil para configurar puertas citometría de flujo.
- Añadir un colorante de viabilidad apropiado. Por ejemplo, añadir 5 l de solución de DAPI (500 ng / l) a 500 l de preparación muscular. Vortex ligeramente antes del análisis. Adquirir 5 x 10 03 al 01 x 10 4 eventos. Analizar las muestras de control de tipo salvaje primero para colocar puertas seguido por análisis de las células musculares aisladas de peces transgénicos.
NOTA: citometría de flujo análisis se realiza generalmente dentro de 1 hora después de la disección del tejido muscular, tiempo durante el cual las células disecadas retienen más de 60% de viabilidad (Figura 2). Las células deben mantenerse en hielo en todo momento. La viabilidad celular total puede ser re-evaluado antes del trasplante utilizando colorante azul de tripano y un hemocitómetro.
3. intramuscular El trasplante de células del músculo esquelético en rag2 Adulto Homocigótica pez cebra mutante
- Limpie a 10 μ; L 26S G micro-jeringa por el dibujo en y expulsar solución de lejía al 10% (5 veces), seguido por etanol al 70% (5 veces), y luego seguido por tampón de suspensión (0.9x PBS + 5% FBS, 10 veces).
- Anestesiar 2-4 meses de edad homocigotos peces mutantes rag2 o pescado tipo de destinatario salvaje (como controles) añadiendo gotas individuales de metanosulfonato tricaína (MS222, 4 mg / ml solución madre) en una placa de Petri que contiene el pez en el agua del sistema hasta que los movimientos lentos opérculo y el pescado son todavía.
NOTA: Dosis de la anestesia tricaína dependerá de la edad y tamaño del pez cebra destinatario. - Coloque el pez cebra destinatario anestesiado sobre una toalla de papel húmedo o una esponja, con el lado izquierdo hacia arriba.
- Insertar la aguja de la jeringa en la musculatura latero-dorsal (refiérase a la Figura 1A). Asegúrese de que las inyecciones se realizan en un ángulo de 45 °. Inyectar 3 l de la suspensión celular (preparado en la etapa 1.12) por pez para un total de 1 x 10 6 células por receptor.
- Transferir cuidadosamente el pez cebra se inyecta en un tanque limpio usando una cuchara de plástico para recuperarse.
- Evaluar el pez cebra destinatario para las tasas de injerto a los 10, 20, 30 días después del trasplante por imágenes peces anestesiados bajo campo claro y microscopía de epifluorescencia.
Sección 2. Rabdomiosarcoma embrionario (SGDEA) Trasplante en adultos Homocigótica rag2 pez cebra mutante
4. ADN microinyección de embriones de pez cebra
- Linealizar el plásmido rag2-kRASG12D 7 digiriendo 10 g de ADN con XhoI, a 37 ° C durante 6 horas o O / N.
- Se purifica el ADN con fenol estándar: extracción con cloroformo y precipitar con etanol. Resuspender en 20 l de agua desionizada (alternativamente, columnas de purificación de fragmentos de ADN comerciales pueden ser utilizados).
- Ejecutar el ADN no digerido y digerido en un gel de agarosa al 1% y determinar la concentración de ADN bespectrómetro de lectura y. Alternativamente, ejecute muestras a 1: 1, 1: 5, 01:10 y diluciones en un gel de agarosa al 1% y cuantificar en comparación con una escalera de ADN.
- Preparar una mezcla de inyección a una concentración final de 15 ng / l de ADN rag2-kRASG12D digerido en 0.1 M KCl y 0,5x Tris-EDTA. La cantidad final de ADN se inyecta en 2 nl de volumen de inyección será 30 pg.
NOTA: Hasta tres construcciones de ADN diferentes pueden ser eficientemente co-inyectados en un máximo de 60 pg de ADN por embrión. Estos transgenes se integran en el genoma y co-expresados en el tumor en desarrollo 26. - Inyectar linealizado rag2-kRASG12D en embriones etapa de células esencialmente como se describe 27 en una cepa de pez cebra de interés (Figura 1B). Las inyecciones se deben realizar en la célula y no en la yema de huevo para una mayor eficiencia. En este experimento, un transgénico AB-doble cepa; myf5-GFP, se utilizó mylpfa-mCherry. Levante pez cebra mediante la cría estándar protocols 28.
NOTA: la supervivencia de inyección es a menudo depende de la cepa utilizada pez cebra. En promedio, 30% de los embriones inyectados desarrollará SGDEA. 300-600 embriones deben ser inyectados por experimento con el fin de garantizar que los tumores primarios suficientes GFP-positivas y mCherry-positivos se generan para el trasplante y el análisis.
5. Detección del SGDEA primarias en pez cebra larvas
- Observe el pez cebra inyectado desde 10 a 30 días después de la inyección para el surgimiento de SGDEA primarias visibles externamente.
- A los 30 días después de la inyección, anestesiar pez cebra destinatario añadiendo gotas individuales de metanosulfonato tricaína (MS222 4 mg solución / ml) en una placa de Petri que contiene agua del sistema pescado hasta movimientos opérculo lento y el pescado son todavía.
NOTA: Dosis de la anestesia tricaína dependerá de la edad y tamaño del pez cebra destinatario. Pez cebra con tumores primarios requieren dosis más bajas de tricaína. - Seleccione SGDEA portadora primariapeces que son myf5-GFP -positivo y mylpfa-mCherry -positivo, utilizando un microscopio de epifluorescencia.
6. SGDEA Tumor Preparación
- Sacrificar el pez cebra SGDEA-cojinete primaria seleccionada en 1,6 mg / ml tricaína metanosulfonato (MS222) durante 10 min o hasta que no hay movimiento opérculo es evidente.
- Procesar cada pez cebra portadores de tumor por separado. Coloque el pescado en un plato de Petri limpia y diseccionar alrededor del tumor utilizando una hoja de afeitar y unas pinzas finas (como se muestra en la Figura 1B). Transferir el tejido tumoral diseccionado a una placa de Petri limpia.
- Añadir 100 l de 0.9x pre-enfriada de tampón fosfato salino (PBS) suplementado con 5% de suero bovino fetal (FBS). Tejido Pique con una hoja de afeitar limpia> 20 veces hasta que las células se encuentran en una suspensión uniforme.
- Añadir 900 l de la misma solución tampón (0.9x PBS + 5% FBS), pipeta hacia arriba y abajo varias veces para disociar las células utilizando un 1000 l filtrados punta de la pipeta. Filtrar con un 40 &# 956; m colador de malla en el tubo cónico de 50 ml correspondiente. Almacenar en hielo.
- Lavar la placa de Petri con un adicional de 2-4 ml de tampón, y pasar a través del mismo filtro de malla y dentro del tubo cónico correspondiente.
- Centrifugar a 1000 xg, durante 10 min, a 4 ° C.
- Desechar el sobrenadante y resuspender en 100 l de tampón.
- Cuente el número total de células viables utilizando colorante azul de tripano y un hemocitómetro.
- Diluir las células a la concentración deseada en el mismo tampón (0.9x PBS + 5% FBS). Las células deben diluirse a 5 x 10 3 células / l para el trasplante 5 l por pez cebra destinatario en un total de 2,5 x 10 4 células por destinatario.
- Análisis de citometría de flujo también se puede realizar con una pequeña cantidad de la suspensión de la etapa 6.5 para cuantificar las proporciones relativas de células fluorescentes en la muestra.
NOTA: Dejar de lado 100 l de suspensión celular (después de filtración en el paso 3.5) y diluir con 400 lde 0.9x PBS + 5% FBS tampón de suspensión para el análisis de citometría de flujo. Para asegurar la selección adecuada, realizar análisis adicionales utilizando tejido tumoral transgénico sola o músculo aislado de tipo salvaje adulto, myf5-GFP y pescado mylpfa-mCherry. Realizar Citometría de Flujo esencialmente como se describe en el paso 2 de la sección 1.
7. El trasplante de SGDEA en adultos rag2 Homocigótica pez cebra mutante
- Limpiar a 10 l 26S G micro-jeringa por el dibujo en y expulsar 10% de solución de lejía (5 veces), seguido por etanol al 70% (5 veces), y luego seguido por tampón de suspensión (0.9x PBS + 5% FBS, 10 veces ).
- Anestesiar destinatario homocigotos peces mutantes rag2 añadiendo gotas individuales de metanosulfonato tricaína (MS222 4 mg solución madre / ml) en una placa de Petri que contiene el pez en el agua del sistema hasta los movimientos opérculo son lentos y el pescado son todavía.
- Coloque el pez cebra destinatario anestesiado sobre una toalla de papel húmeda o spoENS, con la parte ventral hacia arriba.
- Inyectar 5 l de la suspensión celular en la cavidad peritoneal (2,5 x 10 4 células por recipiente).
NOTA: La aguja de inyección se debe limpiar entre las inyecciones de diferentes tumores como se describe en el paso 4.1. 5 a 10 l pueden ser trasplantados de manera eficiente por vía intraperitoneal, dependiendo de receptor tamaño del pescado. El injerto del tumor se puede lograr mediante la inyección de 1 x 04 al 05 octubre x 10 5 células no clasificadas por pez receptor (Tabla 1). - Con cuidado, coloque el pez cebra destinatario en un tanque limpio con una cuchara de plástico.
- Evaluar el pez cebra destinatario para las tasas de injerto a los 10, 20, 30 días después del trasplante por imágenes peces anestesiados bajo campo claro y microscopía de epifluorescencia.
- Utilizar peces implantada para aplicaciones posteriores, incluyendo clasificación de células activadas por fluorescencia (FACS) para evaluar el estado de diferenciación (Figura 3H), Analy histológico estándarsis (Figura 3F), las respuestas de terapia de imagen 15, y / o trasplante de serie enfoques incluyendo análisis de dilución limitante 11.
Resultados
Un procedimiento para la preparación y el trasplante de células del músculo esquelético de los donantes transgénicos α-actina-RFP en inmunológico comprometido homocigotos pez cebra mutante rag2 se ha demostrado (sección Protocolo 1, la Figura 1A y Figura 2). Tejido muscular esquelético se preparó a partir donantes transgénicas α-actina-RFP y la suspensión de una sola célula resultante contenía 84,3% de células viables como se evaluó mediante exclusión DAPI siguiente análisis de citometría de flujo (Figura 2B). RFP-células positivas comprendían 35,3% de esta suspensión de células individuales (Figura 2C). El trasplante de células en el músculo esquelético dorsal de rag2 peces receptores homocigotos mutantes llevó al injerto consistente y fuerte según la evaluación de la diferenciación de las células individuales en fibras multinucleadas (1 x 10 6 células inyectadas por pez, Tabla 1, Figura 2D-I). Wild tipobeneficiario los peces no se injertan las fibras musculares durante el experimento de 30 días (n = 13). A los 10 días después del trasplante, 9 de cada 14 rag2 homocigotos pez cebra mutante contenía fibras musculares RFP-positivo cerca del sitio de la inyección (64,3%, Figura 2E, F). Es importante destacar que, músculo RFP-positivo injertado persistió a 30 días post-trasplante (Figura 2G-I), con un subconjunto de animales que se seguido por 115 días post-injerto y exhibiendo el injerto muscular robusto y persistente (datos no mostrados). Estos resultados son similares a los reportados previamente por nuestro grupo 23 utilizando el mismo protocolo (Tabla 1).
También hemos presentado un método para la generación, la preparación y el trasplante de células tumorales SGDEA en la cavidad peritoneal de los peces receptor rag2 homocigotos mutantes (Sección Protocolo 2, Figura 1B y la Figura 3). SGDEA se generaron en double transgénico myf5-GFP; pescado mylpfa-mCherry que se han mostrado para permitir la visualización de la heterogeneidad intra-tumoral y el análisis funcional de las subpoblaciones de células tumorales después del trasplante 11. Sin embargo, una mayor caracterización molecular de cada subpoblación es difícil porque los peces son pequeños cuando se desarrollan SGDEA entre 10 a 30 días de vida y el número de células tumorales son limitante para aplicaciones posteriores. Una solución es ampliar el número de células tumorales injertando SGDEA en pez cebra receptor adulto. Hasta la fecha, los experimentos similares se han completado usando CG1-deformación peces singénico y requerida en exceso de 4 generaciones de retrocruzamiento para desarrollar líneas singénicos que eran transgénicos para myf5-GFP; mylpfa-mCherry. Para evitar estos problemas, hemos demostrado la utilidad de rag2 comprometida homocigotos pez cebra receptor mutante inmune a injertarse SGDEA primarias de un pez cebra AB-deformación. Todos SGDEA primarios injertados en rag2 animales mutantes homocigotos, lo que facilita la expansión del tumor (Tabla 1). Resultados similares fueron reportados recientemente donde 24 de 27 rag2 pez cebra mutante homocigotos SGDEA injertadas, mientras que 0 de 7 hermanos de tipo salvaje injertados enfermedad 23. Un ejemplo representativo de un SGDEA injertado se muestra a los 30 días post-trasplante en la figura 3E. Injertadas SGDEA comparten características histológicas de rabdomiosarcoma embrionario, similar a la encontrada en el tumor primario (Figura 3B y 3F). FACS análisis confirmó que SGDEA contenían funcionalmente tumor distinto propagar células y las células diferenciadas que expresan myf5-GFP y / o mylpfa-mCherry. Las tasas de supervivencia tras el procedimiento de inyección intraperitoneal fueron más de 95%. Pez cebra destinatario comúnmente sucumben de carga tumoral después del punto 30 días el tiempo post-trasplante.
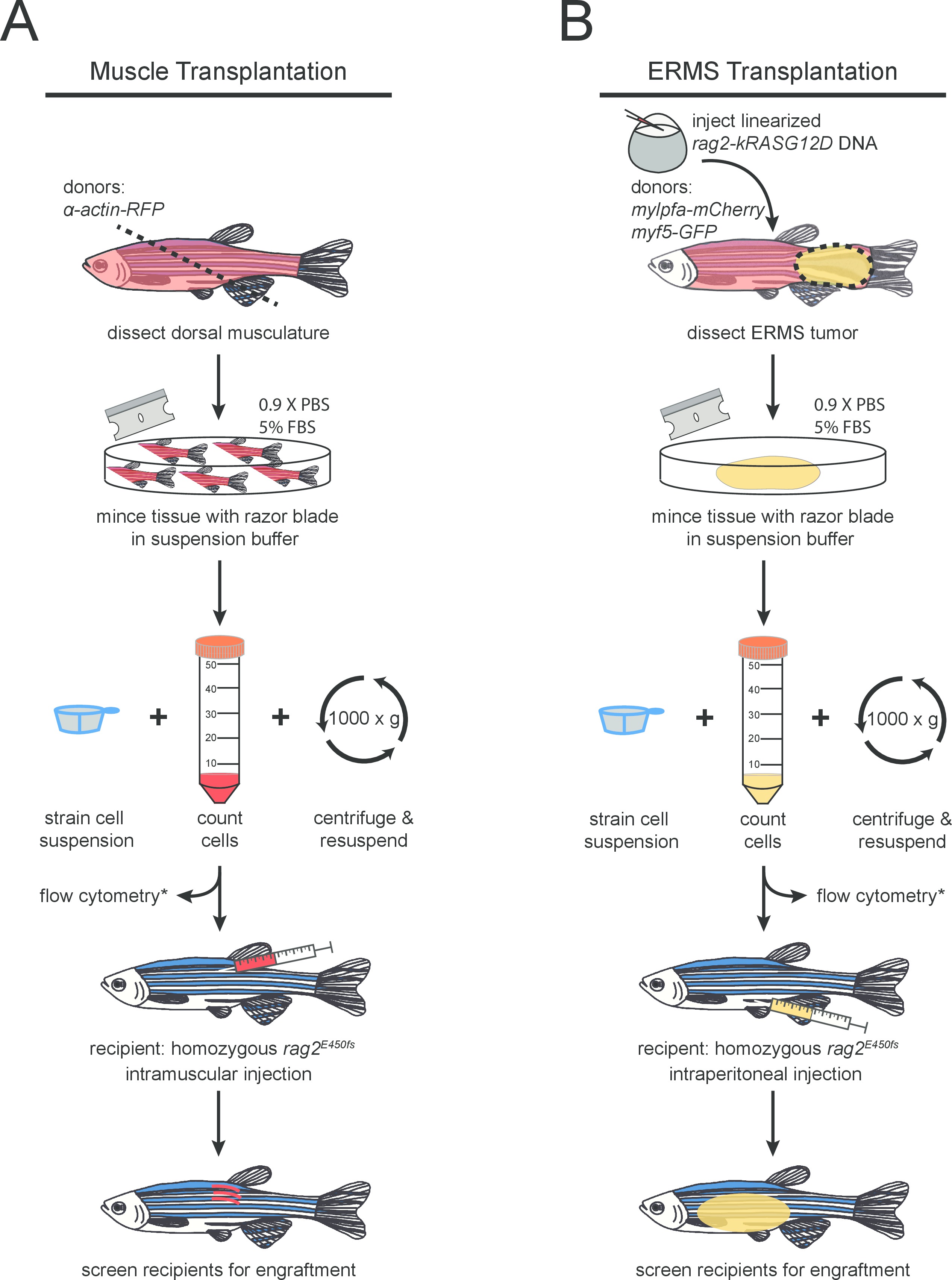
Figura 1. Protocolo esquemático para (A) normal y (B) maligno esquelético trasplante de células del músculo en rag2 mutante homocigoto el pez cebra. Los pasos opcionales están marcados con (*).

Figura 2. injerto muscular esquelético en rag2 homocigotos pez cebra mutante. (A) transgénico pez cebra donante α-actina-RFP. (B) La viabilidad celular de aislados de la suspensión de células de músculo evaluada por exclusión de colorante DAPI y citometría de flujo. (C) Proporción de células RFP-positiva se encuentran dentro de la suspensión de células de músculo desde el donante α-actina-RFP (rojo), en comparación con un control de tipo salvaje(Gris). (DE) Fusionada campo brillante y las imágenes fluorescentes de animales salvajes de tipo (D) o rag2 peces mutantes homocigotos (E) a los 30 días post-trasplante. tarifas (F) el injerto en el tiempo. Red denota número de animales injertados mientras gris muestra peces no injertado. Número de animales analizados en cada punto de tiempo se indican. (GI) Imágenes de magnificación de alta de la región de caja en el panel E se muestran a 10 (G), 20 (H) y 30 (I) días post-trasplante, que muestra la retención de las fibras musculares diferenciadas en el tiempo (puntas de flecha). Las barras de escala son iguales a 2 mm. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Trasplante de myf5-GFP; mylpfa-mCherry SGDEA en homocigotos mutantes rag2 . pez cebra (AD) rag2-kRASG12D SGDEA primarias inducidas surgen en AB-deformación myf5-GFP; pez cebra mylpfa-mCherry a los 30 días de vida. (EH) rag2 homocigotos pez cebra mutante injertado con SGDEA y analizados a los 30 días post-trasplante. (A, E) Fusionada campo brillante y las imágenes fluorescentes de SGDEA primarias y trasplantados. El área tumoral se describe y punta de flecha indica el sitio de inyección en E. (B, F) hematoxilina y eosina secciones de parafina de teñido primario (B) y SGDEA injertadas (F) muestra las zonas de aumento de celularidad asociado con el cáncer. (C,G) La viabilidad celular, evaluada por exclusión de colorante DAPI y citometría de flujo. (D, H) subpoblaciones de células tumorales fluorescentes, según lo evaluado por citometría de flujo. Las barras de escala son iguales a 2 mm (A, E) y 50 m (B, F). Por favor, haga clic aquí para ver una versión más grande de esta figura.
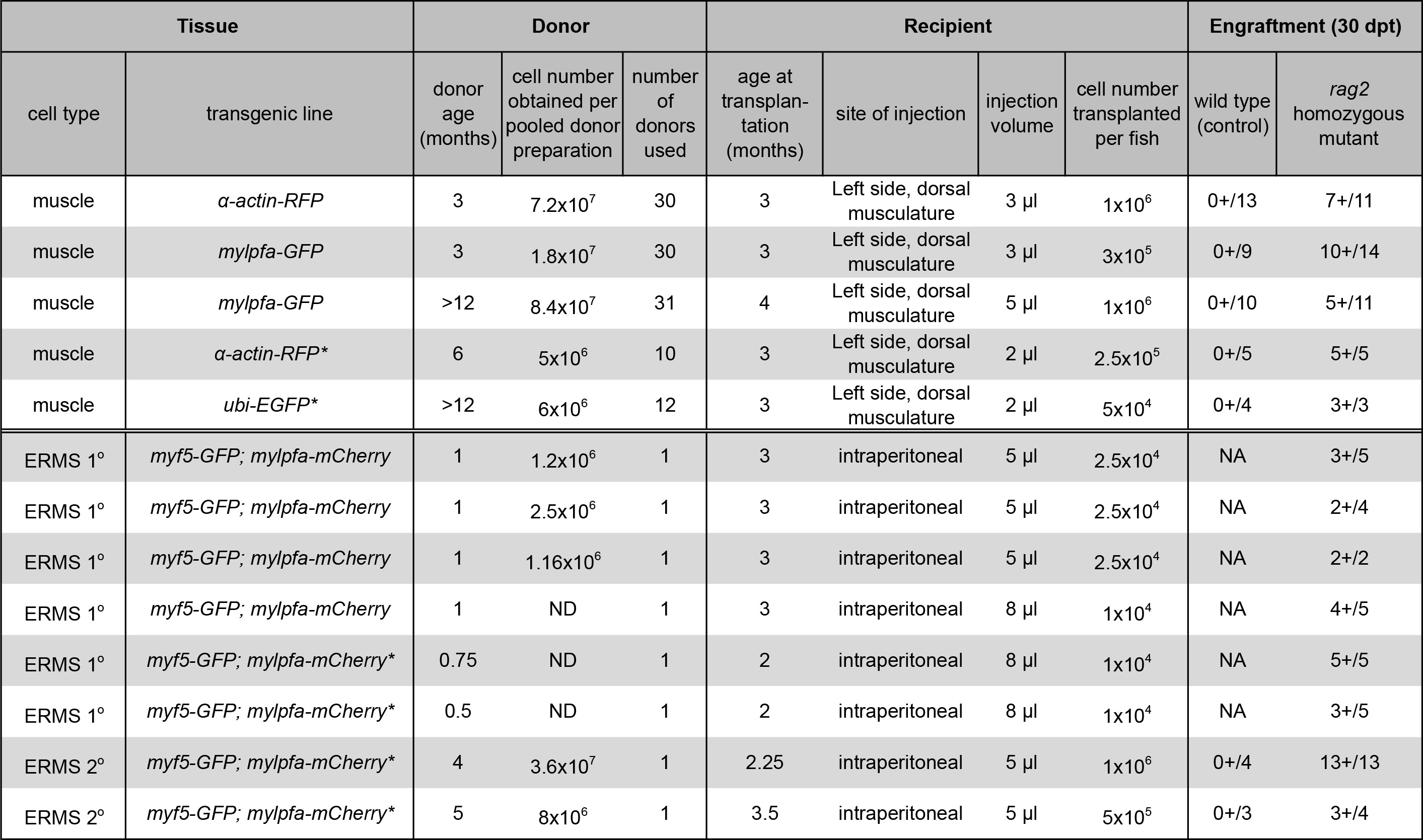
Tabla 1. Resultados de injerto para el músculo y el trasplante de células SGDEA. (*) Indica los datos reportados previamente usando las mismas técnicas 23. Los datos se reimprime con permiso de Nature Methods. Por favor, haga clic aquí para ver una versión más grande de esta tabla.
Discusión
Injerto eficiente y robusto del músculo esquelético dorsal adulta se alcanza con un método muy simple preparación de células seguido de la inyección de las células en la musculatura dorsal de rag2 peces mutantes homocigotos. En general, los procedimientos de inyección intramuscular fueron muy robusto, con un poco de muerte asociado inmediatamente después del procedimiento de implantación, que van desde 10% a 35% dependiendo del experimento. Optimización adicional que se centrará en la utilización de agujas de calibre más pequeños para inyección y desarrollo de aparato de inyección estacionario utilizando un microscopio y micromanipulador, lo que facilitará la facilidad de la implantación de células. Nuestro enfoque también utiliza células musculares sin ordenar de animales donantes y sólo contenía aproximadamente 30% de células progenitoras de músculo. El uso de líneas transgénicas reportero que etiquetan las células madre y el aislamiento FACS probablemente proporcionar suspensiones de células enriquecidas que conducen a un aumento de injerto en peces destinatario. Esquelético muscular cells también podría ser enriquecido y se cultivaron antes del trasplante, como se describió anteriormente 29. Sorprendentemente, nuestros resultados también indican que las etapas de establecimiento de nicho y la diferenciación del tejido muscular de los donantes se producen antes de 10 días después del trasplante, el establecimiento de este modelo como una plataforma experimental robusto y rápido para evaluar el injerto y la regeneración muscular. Por otra parte, estos experimentos contrastan fuertemente con las realizadas en ratones, donde se requiere antes de la lesión del músculo con cardiotoxina o bario cloruro de dos días antes del injerto 30,31. Es probable que el daño de la aguja producida durante el procedimiento de trasplante potencia el injerto mediante la estimulación de la producción de un entorno regenerativo en el animal receptor 32,33. También Prevemos que nuestro método se adapta fácilmente a el trasplante de tejido de músculo esquelético de pez cebra más joven, lo que permite la evaluación de mutaciones genéticas que afectan al desarrollo del músculo esquelético tempranopero llevar a la letalidad a los estadios larvarios.
También hemos proporcionado un protocolo detallado para el injerto de SGDEA pez cebra mediante inyección intraperitoneal en, rag2 peces mutantes no condicionado homocigotos. Este enfoque era útil para la expansión de los tumores primarios transgénicos dobles sin la necesidad de generar tumores dentro de una línea transgénica singénico. Nuestro trabajo reciente ha demostrado que los enfoques de trasplante de células proporcionan nuevos modelos experimentales para evaluar la sensibilidad de drogas SGDEA in vivo, donde un solo tumor se puede ampliar en miles de animales y evaluado por sus efectos sobre el crecimiento, la auto-renovación, y neovascularización 15. Además, hemos incorporado con éxito una amplia gama de tumores en rag2 peces mutantes homocigotos incluyendo células T leucemia linfoblástica aguda, el melanoma y SGDEA 23. Mirando hacia el futuro, prevemos estas líneas serán de utilidad para la evaluación de las propiedades funcionales importantes de cáncer envivo incluyendo la evaluación de la heterogeneidad intra-tumoral, invasión, metástasis, angiogénesis, y resistencia a la terapia. Por otra parte, la generación de rag2 homocigoto mutante de pescado en el ópticamente transparente Casper pez cebra cepa 34 probable facilitará formación directa de imágenes de muchas de estas características del cáncer.
En total, ofrecemos protocolos detallados para el éxito del injerto de músculo esquelético marcado con fluorescencia normal y maligno en a rag2 adultos homocigotos inmune pez cebra mutante comprometido.
Divulgaciones
The authors have no competing financial interests.
Agradecimientos
Este trabajo es apoyado por Alex Limonada Foundation (LMD), la Sociedad Americana del Cáncer (LMD), el MGH Howard Goodman Fellowship (LMD), y los Institutos Nacionales de Salud subvenciones R24OD016761 y 1R01CA154923 (DML). CNY Citometría de Flujo y Análisis de Flujo de imagen, instrumentación compartida número de concesión 1S10RR023440-01A1. IMT es financiado por una beca de la Fundación para la Ciencia y la Tecnología (Fundação para a Ciência e Tecnologia - FCT). QT es financiado por el Consejo de Becas de China. Damos las gracias a Angela Volorio por sus valiosos comentarios y consejos.
Materiales
| Name | Company | Catalog Number | Comments |
| Tris-EDTA buffer solution 1x | Sigma-Aldrich | 93283-100ML | Microinjection. Injection mix. |
| Potassium Chloride | Fisher Science Education | S77375-1 | Microinjection. Injection mix. |
| XhoI Restriction Enzyme | New England Biolabs | R0146S | Microinjection. Plasmid linearization. |
| QIAquick PCR Purification Kit | Qiagen | 28104 (50) or 28106 (250) | Microinjection. For purification of linearized plasmid up to 10 kb. |
| Phenol/Chloroform/Isoamyl Alcohol | Fisher Scientific | BP1753I-100 | Microinjection. For purification of linearized plasmid. |
| UltraPure Agarose, 500 g | Invitrogen | 16500-500 | Microinjection. Linearized plasmid quantification. |
| Nanodrop 2000 Spectrophotometer | Thermo Scientific | http://www.nanodrop.com/Productnd2000overview.aspx | Microinjection. Linearized plasmid quantification. |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Life Technologies | D1306 | flow cytometry/FACS |
| 5 ml polystyrene round bottom tube | BD Falcon | 352058 | flow cytometry collection tube |
| BD FACSAria II | BD Biosciences | Special Order Research Products (SORP) program | FACS |
| 5 ml polypropylene round bottom tube | BD Falcon | 352063 | FACS collection tube |
| BD LSR II | BD Biosciences | Special Order Research Products (SORP) program | flow cytometry |
| Phosphate Buffered Saline, pH 7.4 (1x) | Life Technologies | 10010-023 | transplantation |
| Fetal Bovine Serum | Omega Scientific | FB-01 | transplantation |
| Tricaine methanesulphonate (MS-222) | Western Chemical Inc. | http://www.wchemical.com/tricaine-s-ms-222.html | Transplantation. Anesthetic. Caution: Irritant. Irritating to eyes, respiratory system, and skin. |
| VWR Absorbent Bench Underpads | VWR | 56616-018 | Transplantation. Regular paper towels or sponge can be used as an alternative. |
| Singe Edge Industrial Razor Blades | VWR | 55411-050 | transplantation |
| Petri Dish, Polystryrene Disposable Sterile | VWR | 25384-302 | transplantation |
| Cell Strainer, 40 µm Nylon | Falcon-Corning Incorporated | 352340 | transplantation |
| 50 ml Centrifuge Tube | Corning Incorporated | 430828 | transplantation |
| Trypan Blue Stain (0.4%) | Life Technologies | 15250-061 | transplantation |
| Hemacytometer Set | Hausser Scientific | 1483 | transplantation |
| Hamilton syringe, fixed needle, volume 10 µl, needle size 26s ga (bevel tip) | Hamilton | 80366 | transplantation |
| Austin's A-1 Bleach, Commercial | James Austin Company | Transplantation. Any commercial solution can be used. | |
| Ethanol 190 Proof | Decon Labs, Inc. | DSP-MD.43 | Microinjection (linearized plasmid purification) and transplantation. Any commercial solution can be used. |
| High Speed Microcentrifuge, 300D Digital Microcentrifuge | Denville Scientific Inc. | C0265-24 | transplantation |
| Sorvall Legend XFR Centrifuge | Thermo Scientific | 75004539 | Transplantation. Catalog number for 120 V, 60 Hz (US). |
| 5 ml serological pipets | BD Falcon | 357529 | transplantation |
| Corning Stripettor Plus Pipetting Controller | Corning Incorporated | 4090 | Transplantation. Any automatic pipetting controller can be used. |
| Powder free examination gloves | All steps. Any commercial brand can be used. | ||
| Filter pipet tips and micropipettes | All steps. Any commercial brand can be used. | ||
| Dumont forceps #5 | Fine Science Tools | 11205-20 | transplantation |
| Fluorescent Stereomicroscope | Olympus | MVX10 | Scoring. Any appropriate fluorescent stereomicroscope can be used. |
| Olympus DP72 microscope digital camera | Olympus | DP72 | Scoring. Multiple adequate cameras for the selected imaging system can be used. |
Referencias
- Gemberling, M., Bailey, T. J., Hyde, D. R., Poss, K. D. The zebrafish as a model for complex tissue regeneration. Trends in genetics TIG. 29 (11), (2013).
- Boatman, S., Barrett, F., Satishchandran, S., Jing, L., Shestopalov, I., Zon, L. I. Assaying hematopoiesis using zebrafish. Blood cells, molecule., & diseases. 51 (4), 271-276 (2013).
- Langenau, D. M., Traver, D., et al. Myc-induced T cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Yang, H. W., Kutok, J. L., et al. Targeted Expression of Human MYCN Selectively Causes Pancreatic Neuroendocrine Tumors in Transgenic Zebrafish Targeted Expression of Human MYCN Selectively Causes Pancreatic Neuroendocrine Tumors in Transgenic Zebrafish. Cancer Research. , 7256-7262 (2004).
- Patton, E. E., Widlund, H. R., et al. BRAF mutations are sufficient to promote nevi formation and cooperate with p53 in the genesis of melanoma. Current Biology. 15 (3), 249-254 (2005).
- Sabaawy, H. E., Azuma, M., Embree, L. J., Tsai, H. -. J., Starost, M. F., Hickstein, D. D. TEL-AML1 transgenic zebrafish model of precursor B cell acute lymphoblastic leukemia. Proceedings of the National Academy of Sciences of the United States of America. 103 (41), 15166-15171 (2006).
- Langenau, D. M., Keefe, M. D., et al. . Effects of RAS on the genesis of embryonal rhabdomyosarcoma. Gene. 21 (11), 1382-1395 (2007).
- Le, X., Langenau, D. M., Keefe, M. D., Kutok, J. L., Neuberg, D. S., Zon, L. I. Heat shock-inducible Cre/Lox approaches to induce diverse types of tumors and hyperplasia in transgenic zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 104 (22), 9410-9415 (2007).
- Park, S. W., Davison, J. M., Rhee, J., Hruban, R. H., Maitra, A., Leach, S. D. Oncogenic KRAS induces progenitor cell expansion and malignant transformation in zebrafish exocrine pancreas. Gastroenterology. 134 (7), 2080-2090 (2008).
- Zhuravleva, J., Paggetti, J., et al. MOZ/TIF2-induced acute myeloid leukaemia in transgenic fish. British journal of haematology. 143 (3), 378-382 (2008).
- Ignatius, M. S., Chen, E. Y., et al. In vivo imaging of tumor-propagating cells, regional tumor heterogeneity, and dynamic cell movements in embryonal rhabdomyosarcoma. Suppl Data. Cancer cell. 21 (5), 680-693 (2012).
- Blackburn, J. S., Liu, S., et al. Clonal Evolution Enhances Leukemia-Propagating Cell Frequency. Cancer cell. 25 (3), 366-378 (2014).
- Blackburn, J. S., Langenau, D. M. Zebrafish as a model to assess cancer heterogeneity, progression and relapse. Disease model. 7 (7), 755-762 (2014).
- Zhao, C., Wang, X., et al. A novel xenograft model in zebrafish for high-resolution investigating dynamics of neovascularization in tumors. PloS one. 6 (7), e21768 (2011).
- Chen, E. Y., DeRan, M. T., et al. Glycogen synthase kinase 3 inhibitors induce the canonical WNT/β-catenin pathway to suppress growth and self-renewal in embryonal rhabdomyosarcoma. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5349-5354 (2014).
- Yang, X. -. J., Cui, W., et al. A novel zebrafish xenotransplantation model for study of glioma stem cell invasion. PloS one. 8 (4), e61801 (2013).
- Chapman, A., Fernandez del Ama, L., Ferguson, J., Kamarashev, J., Wellbrock, C., Hurlstone, A. Heterogeneous Tumor Subpopulations Cooperate to Drive Invasion. Cell Reports. 8 (8), 1-8 (2014).
- Smith, A. C. H., Raimondi, A. R., et al. High-throughput cell transplantation establishes that tumor-initiating cells are abundant in zebrafish T-cell acute lymphoblastic leukemia. Blood. 115 (16), 3296-3303 (2010).
- Iyengar, S., Houvras, Y., Ceol, C. J. Screening for melanoma modifiers using a zebrafish autochthonous tumor model. Journal of visualized experiments JoVE. (69), e50086 (2012).
- Mizgireuv, I., Revskoy, S. Y. Transplantable tumor lines generated in clonal zebrafish. Cancer research. 66 (6), 3120-3125 (2006).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291, 293-296 (1981).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. Journal of visualized experiments JoVE. (53), e2790 (2011).
- Tang, Q., Abdelfattah, N. S., et al. Optimized cell transplantation using adult rag2 mutant zebrafish. Nature methods. 11, 821-824 (2014).
- Zhou, Q., Facciponte, J., Jin, M., Shen, Q., Lin, Q. Humanized NOD-SCID IL2rg–/– mice as a preclinical model for cancer research and its potential use for individualized cancer therapies. Cancer letters. 344 (1), 13-19 (2014).
- Higashijima, S., Okamoto, H., Ueno, N., Hotta, Y., Eguchi, G. High-frequency generation of transgenic zebrafish which reliably express GFP in whole muscles or the whole body by using promoters of zebrafish origin. Developmental biology. 192 (2), 289-299 (1997).
- Langenau, D. M., Keefe, M. D. D. D., et al. Co-injection strategies to modify radiation sensitivity and tumor initiation in transgenic Zebrafish. Oncogene. 27 (30), 4242-4248 (2008).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), 1-5 (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Alexander, M. S., Kawahara, G., et al. Isolation and transcriptome analysis of adult zebrafish cells enriched for skeletal muscle progenitors). Muscl, & nerve. 43 (5), 741-750 (2011).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation, culture, and transplantation of muscle satellite cells. Journal of visualized experiments JoVE. (86), 1-7 (2014).
- Gerli, M. F. M., Maffioletti, S. M., Millet, Q., Tedesco, F. S. Transplantation of induced pluripotent stem cell-derived mesoangioblast-like myogenic progenitors in mouse models of muscle regeneration. J Vis Exp. (83), e50532 (2014).
- Siegel, A. L., Gurevich, D. B., Currie, P. D. A myogenic precursor cell that could contribute to regeneration in zebrafish and its similarity to the satellite cell. The FEBS journal. 280 (17), 4074-4088 (2013).
- Rowlerson, a., Radaelli, G., Mascarello, F., Veggetti, Regeneration of skeletal muscle in two teleost fish: Sparus aurata and Brachydanio rerio. Cell Tissue Res. 289 (2), 311-322 (1997).
- White, R. M., Sessa, A., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell stem cell. 2 (2), 183-189 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados