Method Article
Transplantation des cellules musculaires normales et malignes dans immunodéprimés adultes poisson zèbre
Dans cet article
Résumé
Here, we present a protocol for cell transplantation of zebrafish skeletal muscle and embryonal rhabdomyosarcoma (ERMS) into adult immune compromised rag2E450fs homozygous mutant zebrafish. This protocol allows for the efficient analysis of regeneration and malignant transformation of muscle cells.
Résumé
Poisson zèbre sont devenus un outil puissant pour l'évaluation du développement, de la régénération, et le cancer. Plus récemment, des protocoles de transplantation d'allogreffes de cellules ont été développées qui permettent la prise de greffe de cellules normales et malignes dans irradié, syngéniques, et le poisson zèbre adulte immunitaire compromis. Ces modèles lorsqu'il est couplé avec des protocoles de transplantation de cellules optimisées permettent pour l'évaluation rapide de la fonction des cellules souches, la régénération après une blessure, et le cancer. Ici, nous présentons une méthode pour la transplantation de cellules de poisson zèbre adulte muscle squelettique et rhabdomyosarcome embryonnaire (SAE), un sarcome pédiatrique qui partage des caractéristiques avec le muscle embryonnaire, dans immunitaire affaibli rag2 adulte E450fs poisson zèbre mutant homozygote. Fait important, ces animaux ne ont pas les cellules T et ont réduit la fonction des cellules B, ce qui facilite la prise de greffe d'un large éventail de tissus provenant d'animaux donneurs non apparentés. Nos protocoles optimisés montrent que marquées par fluorescence des cellules musculaires préparations de poisson zèbre transgénique α-actine-DP greffent robuste lorsqu'ils sont implantés dans la musculature dorsale de rag2 poisson mutant homozygote. Nous démontrons également greffe de ERMS fluorescentes transgénique où la fluorescence est confinée à des cellules fondées sur le statut de différenciation. Plus précisément, SAE ont été créés dans AB-souche myf5-GFP; mylpfa-mCherry animaux transgéniques et les tumeurs doubles injectés dans le péritoine des adultes immunitaire poissons compromise. L'utilité de ces protocoles pour la prise de greffe se étend d'une large gamme de cellules de donneurs normaux et malins qui peut être implanté dans la musculature dorsale péritoine ou de poisson zèbre adulte.
Introduction
Poisson zèbre constituent un excellent modèle pour les études de régénération parce qu'ils peuvent se régénérer ailettes amputés, ainsi que d'un cerveau endommagé, la rétine, la moelle épinière, le cœur, les muscles squelettiques et d'autres tissus 1. Les cellules souches et les études de régénération chez le poisson zèbre adultes ont surtout porté sur la caractérisation de la régénération en réponse à une blessure, alors que l'identification de cellules souches et progénitrices provenant de divers tissus par transplantation de cellules n'a été que récemment exploré deux. Poisson zèbre ont également de plus en plus utilisé pour l'étude du cancer par la génération de modèles de cancer transgéniques qui simulent la maladie humaine 3-10.
Dans le cadre du cancer, les approches de transplantation de cellules ont été largement adopté et permettre l'évaluation dynamique des processus de cancer importantes, y compris l'auto-renouvellement 11, hétérogénéité fonctionnelle 12,13, 14 néovascularisation, la prolifération,15 réponses thérapie, et l'invasion 16,17. Cependant, les cellules greffées sont souvent rejetées du poisson receveur doit accueillir les défenses immunitaires qui attaquent et tuent le greffon 18. Plusieurs méthodes ont été utilisées pour surmonter le rejet des cellules greffées. Par exemple, les animaux receveurs du système immunitaire peuvent être transitoirement ablation par faible dose gamma-irradiation avant la transplantation 18,19. Cependant, le système immunitaire destinataire récupérer en 20 jours post-irradiation et de tuer les cellules du donneur 18. Alternativement, le traitement de dexaméthasone a été utilisé pour supprimer T et la fonction des cellules B, fournissant plus à l'abri suppressive conditionné et de faciliter la prise de greffe d'un large éventail de tumeurs humaines jusqu'à 30 jours 14. Ces expériences nécessitent un dosage de médicament constante et sont limitées à l'étude des tumeurs solides. Essais de greffe à long terme ont utilisé lignes syngéniques génétiquement identiques 20-22, où le donneur et recipicellules ent sont à l'abri adapté. Cependant, ces modèles nécessitent lignées transgéniques d'intérêt à traverser dans le fond syngénique pendant plus de quatre générations pour produire des lignées entièrement syngéniques. Pour éviter les problèmes de rejet immunitaire des poissons bénéficiaire, notre groupe a récemment développé un immunitaire affaibli rag2 E450fs mutant homozygote (ZFIN désignation allèle rag2 FB101) ligne qui ont réduit la fonction des cellules T et B et qui permettent la prise de greffe d'un large éventail de tissus 23. Des modèles de souris immunodéficientes similaires ont été largement utilisés pour la transplantation de cellules de souris et de 24 tissus humains.
Ici, nous présentons les méthodes pour la transplantation de muscle squelettique et rhabdomyosarcome embryonnaire (SAE), un sarcome pédiatrique qui partage des caractéristiques avec le muscle squelettique, dans le rag2 nouvellement décrit homozygote poisson zèbre mutant. La disponibilité d'un poisson zèbre adulte immunitaire compromiseélargit notre capacité à réaliser des études de transplantation de cellules à grande échelle de visualiser et d'évaluer les cellules souches auto-renouvellement dans les tissus normaux et malins directement. Avec cette méthode, marqué par fluorescence préparations de cellules musculaires de l'adulte α-actine-DP 25 poisson zèbre transgénique greffer robuste dans rag2 poisson zèbre mutant homozygote après injection dans la musculature dorsale. De plus, nous démontrons la prise de greffe et l'expansion de GFP de myf5 primaire; mylpfa- ERMS transgéniques mCherry suivantes injection intrapéritonéale en rag2 E450fs poisson zèbre mutant homozygote. L'utilité de ces protocoles va au-delà des exemples illustrés et peut être facilement appliquée à tissus régénérables poisson zèbre supplémentaires et les cancers.
Protocole
Toutes les procédures d'animaux ont été approuvés par l'Hôpital général du Massachusetts Sous-comité sur la recherche de protection des animaux, sous le protocole # 2011N000127.
Section 1. Skeletal Muscle Cell Transplantation dans rag2 adultes E450fs homozygote Mutant poisson zèbre
1. Préparation de poisson zèbre adulte donateurs cellules musculaires squelettiques
- Obtenir le poisson zèbre adulte transgéniques qui ont marqué par fluorescence musculaire. Dans cette expérience, 30 α actine-DP donateurs poissons 25 ont été utilisées pour transplanter 1 x 10 6 cellules par poisson receveur.
- Sacrifice donateurs poisson zèbre dans 1,6 mg / ml méthanesulfonate de tricaïne (MS222) pendant 10 minutes ou jusqu'à ce que aucun mouvement de opercule est évident.
- Placer le poisson des bailleurs de fonds sur une serviette de papier absorbant et de l'accise du muscle dorsal en utilisant une lame de rasoir propre. La coupe doit être faite près de l'anus à un angle de 45 ° afin de maximiser la collecte de tissus (comme indiqué dans la figure 1A ). Placez le tissu disséqué dans un récipient propre 10 cm boîte de Pétri.
- Ajouter 500 ul de tampon de suspension (0.9x pré-réfrigérés Phosphate Buffer Saline (PBS) additionné de 5% de sérum bovin fœtal (FBS)) pour le tissu disséqué. Jusqu'à 10 donateurs poisson zèbre peut être placés ensemble dans ce volume.
- Hacher le tissu avec une lame de rasoir> 20 fois jusqu'à ce que les cellules sont en suspension uniforme. L'ensemble de la musculature dorsale est homogénéisé y compris la peau, les os et les nageoires. Ajouter 2 ml de tampon de suspension. L'utilisation d'une pipette de 5 ml, triturer la suspension cellulaire ≥20 fois pour dissocier les cellules.
- On filtre la suspension de cellules à travers une passoire de 40 pm dans un tube conique de 50 ml, placé sur de la glace.
- Laver la boîte de Pétri avec une 2,5 ml supplémentaires de tampon de suspension pour recueillir le tissu restant et filtrer à travers le même tamis et un tube conique, à un volume final de 5 ml (10 poissons donneurs peut être utilisé par isolat).
REMARQUE: la peau, les os et les ailerons seront exclus après filtration. - Le cas échéant, combiner suspensions similaires dans le même tube conique.
- Comptez le nombre total de cellules viables en utilisant un colorant bleu trypan et un hémocytomètre.
- Réserver 500 pi pour cytométrie de flux, si on le souhaite (en option, l'étape 2).
- Centrifuger la suspension cellulaire à 1000 xg pendant 10 min, à 4 ° C.
- Jeter cellules surnageant et remettre à 3,33 x 10 5 cellules / ul (0.9x PBS + 5% de FBS). Au total, 3 pi sera injecté par poisson bénéficiaire pour un total de 1 x 10 6 cellules par bénéficiaire (étape 3).
REMARQUE: Moins de 3 pi de suspension cellulaire devraient être transplantés dans le poisson receveur. Si le nombre de cellules est de limiter, aussi bas que 5 x 10 4 cellules par bénéficiaire peuvent conduire à la prise de greffe réussie (tableau 1).
2. Analyse de cytométrie en flux donateurs Skeletal Muscle Préparation des cellules (Facultatif)
- Isoler musculaire à partir d'un type sauvage, le poisson non transgénique comme indiqué in l'étape 1.1. Cet échantillon sert de témoin négatif et est utile pour définir portes cytométrie de flux.
- Ajouter un colorant de viabilité appropriée. Par exemple, ajouter 5 pi de solution stock DAPI (500 ng / ul) 500 pi de préparation musculaire. Vortex légèrement avant l'analyse. Acquérir 5 x 10 3 à 1 x 10 4 événements. Analyser les échantillons témoins de type sauvage de placer d'abord les portes suivie d'une analyse des cellules musculaires isolées à partir de poisson transgénique.
REMARQUE: analyse de cytométrie en flux est généralement effectuée à l'intérieur de 1 h après la dissection du tissu musculaire, temps pendant lequel les cellules disséquées conservent plus de 60% de viabilité (figure 2). Les cellules doivent être conservés dans la glace en tout temps. La viabilité cellulaire total peut être réévalué avant la transplantation utilisant un colorant bleu trypan et un hémocytomètre.
3. intramusculaire transplantation de cellules de muscle squelettique en rag2 adultes homozygote Mutant poisson zèbre
- Nettoyez à 10 μ; L 26S G micro-seringue par aspiration et expulsion de solution à 10% d'agent de blanchiment (5 fois), suivi par 70% d'éthanol (5 fois), puis suivi par un tampon de suspension (0,9x PBS + 5% de FBS, 10 fois).
- Anesthésier vieille 2-4 mois poisson mutant rag2 homozygote ou poisson sauvage type de destinataire (comme contrôles) en ajoutant de simples gouttes de méthanesulfonate de tricaïne (MS222, 4 mg / ml solution mère) dans une boîte de Pétri contenant le poisson dans l'eau du système jusqu'à ce que les mouvements de l'opercule lents et les poissons sont encore.
REMARQUE: Dose de tricaïne anesthésie dépend de l'âge et la taille de poisson zèbre bénéficiaire. - Placez le poisson zèbre anesthésiés bénéficiaire sur une serviette en papier ou une éponge humide, avec le côté gauche vers le haut.
- Insérez l'aiguille de la seringue dans la musculature latéro-dorsale (voir la figure 1A). Veiller à ce que les injections sont effectuées à un angle de 45 °. Injecter 3 pi de la suspension cellulaire (préparé à l'étape 1.12) par poisson pour un total de 1 x 10 6 cellules par destinataire.
- Soigneusement transférer le poisson zèbre injectée dans un réservoir propre en utilisant une cuillère en plastique pour récupérer.
- Évaluer poisson zèbre bénéficiaire pour les taux de prise de greffe à 10, 20, 30 jours après la transplantation par imagerie poissons anesthésiés sous champ lumineux et microscopie à épifluorescence.
Section 2. embryonnaire rhabdomyosarcome (SAE) en transplantation adulte homozygote rag2 Mutant poisson zèbre
4. microinjection d'ADN des embryons de poissons zèbres
- Linéariser le plasmide rag2 kRASG12D-7 par digestion de 10 ug d'ADN avec Xhol, à 37 ° C pendant 6 heures ou O / N.
- Purifier l'ADN par standard au phénol: chloroforme et précipiter l'extraction avec de l'éthanol. Remettre en suspension dans 20 pi d'eau déminéralisée (en variante, des colonnes de purification de fragments d'ADN commerciaux peuvent être utilisés).
- Exécuter l'ADN non digéré et digéré sur un gel d'agarose à 1% et de déterminer la concentration d'ADN by lecture du spectromètre. Alternativement, les échantillons fonctionner à 1: 1, 1: 5 et 1:10 dilutions sur un gel d'agarose à 1% et à quantifier par rapport à une échelle d'ADN.
- Préparer un mélange d'injection à une concentration finale de 15 ng / pl de l'ADN digéré rag2-kRASG12D dans 0,1 M de KCl et 0,5 x Tris-EDTA. La quantité finale d'ADN injectée dans deux nl du volume d'injection sera de 30 p.
REMARQUE: Jusqu'à trois constructions d'ADN différentes peuvent être co-injectées efficacement dans un maximum de 60 pg d'ADN par embryon. Ces transgènes se intégrer dans le génome et co-exprimés dans la tumeur en développement 26. - Injecter linéarisé rag2-kRASG12D dans des embryons de stade unicellulaire essentiellement comme décrit 27 dans une souche de poisson zèbre d'intérêt (figure 1B). Les injections doivent être effectuées dans la cellule et non pas dans le jaune pour une plus grande efficacité. Dans cette expérience, un AB-souche à double transgénique; myf5-GFP, mylpfa-mCherry a été utilisé. Soulever le poisson zèbre en utilisant élevage standard pPROTOCOLES 28.
REMARQUE: la survie de l'injection dépend souvent de la souche de poisson zèbre utilisé. En moyenne, 30% des embryons injectés développera SAE. 300-600 embryons doivent être injectés par expérience afin de se assurer que suffisamment de GFP-positives et mCherry-positifs tumeurs primaires sont générés pour la transplantation et l'analyse.
5. Dépistage de la SAE primaires chez le poisson zèbre larves
- Observez le poisson zèbre injecté 10 à 30 jours après l'injection pour l'émergence d'ERMS primaires visibles de l'extérieur.
- Après l'injection de 30 jours, anesthésier le poisson zèbre bénéficiaire en ajoutant de simples gouttes de méthanesulfonate de tricaïne (MS222 4 mg / ml solution mère) dans une boîte de Pétri contenant de l'eau du système de poisson jusqu'à mouvements opercule lente et poissons sont toujours.
REMARQUE: Dose de tricaïne anesthésie dépendra de l'âge et la taille de poisson zèbre bénéficiaire. Zebrafish porteuses de tumeurs primaires nécessitent des doses plus faibles de tricaïne. - Sélectionnez SAE portant primairepoissons qui sont myf5-GFP -positif et mylpfa-mCherry -positif, en utilisant un microscope à épifluorescence.
6. ERMS tumeur Préparation
- Sacrifiez principal sélectionné poisson zèbre SAE portant à 1,6 mg / ml méthanesulfonate de tricaïne (MS222) pendant 10 minutes ou jusqu'à ce que aucun mouvement de opercule est évident.
- Traiter chaque poisson zèbre porteur d'une tumeur séparément. Placer le poisson dans une boîte de Pétri propre et disséquer autour de la tumeur en utilisant une lame de rasoir et une pince fine (comme représenté sur la figure 1B). Transférer le tissu tumoral disséqués à une boîte de Pétri propre.
- Ajouter 100 ul de 0,9x pré-réfrigérés Phosphate Buffer Saline (PBS) supplémenté avec 5% de sérum bovin fœtal (FBS). tissu Mince avec une lame de rasoir propre> 20 fois jusqu'à ce que les cellules sont en suspension uniforme.
- Ajouter 900 ul du même tampon (0.9x PBS + 5% FBS), pipette de haut en bas à plusieurs reprises pour dissocier les cellules en utilisant un 1000 ul filtrés pointe de la pipette. Filtrer à travers un 40 &# 956; m passoire dans la 50 ml tube conique correspondante. Stocker sur la glace.
- Laver la boîte de Pétri avec un supplément de 2-4 ml de tampon, et passer par le même passoire et dans le tube conique correspondante.
- Centrifuger à 1000 xg pendant 10 min, à 4 ° C.
- Rejeter le surnageant et remettre en suspension dans 100 ul de tampon.
- Comptez le nombre total de cellules viables en utilisant un colorant bleu trypan et un hémocytomètre.
- Diluer cellules à concentration voulue dans le même tampon (0.9x PBS + 5% de FBS). Les cellules doivent être dilués à 5 x 10 3 cellules / ul pour la transplantation 5 pi par poisson zèbre de destinataire dans un total de 2,5 x 10 4 cellules par destinataire.
- Analyse de cytométrie en flux peut également être effectuée avec une petite quantité de la suspension provenant de l'étape 6.5 pour quantifier les proportions relatives de cellules fluorescentes dans l'échantillon.
REMARQUE: Mettez de côté 100 pi de suspension cellulaire (après filtrage à l'étape 3.5) et diluer avec 400 pide 0.9x PBS + 5% de FBS tampon de suspension pour l'analyse de cytométrie en flux. Pour assurer déclenchement appropriée, effectuer des analyses complémentaires en utilisant des tissus de la tumeur transgénique unique ou musculaire isolé de type sauvage adultes, myf5-GFP et le poisson-mylpfa mCherry. Effectuer cytométrie en flux essentiellement comme décrit dans l'étape 2 de la section 1.
7. La transplantation de SAE en adultes rag2 homozygote Mutant poisson zèbre
- Nettoyer une 10 ul 26S G micro-seringue par aspiration et expulsion de solution à 10% d'agent de blanchiment (5 fois), suivi par 70% d'éthanol (5 fois), puis suivi par un tampon de suspension (0,9x PBS + 5% de FBS, 10 fois ).
- Anesthésier destinataire homozygote poisson mutant rag2 en ajoutant de simples gouttes de méthanesulfonate de tricaïne (MS222 4 mg / ml de solution mère) dans une boîte de Pétri contenant le poisson dans l'eau du système jusqu'à ce que les mouvements de l'opercule sont lents et les poissons sont encore.
- Placez le poisson zèbre anesthésiés bénéficiaire sur une serviette en papier humide ou spoESN, avec la face ventrale vers le haut.
- Injecter 5 ul de la suspension de cellules dans la cavité peritoneale (2,5 x 10 4 cellules par receveur).
REMARQUE: L'aiguille d'injection doit être nettoyé entre les injections de différentes tumeurs comme décrit dans l'étape 4.1. 5-10 ul peuvent être efficacement transplantées par voie intrapéritonéale, selon la taille du poisson receveur. Tumor prise de greffe peut être réalisée en injectant une x 10 4 à 5 x 10 5 cellules non triées par poisson receveur (tableau 1). - Placez délicatement le poisson zèbre bénéficiaire dans un réservoir propre avec une cuillère en plastique.
- Évaluer poisson zèbre bénéficiaire pour les taux de prise de greffe à 10, 20, 30 jours après la transplantation par imagerie poissons anesthésiés sous champ lumineux et microscopie à épifluorescence.
- Utiliser poissons greffées pour les applications en aval y compris le tri cellulaire activé par fluorescence (FACS) pour évaluer l'état de différenciation (figure 3H), analy histologique normeSIS (figure 3F), la thérapie d'imagerie réponses, 15 et / ou la transplantation de série approches notamment en limitant l'analyse de dilution 11.
Résultats
Une procédure pour la préparation et la transplantation de cellules musculaires squelettiques de donateurs transgéniques α-actine-DP dans immunodéprimé homozygote poisson zèbre mutant rag2 a été démontrée (service du protocole 1, la figure 1A et la figure 2). Tissu musculaire squelettique a été préparé à partir de donneurs transgéniques α-actine-DP et la suspension cellulaire unique résultant contenait des cellules viables de 84,3% tel qu'évalué par l'exclusion DAPI après analyse de cytométrie en flux (figure 2B). DP cellules positives comprennent 35,3% de cette suspension cellulaire unique (figure 2C). La transplantation de cellules dans le muscle dorsal squelettique rag2 homozygote poisson receveur mutant a conduit à la prise de greffe cohérente et forte comme évalué par la différenciation des cellules simples en fibres multinucléées (1 x 10 6 cellules injectées par poisson, tableau 1, figure 2D-I). Sauvage typedestinataire poissons n'a pas réussi à greffer fibres musculaires plus de l'expérience de 30 jours (n = 13). En 10 jours après la transplantation, 9 sur 14 rag2 homozygote poisson zèbre mutant contenaient les fibres musculaires de la DP-positif à proximité du site d'injection (64,3%, figure 2E, F). Surtout, greffé muscle DP positif persistait à 30 jours post-transplantation (Figure 2G-I), avec un sous-ensemble d'animaux étant suivis pendant 115 jours post-prise de greffe et présentant prise de greffe musculaire solide et persistante (données non présentées). Ces résultats sont similaires à ceux rapportés précédemment par notre groupe 23 selon le même protocole (tableau 1).
Nous avons également présenté une méthode pour la production, de la préparation et de la transplantation de cellules tumorales ERMS dans la cavité péritonéale de poisson receveur rag2 homozygote mutant (section Protocole 2, figure 1B et la figure 3). SAE ont été générés dans double-GFP transgénique Myf5; mylpfa poisson-mCherry qui ont été montré pour permettre la visualisation de l'hétérogénéité intra-tumorale et l'analyse fonctionnelle des sous-populations de cellules tumorales après une transplantation 11. Toutefois, outre la caractérisation moléculaire de chaque sous-population est difficile parce que les poissons sont petits quand ils développent SAE entre 10 et 30 jours de vie et le nombre de cellules tumorales sont un facteur limitatif pour les applications en aval. Une solution consiste à élargir le nombre de cellules de la tumeur en greffant dans ERMS destinataire adultes poisson zèbre. À ce jour, des expériences similaires ont été menées à l'aide de CG1 souche poissons syngénique et requis en excédent des quatre générations de rétrocroisements pour développer des lignées syngéniques qui étaient transgéniques pour myf5-GFP; mylpfa-mCherry. Pour contourner ces problèmes, nous avons démontré l'utilité de rag2 immunitaire compromis homozygote mutant destinataire poisson zèbre de greffer ERMS primaires d'un poisson zèbre AB-souche. Tous ERMS primaires greffées en rag2 animaux mutants homozygotes, ce qui facilite l'expansion de la tumeur (Tableau 1). Des résultats similaires ont été signalés récemment, où 24 des 27 rag2 poisson zèbre mutant homozygote des ERMS greffées, tandis que 0 de sept frères et sœurs de type sauvage greffées maladie 23. Un exemple représentatif d'un ERMS greffé est représenté à 30 jours après la transplantation dans la figure 3E. Greffées ERMS part caractéristiques histologiques de rhabdomyosarcome embryonnaire, semblable à celle trouvée dans la tumeur primaire (figure 3B et 3F). Analyse FACS a confirmé que ERM contenait fonctionnellement tumeur distincte de multiplication des cellules et des cellules différenciées qui expriment myf5-GFP et / ou mylpfa-mCherry. Les taux de survie après la procédure d'injection intrapéritonéale étaient au-delà de 95%. poisson zèbre du bénéficiaire succombent souvent à partir de la charge tumorale après la post-transplantation point de temps de 30 jours.
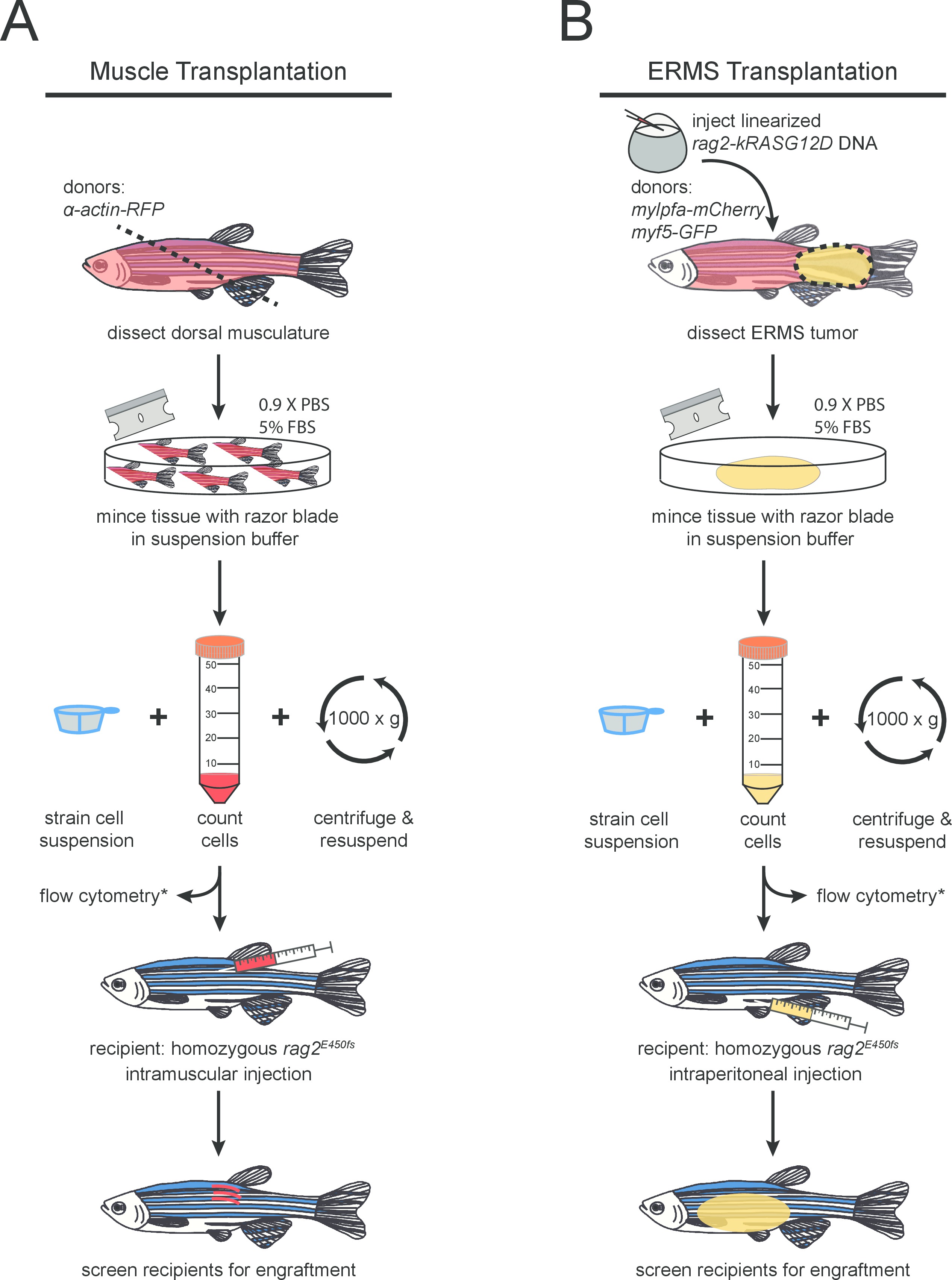
La figure schématique 1. Le protocole pour (A) normal et (B) d'une greffe de cellules malignes dans le muscle squelettique rag2 mutant homozygote poisson zèbre. étapes facultatives sont marquées d'un (*).

Figure 2. la prise de greffe musculaire squelettique dans rag2 homozygote poisson zèbre mutant. (A) de poisson zèbre transgénique des donateurs α-actine-DP. (B) La viabilité des cellules isolées de la suspension de cellules de muscle évaluée par exclusion au colorant DAPI et cytométrie de flux. (C) Proportion des cellules de la DP-positif trouvés dans la suspension de cellules musculaires de α-actine-DP donneur (rouge), par rapport à un témoin de type sauvage(Gris). (DE) a fusionné champ lumineux et images fluorescentes d'animaux sauvages de type (D) ou homozygote rag2 poisson mutant (E) à 30 jours post-transplantation. taux (F) la prise de greffe au fil du temps. Rouge désigne nombre d'animaux greffés tandis grise montre les poissons non greffées. Nombre d'animaux analysés à chaque point de temps sont indiqués. (GI) des images de grossissement élevés de région encadrée dans le panneau E représenté en 10 (G), 20 (H) et 30 (I) jours après la transplantation, montrant rétention des fibres musculaires différenciées dans le temps (pointes de flèches). barres échelle égale 2 mm. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3. La transplantation de myf5-GFP; mylpfa-mCherry ERMS en mutant homozygote rag2 poisson zèbre. (AD) rag2-kRASG12D ERMS primaires induites provenant d'AB-souche myf5-GFP; poisson zèbre mylpfa-mCherry à 30 jours de la vie. (EH) rag2 homozygote poisson zèbre mutant greffés avec le SAE et analysées à 30 jours post-transplantation. (A, E) a fusionné champ lumineux et images fluorescentes de ERMS primaires et transplantées. zone tumorale est décrite et flèche indique le site d'injection E. (B, F) et des sections de hématoxyline éosine teinté de paraffine primaire (B) et SAE greffées (F) montrant les zones de cellularité accrue associée au cancer. (C,G) la viabilité cellulaire évaluée par DAPI exclusion de colorant et cytométrie de flux. (D, H) des sous-populations de cellules tumorales fluorescentes, telle qu'elle est évaluée par cytométrie en flux. barres échelle égale à 2 mm (A, E) et 50 um (B, F). Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
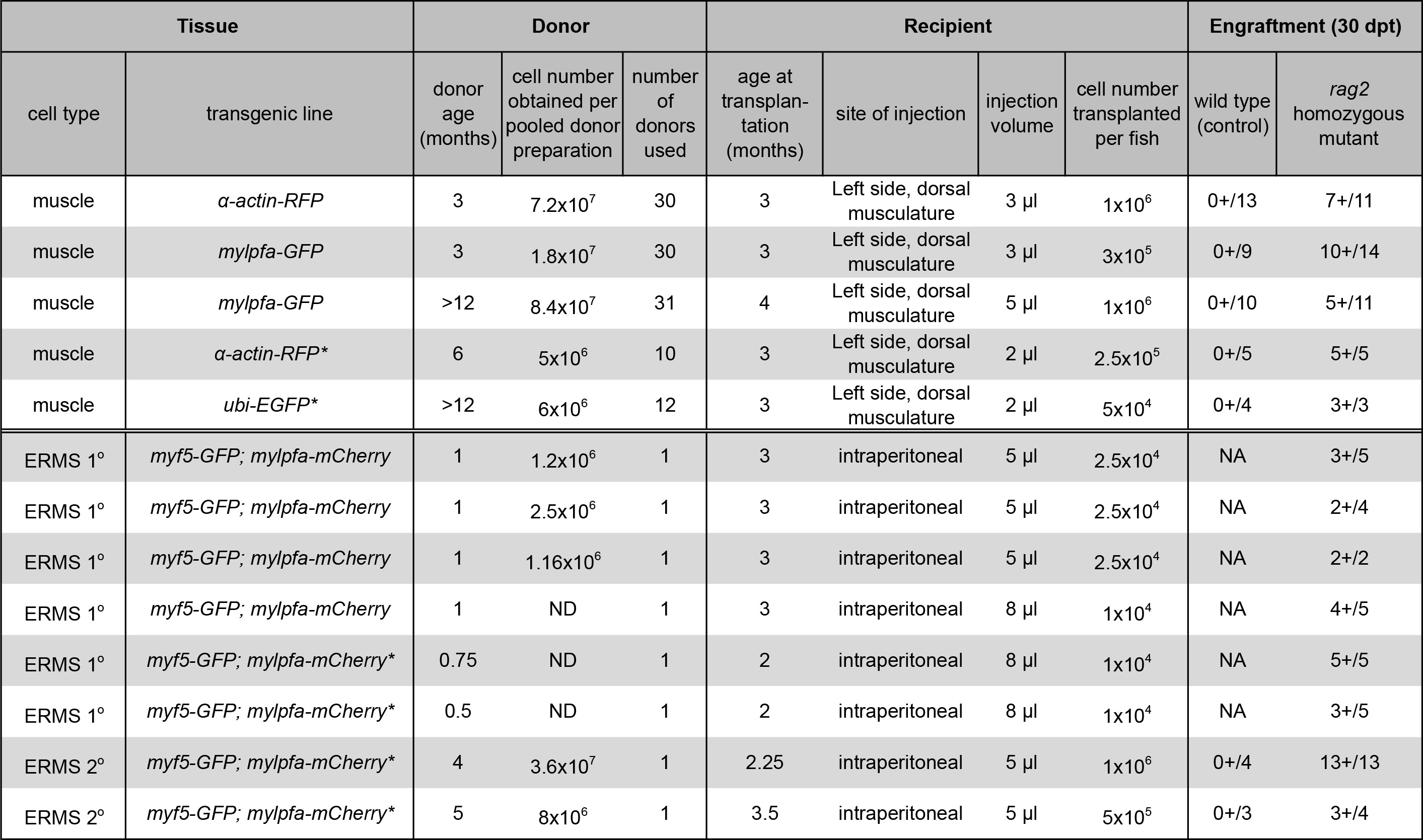
Tableau 1. Résultats pour la prise de greffe musculaire et ERMS transplantation de cellules. (*) Indique les données déclarées précédemment en utilisant les mêmes techniques 23. Données est reproduit avec la permission de Nature Methods. Se il vous plaît cliquer ici pour voir une version plus grande de cette table.
Discussion
Greffe efficace et robuste des adultes dorsale muscle squelettique a été atteint avec une méthode très simple de préparation de cellules suivie d'une injection de cellules dans la musculature dorsale de rag2 poissons mutant homozygote. En général, les procédures d'injection intramusculaire étaient très robuste, avec une certaine mortalité associées suivant immédiatement la procédure d'implantation allant de 10% à 35% en fonction de l'expérience. Optimisation supplémentaire sera probablement centrer sur l'utilisation de petites aiguilles de calibre pour l'injection et le développement d'un appareil d'injection stationnaire en utilisant un microscope et micromanipulateur, ce qui facilitera la facilité d'implantation de cellules. Notre approche a également utilisé des cellules musculaires non triés des animaux donneurs et ne contenait environ 30% de cellules progénitrices musculaires. L'utilisation de lignées rapporteuses transgéniques qui marquent les cellules souches et FACS isolement probablement fournir des suspensions de cellules enrichies qui conduisent à une augmentation de la prise de greffe dans le poisson receveur. Muscle squelettique caunes pourrait également être enrichi et mis en culture avant la transplantation, comme décrit précédemment 29. Remarquablement, nos résultats indiquent également que les étapes de mise en place de niche et la différenciation du tissu musculaire des bailleurs de fonds se produisent avant 10 jours après la transplantation, l'établissement de ce modèle comme une plate-forme expérimentale robuste et rapide d'évaluer la prise de greffe musculaire et la régénération. En outre, ces expériences contrastent fortement avec celles accomplies dans les souris, où avant la blessure de muscle avec cardiotoxine ou de chlorure de baryum est requis deux jours avant la prise de greffe 30,31. Il est probable que le dommage de l'aiguille produit pendant la procédure de transplantation potentialise la prise de greffe en stimulant la production d'un milieu de régénération à l'intérieur de l'animal receveur 32,33. Nous envisageons également que notre méthode sera facilement adapté à la transplantation de tissu musculaire squelettique du jeune poisson zèbre, permettant d'évaluer les mutations génétiques qui affectent le développement du muscle squelettique débutmais conduire à létalité au stade larvaire.
Nous avons également fourni un protocole détaillé pour la greffe de ERMS poisson zèbre par injection intrapéritonéale en, rag2 poisson mutant non conditionné homozygote. Cette approche est utile pour l'expansion des tumeurs primaires doubles transgéniques sans avoir besoin de générer des tumeurs au sein d'une lignée transgénique syngénique. Nos travaux récents ont montré que les approches de transplantation de cellules fournissent de nouveaux modèles expérimentaux pour évaluer ERMS sensibilité au médicament in vivo, où une seule tumeur peut être étendu à des milliers d'animaux et d'évaluer les effets sur la croissance, l'auto-renouvellement, et la néovascularisation 15. En outre, nous avons greffé avec succès une large gamme de tumeurs en poissons mutant homozygote rag2 y compris T leucémie lymphoblastique aiguë, le mélanome, et SAE 23. En regardant vers l'avenir, nous envisageons ces lignes seront utiles pour évaluer les propriétés fonctionnelles de cancer chez lesvivo, y compris l'évaluation de l'hétérogénéité intra-tumorale, l'invasion, la métastase, l'angiogenèse et la résistance à la thérapie. En outre, la production de poissons rag2 homozygote mutant dans le optiquement clair Casper souche de poisson zèbre 34 sera probablement faciliter imagerie directe d'un grand nombre de ces caractéristiques du cancer.
Au total, nous fournissons des protocoles détaillés pour la prise de greffe réussie du muscle squelettique marqué par fluorescence normale et maligne à rag2 adultes homozygote mutant poisson zèbre immunitaire compromis.
Déclarations de divulgation
The authors have no competing financial interests.
Remerciements
Ce travail est soutenu par Alex Lemonade stand Fondation (DML), American Cancer Society (DML), le MGH Howard Goodman Fellowship (DML), et les instituts nationaux américains de la santé accorde R24OD016761 et 1R01CA154923 (DML). CNY cytométrie de flux de base et débit d'analyse d'images, l'instrumentation partagée numéro de subvention 1S10RR023440-01A1. IMT est financé par une bourse de la Fondation pour la Science et de la Technologie (Fundação para a Ciência e Tecnologia de - FCT). QT est financé par le China Scholarship Council. Nous remercions Angela Volorio pour ses commentaires et des conseils utiles.
matériels
| Name | Company | Catalog Number | Comments |
| Tris-EDTA buffer solution 1x | Sigma-Aldrich | 93283-100ML | Microinjection. Injection mix. |
| Potassium Chloride | Fisher Science Education | S77375-1 | Microinjection. Injection mix. |
| XhoI Restriction Enzyme | New England Biolabs | R0146S | Microinjection. Plasmid linearization. |
| QIAquick PCR Purification Kit | Qiagen | 28104 (50) or 28106 (250) | Microinjection. For purification of linearized plasmid up to 10 kb. |
| Phenol/Chloroform/Isoamyl Alcohol | Fisher Scientific | BP1753I-100 | Microinjection. For purification of linearized plasmid. |
| UltraPure Agarose, 500 g | Invitrogen | 16500-500 | Microinjection. Linearized plasmid quantification. |
| Nanodrop 2000 Spectrophotometer | Thermo Scientific | http://www.nanodrop.com/Productnd2000overview.aspx | Microinjection. Linearized plasmid quantification. |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Life Technologies | D1306 | flow cytometry/FACS |
| 5 ml polystyrene round bottom tube | BD Falcon | 352058 | flow cytometry collection tube |
| BD FACSAria II | BD Biosciences | Special Order Research Products (SORP) program | FACS |
| 5 ml polypropylene round bottom tube | BD Falcon | 352063 | FACS collection tube |
| BD LSR II | BD Biosciences | Special Order Research Products (SORP) program | flow cytometry |
| Phosphate Buffered Saline, pH 7.4 (1x) | Life Technologies | 10010-023 | transplantation |
| Fetal Bovine Serum | Omega Scientific | FB-01 | transplantation |
| Tricaine methanesulphonate (MS-222) | Western Chemical Inc. | http://www.wchemical.com/tricaine-s-ms-222.html | Transplantation. Anesthetic. Caution: Irritant. Irritating to eyes, respiratory system, and skin. |
| VWR Absorbent Bench Underpads | VWR | 56616-018 | Transplantation. Regular paper towels or sponge can be used as an alternative. |
| Singe Edge Industrial Razor Blades | VWR | 55411-050 | transplantation |
| Petri Dish, Polystryrene Disposable Sterile | VWR | 25384-302 | transplantation |
| Cell Strainer, 40 µm Nylon | Falcon-Corning Incorporated | 352340 | transplantation |
| 50 ml Centrifuge Tube | Corning Incorporated | 430828 | transplantation |
| Trypan Blue Stain (0.4%) | Life Technologies | 15250-061 | transplantation |
| Hemacytometer Set | Hausser Scientific | 1483 | transplantation |
| Hamilton syringe, fixed needle, volume 10 µl, needle size 26s ga (bevel tip) | Hamilton | 80366 | transplantation |
| Austin's A-1 Bleach, Commercial | James Austin Company | Transplantation. Any commercial solution can be used. | |
| Ethanol 190 Proof | Decon Labs, Inc. | DSP-MD.43 | Microinjection (linearized plasmid purification) and transplantation. Any commercial solution can be used. |
| High Speed Microcentrifuge, 300D Digital Microcentrifuge | Denville Scientific Inc. | C0265-24 | transplantation |
| Sorvall Legend XFR Centrifuge | Thermo Scientific | 75004539 | Transplantation. Catalog number for 120 V, 60 Hz (US). |
| 5 ml serological pipets | BD Falcon | 357529 | transplantation |
| Corning Stripettor Plus Pipetting Controller | Corning Incorporated | 4090 | Transplantation. Any automatic pipetting controller can be used. |
| Powder free examination gloves | All steps. Any commercial brand can be used. | ||
| Filter pipet tips and micropipettes | All steps. Any commercial brand can be used. | ||
| Dumont forceps #5 | Fine Science Tools | 11205-20 | transplantation |
| Fluorescent Stereomicroscope | Olympus | MVX10 | Scoring. Any appropriate fluorescent stereomicroscope can be used. |
| Olympus DP72 microscope digital camera | Olympus | DP72 | Scoring. Multiple adequate cameras for the selected imaging system can be used. |
Références
- Gemberling, M., Bailey, T. J., Hyde, D. R., Poss, K. D. The zebrafish as a model for complex tissue regeneration. Trends in genetics TIG. 29 (11), (2013).
- Boatman, S., Barrett, F., Satishchandran, S., Jing, L., Shestopalov, I., Zon, L. I. Assaying hematopoiesis using zebrafish. Blood cells, molecule., & diseases. 51 (4), 271-276 (2013).
- Langenau, D. M., Traver, D., et al. Myc-induced T cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Yang, H. W., Kutok, J. L., et al. Targeted Expression of Human MYCN Selectively Causes Pancreatic Neuroendocrine Tumors in Transgenic Zebrafish Targeted Expression of Human MYCN Selectively Causes Pancreatic Neuroendocrine Tumors in Transgenic Zebrafish. Cancer Research. , 7256-7262 (2004).
- Patton, E. E., Widlund, H. R., et al. BRAF mutations are sufficient to promote nevi formation and cooperate with p53 in the genesis of melanoma. Current Biology. 15 (3), 249-254 (2005).
- Sabaawy, H. E., Azuma, M., Embree, L. J., Tsai, H. -. J., Starost, M. F., Hickstein, D. D. TEL-AML1 transgenic zebrafish model of precursor B cell acute lymphoblastic leukemia. Proceedings of the National Academy of Sciences of the United States of America. 103 (41), 15166-15171 (2006).
- Langenau, D. M., Keefe, M. D., et al. . Effects of RAS on the genesis of embryonal rhabdomyosarcoma. Gene. 21 (11), 1382-1395 (2007).
- Le, X., Langenau, D. M., Keefe, M. D., Kutok, J. L., Neuberg, D. S., Zon, L. I. Heat shock-inducible Cre/Lox approaches to induce diverse types of tumors and hyperplasia in transgenic zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 104 (22), 9410-9415 (2007).
- Park, S. W., Davison, J. M., Rhee, J., Hruban, R. H., Maitra, A., Leach, S. D. Oncogenic KRAS induces progenitor cell expansion and malignant transformation in zebrafish exocrine pancreas. Gastroenterology. 134 (7), 2080-2090 (2008).
- Zhuravleva, J., Paggetti, J., et al. MOZ/TIF2-induced acute myeloid leukaemia in transgenic fish. British journal of haematology. 143 (3), 378-382 (2008).
- Ignatius, M. S., Chen, E. Y., et al. In vivo imaging of tumor-propagating cells, regional tumor heterogeneity, and dynamic cell movements in embryonal rhabdomyosarcoma. Suppl Data. Cancer cell. 21 (5), 680-693 (2012).
- Blackburn, J. S., Liu, S., et al. Clonal Evolution Enhances Leukemia-Propagating Cell Frequency. Cancer cell. 25 (3), 366-378 (2014).
- Blackburn, J. S., Langenau, D. M. Zebrafish as a model to assess cancer heterogeneity, progression and relapse. Disease model. 7 (7), 755-762 (2014).
- Zhao, C., Wang, X., et al. A novel xenograft model in zebrafish for high-resolution investigating dynamics of neovascularization in tumors. PloS one. 6 (7), e21768 (2011).
- Chen, E. Y., DeRan, M. T., et al. Glycogen synthase kinase 3 inhibitors induce the canonical WNT/β-catenin pathway to suppress growth and self-renewal in embryonal rhabdomyosarcoma. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5349-5354 (2014).
- Yang, X. -. J., Cui, W., et al. A novel zebrafish xenotransplantation model for study of glioma stem cell invasion. PloS one. 8 (4), e61801 (2013).
- Chapman, A., Fernandez del Ama, L., Ferguson, J., Kamarashev, J., Wellbrock, C., Hurlstone, A. Heterogeneous Tumor Subpopulations Cooperate to Drive Invasion. Cell Reports. 8 (8), 1-8 (2014).
- Smith, A. C. H., Raimondi, A. R., et al. High-throughput cell transplantation establishes that tumor-initiating cells are abundant in zebrafish T-cell acute lymphoblastic leukemia. Blood. 115 (16), 3296-3303 (2010).
- Iyengar, S., Houvras, Y., Ceol, C. J. Screening for melanoma modifiers using a zebrafish autochthonous tumor model. Journal of visualized experiments JoVE. (69), e50086 (2012).
- Mizgireuv, I., Revskoy, S. Y. Transplantable tumor lines generated in clonal zebrafish. Cancer research. 66 (6), 3120-3125 (2006).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291, 293-296 (1981).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. Journal of visualized experiments JoVE. (53), e2790 (2011).
- Tang, Q., Abdelfattah, N. S., et al. Optimized cell transplantation using adult rag2 mutant zebrafish. Nature methods. 11, 821-824 (2014).
- Zhou, Q., Facciponte, J., Jin, M., Shen, Q., Lin, Q. Humanized NOD-SCID IL2rg–/– mice as a preclinical model for cancer research and its potential use for individualized cancer therapies. Cancer letters. 344 (1), 13-19 (2014).
- Higashijima, S., Okamoto, H., Ueno, N., Hotta, Y., Eguchi, G. High-frequency generation of transgenic zebrafish which reliably express GFP in whole muscles or the whole body by using promoters of zebrafish origin. Developmental biology. 192 (2), 289-299 (1997).
- Langenau, D. M., Keefe, M. D. D. D., et al. Co-injection strategies to modify radiation sensitivity and tumor initiation in transgenic Zebrafish. Oncogene. 27 (30), 4242-4248 (2008).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), 1-5 (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Alexander, M. S., Kawahara, G., et al. Isolation and transcriptome analysis of adult zebrafish cells enriched for skeletal muscle progenitors). Muscl, & nerve. 43 (5), 741-750 (2011).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation, culture, and transplantation of muscle satellite cells. Journal of visualized experiments JoVE. (86), 1-7 (2014).
- Gerli, M. F. M., Maffioletti, S. M., Millet, Q., Tedesco, F. S. Transplantation of induced pluripotent stem cell-derived mesoangioblast-like myogenic progenitors in mouse models of muscle regeneration. J Vis Exp. (83), e50532 (2014).
- Siegel, A. L., Gurevich, D. B., Currie, P. D. A myogenic precursor cell that could contribute to regeneration in zebrafish and its similarity to the satellite cell. The FEBS journal. 280 (17), 4074-4088 (2013).
- Rowlerson, a., Radaelli, G., Mascarello, F., Veggetti, Regeneration of skeletal muscle in two teleost fish: Sparus aurata and Brachydanio rerio. Cell Tissue Res. 289 (2), 311-322 (1997).
- White, R. M., Sessa, A., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell stem cell. 2 (2), 183-189 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon