Method Article
Diferenciación rápida y dirigida de las células epiteliales del pigmento retiniano de humanos embrionarios o inducidas pluripotenciales células
En este artículo
Resumen
Este protocolo describe cómo producir células epiteliales del pigmento retiniano (RPE) de células madre pluripotentes. El método utiliza una combinación de factores de crecimiento y moléculas pequeñas para dirigir la diferenciación de células madre en RPE inmaduro en catorce días y RPE madura y funcional después de tres meses.
Resumen
Se describe un método robusto para dirigir la diferenciación de células madre pluripotentes en retiniano del pigmento epiteliales células (RPE). El propósito de ofrecer un protocolo detallado y minucioso es demostrar claramente cada paso y para hacerlo accesible a los investigadores en el campo. Este protocolo da lugar a una capa homogénea de RPE con disección mínima o manual no es necesitada. El método presentado aquí se ha demostrado para ser eficaz para inducida por células madre pluripotentes (iPSC) y células madre embrionarias humanas. Asimismo, describen métodos de criopreservación de los bancos de células intermedias que permiten el almacenamiento a largo plazo. RPE generado mediante este protocolo podría ser útil para el modelado de enfermedades-en-un-plato de iPSC o aplicación clínica.
Introducción
El epitelio pigmentario de la retina es una monocapa de células pigmentadas que proporciona soporte crucial para fotorreceptores. Las células epiteliales del pigmento retiniano (RPE) tienen numerosas funciones en la visión, incluyendo la absorción de la luz, transporte de nutrientes y de iones, retinoide ciclismo, fagocitosis del segmento externo de fotorreceptor, y1de la secreción del factor de crecimiento. Hay una gran variedad de distrofias retinales que afectan la función de RPE y resultado en una pérdida de visión como degeneración macular y retinitis pigmentosa. Generación de la RPE de células madre pluripotentes puede facilitar la investigación para comprender estas enfermedades de los ojos y puede proporcionar una fuente ilimitada de RPE para celular terapias2. De hecho, múltiples ensayos clínicos en curso están utilizando RPE derivada de células madre pluripotentes3.
Este protocolo de diferenciación fue descrito originalmente por Buchholz4 y se basó en el método anteriormente publicado de Clegg5. El procedimiento simula el proceso del desarrollo normal en vivo para dirigir células pluripotenciales indiferenciadas hacia un destino RPE través de la manipulación de los factores de crecimiento de insulina (IGF), factor de crecimiento básico del fibroblasto (FGF-2; FGF-basic), transformación de factor de crecimiento beta (TGF-β) y las vías WNT4,5. El protocolo fue mejorado significativamente por la adición de un agonista de la vía WNT en el protocolo, que rindió 97.77% ± 0.1% pre-melanosome células positivas de proteína (PMEL) y ha sido adaptado a condiciones xeno-libre6,7. El RPE resultante han demostrado expresar marcadores RPE en los niveles de transcripción y proteína, secretan factores de crecimiento conocidos RPE con la polaridad adecuada, y llevar a cabo la fagocitosis de fotorreceptor segmentos externo8. Este protocolo es más rápida y fiable que "espontánea" protocolos de diferenciación que involucran la extirpación simple del factor de crecimiento de fibroblasto básico8. Además, los datos muestran que RPE obtenidos utilizando este protocolo de la secuencia de RNA son muy similares a los obtenidos utilizando el enfoque espontáneo más comunes8. El método 14 días genera RPE que caben las "5 P" mencionado por Mazzoni9 (pigmentadas, polarizado, fagocíticas, poste-mitotic, poligonal)9. Si bien este procedimiento ha demostrado para ser reproducibles en laboratorios múltiples, queremos reconocer varios métodos adicionales de diferenciación dirigida que han sido publicados en los últimos años10,11,12 , 13.
Protocolo
1. preparación de reactivos para el día 0 al día 14 del protocolo
- preparar los siguientes componentes medio:
- hacer 100 mL de diferenciación retiniana media (RDM) Añadir 1 mL de suplemento de x N2 100, 2 mL de 50 suplemento de x B27 y 1 mL de 100 x aminoácidos no esenciales (AANE) a 96 mL de Dulbecco ' s modificado mezcla medio/nutrientes esencial 9 F12 (DMEM/F12).
- Tomar 10 mL de 1 M nicotinamida (NIC) por disolución 1,221 g de NIC en 8 mL de agua estéril, Vortex y llevar el volumen a 10 mL con agua estéril. La solución del filtro estéril.
- Preparar los siguientes factores de crecimiento y moléculas pequeñas:
- noggin ratón recombinante de reconstituir, inhibidor de vía señalización WNT humano dickkopf 1 (DKK-1) y el IGF-1 y 100 μg/mL cada en 0,1% de seroalbúmina bovina (BSA) en solución tampón fosfato (PBS). Alícuota según sea necesario y almacenar a-20 ° C hasta por 3 meses.
- Reconstituir el FGF-básico a 10 μg/mL y recombinante humano/ratón/rata activina A y 100 μg/mL cada en 0.1% de BSA en PBS. Alícuota según sea necesario y almacenar a-80 ° C hasta por 1 año.
- Reconstituir SU 5402 (inhibidor de la cinasa de la tirosina del receptor específico FGF) y CHIR99021 (cinasa de la sintasa de glucógeno 3, GSK-3β, inhibidor) a 10 mM en dimetil sulfóxido (DMSO). Alícuota y almacenar a-20 ° C hasta 1 año o 6 meses, respectivamente.
- Obtener el siguiente para el día 0 y día x ethylenediaminetetraacetic 14: 1 ácido (EDTA) solución (0,2 g de EDTA por 1 L de PBS), 1 X PBS- / - enzima de disociación similar a tripsina (PBS sin calcio ni magnesio, pH 7,4), 1 x (TDE), DPBS (Dulbecco ' s PBS), PRMA apoya medio (RSM) y Y-27632 diclorhidrato (uso en 10 μm).
2. Día 0: Día del paso de células madre pluripotentes para la diferenciación
- crecer colonias de células madre en condiciones libre de suero y alimentador de aproximadamente 80% de confluencia antes pases.
Nota: Vea la discusión para más detalles en la optimización de este paso. - Recubrir una placa de 12 pozos con hidrogel basado en la matriz extracelular (ECMH) según recomendaciones del fabricante. Permite establecer por 1 h a temperatura ambiente o durante la noche a 4 ° C.
- Alícuota del volumen de RDM y PBS- / - necesario para el día 0 y caliente en baño de agua a 37 ° C antes de agregar factores de crecimiento. Poner EDTA a temperatura ambiente.
- Agregar los factores de crecimiento necesarios para el día 0 al RDM calentado con NIC de 10 mM, 50 noggin ng/mL, ng/mL 10 DKK-1 y 10 ng/mL IGF-1. De las acciones descritas en el paso 1.2, añadir 100 μl de NIC, 5 μl de noggin, 1 μl de DKK-1 y 1 μl de IGF-1 a 10 mL de RDM.
- Elegir para eliminar todas las colonias diferenciadas basadas en la morfología de las células madre que serán pasados por diferenciación. Utilice una punta de pipeta P10 para eliminar manualmente las células diferenciadas.
Nota: Las células fibroblásticas entre colonias, así como las células opacas dentro de las colonias indican células diferenciadas para eliminarse. Vea la discusión para más detalles acerca de las células diferenciadas. - Paso un único pozo de una placa de 6 pozos en 4 pozos de una placa de 12 pozos (1:4).
Nota: Ver discusión para obtener más información sobre pases de células madre en esta etapa.- El medio de la célula de vástago de las células madre de aspirar y lavar los pocillos de una vez con 2 mL de PBS precalentada- / -.
- Aspire PBS- / - y enjuague bien tres veces con 1 mL de EDTA por pozo de una placa de la pozo 6.
- Suavemente incline la placa y aspirar el EDTA. No agitar la placa en alguna forma de evitar prematuramente las celdas de elevación.
- Después del tercer lavado, añada 1 mL de EDTA e incubar a temperatura ambiente en la campana durante 3-5 minutos. No molestar la placa durante la incubación.
- Aspire el EDTA y añadir 1 mL de RDM por bien que se siembran con 0,5 mL de medio extra. Por ejemplo, lavar 1 pozo de una placa de 6 pozos con 4,5 mL de RDM para placa de 4 pozos de una placa de la pozo 12.
- Use un raspador celular para separar suavemente las células. Recoge todas las células en un tubo cónico y triturate las células en RDM mediante pipeteo arriba y abajo 5 veces. Disociar los grumos grandes de células, pero no triturate suspensión unicelular. Distribuir las células uniformemente en la pipeta. Completar este paso rápidamente para evitar la reconexión a la plancha.
- De semilla de las células en las placas 12-bien revestido de ECM (1 mL de la suspensión celular por pozo).
- Inclinar la plancha hacia adelante y hacia atrás para distribuir las células uniformemente a lo largo de los pozos. Coloque con cuidado en una incubadora de cultivo celular a 37 ° C y 5% de CO 2 hasta el próximo cambio de medio.
- En cuenta la hora exacta. Medio de cambio a la misma hora cada día.
3. Día 1 al 14: adición de factores de crecimiento
- día 1: cambiar el medio en todos los pocillos (1 mL por pozo) usando RDM con la composición del factor de crecimiento por día (consulte el paso 2.4) 0.
- Día 2: cambiar el medio mediante RDM (1 mL por pozo) con 10 mM NIC, FGF-básico de 5 ng/mL, 10 noggin ng/mL, DKK-1 de 10 ng/mL y 10 ng/mL de IGF-1. De las acciones descritas en el paso 1.2, añada 100 μl de NIC, 5 μl de FGF-básico, 1 μl de noggin, 1 μl de DKK1 y 1 μl de IGF1 a 10 mL de RDM.
- Día 4: cambiar el medio mediante RDM (1 mL por pozo) con 100 ng/mL activin A, DKK-1 de 10 ng/mL y 10 ng/mL de IGF-1. De las acciones descritas en el paso 1.2, añadir 10 μl de activin A, 1 μl de DKK1 y 1 μl de IGF-1 a 10 mL de RDM.
Nota: Observe que las células son confluentes en este momento. - Día 6: cambiar el medio mediante RDM (1 mL por pozo) con 100 ng/mL activina A y 10 μm SU 5402. De las acciones descritas en el paso 1.2, añadir 10 μl de la activina A y 10 μl de SU 5402 a 10 mL de RDM.
- Días 8, 10 y 12: cambiar el medio mediante RDM (1 mL por pozo) con 100 ng/mL activin A, SU 5402 de 10 μm y 3 μm CHIR99021. De las acciones descritas en el paso 1.2, añadir 10 μl de activin A, 10 μl de SU 5402 y 3 μl de CHIR99021 a 10 mL de RDM.
4. Día de enriquecimiento al paso 0 de RPE
- capa una placa de 6 pozos con factor de crecimiento reducido ECMH según recomendaciones del fabricante. Permite establecer por 1 h a temperatura ambiente o durante la noche a 4 ° C.
- Alícuota del volumen de DPBS necesitada y 1 mL de RDM por pozo de enriquecimiento y caliente en baño de agua a 37 ° C. traer el TDE a temperatura ambiente y caliente suficiente volumen de RSM, reactivo antimicrobiano y Y-27632 a 37 ° C.
- Agregar reactivo antimicrobiano y Y-27632 obtener x 0,5 y 10 composiciones μm respectivamente a RSM. Utilicen este medio para los primeros 4-7 días para mejorar la fijación.
- Aspirado medio gastado de todos los pozos y añada 1 mL por pocillo del RDM precalentado (no requeridos factores de crecimiento).
- Manualmente usando un microscopio de disección, diseccionar y raspe todas las células de RPE no usando una punta de pipeta P10.
Nota: Consulte la sección de resultados representativos ejemplos. - Después de la disección, Aspire RDM y todos los desechos de la célula. Lave dos veces con 1 mL de DPBS precalentado por bien.
- Añadir 0,5 mL de TDE por pozo de una placa de 12 pozos e incubar a 37 ° C por 5 min uso un raspador celular para eliminar suavemente las células de la placa. Utilice una pipeta de P1000 a triturate suavemente la suspensión celular/TDE mediante pipeteo arriba y abajo 3 - 4 veces para crear una suspensión uniforme.
- Diluir la suspensión celular/TDE 1:10 en RSM precalentado, sin Y-27632. Centrifugar la suspensión celular a 173 x g durante 5 min a temperatura ambiente.
- Aspirar el medio pellets celulares y resuspender las células en RSM con el μm 10 Y-27632 (enriquecido de 1 mL por pozo).
- Protector de las células utilizando un colador de celda de malla de nylon con poros μm 40. Contar el número de células en un volumen especificado usando un hemocitómetro y calcular la concentración de células en la solución filtrada.
- Células de semilla en el factor de crecimiento reducidas las placas revestidas de ECM en 1 x 10 5 células/cm 2 en 4 mL de RSM con el μm 10 Y-27632.
- Reemplazar el RSM con el μm 10 Y-27632 48 h después de la siembra celular y continuar reemplazar los medios de comunicación cada 3-4 días (por ejemplo, los lunes y el jueves). No reemplace el μm 10 Y-27632 después de 4-7 días.
- Permiten que las células maduras de 28 a 35 días a 37 ° C y 5% CO 2. Seguir reemplazar el RSM cada 3-4 días (por ejemplo, los lunes y el jueves).
5. Maduración: Del paso 1 y 2 de RPE
Nota: los volúmenes son los indicados para 1 pozo de una placa de 6 pozos o un matraz T75 como se indica en paréntesis.
- Entre los días 28 a 35 de paso 0, recubrir una placa de 6 pozos (T75 matraz) con ECMH según recomendaciones del fabricante.
- Alícuota del volumen de DPBS y RSM necesario y caliente en baño de agua a 37 ° C. traer TDE a temperatura ambiente.
- Aspirado pasado medio de pozos y lavado cada bien dos veces con 2 mL (10 mL) de DPBS precalentado.
Nota: No use el μm 10 Y-27632. - Aspire DPBS y añadir 1 mL (5 mL) de TDE. Colocar en incubadora a 37 ° C y 5% CO 2 durante 5 minutos. Después de la incubación, las células vistas en un microscopio invertido para confirmar las células son contratación y separación.
- Con un raspador celular tamaño adecuado, eliminar suavemente las células desde el fondo del pozo o matraz.
- Usar una punta de P1000 (pipeta serológica de 10 mL) para suavemente triturate la suspensión celular/TDE arriba y abajo 3 - 4 veces para crear una suspensión uniforme.
- Diluir celular suspensión 1:10 en RSM. Reserva 2 mL (5 mL) de RSM para enjuagar el matraz de bien y añadir a la suspensión de células diluidas.
Nota: No permita que el tiempo de exposición de enzima exceda 25 minutos - Centrifugar la suspensión de células a 173 x g durante 5 min a temperatura ambiente.
- Aspire el medio pellets celulares y resuspender las células en 1 mL (5 mL) de RSM
- Protector de las células utilizando un colador de celda de malla de nylon con poros μm 40. Contar el número de células en un volumen especificado usando un hemocitómetro y calcular la concentración de células en la solución filtrada.
- De semilla de las células en las placas de revestimiento ECMH en 1 x 10 5 células/cm 2 en 4 mL (15 mL) de RSM.
- Permite a las células madurar durante 30 días. Continúan cambiando el RSM cada 3-4 días.
- Repita el procedimiento anterior (paso 5.2-5.11) en el día 30 a paso de las células del paso 1 y 2.
6. Creación de un banco de células intermedias: criopreservación de paso 2 días 3-5 RPE
Nota: criopreservar las células mientras son subconfluente (~ 50%) y no han recuperado el pigmento.
- Basado en el número de células, calcular el volumen de medio de criopreservación con 10% DMSO necesario para resuspender las células a una concentración de 3 x 10 6 células/mL.
- Siga los pasos 5.2 a 5.8. Resuspender el precipitado de células en el medio de la criopreservación con 10% de DMSO a 3 x 10 6 células/mL y transferir 1 mL de la suspensión de células viales criogénicos 1,2 mL.
- Colocar frascos criogénicos en un recipiente congelación diseñado para enfriar a-1 ° C/min y coloque a-80 ° C durante la noche. Transferencia de nitrógeno líquido para el almacenamiento a largo plazo.
Nota: Estas células serán paso 3 a descongelar. Las células de cultivo por 30 días más antes de caracterización. Semilla del paso 3 RPE en 1.5 x 10 5 por cm 2 a descongelar. 2 , 4 , 6 , 7
Resultados
Este método resulta en la producción de una monocapa homogénea, pigmentada y cuboidal de RPE. La línea de tiempo en la figura 1 corresponde a las imágenes representadas en la figura 2. Como se muestra en la figura 2A, las colonias de células madre se embalan firmemente con bordes definidos y sin las células fibroblásticas entre colonias u opacas células dentro de colonias. Figura 2B proporciona una representación de RPE inmaduro que son subconfluente. Si las células están ya confluentes en esta etapa, no se extienden proyecciones que son críticas para el proceso de diferenciación. Las células que son severamente subconfluente no serán capaces de establecer una monocapa y forman a uniones estrechas, característicos del epitelio. Información sobre cómo optimizar esta confluencia es descritos en la sección de discusión. Figura 2 muestra la morfología de los dos tipos más comunes de no RPE que puedan surgir durante este proceso de diferenciación: parches neurales o fibroblásticos. Es importante tener en cuenta que estos parches neurales aparecen especialmente opacos en un microscopio de disección, mientras que los parches definidos, fibroblástico como son casi translúcidos en un microscopio de disección. Puede ser útil marcar estas áreas en una placa de cultivo de tejidos con una pluma de etanol-prueba de laboratorio para identificarlos más fácilmente en un microscopio óptico compuesto y microscopio de disección. Figuras 2D-F muestran los característicos bordes brillantes, guijarro morfología y pigmentación que indican una cultura saludable, maduración de RPE. Figura 3 es una imagen de aumento mayor para mostrar el aspecto diferente de RPE totalmente maduro representado por microscopia de campo claro y contraste de fases. En el paso 3 día 30, las células están listas para la caracterización que se ha descrito en publicaciones anteriores, incluyendo la expresión de ARN, expresión de proteínas, secreción de factor de crecimiento y fagocitosis2,4,6 ,7. Estas caracterizaciones muestran que las células en estas imágenes no sólo pigmentado y cuboidales, pero también fagocíticas, poste-mitotic y polarizado.
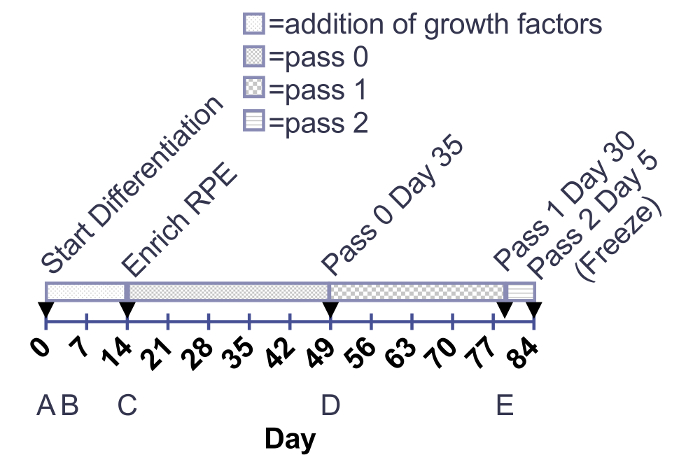
Figura 1:. Línea de tiempo para la incorporación de factores de crecimiento y maduración de RPE. Factores de crecimiento se agregan a las placas 12-bien desde el día 0-14. Maduración de RPE se cultivan en placas de 6 pocillos o T75 frascos de día de enriquecimiento al deshielo después de 30 días (paso 3 día 30). Las flechas indican enzimática celular pases. (A-E) por debajo de las líneas de tiempo corresponden a las imágenes en la figura 2. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: morfología representativa y confluencia de maduración RPE. Células madre pluripotentes inducidas inmediatamente antes de pases para la diferenciación (A). Subconfluent inmaduro de las células RPE en día 2 (B) y antes de enriquecimiento pick para retirar en el día 14; los parches no-RPE (indicados por las flechas blancas) aparecen como parches u opaco "cintas" (C). RPE en el paso 0, 1 y 3 día 30 (D, E y F). Barra de escala = 200 μm. haga clic aquí para ver una versión más grande de esta figura.
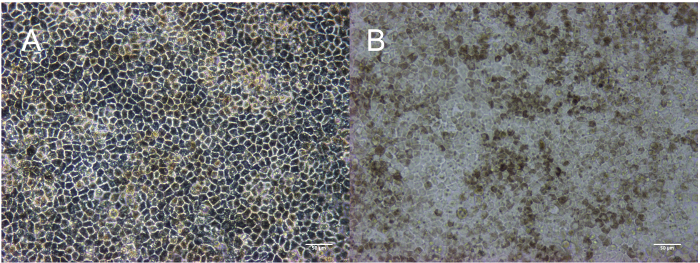
Figura 3: maduras RPE en el paso 3: día 30 Morfología cuboidal en contraste de fase (A) y pigmentación en campo brillante (B). Barra de escala = 50 μm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe cómo producir las células epiteliales del pigmento retiniano de células madre pluripotentes. El método se optimizó utilizando ambas células pluripotentes embrionarias e inducidas humanas de un método de cultivo libre de suero y alimentador. Desde el aislamiento inicial de células madre embrionarias humanas en 1998 y la derivación de células madre pluripotentes inducidas (iPSC) en 2007, una multitud de células madre cultura métodos han sido desarrollados14,15,16, 17. Estos métodos deben ser suficientes para la producción de colonias de células madre que son susceptibles a esta diferenciación. No hay conocidos limitaciones a la aplicabilidad de este método a células madre pluripotentes derivadas y mantenido adecuadamente.
Los pasos más críticos son los pases de células al día 0 de la diferenciación (paso 2.5) y la necesidad potencial de disección manual en el día 14 del proceso (paso 4.5). Al escoger para eliminar las células diferenciadas de las colonias de células madre, se refieren a las imágenes de Kent18. Como se indica, las células fibroblásticas entre las colonias y las opacas células dentro de colonias indican células diferenciadas que deben quitarse antes de iniciar este protocolo18. Sólo no diferenciadas, apretadas colonias con bordes definidos deben pasadas para la diferenciación.
El número de células sembradas por pozo (paso 2.6.7) es complicado por el hecho de que las células madre no puede ser trituradas en una suspensión unicelular al paso y no se puede contar con precisión usando un hemocitómetro. La aproximación de células confluentes de 80% está indicada para 1 pases de una placa de 6 pozos en 4 pozos de una placa de 12 pozos. Diferencias entre líneas de células madre, tales como tasa de crecimiento, pueden afectar cómo el RPE llega a la confluencia entre los días 0 y 4. Las células madre se producirá RPE independientemente de confluencia exacta, pero el rendimiento celular se verá afectado negativamente si las células son demasiado escasas en esta etapa. Las células inmaduras de la RPE deben ser aproximadamente 40-50% confluente en el día 1 y casi 100% confluente por día 4. Si las células no producen una monocapa confluente por día 4 o 6, el protocolo debe repetirse en una mayor densidad de siembra en el día 0. Por ejemplo, si 1 de una placa de 6 pozos fue pasados a 4 pozos de una placa de 12 pozos en el día 0 y el RPE inmaduro no son 100% confluente en el día 4, reducir la siembra a un paso de 1:3 o 1:2 en el día 0 o permitir que las células madre para convertirse en más confluentes antes de pases. Es fundamental establecer una densidad de siembra consistente al comparar múltiples líneas celulares.
El paso de la disección manual en día 14 sólo es necesario cuando las células RPE no están presentes en la cultura (figura 2). Desde la incorporación de CHIR99021 al Protocolo, muchas líneas de células madre pluripotenciales no requieren poca o ninguna disección manual. Algunas preparaciones tienen una incidencia más alta de parches de nervios y es fundamental para eliminar esas células. Si no es viable en el paso 0 a paso 3 el RPE, es posible repetir el protocolo de diferenciación, teniendo tiempo suficiente para eliminar todas las células de RPE no. Esto no sucede a menudo, pero se menciona aquí tener en cuenta que el paso de la disección en el día 14 puede optimizarse cuando sea necesario.
Hay una variedad de protocolos de diferenciación de RPE que varían en costo, así como métodos de cultivo, eficiencia, cuantificación y evaluación funcional, que ha sido completamente revisado2. Preferimos el método 14 días detallado aquí debido a su eficacia, adaptabilidad y aplicabilidad a una amplia gama de líneas de celular4,7,8. El paso de la criopreservación en este protocolo también proporciona una importante ventaja en la creación de un banco de células intermedio para uso futuro, evitando la variabilidad lote a lote en experimentos. A partir de solamente 4 pozos de una placa de 12 pozos, es posible ampliar en placas de 6 pozos en el paso 0 y T75 matraces en el paso 1 y 2. En el paso 2 días 3-5, cuando las células son todavía subconfluente y no han recuperado el pigmento, es posible criopreservar decenas de millones de células y luego descongelar el RPE maduro, designado paso 3 día 30, para comprobar la expresión de RNA, expresión de la proteína, el factor de crecimiento secreción, fagocitosis, etcetera. También hemos establecido protocolos para ampliar RPE para pasajes hasta 13 19.
Mirando hacia adelante, este método será útil para iPSC modelado de enfermedades oculares y para generación de RPE para terapia celular. Con respecto a la modelación de la enfermedad de iPSC, este protocolo actualmente se utiliza en el laboratorio para producir RPE de líneas CRISPR-corregida con controles no corregido del mismo paciente. Además, este protocolo es adaptable a sustratos sintéticos y condiciones xeno-libre que sirven para adherirse a las buenas prácticas de manufactura para una terapia celular.
Divulgaciones
Dr. Clegg es uno de los fundadores de regenerativa parche Technologies LLC.
Agradecimientos
Este trabajo fue financiado por la iniciativa de Garland para la visión, el Instituto de California para la medicina regenerativa (CIRM; subvenciones DR1-01444 y CL1-00521, TB1-01177, FA1-00616, TG2-01151), la Fundación de la comunidad de Vermont, la Fundación Breaux y los Fundación lucha contra el programa de aceleración de la investigación traslacional de Wynn-Gund de ceguera.
Materiales
| Name | Company | Catalog Number | Comments |
| SterilGARD III laminar flow biosafety cabinet | Baker | model: SG603A-HE, type: A2, class: 2 | 6' Baker laminar flow biosafety cabinet |
| Dissection Hood | Labconco | Model 3970405 | laminar flow bench top |
| dissecting microscope | Nikon | SMZ 1500 | heated stage |
| air-jacketed CO2 incubator | Sanyo | MCO-17AIC | 37 oC and 5% CO2 |
| inverted phase contrast microscope | Olympus | IX53 | |
| Name | Company | Catalog Number | Comments |
| Media Components | |||
| DMEM/F12 | Gibco | 10565042 | |
| N2 Supplement | Gibco | 17502048 | |
| B27 Supplement | Gibco | 17504044 | |
| NEAA | Gibco | 11140050 | |
| Name | Company | Catalog Number | Comments |
| Growth Factors and Reagents | |||
| Nicotinamide | Sigma | N0636 | |
| Recombinant mouse noggin | R&D systems | 1967-NG-025 | |
| Recombinant human DKK-1 | R&D systems | 5439-DK-010 | |
| Recombinant IGF-1 | R&D systems | 291-G1-200 | |
| FGF-basic | Peprotech | 100-18B | |
| Recombinant human/mouse/rat Activin A | Peprotech | 120-14E | |
| SU5402 FGF inhibitor | Santa Cruz Biotechnology | sc-204308 | |
| Name | Company | Catalog Number | Comments |
| Substrates | |||
| Matrigel Basement Membrane Matrix, Phenol Red-Free, LDEV-Free | Corning | 356237 | extracellular matrix-based hydrogel (ECMH) |
| Matrigel hESC-Qualified Matrix, LDEV-Free | Corning | 354277 | growth factor reduced ECMH |
| Name | Company | Catalog Number | Comments |
| Other reagents | |||
| 1X Versene (EDTA) | Gibco | 15040066 | |
| DPBS | Gibco | 14190250 | |
| 1X PBS (no calcium, no magnesium) | Gibco | 10010023 | |
| TrypLE (trypsin-like dissociation enzyme, TDE) | Gibco | 12563011 | |
| X-VIVO 10 (RPE supporting medium) | Lonza | BW04-743Q | |
| Y-27632 | Tocris | 12-541-0 (1254) | |
| CryoStor CS10 | BioLife Solutions | 210102 | cryopreservation medium |
| 1.2 mL Cryogenic Vial | Corning | 430487 | |
| Mr. Frosty (freezing container) | Nalgene | 5100-0001 | freezing container |
| Normocin | Invivogen | ant-nr-2 | antimicrobial reagent |
| Name | Company | Catalog Number | Comments |
| Other Equipment | |||
| Pipet-aid | Drummond | 4-000-101 | |
| 12-well culture plate | Corning | CLS3516 | Used during differentiation. |
| T75 flask | Corning | 430641 | Used during RPE maturation. |
| 6-well culture plate | Corning | CLS3513 | Used during RPE maturation. |
| cell scraper | Corning | 08-771-1A | Used during passages. |
| cell strainer | Falcon | 352340 | Used during passages before cell count. |
Referencias
- Strauss, O. The retinal pigment epithelium in visual function. Physiol. Rev. 85 (3), 845-881 (2005).
- Leach, L. L., Clegg, D. O. Concise Review: Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients With Ocular Disease. Stem Cells. 33 (8), 2363-2373 (2015).
- Pennington, B. O., Clegg, D. O. Pluripotent Stem Cell-Based Therapies in Combination with Substrate for the Treatment of Age-Related Macular Degeneration. J. Ocul. Pharmacol. Ther. 32 (5), 261-271 (2016).
- Buchholz, D. E., Pennington, B. O., Croze, R. H., Hinman, C. R., Coffey, P. J., Clegg, D. O. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium. Stem Cells Transl. Med. 2 (5), 384-393 (2013).
- Clegg, D. O., Buchholz, D., Hikita, S., Rowland, T., Hu, Q., Johnson, L. V. Retinal Pigment Epithelial Cells: Development In Vivo and Derivation from Human Embryonic Stem Cells In Vitro for Treatment of Age-Related Macular Degeneration. Stem Cell Res. Ther. (Chapter 1), 1-24 (2008).
- Leach, L. L., Buchholz, D. E., Nadar, V. P., Lowenstein, S. E., Clegg, D. O. Canonical/β-catenin Wnt pathway activation improves retinal pigmented epithelium derivation from human embryonic stem cells. Invest. Ophthalmol. Vis. Sci. 56 (2), 1002-1013 (2015).
- Pennington, B. O., Clegg, D. O., Melkoumian, Z. K., Hikita, S. T. Defined culture of human embryonic stem cells and xeno-free derivation of retinal pigmented epithelial cells on a novel, synthetic substrate. Stem Cells Transl. Med. 4 (2), 165-177 (2015).
- Leach, L. L., et al. Induced Pluripotent Stem Cell-Derived Retinal Pigmented Epithelium: A Comparative Study Between Cell Lines and Differentiation Methods. J. Ocul. Pharmacol. Ther. 32 (5), 317-330 (2016).
- Mazzoni, F., Safa, H., Finnemann, S. C. Understanding photoreceptor outer segment phagocytosis: use and utility of RPE cells in culture. Exp. Eye Res. 126, 51-60 (2014).
- Sonoda, S., Spee, C., Barron, E., Ryan, S. J., Kannan, R., Hinton, D. R. A protocol for the culture and differentiation of highly polarized human retinal pigment epithelial cells. Nat. Protoc. 4 (5), 662-673 (2009).
- Choudhary, P., et al. Directing Differentiation of Pluripotent Stem Cells Toward Retinal Pigment Epithelium Lineage. Stem Cells Transl. Med. 6 (2), 490-501 (2017).
- Maruotti, J., et al. Small-molecule-directed, efficient generation of retinal pigment epithelium from human pluripotent stem cells. Proc. Natl. Acad. Sci. U.S.A. 112 (35), 10950-10955 (2015).
- Lane, A., et al. Engineering efficient retinal pigment epithelium differentiation from human pluripotent stem cells. Stem Cells Transl. Med. 3 (11), 1295-1304 (2014).
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147 (1998).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318 (5858), 1917-1920 (2007).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Amit, M., Itskovitz-Eldor, J. Derivation and spontaneous differentiation of human embryonic stem cells. J. Anat. 200 (Pt 3), 225-232 (2002).
- Kent, L. Culture and Maintenance of Human Embryonic Stem Cells. J. Vis. Exp. (34), e1427-e1427 (2009).
- Croze, R. H., et al. ROCK Inhibition Extends Passage of Pluripotent Stem Cell-Derived Retinal Pigmented Epithelium. Stem Cells Transl. Med. 3 (9), 1066-1078 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados