Method Article
Rápida, dirigida a diferenciação de células epiteliais de pigmento Retinal de células-tronco humanas embrionárias ou induzida de Pluripotent
Neste Artigo
Resumo
Este protocolo descreve como produzir células epiteliais de pigmento retinal (RPE) de células-tronco pluripotentes. O método usa uma combinação de fatores de crescimento e de pequenas moléculas para direcionar a diferenciação de células-tronco em RPE imaturo em catorze dias e RPE maduro e funcional, depois de três meses.
Resumo
Nós descrevemos um método robusto para direcionar a diferenciação de células-tronco pluripotentes em retinal pigment pilhas epithelial (RPE). A finalidade de fornecer um protocolo detalhado e completo é para demonstrar claramente cada passo e para fazer esta prontamente disponível para pesquisadores no campo. Este protocolo resulta em uma camada homogênea de RPE com dissecação não manual ou mínima necessária. O método apresentado aqui foi mostrado para ser eficaz para induzida por células-tronco pluripotentes (iPSC) e células estaminais embrionárias humanas. Além disso, descrevemos a métodos para criopreservação de bancos de células intermediárias que permitem o armazenamento a longo prazo. RPE gerado usando este protocolo pode ser útil para a modelagem de iPSC doença-em-um-prato ou aplicação clínica.
Introdução
O epithelium retinal do pigment é uma monocamada de células pigmentadas que fornece apoio crucial para fotorreceptores. Células epiteliais de pigmento retinal (RPE) tem inúmeras funções na visão, incluindo a absorção de luz, transporte de nutrientes e íons, retinoide ciclismo, fagocitose de segmento externo do fotoreceptor, e secreção1do fator de crescimento. Há uma variedade de distrofias da retina que afetam a função do RPE e resultar em uma perda de visão, incluindo degeneração macular relacionada à idade e retinose pigmentária. Geração de RPE de células-tronco pluripotentes pode facilitar a pesquisa para compreender estas doenças do olho e pode fornecer uma fonte ilimitada de RPE para terapias de célula2. Na verdade, vários ensaios clínicos estão em andamento usando RPE derivado de células-tronco pluripotentes3.
Este protocolo de diferenciação foi originalmente descrito por Buchholz4 e baseou-se no método de Clegg5publicado anteriormente. O procedimento imita o normal na vivo do desenvolvimento processo para direcionar as células-tronco pluripotentes indiferenciadas em direção um destino RPE através de manipulação dos fatores de crescimento insulina (IGF), fator de crescimento básico de fibroblasto (FGF-2; FGF-basic), transformando o fator de crescimento beta (TGF-β) e WNT vias4,5. O protocolo foi significativamente melhorado pela adição de um agonista de via WNT no final do protocolo, que rendeu 97.77% ± 0,1% pre-melanoma células positivas de proteína (PMEL) e tem sido adaptado para condições de xeno-free6,7. O RPE resultante foram mostrados para expressar marcadores RPE para os níveis de transcrição e proteínas, que secretam fatores de crescimento RPE conhecidos com polaridade apropriada e realizar a fagocitose de fotorreceptoras segmentos exterior8. Este protocolo é mais rápida e confiável do que os protocolos "espontânea" de diferenciação que envolvem a simples remoção do fator de crescimento de fibroblastos básico8. Além disso, os dados mostram que o RPE obtido usando este protocolo a sequenciação do ARN são muito semelhantes aos obtidos usando a abordagem espontânea mais comum8. O método de 14 dias gera RPE que cabem o "P 5" mencionada por Mazzoni9 (pigmentada, polarizada, fagocíticas, pós mitóticas, poligonal)9. Enquanto esse procedimento tem provado para ser reproduzíveis em vários laboratórios, queremos reconhecer vários métodos de diferenciação dirigido adicionais que foram publicados nos últimos anos10,11,12 , 13.
Protocolo
1. preparação dos reagentes para 0 de dia para dia 14 do protocolo de
- preparar os seguintes componentes médios:
- fazer 100 mL de diferenciação da retina médio (RDM), adicionando 1 mL de suplemento de x N2 100, 2 mL de 50 x B27 suplemento e 1 mL de 100 x aminoácidos não-essenciais (timina) a 96 mL de Dulbecco ' s modificado mistura de médio/nutriente essencial 9 F12 (DMEM/F12).
- Fazer 10 mL de 1m nicotinamida (NIC) pela dissolução 1,221 g de NIC em 8 mL de água estéril, num Vortex e trazendo o volume para 10ml com água estéril. A solução do filtro estéril.
- Preparar os seguintes fatores de crescimento e pequenas moléculas:
- reconstituir rato recombinante noggin, dickkopf humana WNT sinalização via inibidor 1 (DKK-1) e IGF-1 a 100 µ g/mL cada em 0,1% albumina de soro bovino (BSA) em solução tampão fosfato (PBS). Alíquota conforme necessário e loja a-20 ° C por até 3 meses.
- Reconstituir FGF-basic para 10 µ g/mL e recombinante humano/rato/rato Activin A 100 µ g/ml cada em 0,1% BSA em PBS. Alíquota conforme necessário e loja a-80 ° C por até 1 ano.
- Reconstituir SU 5402 (inibidor de quinase de tirosina específicos do receptor FGF) e CHIR99021 (glicogênio sintase quinase 3 de, GSK-3beta, inibidor) até 10 mM em dimetilsulfóxido (DMSO). Alíquota e loja a-20 ° C por até 1 ano ou 6 meses, respectivamente.
- Obter o seguinte para o dia 0 e/ou solução de ácido (EDTA) de 14: 1 x ethylenediaminetetraacetic de dia (0,2 g de EDTA por 1 L de PBS), 1X PBS- / - enzima (PBS sem cálcio ou magnésio, pH 7,4), de tripsina dissociação de 1x (TDE), DPBS (Dulbecco ' s PBS), RPE apoio médio (RSM) e Y-27632 dicloridrato (uso a 10 µM).
2. Dia 0: Dia de passagem de células-tronco pluripotentes para diferenciação
colônias de células-tronco- crescem em condições de alimentador-livre, sem soro para aproximadamente 80% confluência antes passagem.
Nota: Veja a discussão para obter detalhes sobre como otimizar este passo. - Revestir uma placa de 12 com hidrogel de baseada em matriz extracelular (ECMH) conforme recomendações do fabricante. Permitem definir por 1h à temperatura ambiente ou durante a noite a 4 ° C.
- Alíquota do volume de RDM e PBS- / - necessário para dia 0 e aquecido em banho-maria a 37 ° C antes de adicionar a fatores de crescimento. Levar o EDTA à temperatura.
- Adicionar os fatores de crescimento necessários para o dia 0 para o RDM aquecido com 10mm NIC, 50 cabeça ng/mL, 10 ng/mL DKK-1 e 10 ng/mL IGF-1. Das existências descritas na etapa 1.2, adicionar 100 µ l de NIC, 5 µ l de cabeça, 1 µ l de DKK-1 e 1 µ l de IGF-1 a 10 mL de RDM.
- Escolha para remover todas as colônias diferenciadas com base na morfologia das células-tronco que vai ser passado para a diferenciação. Use a ponta da pipeta P10 para remover manualmente as células diferenciadas.
Nota: Células fibroblástica entre colônias, bem como as células opacas dentro colônias indicam células diferenciadas para ser removido. Veja a discussão para obter detalhes sobre células diferenciadas. - Passagem de um único poço de uma placa de 6 para 4 poços de uma placa de 12 (1:4).
Nota: Ver discussão para obter detalhes sobre a passagem de células-tronco nesta fase.- No meio de células-tronco, pelas células-tronco de aspirar e lavar os poços uma vez com 2 mL de PBS pré-aquecido- / -.
- Aspire PBS- / - e enxaguar cada poço três vezes com 1 mL de EDTA por bem de uma placa de 6.
- Delicadamente incline o prato e aspire o EDTA. Não agitar a placa em alguma maneira de evitar levantar prematuramente as células.
- Após a terceira lavagem, adicione 1 mL de EDTA e incubar à temperatura de capuz para 3-5 min. Não perturbe a placa durante esta incubação.
- Aspire o EDTA e adicionar 1 mL de RDM por bem isso será propagada com 0,5 mL de meio extra. Por exemplo, lavar 1 bem de uma placa de 6 com 4,5 mL de RDM a placa em 4 poços de uma placa de 12.
- Use um raspador de célula para retirar delicadamente as células. Recolher todas as pilhas em um tubo cônico e triture as células em RDM pipetando subindo e descendo 5 vezes. Dissociar a grandes aglomerações de células, mas não triture a suspensão de célula única. Distribua uniformemente as células a pipeta. Conclua esta etapa rapidamente para evitar a recolocação para o prato.
- Sementes de células com as placas do 12-poços de ECM-revestido (1 mL de suspensão de células por alvéolo).
- De inclinação da placa e para trás para distribuir as células uniformemente ao longo dos poços. Coloque delicadamente em uma incubadora de cultura celular em 37 ° C e 5% de CO 2 até a próxima alteração média.
- Anote a hora exata. Médio de mudança ao mesmo tempo cada dia.
3. Dia 1 a 14: adição de fatores de crescimento
- dia 1: alterar o meio em todos os poços (1 mL por alvéolo) usando RDM com a composição do fator de crescimento para o dia 0 (ver passo 2.4).
- Dia 2: mudar o meio usando RDM (1 mL por poço) com 10 mM NIC, FGF-basic de 5 ng/mL, 10 cabeça de ng/mL, 10 ng/mL DKK-1 e IGF-1 de 10 ng/mL. Das existências descritas na etapa 1.2, adicionar 100 µ l de NIC, 5 µ l de FGF-basic, 1 µ l de cabeça, 1 µ l de DKK1 e 1 µ l de IGF1 a 10 mL de RDM.
- Dia 4: mudar o meio usando RDM (1 mL por bem) com 100 ng/mL União A 10 ng/mL DKK-1 e IGF-1 de 10 ng/mL. Das existências descritas na etapa 1.2, adicionar 10 µ l de A União, 1 µ l de DKK1 e 1 µ l de IGF-1 a 10 mL de RDM.
Nota: Observar que as células são confluentes nesta fase. - Dia 6: mudar o meio usando RDM (1 mL por bem) com 100 A de União de ng/mL e 10 µM SU 5402. Das existências descritas na etapa 1.2, adicionar 10 µ l da União A e 10 µ l de SU 5402 e 10 mL de RDM.
- Dias 8, 10 e 12: alterar o meio usando RDM (1 mL por bem) com A de União 100 ng/mL, 10 µM SU 5402 e 3 µM CHIR99021. Das existências descritas na etapa 1.2, adicionar 10 µ l de A União, 10 µ l de SU 5402 e 3 µ l de CHIR99021 a 10 mL de RDM.
4. Dia de enriquecimento para passagem 0 de RPE
- casaco uma placa de 6 com fator de crescimento reduzido ECMH conforme as recomendações do fabricante. Permitem definir por 1h à temperatura ambiente ou durante a noite a 4 ° C.
- Alíquota do volume de DPBS necessários e 1 mL de RDM por poço de enriquecimento e aquecer em banho-maria a 37 ° C. trazer a TDE a quente e a temperatura volume necessário de RSM, reagente antimicrobiana e Y-27632 a 37 ° C.
- Add antimicrobiana reagente e Y-27632 obtenção de 0.5 x e 10 µM composições, respectivamente para o RSM. Usar este meio para os primeiros 4-7 dias para melhorar a fixação.
- Aspirado gasto médio de todos os poços e adicionar 1 mL por poço de RDM previamente aquecido (sem fatores de crescimento necessários).
- Manualmente usando um microscópio de dissecação, dissecar e raspar todas as células de RPE não usando uma ponta da pipeta P10.
Nota: Consulte a seção de resultados representativos para exemplos. - Após a dissecação, Aspire RDM e todos os detritos de células. Lave duas vezes com 1 mL de DPBS pré-aquecido por alvéolo.
- Adicionar 0,5 mL de TDE por bem de uma placa de 12 e incubar a 37 ° C por 5 min. Use um raspador de célula para remover suavemente as células da placa. Usar uma pipeta P1000 para suavemente, Triture a suspensão celular/TDE pipetando acima e para baixo 3 - 4 vezes para criar uma suspensão uniforme.
- Diluir a suspensão de célula/TDE 01:10 no RSM previamente aquecido, sem Y-27632. Centrifugar a suspensão de células a 173 x g durante 5 min à temperatura ambiente.
- Aspirar o meio do centrifugado e ressuspender as células em RSM com 10 µM Y-27632 (1 mL por enriquecido bem).
- Coe as células usando um filtro de célula de malha de nylon com 40 µm de poros. Contar o número de células em um volume especificado usando um hemocytometer e calcular a concentração de células na solução tensa.
- Células de semente do factor de crescimento reduziram de placas com revestimento em ECM a 1 x 10 5 células/cm 2 em 4 mL de RSM com 10 µM Y-27632.
- Substituir o RSM com 10 µM Y-27632 48 h após a semeadura de célula e continuar a substituir a mídia (por exemplo, às segundas e quintas-feiras) a cada 3-4 dias. Não substitua a 10 µM Y-27632 após 4-7 dias.
- Permitem que as células amadurecer durante 28 a 35 dias a 37 ° C e 5% de CO 2. Continuar a substituir o RSM cada 3-4 dias (por exemplo, às segundas e quintas-feiras).
5. Maturação: Passagem de 1 e 2 do RPE
Nota: volumes são indicados para 1 bem de uma placa de 6 ou um balão T75 conforme indicado pelos parênteses.
- Entre os dias 28 e 35 anos de passagem 0, revestir uma placa de 6-poços (T75 balão) com ECMH conforme as recomendações do fabricante.
- Alíquota do volume de DPBS e RSM necessário e aquecido em banho-maria a 37 ° C. trazer TDE à temperatura ambiente.
- Aspirado gasto médio de poços e lavar cada bem duas vezes com 2 mL (10 mL) de DPBS pré-aquecido.
Nota: Não utilize 10 µM Y-27632. - Aspire DPBS e adicionar 1 mL (5 mL) de TDE. Colocar na incubadora a 37 ° C e 5% de CO 2 por 5 min. Após a incubação, exibição de células em um microscópio invertido para confirmar as células são contratantes e desanexação.
- Delicadamente com uma espátula de célula de tamanho apropriado, remover as células do fundo do poço ou balão.
- Use uma ponta de P1000 (pipeta sorológica de 10 mL) para suavemente triture a suspensão celular/TDE acima e para baixo 3 - 4 vezes para criar uma suspensão uniforme.
- Diluir celular suspensão 01:10 no RSM. Reserva 2 mL (5 mL) do RSM para lavar o balão/bem e adicionar à suspensão diluída celular.
Nota: Não permitir o tempo de exposição de enzima exceder 25 min. - Centrifugar a suspensão de eritrócitos a 173 x g durante 5 min à temperatura ambiente.
- Aspirar o meio do centrifugado e ressuspender as células em 1 mL (5 mL) de RSM
- Coe as células usando um filtro de célula de malha de nylon com 40 µm de poros. Contar o número de células em um volume especificado usando um hemocytometer e calcular a concentração de células na solução tensa.
- Sementes de células nas chapas revestidas ECMH a 1 x 10 5 células/cm 2 em 4 mL (15ml) de RSM.
- Permitem que as células amadurecer-se por 30 dias. Continuam a mudar o RSM cada 3-4 dias.
- Repita o procedimento acima (passo 5.2-5.11) no dia 30 a passagem das células de passagem 1 a 2.
6. Criando um banco de células intermediárias: criopreservação de passagem dia 2 3-5 RPE
Nota: Cryopreserve células, enquanto eles são Observacao (~ 50%) e não tem recuperado pigmento.
- Com base no número de células, calcular o volume de meio de criopreservação com 10% de DMSO necessária para Ressuspender as células em uma concentração de 3 x 10 6 células/mL.
- Siga os passos 5.2 a 5.8. Ressuspender as células no meio de criopreservação com 10% de DMSO a 3 x 10 6 células/mL e transferir 1 mL da suspensão de células para frascos criogênicos de 1,2 mL.
- Colocar frascos criogênicos em um recipiente de congelação projetado para arrefecer a-1 ° C/min e coloque a-80 ° C durante a noite. Transferência de nitrogênio líquido para armazenamento a longo prazo.
Nota: Estas células será passagem 3 após o descongelamento. Cultura de células para mais 30 dias antes de caracterização. Semente de passage 3 RPE em 1,5 x 10 5 por cm 2 após descongelamento. 2 , 4 , 6 , 7
Resultados
Esse método resulta na produção de uma monocamada homogênea, pigmentada e cuboidal de RPE. A linha do tempo na Figura 1 corresponde às imagens representadas na Figura 2. Como mostrado na Figura 2A, as colônias de células-tronco são hermeticamente embaladas com bordas definidas e sem células fibroblástica entre colônias ou células opacas dentro de colônias. Figura 2B fornece uma representação de RPE imaturo que são Observacao. Se as células são confluentes já nesta fase, não pode estender as projeções que são críticas para o processo de diferenciação. As células que são severamente Observacao não será capazes de estabelecer uma monocamada e formam junções apertadas, características do epitélio. Detalhes sobre como otimizar essa confluência são descritas na seção de discussão. A Figura 2 mostra a morfologia dos dois tipos mais comuns de não-RPE que podem surgir durante este processo de diferenciação: patches neurais ou fibroblástica. É importante salientar que essas manchas neurais aparecem especialmente opacas em um microscópio de dissecação, Considerando que os patches definidos, fibroblástica, como são quase translúcidos em um microscópio de dissecação. Pode ser útil marcar essas áreas em uma placa de cultura de tecido com uma caneta de laboratório à prova de etanol mais facilmente identificá-los em um microscópio composto e o microscópio de dissecação. Figuras 2D-F mostrar a características bordas brilhantes, morfologia de paralelepípedos e pigmentação que indicam uma cultura saudável, amadurecimento de RPE. A Figura 3 é uma imagem de ampliação mais elevada para mostrar a aparência diferente da RPE totalmente maduro, retratado por contraste de fase e microscopia de campo claro. Passagem 3 dia 30, as células estão prontas para a caracterização que tem sido descrita em publicações anteriores, incluindo a expressão do RNA, expressão da proteína, secreção de fator de crescimento e fagocitose2,4,6 ,7. Estas caracterizações mostram que as células representadas nestas imagens não só pigmentadas e cuboidal, mas também fagocíticas, pós mitóticas e polarizada.
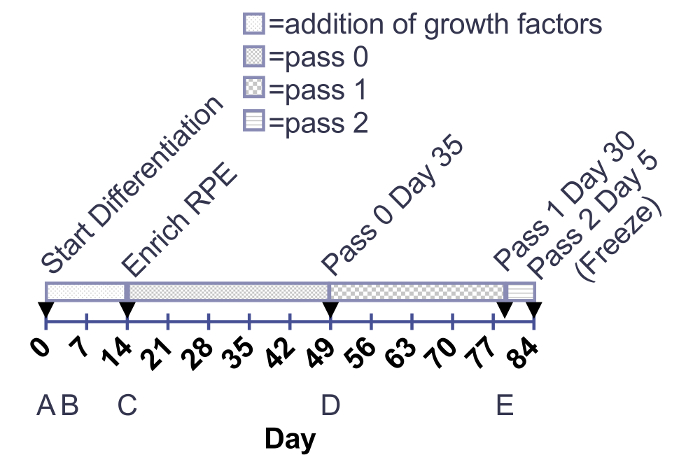
Figura 1:. Cronograma para a adição de fatores de crescimento e maturação de RPE. Fatores de crescimento são adicionados às placas 12-poços de dia 0-14. Amadurecimento de RPE são cultivadas em placas boas 6 ou T75 frascos de dia de enriquecimento para degelo após de 30 dias (passagem 3 dia 30). As setas indicam a passagem de células enzimática. (A-E) abaixo os prazos correspondem às imagens na Figura 2. Clique aqui para ver uma versão maior desta figura.

Figura 2: morfologia representativa e confluência de amadurecimento RPE. Células-tronco pluripotentes induzidas imediatamente antes da passagem de diferenciação (A). Subconfluent de células RPE imaturo no dia 2 (B) e antes da escolha de remover enriquecimento no dia 14; patches não-RPE (indicados pelas setas brancas) aparecem como patches ou opaco "fitas" (C). RPE na passagem, 0, 1 e 3 no dia 30 (D, E e F). Barra de escala = 200 µm. clique aqui para ver uma versão maior desta figura.
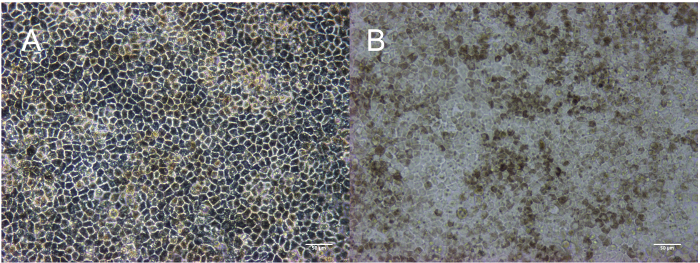
Figura 3: amadurecer RPE na passagem 3: 30 do dia Cuboidal morfologia retratado em contraste de fase (A) e pigmentação retratado em campo claro-(B). Barra de escala = 50 µm. clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve como produzir células epiteliais de pigmento retinal de células-tronco pluripotentes. O método foi otimizado usando ambas as células-tronco pluripotentes embrionárias e induzida humana de um método de cultura alimentador-livre, sem soro. Desde o isolamento inicial das células-tronco embrionárias humanas em 1998 e a derivação de células-tronco pluripotentes induzidas (iPSC) em 2007, uma infinidade de cultura de células-tronco métodos têm sido desenvolvidos14,15,16, 17. Esses métodos devem ser suficientes para a produção de colônias de células-tronco que são suscetíveis a essa diferenciação. Não existem limitações conhecidas para a aplicabilidade deste método de células-tronco pluripotentes corretamente derivada e mantida.
Os passos mais críticos são a passagem de células-tronco para o dia 0 de diferenciação (etapa 2.5) e a necessidade potencial de dissecação manual no dia 14 do processo (passo 4.5). Ao escolher para remover células diferenciadas de colônias de células-tronco, referir-se a imagens em Kent18. Como indicado, as células fibroblástica entre colônias e as células opacas dentro colônias indicam células diferenciadas que precisam ser removidas antes de iniciar este protocolo18. Só colônias indiferenciadas, hermeticamente embaladas com bordas definidas devem ser passadas para diferenciação.
O número de células-tronco sem sementes por alvéolo (etapa 2.6.7) é complicado pelo fato de que as células-tronco não pode ser trituradas em uma suspensão de célula única mediante passagem e não pode ser contadas com precisão usando um hemocytometer. A aproximação de células-tronco confluente 80% é indicada para 1 passagem bem de uma placa de 6 para 4 poços de uma placa de 12. Diferenças entre as linhas de células-tronco, tais como taxa de crescimento, podem afetar a rapidez o RPE imaturo alcançar confluência entre os dias 0 a 4. As células-tronco produzirá RPE independentemente da confluência precisa, mas o rendimento da célula será afetado negativamente se as células são muito escassas nesta fase. As células RPE imaturas devem ser aproximadamente 40-50% de confluencia no dia 1 e quase 100% de confluencia por dia 4. Se as células não estão produzindo uma monocamada confluente pelo dia 4 ou 6, o protocolo deve ser repetido em uma maior densidade de semeadura no dia 0. Por exemplo, se 1 bem de uma placa de 6 foi passado para 4 poços de uma placa de 12 no dia 0 e o RPE imaturo não são 100% confluente no dia 4, reduzir a propagação de uma passagem de 1:3 ou 1:2 em dia 0 ou permitir que as células-tronco para se tornar mais confluente antes de passagem. É fundamental estabelecer uma densidade de semeadura consistente ao comparar várias linhas de célula.
Etapa no dia 14 de dissecação manual só é necessária quando as células de RPE não estão presentes na cultura (Figura 2). Desde a adição de CHIR99021 ao protocolo, muitas linhas de células-tronco pluripotentes não exigem pouca ou nenhuma dissecação manual. Algumas preparações têm uma maior incidência de patches neurais e é fundamental para remover as células. Se o RPE não é viável na passagem passagem 3 0, é possível repetir o protocolo de diferenciação tendo tempo suficiente para remover todas as células não-RPE. Isso não acontece frequentemente, mas é mencionado aqui notar que a etapa de dissecação no dia 14 pode ser otimizada quando necessário.
Há uma variedade de protocolos de diferenciação RPE que variam em custo, bem como métodos de cultura, eficiência, quantificação e avaliação funcional, o último dos quais foi completamente revisado2. Nós preferimos o método 14 dias detalhado aqui por causa de sua eficácia, capacidade de adaptação e aplicabilidade a uma ampla gama de linhas de celular4,7,8. A etapa de criopreservação neste protocolo também oferece uma grande vantagem na criação de um banco de células intermediárias para uso futuro, evitando a variabilidade de lote para lote em experimentos. Começando com apenas 4 poços de uma placa de 12, é possível expandir em placas 6-poços em passagem 0 e T75 frascos na passagem 1 e 2. Passagem 2 dias 3-5, quando as células são ainda Observacao e não tem recuperado o pigmento, é possível cryopreserve dezenas de milhões de células e depois descongelar o RPE maduro, designado passagem 3 dia 30, para verificar a expressão de RNA, expressão de proteínas, fator de crescimento secreção, fagocitose, etc. Também estabelecemos protocolos para expandir o RPE para até 13 passagens 19.
Olhando para a frente, este método será útil para iPSC modelagem de doença ocular e para geração de RPE para terapia celular. Com relação à modelagem de doença de iPSC, este protocolo está sendo usado atualmente no laboratório, para produzir o RPE de linhas CRISPR-corrigido com controles não corrigida do mesmo paciente. Além disso, este protocolo é adaptável aos substratos sintéticos e condições xeno-livre que são úteis para aderir às boas práticas de fabricação exigidas para uma terapia celular.
Divulgações
Dr. Clegg é co-fundador da regenerativa Patch Technologies LLC.
Agradecimentos
Este trabalho foi financiado pela iniciativa de Garland para a visão, o Instituto de Califórnia para a medicina regenerativa (CIRM; subvenções DR1-01444, CL1-00521, TB1-01177, FA1-00616 e TG2-01151), The Vermont Community Foundation, Fundação Breaux e o Fundação de luta contra a cegueira Gund Wynn programa de aceleração de pesquisa translacional.
Materiais
| Name | Company | Catalog Number | Comments |
| SterilGARD III laminar flow biosafety cabinet | Baker | model: SG603A-HE, type: A2, class: 2 | 6' Baker laminar flow biosafety cabinet |
| Dissection Hood | Labconco | Model 3970405 | laminar flow bench top |
| dissecting microscope | Nikon | SMZ 1500 | heated stage |
| air-jacketed CO2 incubator | Sanyo | MCO-17AIC | 37 oC and 5% CO2 |
| inverted phase contrast microscope | Olympus | IX53 | |
| Name | Company | Catalog Number | Comments |
| Media Components | |||
| DMEM/F12 | Gibco | 10565042 | |
| N2 Supplement | Gibco | 17502048 | |
| B27 Supplement | Gibco | 17504044 | |
| NEAA | Gibco | 11140050 | |
| Name | Company | Catalog Number | Comments |
| Growth Factors and Reagents | |||
| Nicotinamide | Sigma | N0636 | |
| Recombinant mouse noggin | R&D systems | 1967-NG-025 | |
| Recombinant human DKK-1 | R&D systems | 5439-DK-010 | |
| Recombinant IGF-1 | R&D systems | 291-G1-200 | |
| FGF-basic | Peprotech | 100-18B | |
| Recombinant human/mouse/rat Activin A | Peprotech | 120-14E | |
| SU5402 FGF inhibitor | Santa Cruz Biotechnology | sc-204308 | |
| Name | Company | Catalog Number | Comments |
| Substrates | |||
| Matrigel Basement Membrane Matrix, Phenol Red-Free, LDEV-Free | Corning | 356237 | extracellular matrix-based hydrogel (ECMH) |
| Matrigel hESC-Qualified Matrix, LDEV-Free | Corning | 354277 | growth factor reduced ECMH |
| Name | Company | Catalog Number | Comments |
| Other reagents | |||
| 1X Versene (EDTA) | Gibco | 15040066 | |
| DPBS | Gibco | 14190250 | |
| 1X PBS (no calcium, no magnesium) | Gibco | 10010023 | |
| TrypLE (trypsin-like dissociation enzyme, TDE) | Gibco | 12563011 | |
| X-VIVO 10 (RPE supporting medium) | Lonza | BW04-743Q | |
| Y-27632 | Tocris | 12-541-0 (1254) | |
| CryoStor CS10 | BioLife Solutions | 210102 | cryopreservation medium |
| 1.2 mL Cryogenic Vial | Corning | 430487 | |
| Mr. Frosty (freezing container) | Nalgene | 5100-0001 | freezing container |
| Normocin | Invivogen | ant-nr-2 | antimicrobial reagent |
| Name | Company | Catalog Number | Comments |
| Other Equipment | |||
| Pipet-aid | Drummond | 4-000-101 | |
| 12-well culture plate | Corning | CLS3516 | Used during differentiation. |
| T75 flask | Corning | 430641 | Used during RPE maturation. |
| 6-well culture plate | Corning | CLS3513 | Used during RPE maturation. |
| cell scraper | Corning | 08-771-1A | Used during passages. |
| cell strainer | Falcon | 352340 | Used during passages before cell count. |
Referências
- Strauss, O. The retinal pigment epithelium in visual function. Physiol. Rev. 85 (3), 845-881 (2005).
- Leach, L. L., Clegg, D. O. Concise Review: Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients With Ocular Disease. Stem Cells. 33 (8), 2363-2373 (2015).
- Pennington, B. O., Clegg, D. O. Pluripotent Stem Cell-Based Therapies in Combination with Substrate for the Treatment of Age-Related Macular Degeneration. J. Ocul. Pharmacol. Ther. 32 (5), 261-271 (2016).
- Buchholz, D. E., Pennington, B. O., Croze, R. H., Hinman, C. R., Coffey, P. J., Clegg, D. O. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium. Stem Cells Transl. Med. 2 (5), 384-393 (2013).
- Clegg, D. O., Buchholz, D., Hikita, S., Rowland, T., Hu, Q., Johnson, L. V. Retinal Pigment Epithelial Cells: Development In Vivo and Derivation from Human Embryonic Stem Cells In Vitro for Treatment of Age-Related Macular Degeneration. Stem Cell Res. Ther. (Chapter 1), 1-24 (2008).
- Leach, L. L., Buchholz, D. E., Nadar, V. P., Lowenstein, S. E., Clegg, D. O. Canonical/β-catenin Wnt pathway activation improves retinal pigmented epithelium derivation from human embryonic stem cells. Invest. Ophthalmol. Vis. Sci. 56 (2), 1002-1013 (2015).
- Pennington, B. O., Clegg, D. O., Melkoumian, Z. K., Hikita, S. T. Defined culture of human embryonic stem cells and xeno-free derivation of retinal pigmented epithelial cells on a novel, synthetic substrate. Stem Cells Transl. Med. 4 (2), 165-177 (2015).
- Leach, L. L., et al. Induced Pluripotent Stem Cell-Derived Retinal Pigmented Epithelium: A Comparative Study Between Cell Lines and Differentiation Methods. J. Ocul. Pharmacol. Ther. 32 (5), 317-330 (2016).
- Mazzoni, F., Safa, H., Finnemann, S. C. Understanding photoreceptor outer segment phagocytosis: use and utility of RPE cells in culture. Exp. Eye Res. 126, 51-60 (2014).
- Sonoda, S., Spee, C., Barron, E., Ryan, S. J., Kannan, R., Hinton, D. R. A protocol for the culture and differentiation of highly polarized human retinal pigment epithelial cells. Nat. Protoc. 4 (5), 662-673 (2009).
- Choudhary, P., et al. Directing Differentiation of Pluripotent Stem Cells Toward Retinal Pigment Epithelium Lineage. Stem Cells Transl. Med. 6 (2), 490-501 (2017).
- Maruotti, J., et al. Small-molecule-directed, efficient generation of retinal pigment epithelium from human pluripotent stem cells. Proc. Natl. Acad. Sci. U.S.A. 112 (35), 10950-10955 (2015).
- Lane, A., et al. Engineering efficient retinal pigment epithelium differentiation from human pluripotent stem cells. Stem Cells Transl. Med. 3 (11), 1295-1304 (2014).
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147 (1998).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318 (5858), 1917-1920 (2007).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Amit, M., Itskovitz-Eldor, J. Derivation and spontaneous differentiation of human embryonic stem cells. J. Anat. 200 (Pt 3), 225-232 (2002).
- Kent, L. Culture and Maintenance of Human Embryonic Stem Cells. J. Vis. Exp. (34), e1427-e1427 (2009).
- Croze, R. H., et al. ROCK Inhibition Extends Passage of Pluripotent Stem Cell-Derived Retinal Pigmented Epithelium. Stem Cells Transl. Med. 3 (9), 1066-1078 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados