Method Article
Caracterización estructural de polisacáridos de pared celular mananos en plantas con ritmo
En este artículo
Resumen
Un protocolo para el análisis estructural de polisacáridos por electroforesis del gel (PACE), usando Manano como ejemplo, se describe.
Resumen
Polisacáridos de pared celular vegetal son notoriamente difíciles de analizar, y mayoría de los métodos requiere equipo costoso, operadores calificados y grandes cantidades de material purificado. Aquí, describimos un simple método para obtener polisacárido estructural información detallada, incluyendo resolución de isómeros estructurales. Para el análisis de polisacáridos por electroforesis del gel (PACE), material de la pared celular vegetal es hidrolizado con glicosil hidrolasas específicas de los polisacáridos de interés (por ejemplo, mannanases para Manano). Geles de poliacrilamida de gran formato se utilizan luego para separar los oligosacáridos liberados, que han sido etiquetados fluorescente. Los geles pueden ser visualizados con un gel modificado sistema de imagen (véase Tabla de materiales). La huella resultante de oligosacárido puede bien compararse cualitativa o con la replicación, cuantitativamente. Vinculación e información ramificación pueden establecerse usando adicional glicosil hidrolasas (p. ej., manosidasas y galactosidases). Mientras que este protocolo describe un método para el análisis de estructura de glucomanano, puede aplicarse a cualquier polisacárido que existen caracterizado glicosil hidrolasas. Alternativamente, puede utilizarse para caracterizar la novela glicosil hidrolasas utilizando sustratos definidos polisacáridos.
Introducción
Polisacárido análisis por electroforesis en gel (paso) es un método para la caracterización detallada de polisacáridos1,2,3. Polisacáridos de pared celular vegetal son notoriamente difíciles de analizar, y mayoría de los métodos requiere equipo costoso, operadores calificados y grandes cantidades de material purificado. Aquí, describimos un simple método para obtener polisacárido estructural información detallada, incluyendo resolución de isómeros estructurales.
Estructura de polisacáridos de pared celular de planta de entendimiento es necesario para aquellos investigadores explorar la planta pared de célula biosíntesis o el papel de la pared de célula de la planta en desarrollo de la planta. Recientemente, sin embargo, planta composición de pared celular se ha convertido en interesante para un grupo más amplio de investigadores debido al foco sobre el uso de biomasa vegetal (esencialmente la pared de célula) como materia prima para producir biocombustibles y productos bioquímicos4. Por ejemplo, sacarificación enzimática eficiente de este material requiere una comprensión detallada de las estructuras del polisacárido, para poder optimizados cócteles enzimáticos seleccionados5.
RITMO tiene varias ventajas sobre otros métodos que la hacen ideal para el rápido análisis de glicanos complejas estructuras. En primer lugar, no requiere la purificación de los polisacáridos en cuestión, ya que se requiere para la solución estado resonancia magnética nuclear (RMN)6. En segundo lugar, el ritmo puede resolver isómeros estructurales, a diferencia de la espectrometría de masas (MS, por ejemplo, asistida por matriz láser de desorción/ionización (MALDI) y la ionización por electrospray (ESI)), que también puede ser difícil realizar por cromatografía líquida (LC) 7. en tercer lugar, el ritmo es muy sensible, con picomole de baja resolución, a diferencia de la cromatografía en capa fina (TLC) o cromatografía de papel. Por último, no requiere conocimientos de equipos o especialista caro, como es el caso de MS, RMN y LC.
El método del ritmo se basa en la especificidad de glicosil hidrolasa (GH) enzimas, que tienen como objetivo ciertos acoplamientos glucosídicos en una mezcla de polisacáridos. Cuando la enzima GH actúa sobre la cadena de polisacárido, revela un extremo reductor que puede entonces ser químicamente derivatizado, en este caso con una etiqueta fluorescente. La porción unhydrolyzed de la muestra se representa por lo tanto indetectable por este método. Los oligosacáridos etiqueta entonces se separan en un gel de acrilamida de gran formato por electroforesis. Esto da excelente resolución de moléculas muy similares, por ejemplo, los trisacáridos Glc-hombre-hombre y hombre-Glc-Glc tendrá una diferente Rf.
RITMO se ha utilizado ampliamente para caracterizar estructuras diferentes xilano en planta especies8, para identificar a glycosyltransferase mutantes en Arabidopsis6,9,10,11 , para realizar ensayos de glicosidas9y caracterizar nuevos GH actividades12,13. Recientemente nos hemos utilizado para caracterizar mannan de la pared celular de levaduras (Mahboubi y Mortimer, en preparación). Aquí se describe un método para caracterizar la estructura de la pared celular de planta de glucomannan, basado en anteriores informes11,14.
Protocolo
1. recolección de Material vegetal
- cosecha material de planta fresco (20 mg) inmediatamente sumérjalo en 96% (v/v) de etanol e incubar a 70 ° C por 30 min; Esto desactiva cualquier pared celular degradación enzimas presentes. Para seco, empezar en el paso 2.
PRECAUCIÓN: El etanol es inflamable.
Nota: Una sola hoja de tallo o la roseta proporcionará suficiente material para el análisis. Sin embargo, se presentan menos errores si una mayor cantidad de tejido es agrupada y analizada ya que es más fácil pesar y. - Registrar cuidadosamente el tipo de tejido y etapa de desarrollo, como estructura de polisacárido varía con ambos. Por ejemplo, con Arabidopsis thaliana (utilizado aquí), la etapa del tejido según los métodos de Boyes et al. 15
Nota: en el presente Protocolo, hemos utilizado la mitad inferior del tallo de la inflorescencia, donde el primer silicua completamente es alargada pero no amarilleando.
2. preparación de Alcohol Insoluble residuo (aire)
- preparar aire, siguiendo el método de Mortimer et al. 9 u otro método similar, para producir un polvo falta de azúcares solubles, como la sacarosa y el almidón.
3. Alicuotar y tratamiento previo del aire
Nota: la cantidad exacta de aire necesario para cada muestra dependerá de la abundancia de polisacáridos de interés en el material y (b) el tamaño promedio de oligosacáridos por la GH. El método agrega una sola molécula fluorescente el reducción final de cada oligosacáridos, por lo que el número de oligosacáridos determina la sensibilidad del experimento. Como pauta, glucomannan en Arabidopsis madre digerido con GH5 GH26 (como descrito), 500 μg se recomienda 11, mientras que para el xilano en Arabidopsis madre digerido con GH11, 100 μg se recomienda como Mortimer ' estudio s 3.
- pesar aire (10-15 mg) en un tubo de centrífuga de 15 mL, y añadir y H 2 O a una concentración final de 2 mg/mL. Vortex para lograr una suspensión uniforme. Si esto es problemático, utilizar un homogeneizador de vidrio para ayudar a este proceso. Tubos
- alícuota 500 μg en microcentrífuga. Alícuotas utilizando una centrífuga de vacío en seco (véase la Tabla de materiales) durante la noche a 30 ° C.
- Tratamiento de aire con 1 M NaOH (20 μl) por 1 h a temperatura ambiente; esto acetylates de los polisacáridos y se hincha las microfibrillas de celulosa, perturban la estructura de la biomasa y permitir el acceso de GH.
Nota: Este paso puede omitirse para polisacáridos purificados. PRECAUCIÓN – base/ácido fuerte.- Incluyen una parte alícuota de un control de aire no-enzimática (tratan de la misma como todas las muestras, excepto el paso 4.1. queda excluida).
- Añadir 200 μL de H 2 O y 20 μL 1 M HCl para neutralizar. Prueba de que el pH es ~ 6-7 quitando 1 μl y manchado en las tiras de papel pH indicador.
- Amonio de 1 M agregue 50 μl del tampón de acetato, pH 6.0 (o sea pH es apropiado para el GHs utilizados en el estudio) y H 2 O para dar un volumen total de 500 μl.
Nota: El acetato de amonio se utiliza ya que sublimes al secado, y no añade sal adicional a la muestra. Un exceso de sal puede conducir a pobres en forma de banda y resolución sobre el gel ritmo.
4. Hidrólisis de aire con Glycosyl Hydrolases (GHs)
Nota: como se mencionó en la discusión, la pureza de las GHs es crítica. Use solamente expresado heterologously, enzimas purificados por afinidad. Tras la recepción de cada lote del fabricante, hidrolizar alícuotas definidas de sustrato (por ejemplo, 500 μg aire) con cantidades crecientes de GH durante la noche (p. ej., 0,5, 1, 2, 5, 10, 15, 20 μl) (3 unidades/μL). Cuando hay un exceso de GH, la huella de ritmo se verá idéntica. Un exceso de la enzima es necesario para entregar un resultado reproducible porque debe ser cierto que la reacción de hidrólisis aproxima el punto final.
- Agregar una cantidad predeterminada (ver arriba) de mannanases (GH5 y GH26 11) a las porciones de aire en buffer de paso 3.5, así como un positivo control (30 μg de glucomanano de konjac) y un control negativo de la no-aire (mezcla de enzima en una tubo vacío). Vortex y entonces vuelta brevemente para recoger la mezcla de reacción en la parte inferior del tubo de.
- Incubar durante una noche a 37 ° C (o la temperatura adecuada para el GH de elección) con agitación suave (~ 100 rpm).
- Detener la reacción por incubar a 95 ° C durante 20 min
Nota: Cierre de la tapa puede utilizarse para sellar los tubos del microfuge flip-top.- Centrifugar utilizando una microcentrífuga de Banco superior a la máxima velocidad durante 10 minutos y conservar el sobrenadante.
- Resuspender el precipitado en 250 μl de H 2 O, centrifugar como antes y conservar el sobrenadante.
- Combinar ambos sobrenadantes y secar en una centrífuga de vacío (véase la Tabla de materiales) a 30 ° C (~ 3 h o noche sin calefacción).
5. Elaboración de normas de oligosacárido
soluciones- preparar stock de 1 mM de H 2 O de manosa (hombre), manobiosa (hombre 2), mannotriose (3 de hombre), mannotetraose (Man 4), mannopentaose (hombre 5) y mannohexaose (hombre 6), todos β, 1-4 vinculado. Alícuota y almacenar a-20 ° C hasta que se.
- Preparar 3 diferentes concentraciones de un hombre 1-6 mezcla combinando 1 μl (estándar S1), 2 μl (S2) o 5 μl (S3) de seis todos.
- Seco en una centrífuga de vacío (véase Tabla de materiales) a 30 ° C (~ 1 h).
6. Derivitization de oligosacáridos
- preparar una solución de 0,2 M hormigas (ácido 8-aminonaftaleno-1,3,6-trisulfonic) en H 2 O: 17:3 de ácido acético. Caldo caliente a 60 ° C para disolver completamente el sólido. Almacenar a-20 ° C, protegido de la luz, para 2-3 meses.
- Prepare una solución de 0,2 M de 2-Picolina borano (2-PB) en DMSO. Esto es extremadamente higroscópico, suspender inmediatamente todo el polvo sobre el recibo en DMSO. Alícuota y almacenar a-20 ° C durante 1-2 años. Descongelar alícuotas como requerido (a 4 ° C por 2 semanas y luego deseche).
- Preparar el buffer de derivatización de H 2 O: ácido acético: DMSO en 17:3:20.
- Para cada muestra, añadir 5 μl de las hormigas, 5 μl de 2-PB y 10 μl de tampón de derivatización. Vuelta brevemente a recoger en la parte inferior del tubo, vortex y luego centrifugar brevemente otra vez. Vea la figura 1 para la descripción de la reacción.
- Incubar las muestras durante la noche a 37 ° C, protegido de la luz.
- Seco en una centrífuga de vacío (véase Tabla de materiales) a 30 ° C (~ 2 h).
- Resuspender las muestras y el estándar de urea de 3 M de 100 μl. Almacenar a-20 ° C, protegido de la luz hasta que se.
7. Preparación de ritmo geles
Nota: montaje de los equipos de colada del gel depende de la marca. Aquí, tenemos use un sistema de electroforesis vertical (véase Tabla de materiales), equipado con placas de vidrio de 18 x 24 cm y 1,5 mm de espaciadores de.
- Montaje de gel casting por el fabricante ' instrucciones s.
- Hacer buffer de ritmo x 10 (1 M Tris borato, pH 8.2) como sigue: Añadir 121,14 g de Tris Base a ~ 400 mL de H 2 O y mezclar para disolver. Ajustar el pH a 8.2 por la adición de ácido bórico sólido (aproximadamente 60 g) y luego hacer volumen hasta 1 L.
- Hacer un 10% (w/v) de amonio persulfato (APS) stock en H 2 O. alícuota y almacenar en alícuotas de-20 ° C. deshielo una vez, almacenar a 4 º C y desechar después de 2 semanas.
- Hacer y verter el gel de resolución. Para el equipo anterior, 1 gel equivalen a 50 mL. En un tubo de centrífuga de 50 mL, mezcla de H 2 O (20,2 mL), 5 mL de tampón de paso 10 x 24,6 mL 40% acrilamida/Bis-acrilamida (29: 1 acrylamide:Bis). (PRECAUCIÓN: tóxicos).
- Añada 200 μL de APS y 20 μl de N, N, N, N´-tetrametil-etilendiamina (TEMED). Invertir suavemente a la mezcla (para evitar la introducción de burbujas de aire). Verter el gel usando un serológicos u otras pipetas de gran volumen, a ~ 4 cm por debajo de la parte superior de las placas de vidrio. Preste atención a la posibilidad de burbujas de aire queden atrapados en el gel. Si hacer, dejar de verter y tilt/tap el gel para ponerlos en libertad.
- El gel con isopropanol (inflamable PRECAUCIÓN :) o, con cuidado, con H 2 O. permitir gel para polimerizar (20-30 minutos), luego retirar la capa superior del recubrimiento. Si se utilizó isopropanol, luego lavar 2 x con H 2 O. seco cualquier exceso de líquido con papel secante.
- Hacer y verter el gel de apilamiento. La mezcla 6,8 mL H 2 O, 1 mL x 10 ritmo de tampón, 2,8 mL de acrilamida/Bis-acrilamida (PRECAUCIÓN: tóxicos), 80 μl APS y 8 μl de TEMED en un tubo de centrífuga de 15 mL. Invierta para mezclar y superponer sobre el gel de resolución polimerizado. Inserte suavemente peines, evitando burbujas de aire captura en los dientes del peine. Gel
- permitir a polimerizarse (20-30 min), envolver en el tejido húmedo y luego en envoltura de plástico y almacenar a 4 ° C hasta que se. Tienda con los peines en el lugar.
Nota: Ritmo geles pueden conservarse durante un máximo de 2 semanas (aunque menos de una semana es ideal), si se mantienen húmedos.
8. Ejecutando un ritmo Gel
- utilice un marcador permanente para etiquetar las posiciones bien en el vidrio, que le ayudará a realizar un seguimiento de la orden de carga, y en identificar los pozos una vez se retira el peine.
- Quitar el peine-guía. Llenar los pozos con tampón de ritmo 1 x.
- Usar una microjeringa μl 10 para cargar 2 μl de estándares y muestras en los pocillos. Evitar el uso de los carriles exteriores, que tienden a ejecutar las muestras mal.
- Montar la cámara superior del aparato de gel en ejecución y coloque el gel en un tanque de funcionamiento frío (~ 10 ° C) (10 ° C) con tampón de ritmo x 1. Llenar la cámara superior con tampón de ritmo 1 x.
- Activar la energía y ejecutar el gel a 200 V (constante V) para 30 minutos y luego aumento de la tensión de 1000 V durante 1 h 40 minutos. Geles de proteger de la luz (por ejemplo, por envolver los tanques en bolsas de basura negra).
Nota: Revise en los geles ~ 5 min después de encender la tensión y luego otros 5 minutos después de aumentar la tensión de 1.000 V. Si el paquete de energía es incapaz de mantener la tensión, entonces es probable que hay una fuga de memoria intermedia. Retirar el gel del tanque. Vuelva a la sala superior, revisar cuidadosamente la colocación de todas las juntas. Un chip grande en el borde superior de la placa de vidrio puede prevenir la placa formando un buen sello con la Junta. Esto puede generalmente temporalmente resolver agregando una gota de agarosa fundida 5% (p/v) a la parte astillada del vidrio, antes de añadir la cámara superior.
9. Visualización de un gel de ritmo
Nota: utilice un gel sistema equipado con bombillas UV de onda larga en el transiluminador y un filtro de emisión de la cámara que es conveniente para el fluoróforo, aquí 530 nm para la proyección de imagen. Alternativamente, un escáner láser puede usarse también, como se describe en el Goubet 2.
- Garantizar el gel sistema de imagen es libre de polvo, limpiándolo con pelusa húmedo.
- Retirar el gel del tanque del ritmo y ve brevemente mientras que el gel se encuentra todavía en las placas de vidrio (< 80 ms) para determinar si el frente del tinte es todavía en el gel de.
- Abrir el gel utilizando una herramienta de cuña y mientras que el gel es en placa de vidrio, use un cortador de pizza para quitar tanto el gel de apilamiento y, si el frente del tinte todavía está en el gel, la parte inferior del gel.
- Poner ~ 5 mL H 2 O en la superficie del transiluminador y luego transferir el gel directamente sobre el transiluminador. Establecer el filtro para UV 605 y encender el transiluminador de onda larga UV (véase Tabla de materiales) utilizando el software.
Nota: Las hormigas fluoróforo utilizado aquí tiene una excitación/emisión de 353/520 nm. - Tomar varias imágenes en diferentes tiempos de exposición (por ejemplo, 100 ms a 10 s). Asegúrese de apagar la luz UV entre las imágenes haciendo clic en el botón de la luz UV (para apagar) para evitar degradar la fluorescencia. No garantizar que al menos 2 de las imágenes saturadas bandas (el gel imaging software indicará esto).
- Guardar archivos como imágenes de alta resolution.tif.
Nota: Imágenes pueden ser analizadas utilizando el software suministrado con el sistema de imagen en gel, o mediante el uso de software de análisis de imagen disponibles, como el ImageJ (https://imagej.nih.gov/ij/). Consulte la sección de resultados para una discusión de cuantificación.
Resultados
Aquí, mostramos un gel de ritmo en el ejemplo se ejecute por el protocolo, junto con las descripciones para ayudar con la interpretación de datos y solución de problemas, y esto es seguido por una guía general para el exitoso ritmo gel interpretación13,16. Gel representativo de un ritmo estándar análisis de contenido de pared celular Manano se muestra en la figura 2y se describe carril por carril.
Normas
Carriles 1, 2 y 3 muestran una escalera de oligosacáridos comercialmente comprados (hombre1- hombre6) 5 (S1), 10 (S2) y 50 (S3) pmol concentración. Cuando se recibe un lote nuevo de un oligosacárido comercial, es importante controlar la pureza de un gel. Muchos oligosacáridos, particularmente tetrasacccharides y ya, puede tener contaminación significativa con oligosacáridos de otros grados de polimerización (DPs), como se muestra aquí para hombre6 (marcado con *). Mientras cuantificación un gel, es importante tener al menos 3 concentraciones de los estándares, ya que es necesario para el cálculo de la curva estándar. Cálculo de la curva estándar también puede ser útil para asegurar que la reacción de derivatización es esencialmente al finalizar. Estándares de concentraciones conocidas de permitan comparaciones entre geles y son un control útil para calidad de separación y derivatización.
Control positivo
Carril 4 muestra una digestión mannanase de glucomannan konjac. Konjac glucomannan está disponible comercialmente, y aunque no tiene la misma estructura que, por ejemplo, en Arabidopsis, tiene dos propósitos. En primer lugar, es un control importante de la digestión enzimática. El investigador debe establecer lo que parece un sustrato comercial digerido con su SAM de elección cuando digirió a la terminación (es decir, un gran exceso de GH se agrega a la reacción). Si en el futuro los experimentos el patrón cambia, esto puede indicar una pérdida de actividad o contaminación de las acciones de la GH. En segundo lugar, sirve como control de la reacción de derivatización en presencia de las enzima y tampón de sales. Si las normas se ven bien, pero el control positivo es pobre, esto puede indicar que un componente de la reacción de hidrólisis es inhibitorio para la derivatización.
Tipo salvaje (WT) Arabidopsis eje aire + mannanase cóctel (GH5 + GH26)
Carril 5 muestra la huella del paso de un tallo de Arabidopsis WT (Comparar con referencias11,14).
csla9 Arabidopsis eje aire + mannanase cóctel (GH5 + GH26)
Carril 6 muestra muestra la huella del paso del tallo de un Arabidopsis planta que carece de los principales del tallo manan sintasa11. Comparar con el peso y el control negativo las huellas dactilares. Mientras que la mayoría de la mano está ausente en esta planta, sigue siendo una cantidad pequeña, según lo evidenciado por las intensidades de la reducida banda de oligosacáridos derivados de mannanase todos esto es sintetizado por Manano adicional sintasas (CSLA2, 3)11.
Control negativo - enzima sólo
Carril 8 muestra bandas en el gel que no son específicos que derivan de los contaminantes en el mannanase cóctel y deben ser excluidos del análisis (marcados con *).
Control negativo - WT aire sólo
Carril 9 muestra bandas en el gel que no son específicos y deben ser excluidos del análisis (marcados con *).
Control negativo- csla9 Aire sólo
Carril 10 muestra bandas en el gel que no son específicos y deben ser excluidos del análisis (marcados con *).
Pino madera aire + mannanase cóctel (GH5 + GH26)
Carril 7 muestra la huella de paso de madera de pino, que contiene galactoglucomannan. Esto claramente tiene un patrón diferente de oligosacáridos lanzados a Arabidopsis, debido a su diferente estructura.
Control negativo - pino aire sólo
Carril 11 muestra bandas en el gel que no son específicos y deben ser excluidos del análisis (marcados con *).
Interpretación de un gel de ritmo es relativamente sencilla, pero requiere conocimiento de los siguientes puntos. De datos robustos, se recomienda realizar ritmo en al menos 3 independientemente crecido biológica replica y se recomienda realizar al menos 2 repeticiones técnicas en cada repetición biológica. Los controles descritos son críticos para la interpretación, como bandas inespecíficas que deba excluirse. También se recomienda cargar las muestras en un orden diferente en geles de replicar, para excluir los efectos que resultan de la iluminación desigual por el transiluminador. Interpretación exige el análisis de bandas que no están saturadas. Dado que algunas huellas de oligosacárido pueden contener dos polisacáridos de muy alta y baja abundancia, recomendamos analizar las exposiciones múltiples del mismo gel. Pueden utilizarse los estándares para normalizar entre distintas imágenes.
Para algunos tipos de experimentos, puede ser deseable para cuantificar la cantidad de polisacárido en la preparación de aire. Mientras que es posible cuantificar de un gel de ritmo, requiere conocimiento de la identidad molecular exacta de cada oligosacárido lanzado por el SAM y donde se encuentra en el ritmo del gel. Esto actualmente no es totalmente conocido por Manano, pero se ha determinado para otros polisacáridos por ejemplo xilano3. Los estándares proporcionan una forma de normalización entre geles, incluso cuando no se está realizando cuantificación y por lo que le ayudará a cualquier análisis cualitativos o semi-cuantitativos.
Identificar la estructura de los oligosacáridos se puede lograr utilizando cócteles de GHs. secuencial además de otras GHs pueden revelar detalles sobre los vínculos y las sustituciones de los oligosacáridos liberados (por ejemplo, adición de β - 1, 4 - glucosidasa que actúa sobre el extremo no reductor revelará que oligosacáridos en la mezcla contengan esa característica). Las enzimas disponibles incluyen galactosidases, Betaglucuronidasa y glucosidasas (véase la base de datos de CAZy16 para obtener más información); Ver Hogg, D. et al. 17 como ejemplo.
El protocolo anterior puede utilizarse para caracterizar la actividad de GHs desconocidos. En este caso, debe utilizarse una biomasa definida, tales como Arabidopsis tallo o konjac glucomannan, para el desconocido Sam13.
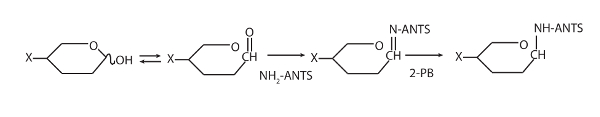
Figura 1 : Esto muestra el esquema para la derivatización fluorescente de oligosacáridos con hormigas. Modificado de Goubet2. haga clic aquí para ver una versión más grande de esta figura.
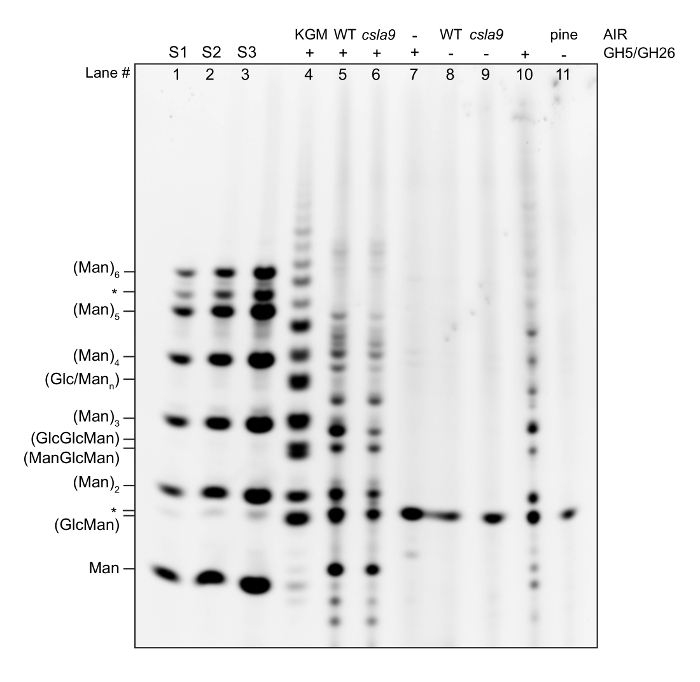
Figura 2 : Gel ritmo representativas que muestran la huella de la mano de Arabidopsis, pino y un mutante de Arabidopsis (csla9) que tiene deterioro de la biosíntesis de Manano. AlR fue hidrolizada con un cóctel mannanase, y los oligosacáridos liberados fueron derivatizados con un fluoróforo. Los oligosacáridos se separaron por electroforesis en gel en base a tamaño, forma y carga. Una escalera de manno-oligosacáridos (Man1-6) se muestra para ayudar a identificar la movilidad relativa de los oligosacáridos lanzados y una hidrólisis de Manano purificada (derivado de konjac) se muestra como un control positivo. * = bandas inespecíficas. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
RITMO es un método simple para caracterizar la estructura de polisacárido. Puede ser aplicado a cualquier polisacárido que se conocen GHs con actividad caracterizado, ver numerosos ejemplos en la literatura1,6,9,11. TT también se ha aplicado a la caracterización de la novela GHs12,13,18 y glicosiltransferasas9, haciendo uso de polisacárido definido sustratos y aceptores.
Resultados reproducibles, interpretables son dependientes en tres pasos claves. En primer lugar, el SAM utilizado debe estar libre de contaminantes de actividades. Esta es la mejor alcanzada solamente usando heterologously expresados, enzimas purificados por afinidad. En segundo lugar, para la mayoría de los experimentos, es importante que la hidrólisis enzimática de los sustratos es al finalizar. Esto asegurará que la misma biomasa hidrolizada con el mismo GH da la misma huella digital en cada experimento. Por último, debe haber un exceso de fluoróforo en la reacción de derivatización. Esto asegura que los extremos reductores disponibles están etiquetados en cerca del 100%. Esto resultará en alta reproducibilidad de resultados, así como datos cuantitativos.
Gel y reactivo de calidad son críticos para asegurar datos reproducibles. Buffers de mala calidad, especialmente del pH incorrecto, burbujas en el gel y las muestras con un exceso de sal pueden todos afectar factor retención y resolución de los oligosacáridos. Sin embargo, inclusión de los controles recomendados descritos en la sección de Protocolo y resultados permitirá solucionar problemas.
RITMO está limitado por su capacidad para identificar los oligosacáridos. Para algunos experimentos, una simple huella digital es todo lo necesario. Sin embargo, para cuantificar realmente la cantidad de glucomannan en una muestra de aire, por ejemplo, la identidad de todos los oligosacáridos liberados se requiere, que es un proceso desperdiciador de tiempo. Esto es más sencillo por menos complejos polisacáridos como xilano3. Puesto que hay pocas normas de oligosacárido comercialmente disponibles, puede que no siempre sea posible o conveniente para identificar a todas las bandas. En este caso, el ritmo puede proporcionar datos muy complementarios a espectrometría de masas (es decir, MALDI-CID9 o ESI-MS7y NMR6). De estos métodos, a menudo es útil hacer una preparación a gran escala, separar por cromatografía de exclusión de tamaño, y luego analizar cada fracción por tanto ritmo antes de MS o NMR. Aunque se ha informado de que bandas pueden ser suprimidas e identificadas por MALDI-CID, en la práctica encontramos que este tiene una baja tasa de éxito (posiblemente debido a las interacciones de los oligosacáridos etiquetados con el gel de acrilamida cuando se expone a la luz UV).
La otra limitación importante del ritmo es rendimiento. Para tener buena calidad, interpretables geles con los controles adecuados, cada gel sólo tenemos muestras experimentales ~ 10, y un investigador puede esperar realizar geles de ritmo ~ 4 por día. Recientemente, una versión de ritmo utilizando electroforesis capilar (CE) ha sido desarrollado19, que permite la preparación de muestras en placas de 96 pocillos. Se ha utilizado con éxito para caracterizar las actividades enzimáticas de glicosidas y polisacárido estructuras6,19, aunque requiere acceso a una máquina de la CE, que puede ser caro para comprar y mantener.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El método de ritmo fue desarrollado y optimizado por los distintos miembros del grupo de Dupree (Universidad de Cambridge, Reino Unido) en los años, y agradecemos todos sus aportes. Este trabajo fue financiado como parte de la DOE Instituto conjunto de Bioenergía (http://www.jbei.org) apoyado por el Departamento de energía de Estados Unidos, oficina de ciencia, oficina de biológico e investigación ambiental, a través de contrato DE-AC02-05CH11231 entre Lawrence Laboratorio Nacional de Berkeley y el Departamento de energía de Estados Unidos. También agradecemos a Thea Pick y Vy Ngo para ayuda con la preparación de las muestras de csla9 .
Materiales
| Name | Company | Catalog Number | Comments |
| Oligosaccaharide Standards | |||
| Mannose | Sigma-Aldrich | CAS 3458-28-4 | |
| Mannobiose | Megazyme | CAS: 14417-51-7 | |
| Mannotriose | Megazyme | CAS: 28173-52-6 | |
| Mannotetraose | Megazyme | CAS: 51327-76-5 | |
| Mannopentaose | Megazyme | CAS: 70281-35-5 | |
| Mannhexaose | Megazyme | CAS: 70281-36-6 | |
| Glucomannan (Konjac; Low Viscosity) | Megazyme | P-GLCML | |
| Name | Company | Catalog Number | Comments |
| Other specialty chemicals | |||
| 8-Aminonaphthalene-1,3,6-trisulfonic acid | (Molecular probes) Thermo | A350 | |
| 2-picoline borane | TCI | B3018 | |
| 40 % acrylamide/Bis-acrylamide (29:1 acrylamide:Bis) | Bio-rad | 1610146 | |
| Name | Company | Catalog Number | Comments |
| Specialty Equipment | |||
| Gel casting kit | Hoefer | SE660 kit | 18x24 cm glass plates, 0.75 mm spacers |
| Cooling recirculating water bath | Hoefer | RCB20-plus 115v | Needs to be able to maintain temperature at ~10 C |
| G:Box Chemi XRQ Imaging System | Syngene | 05-GBOX-CHEMI-XRQ | Order with filters appropriate to fluorphore, and transilluminator should be fitted with long-wave UV light bulbs |
| High Voltage Power Pack | Thermo | EC1000XL | 1000V |
| Vacuum centrifuge(Speedvac) | Savant | SPD131 | |
| Vertical Gel electrophoresis system | Hoefer | SE660 | |
| Glycosyl hydrolases | |||
| These can be obtained from companies e.g. Megazyme (https://www.megazyme.com/) or Prozomix (http://www.prozomix.com/), or can be expressed in house by requesting the plasmid from the relevant research group. | |||
| Name | Company | Catalog Number | Comments |
| Lab supplies | |||
| 15 ml Centrifuge tube ( Falcon Centrifuge Tubes, Polypropylene, Sterile, Corning) | VWR | 21008-918 | |
| 50 ml Centrifuge tube ( Falcon Centrifuge Tubes, Polypropylene, Sterile, Corning) | VWR | 21008-951 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Gel imaging software ( Genesys) | Syngene |
Referencias
- Barton, C. J., et al. Enzymatic fingerprinting of Arabidopsis pectic polysaccharides using polysaccharide analysis by carbohydrate gel electrophoresis (PACE). Planta. 224 (1), 163-174 (2006).
- Goubet, F., Jackson, P., Deery, M. J., Dupree, P. Polysaccharide analysis using carbohydrate gel electrophoresis: A method to study plant cell wall polysaccharides and polysaccharide hydrolases. Anal Biochem. 300 (1), 53-68 (2002).
- Mortimer, J. C. Structural Analysis of Cell Wall Polysaccharides Using PACE. Methods Mol Biol. 1544, 223-231 (2017).
- Pauly, M., Keegstra, K. Cell-wall carbohydrates and their modification as a resource for biofuels. Plant J. 54 (4), 559-568 (2008).
- Lopez-Casado, G., Urbanowicz, B. R., Damasceno, C. M., Rose, J. K. Plant glycosyl hydrolases and biofuels: a natural marriage. Curr Opin Plant Biol. 11 (3), 329-337 (2008).
- Mortimer, J. C., et al. An unusual xylan in Arabidopsis primary cell walls is synthesised by GUX3, IRX9L, IRX10L and IRX14. Plant J. 83 (3), 413-426 (2015).
- Ridlova, G., Mortimer, J. C., Maslen, S. L., Dupree, P., Stephens, E. Oligosaccharide relative quantitation using isotope tagging and normal-phase liquid chromatography/mass spectrometry. Rapid Commun Mass Spectrom. 22 (17), 2723-2730 (2008).
- Busse-Wicher, M., et al. Evolution of Xylan Substitution Patterns in Gymnosperms and Angiosperms: Implications for Xylan Interaction with Cellulose. Plant Physiol. 171 (4), 2418-2431 (2016).
- Mortimer, J., et al. Absence of branches from xylan in Arabidopsis gux mutants reveals potential for simplification of lignocellulosic biomass. Proc Nat Acad Sci USA. 107 (40), 17409-17414 (2010).
- Anders, N., et al. Glycosyl transferases in family 61 mediate arabinofuranosyl transfer onto xylan in grasses. Proc Nat Acad Sci USA. 109 (3), 989-993 (2012).
- Goubet, F., et al. Cell wall glucomannan in Arabidopsis is synthesised by CSLA glycosyltransferases, and influences the progression of embryogenesis. Plant J. 60 (3), 527-538 (2009).
- Rogowski, A., et al. Evidence That GH115 alpha-Glucuronidase Activity, Which Is Required to Degrade Plant Biomass, Is Dependent on Conformational Flexibility. J Biol Chem. 289 (1), 53-64 (2014).
- Rogowski, A., et al. Glycan complexity dictates microbial resource allocation in the large intestine. Nat Commun. 6, 7481 (2015).
- Handford, M. G., et al. Localisation and characterisation of cell wall mannan polysaccharides in Arabidopsis thaliana. Planta. 218 (1), 27-36 (2003).
- Boyes, D. C., et al. Growth stage-based phenotypic analysis of Arabidopsis: a model for high throughput functional genomics in plants. Plant Cell. 13 (7), 1499-1510 (2001).
- . . The Carbohydrate Active Enzyme Database. , (2017).
- Hogg, D., et al. The modular architecture of Cellvibrio japonicus mannanases in glycoside hydrolase families 5 and 26 points to differences in their role in mannan degradation. Biochem J. 371, 1027-1043 (2003).
- Brennan, Y., et al. Unusual microbial xylanases from insect guts. Appl Environ Microbiol. 70 (6), 3609-3617 (2004).
- Li, X., et al. Development and application of a high throughput carbohydrate profiling technique for analyzing plant cell wall polysaccharides and carbohydrate active enzymes. Biotechnol Biofuels. 6, (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados