Method Article
Caratterizzazione strutturale di Mannan polisaccaridi di parete cellulare nelle piante usando passo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Un protocollo per l'analisi strutturale dei polisaccaridi mediante elettroforesi su gel (APCE), utilizzando mannano come esempio, è descritto.
Abstract
Polisaccaridi di parete delle cellule vegetali sono notoriamente difficili da analizzare, e la maggior parte dei metodi richiedono attrezzature costose, operatori specializzati e grandi quantità di materiale purificato. Qui, descriviamo un semplice metodo per ottenere dettagliate informazioni strutturali polisaccaride, compresa la risoluzione di isomeri strutturali. Analisi di polisaccaride tramite elettroforesi del gel (PACE), materiale della parete cellulare vegetale è idrolizzato con glicosil idrolasi specifici per il polisaccaride di interesse (ad esempio, mannanases per mannan). Gel di poliacrilammide di grande formato vengono quindi utilizzati per separare gli oligosaccaridi rilasciati, che sono stati etichettati fluorescente. Gel possono essere visualizzati con un gel modificato sistema di imaging (Vedi Tabella materiali). L'impronta di oligosaccaride risultante sia paragonabile qualitativamente o, con la replica, quantitativamente. Sollevatore e ramificazione informazioni può essere stabilite utilizzando ulteriori glicosil idrolasi (ad es., mannosidases e galactosidases). Mentre questo protocollo descrive un metodo per analizzare la struttura di glucomannano, può essere applicato a qualsiasi polisaccaride per cui esistono caratterizzato glicosil idrolasi. In alternativa, può essere utilizzato per caratterizzare nuovi glicosil idrolasi utilizzando substrati definito polisaccaride.
Introduzione
Polisaccaride analisi mediante elettroforesi su gel (PACE) è un metodo per la caratterizzazione dettagliata di polisaccaridi1,2,3. Polisaccaridi di parete delle cellule vegetali sono notoriamente difficili da analizzare, e la maggior parte dei metodi richiedono attrezzature costose, operatori specializzati e grandi quantità di materiale purificato. Qui, descriviamo un semplice metodo per ottenere dettagliate informazioni strutturali polisaccaride, compresa la risoluzione di isomeri strutturali.
Comprensione pianta parete cellulare polisaccaride struttura è necessaria per quei ricercatori esplorare la biosintesi della parete cellulare di pianta o il ruolo della parete delle cellule vegetali in via di sviluppo di pianta. Recentemente, tuttavia, è diventato interessante per un più ampio gruppo di ricercatori a causa del fuoco sull'utilizzo di biomasse vegetali (essenzialmente la parete cellulare) come materia prima per produrre biocarburanti e prodotti biochimici4composizione parete cellulare vegetale. Ad esempio, efficiente saccarificazione enzimatica di questo materiale richiede una comprensione dettagliata delle strutture polisaccaride, affinché cocktail enzimatico ottimizzato può essere selezionato5.
PACE ha diversi vantaggi rispetto ai metodi alternativi che lo rendono ideale per l'analisi rapida di glycan complesse strutture. In primo luogo, non richiede purificazione del polisaccaride in questione, come è richiesto per la soluzione dello stato a risonanza magnetica nucleare (NMR)6. In secondo luogo, il ritmo può risolvere isomeri strutturali, a differenza di spettrometria di massa (MS, ad es., matrix-assistita laser desorption/ionization (MALDI) e ionizzazione electrospray (ESI)), che può anche essere difficile da eseguire mediante cromatografia liquida (LC) 7. in terzo luogo, il ritmo è molto sensibile, con risoluzione bassa-picomole, a differenza di cromatografia di strato sottile (TLC) o cromatografia su carta. Infine, non richiede costose attrezzature o specialista conoscenza, come è il caso per MS, NMR e LC.
Il metodo di ritmo si basa sulla specificità degli enzimi di glicosil idrolasi (GH), che prendono di mira alcuni legami glicosidici in una miscela di polisaccaridi. Quando l'enzima GH agisce sulla catena polisaccaride, rivela una riduzione fine che può quindi essere chimicamente derivatizzati, in questo caso con un'etichetta fluorescente. La mangiavano parte del campione è pertanto sottoposta a rendering non rilevabile da questo metodo. Gli oligosaccaridi con etichettati vengono quindi separati in un gel di acrilammide grande formato tramite l'elettroforesi. Questo dà un'eccellente risoluzione di molecole molto simili, ad esempio, i trisaccaridi Glc-uomo-uomo e uomo-Glc-Glc avrà un diverso Rf.
RITMO è stato usato estesamente per caratterizzare xilano diverse strutture attraverso pianta specie8, per identificare glycosyltransferase mutanti di Arabidopsis6,9,10,11 , per eseguire analisi di glycosyltransferase9e caratterizzare nuovi GH attività12,13. Abbiamo anche recentemente ha utilizzato per caratterizzare mannan della parete cellulare lievito (mensa e Mortimer, in preparazione). Qui descriviamo un metodo per la caratterizzazione di struttura della pianta parete cellulare glucomannano, basata su precedenti rapporti11,14.
Protocollo
1. raccolta di materiale vegetale
- raccolto materiale vegetale fresco (~ 20 mg) e immediatamente immergerlo in etanolo al 96% (v/v) e incubare a 70 ° C per 30 min; questo disattiva qualsiasi parete cellulare presenti enzimi degradativi. Per materiale secco, iniziare dal passaggio 2.
Attenzione: L'etanolo è infiammabile.
Nota: Una singola foglia di staminali o Rosetta fornirà abbastanza materiale per l'analisi. Tuttavia, meno errori derivano se una maggiore quantità di tessuto è riunite e analizzate dal momento che questo è più facile da pesare e gestire. - Registrare accuratamente tessuto tipo e Stadio di sviluppo, come struttura di polisaccaride varia con entrambi. Ad esempio, con thaliana di Arabidopsis (usato qui), fase il tessuto secondo i metodi da Boyes et al. 15
Nota: nel presente protocollo, abbiamo usato la metà inferiore del fusto infiorescenza, dove il primo anemofila è completamente allungato ma non ingiallimento.
2. residuo insolubile preparazione dell'alcool (aria)
- preparare aria, seguendo il metodo di Mortimer et al. 9 o un altro metodo simile, al fine di produrre una polvere priva di zuccheri solubili, come saccarosio e amido.
3. Aliquotare e pre-trattamento dell'aria
Nota: l'esatta quantità di aria necessaria per ogni campione dipenderà (a) l'abbondanza di polisaccaride di interesse nel materiale e (b) la dimensione media degli oligosaccaridi rilasciato da il GH. Il metodo aggiunge una singola molecola fluorescente alla fine di ogni oligosaccaride, riducendo così il numero degli oligosaccaridi determina la sensibilità dell'esperimento. Indicativamente, per glucomannano in Arabidopsis staminali digerito con GH5/GH26 (come descritto), 500 µ g è consigliato 11, considerando che per xilano in Arabidopsis staminali digerito con GH11, 100 µ g è raccomandato come Mortimer ' Studio s 3.
- pesare aria (10-15 mg) in una provetta da centrifuga 15 mL e aggiungere H 2 O a una concentrazione finale di 2 mg/mL. Vortice per ottenere una sospensione anche. Se questo è problematico, quindi utilizzare un omogeneizzatore di vetro per aiutare questo processo.
- Aliquot 500 µ g in microfuge tubi. Asciugare le aliquote utilizzando una centrifuga vuoto (Vedi la Tabella materiali) durante la notte a 30 ° C.
- Pre-trattamento aria con 1 M NaOH (20 µ l) per 1 h a temperatura ambiente; questo de-acetila i polisaccaridi e gonfia le microfibrille di cellulosa, interrompendo la struttura di biomassa e consentendo l'accesso di GH.
Nota: Questo passaggio può essere ignorato per polisaccaridi purificati. ATTENZIONE – forte acido/base.- Includono un'aliquota per un controllo di aria no-enzima (trattati allo stesso modo come tutti i campioni, eccetto il passaggio 4.1. è escluso).
- Aggiungere 200 µ l di H 2 O e 20 µ l 1 M HCl per neutralizzare. Prova che il pH è ~ 6-7 rimuovendo 1 µ l e spotting sulla carta nastri di indicatore di pH. Tampone di acetato di ammonio 1 M di aggiungere 50 µ l di
- , pH 6.0 (o qualunque pH è appropriato per il GHs utilizzato nello studio) e H 2 O per ottenere un volume totale di 500 µ l.
Nota: Acetato di ammonio è usato poiché esso sublima durante l'essiccazione, e quindi non aggiunge ulteriori sale al campione. Un eccesso di sale può portare a scarsa forma di banda e ad alta risoluzione sul gel ritmo.
4. Idrolisi dell'aria con Glycosyl Hydrolases (GHs)
Nota: come accennato nella discussione, la purezza del GHs è critica. Utilizzare solo heterologously espressi, enzimi purificate per affinità. Al ricevimento di ogni lotto dal produttore, idrolizzano le aliquote definite di substrato (ad es., 500 µ g aria) con aumento della quantità di GH durante la notte (ad esempio, 0,5, 1, 2, 5, 10, 15, 20 µ l) (3 unità / µ l). Quando c'è un eccesso di GH, l'impronta PACE avrà un aspetto identico. Un eccesso di enzima è necessario per fornire un risultato riproducibile perché deve essere certo che la reazione di idrolisi si sta avvicinando l'endpoint.
- Aggiungi un importo predeterminato (Vedi sopra) di mannanases (GH5 e GH26 11) per le aliquote di aria nel buffer da passo 3.5, nonché un positivo controllo (30 µ g di glucomannano di konjac) e un controllo negativo no-aria (enzima mix in un tubo vuoto). Vortice e spin poi brevemente a raccogliere la miscela di reazione nella parte inferiore del tubo.
- Incubare per una notte a 37 ° C (oppure la temperatura appropriata per il GH di scelta) con movimentazione delicata (~ 100 giri/min).
- Fermare la reazione incubando a 95 ° C per 20 min.
Nota: Le chiusure Cap possono essere utilizzate per sigillare tubi del microfuge flip-top.- Centrifugare utilizzando un panca superiore microfuge alla massima velocità per 10 min e conservare il surnatante.
- Risospendere il pellet in 250 µ l di H 2 O, centrifuga come sopra e conservare il surnatante.
- Combinare entrambi i surnatanti e asciugare in una centrifuga vuoto (Vedi la Tabella materiali) a 30 ° C (~ 3 h o durante la notte senza riscaldamento).
5. Preparazione di standard di oligosaccaride
- magazzino di 1 mM di preparare soluzioni in H 2 O di mannosio (uomo), mannobiose (Man 2), mannotriose (Man 3), mannotetraose (Man 4), mannopentaose (Man 5) e mannohexaose (Man 6), tutti i β, 1-4 collegati. Aliquotare e conservare a-20 ° C fino a quando richiesto.
- Preparare 3 diverse concentrazioni di un uomo 1-6 miscela combinando 1 µ l (Standard S1), 2 µ l (S2) o 5 µ l (S3) di tutti e sei.
- Secco in una centrifuga vuoto (Vedi Tabella materiali) a 30 ° C (~ 1 h).
6. Derivitization di oligosaccaridi
- preparare una soluzione stock di 0,2 M formiche (acido 8-amminonaftalen-1,3,6-trisulfonic) in H 2 O: acido acetico 17:3. Brodo caldo a 60 ° C per sciogliere completamente il solido. Conservare a-20 ° C, al riparo dalla luce, per 2-3 mesi.
- Preparare una soluzione stock di 0,2 M di 2-Picolina borano (2-PB) in DMSO. Questo è estremamente igroscopico, quindi immediatamente risospendere tutta polvere al ricevimento in DMSO. Aliquotare e conservare a-20 ° C per 1-2 anni. Disgelare aliquote come richiesto (conservare a 4 ° C per 2 settimane e poi scartare).
- Preparare il tampone di derivatizzazione di H 2 O: acido acetico: DMSO alle 17:03:20.
- Per ogni campione, aggiungere 5 µ l di formiche, 5 µ l di 2-PB e 10 µ l di tampone di derivatizzazione. Spin brevemente per raccogliere sul fondo del tubo, vortice accuratamente e poi girare di nuovo brevemente. Vedere la Figura 1 per reazione descrizione.
- Incubare i campioni durante la notte a 37 ° C, al riparo dalla luce.
- Secco in una centrifuga vuoto (Vedi Tabella materiali) a 30 ° C (~ 2 h).
- Risospendere campioni e standard in 100 µ l 3 M urea. Conservare a-20 ° C, al riparo dalla luce fino a quando richiesto.
7. Preparazione del ritmo gel
Nota: montaggio dell'attrezzatura di colata di gel dipenderà molto il marchio. Qui, abbiamo uSe un sistema di elettroforesi verticale (Vedi Tabella materiali), dotato di distanziali lastre di vetro di 18 x 24 cm e 1,5 mm.
- Montare l'attrezzatura della colata gel per il produttore ' istruzioni s. Buffer di ritmo di 10 x
- make (1 M Tris-borato, pH 8.2) come segue: aggiungere 121,14 g di Tris-Base a ~ 400 mL di H 2 O e mescolare per sciogliere. Aggiustare il pH a 8.2 mediante aggiunta di acido borico solido (circa 60 g) e quindi rendere il volume fino a 1 L.
- Fare un 10% (p/v) di ammonio persolfato (APS) magazzino H 2 O. aliquota e memorizzare una volta alle aliquote di disgelo di-20 ° C., conservare a 4 ° C e scartare dopo 2 settimane.
- Fare e versare il gel di risoluzione. Per l'attrezzatura di cui sopra, 1 gel equivale a 50 mL. In una provetta da centrifuga 50 mL, mescolare H 2 O (20,2 mL), 5 mL di tampone per ritmo 10x, 24,6 mL 40% di acrilammide/Bis-acrilammide (29: 1 acrylamide:Bis). (Attenzione: tossici).
- Aggiungere 200 µ l di APS e 20 µ l di N, N, N, n-tetrametil-etilendiammina (TEMED). Invertire delicatamente per mescolare (per evitare di introdurre bolle d'aria). Versare il gel utilizzando un sierologici o altri pipetta di grande volume, a ~ 4 cm sotto la parte superiore delle lastre vetrate. Prestare attenzione alla possibilità di essere intrappolati nel gel le bolle d'aria. Se essi fare, smettere di versare e tilt/toccare il gel per liberarli.
- Il gel con isopropanolo (infiammabile cautela :) o, con attenzione, con H 2 O. Consenti gel per polimerizzare (20-30 minuti), poi versare lo strato superiore di overlay. Se è stato utilizzato isopropanolo, quindi lavare 2x con H 2 O. a secco liquido in eccesso con carta assorbente.
- Fare e versare il gel d'impilamento. Mix di 6,8 mL H 2 O, 1 mL di tampone di ritmo 10x, 2,8 mL acrilammide/Bis-acrilammide (Attenzione: tossici), 80 µ l APS e 8 µ l di TEMED in una provetta da centrifuga da 15 mL. Inverti per mescolare e overlay sopra gel polimerizzato di risoluzione. Inserire delicatamente pettini, evitando bolle d'aria intrappolamento sotto i denti del pettine.
- Consenti gel per polimerizzare (20-30 min.), avvolgere in tessuto umido e poi nella pellicola trasparente e conservare a 4 ° C fino a quando richiesto. Negozio con i pettini in luogo.
Nota: Ritmo gel possono essere memorizzati per un massimo di 2 settimane (anche se meno di una settimana è l'ideale), se sono mantenuti umidi.
8. In esecuzione di un ritmo Gel
- utilizzare un pennarello indelebile per etichettare le posizioni bene sul vetro, che aiuterà a tenere traccia di ordine di caricamento, e nell'individuare dove i pozzi sono una volta rimosso il pettine.
- Rimuovere il pettine. Riempire i pozzetti con buffer di ritmo di 1 x.
- Utilizzare un 10 µ l microsiringa per caricare 2 µ l di standard e campioni nei pozzetti. Evitare di utilizzare le corsie più esterne, che tendono a correre campioni poco.
- Montare la camera superiore dell'apparato gel-esecuzione e inserire il gel in un serbatoio in esecuzione raffreddato (~ 10 ° C) (° C 10) contenente 1 x ritmo tampone. Riempire la camera superiore con buffer di ritmo di 1 x.
- Accendere il potere ed eseguire il gel a 200 V (costante V) per 30 minuti e quindi aumento di tensione fino a 1000 V per 1h 40 min. Proteggere il gel dalla luce (ad esempio, eseguendo il wrapping serbatoi in sacchi neri della spazzatura).
Nota: Controllare i gel ~ 5 min dopo aver acceso la tensione e poi un altro 5 minuti dopo l'aumento della tensione fino a 1000 V. Se l'alimentatore è in grado di mantenere la tensione, poi c'è probabilmente un problema di buffer. Rimuovere il gel dal serbatoio. Rimontare l'alloggiamento superiore, verificare attentamente il posizionamento di tutte le guarnizioni. Un grande chip sul bordo superiore della lastra di vetro può impedire la piastra formando una buona tenuta con la guarnizione. Questo di solito può essere temporaneamente risolto aggiungendo una goccia di agarosio fuso 5% (p/v) per la parte scheggiata del vetro, prima di aggiungere l'alloggiamento superiore.
9. Visualizzazione di un gel di ritmo
Nota: utilizzare un gel dotato di lungo-fluttuano UV bulbi nel transilluminatore e un filtro di emissione per la fotocamera che è adatto per il fluoroforo, qui 530 nm sistema di imaging. In alternativa, uno scanner laser può essere utilizzato anche, come descritto in Goubet 2.
- Garantire il gel sistema di imaging è privo di polvere pulendo con tessuto umido privo di lanugine.
- Rimuovere il gel nel serbatoio di ritmo e mostra brevemente mentre il gel è ancora nelle lastre di vetro (< 80 ms) per determinare se la parte anteriore della tintura è ancora sul gel.
- Aprire il gel utilizzando uno strumento di Cuneo e mentre il gel è ancora su un vetro piatto, utilizzare una taglierina della pizza per rimuovere sia il gel d'impilamento e, se la parte anteriore della tintura è ancora sul gel, il fondo del gel.
- Mettere ~ 5 mL H 2 O sulla superficie del transilluminatore e quindi trasferire il gel direttamente sul transilluminatore. Impostare il filtro UV 605 e accendere il transilluminatore UV longwave (Vedi Tabella materiali) utilizzando il software.
Nota: Il fluoroforo formiche qui utilizzato ha un'eccitazione/emissione di 353/520 nm. - Prendere diverse immagini a diversi tempi di esposizione (per esempio, 100 ms a 10 s). Accertarsi che la luce UV è spento tra le immagini cliccando sul pulsante di luce UV (per disattivarlo) per evitare di degradare la fluorescenza. Non garantire che almeno 2 delle immagini bande saturi (il software di imaging di gel lo indicherà).
- Salva file come immagini ad alta-resolution.tif.
Nota: Immagini possono essere analizzati utilizzando il software fornito con il gel sistema di imaging, o utilizzando software di analisi di immagine liberamente disponibili, come ad esempio ImageJ (https://imagej.nih.gov/ij/). Vedere la sezione di risultati per una discussione di quantificazione.
Risultati
Qui vi mostriamo un gel di ritmo esempio eseguito per ogni protocollo, insieme alla descrizione di assistervi nell'interpretazione dei dati e risoluzione dei problemi, e questo è seguito da una guida generale per successo ritmo gel interpretazione13,16. Un gel rappresentativo di un ritmo standard è illustrato nella Figura 2analisi del contenuto di mannano parete cellulare ed è descritto lane di corsia.
Standard
Corsie 1, 2 e 3 mostrano una scaletta di oligosaccaridi acquistati in commercio (Man1- Man6) a 5 (S1), 10 (S2) e 50 (S3) pmol concentrazione. Quando si riceve un nuovo lotto di un oligosaccaride commerciale, è importante controllare la purezza su un gel. Molti oligosaccaridi, particolarmente tetrasacccharides e più a lungo, può avere una contaminazione significativa con oligosaccaridi di altri gradi di polimerizzazione (DPs), come mostrato qui per Man6 (contrassegnati con *). Mentre la quantificazione di un gel, è importante avere almeno 3 concentrazioni degli standard, poiché è necessario per il calcolo della curva standard. Calcolo della curva standard può anche essere utile per garantire che la reazione di derivatizzazione è essenzialmente al completamento. Standard di concentrazioni note consentire confronti tra gel e un controllo utile per qualità di separazione e derivatizzazione.
Controllo positivo
Corsia 4 Mostra una digestione mannanasi di glucomannano di konjac. Glucomannano di konjac è disponibile commercialmente, e mentre non ha la stessa struttura che, ad esempio, è trovato in Arabidopsis, serve a due scopi. In primo luogo, è un controllo importante per la digestione enzimatica. Il ricercatore deve stabilire che cosa un substrato commerciale digerito con loro GHs di scelta sembra quando digerito a completamento (cioè, un vasto eccesso di GH viene aggiunto alla reazione). Se in futuro esperimenti il modello cambia, questo può indicare sia una perdita di attività o contaminazione dello stock GH. In secondo luogo, serve come controllo per la reazione di derivatizzazione in presenza di sali di enzima e buffer. Se le norme sembrano buone, ma il controllo positivo è scarso, quindi questo potrebbe indicare che un componente della reazione di idrolisi è inibitorio per la derivatizzazione.
Wild type (WT) Arabidopsis gambo aria + mannanasi cocktail (GH5 + GH26)
Lane 5 Mostra l'impronta di ritmo di uno stelo di Arabidopsis WT (confronta con riferimenti11,14).
csla9 Arabidopsis gambo aria + mannanasi cocktail (GH5 + GH26)
Lane 6 Mostra l'impronta del ritmo dello stelo da un Arabidopsis pianta carente i principali spettacoli mannano sintasi11del gambo. Confrontare il WT e controllo negativo le impronte digitali. Mentre la maggior parte del mannan è assente in questa pianta, rimane una piccola quantità, come testimoniano le intensità di banda ridotto per tutti gli oligosaccaridi mannanasi-derivato questo è sintetizzato da ulteriori mannano sintasi (CSLA2, 3)11.
Controllo negativo - enzima solo
Lane 8 mostra bande sul gel che non sono specifiche che derivano da contaminanti nella mannanasi cocktail e dovrebbero essere esclusi dall'analisi (contrassegnati con *).
Controllo negativo - WT aria solo
Lane 9 Mostra bande sul gel che non sono specifici e devono essere esclusi dall'analisi (contrassegnati con *).
Controllo negativo- csla9 Aria solo
Lane 10 Mostra bande sul gel che non sono specifici e devono essere esclusi dall'analisi (contrassegnati con *).
Pino legno aria + mannanasi cocktail (GH5 + GH26)
Corsia 7 Mostra l'impronta di ritmo di legno di pino, che contiene galactoglucomannan. Questo ha chiaramente un diverso modello di oligosaccaridi rilasciati per Arabidopsis, grazie alla sua struttura diverso.
Controllo negativo - pino aria solo
Lane 11 Mostra bande sul gel che non sono specifici e devono essere esclusi dall'analisi (contrassegnati con *).
Interpretare un gel di ritmo è relativamente semplice, ma richiede la consapevolezza dei seguenti punti. Per dati affidabile, si raccomanda di effettuare ritmo su almeno 3 indipendentemente coltivati biologica replica, e si consiglia di eseguire almeno 2 tecnici replicati su ogni replica biologico. I comandi descritti sono fondamentali per l'interpretazione, come fasce non specifiche devono essere escluse. Si consiglia inoltre di caricamento di campioni in un ordine diverso sui gel di replicare, per escludere effetti derivanti dall'illuminazione irregolare del transilluminatore. Accurata interpretazione richiede analisi delle fasce che non sono saturi. Poiché alcune impronte oligosaccaride possono contenere entrambi polisaccaridi abbondanza molto alta e bassa, si consiglia di analizzare le esposizioni multiple del gel stesso. Gli standard possono essere utilizzati per normalizzare tra immagini diverse.
Per alcuni tipi di esperimenti, può essere desiderabile per quantificare l'importo del polisaccaride nella preparazione aria. Mentre è possibile quantificare un gel di ritmo, richiede conoscenza dell'esatta identità molecolare di ogni oligosaccaride rilasciato dal GHs e dove si trova il ritmo gel. Questo attualmente non è completamente noto per mannan, ma è stato determinato per altri polisaccaridi ad esempio xilano3. Gli standard forniscono un modo di normalizzazione tra gel, anche quando non si esegue la quantificazione e così vi assisterà in ogni analisi semi-quantitativa o qualitativa.
Individuare la struttura di oligosaccaridi individuali può essere raggiunto utilizzando cocktail di GHs. sequenziale aggiunta di ulteriore GHs può rivelare informazioni dettagliate sui collegamenti e sostituzioni di oligosaccaridi rilasciati (per esempio, l'aggiunta di β - 1,4 - glucosidasi che agisce all'estremità non riducente rivelerà quali oligosaccaridi nella miscela contengono tale funzionalità). Enzimi disponibili includono galactosidases, glucuronidases e glucosidasi (Vedi il database di Chriss16 per ulteriori informazioni); vedere Hogg, d. et al. 17 come un esempio.
Il protocollo di cui sopra può essere utilizzato per caratterizzano l'attività del GHs sconosciuto. In questo caso, una biomassa definito, come Arabidopsis staminali o konjac glucomannan, dovrebbe essere utilizzato per schermata il GHs sconosciuto13.
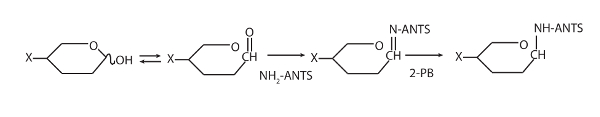
Figura 1 : Questo Mostra lo schema per la derivatizzazione fluorescente di oligosaccaridi con formiche. Per l'ultima volta da Goubet2. Clicca qui per visualizzare una versione più grande di questa figura.
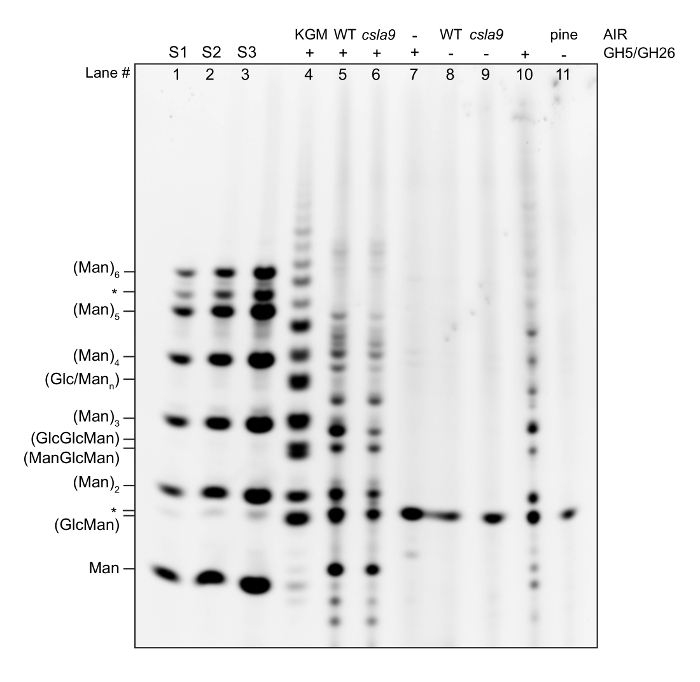
Figura 2 : Gel rappresentante ritmo mostrando l'impronta di mannano da Arabidopsis, pino e un mutante di Arabidopsis (csla9) che ha alterato la biosintesi di mannano. AlR è idrolizzato con un cocktail di mannanasi, e gli oligosaccaridi rilasciati sono stati derivatizzati con un fluoroforo. Gli oligosaccaridi sono stati separati mediante elettroforesi in base a dimensione, forma e carica. Una scaletta di manno-oligosaccaridi (Man1-6) è indicata per aiutare a identificare la relativa mobilità di oligosaccaridi rilasciati, e un'idrolisi di mannano purificato (derivato da konjac) è indicata come controllo positivo. * = fasce non specifiche. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
PACE è un metodo semplice per caratterizzare la struttura del polisaccaride. Può essere applicato a qualsiasi polisaccaride per cui sono noti GHs con attività caratterizzate, vedere numerosi esempi nella letteratura1,6,9,11. TT è stato applicato anche alla caratterizzazione di romanzo GHs12,13,18 e glicosiltrasferasi9, facendo uso di substrati definito polisaccaride e accettori.
Risultati riproducibili, interpretabili dipendono dai tre passaggi chiave. In primo luogo, il GHs utilizzato dovrebbe essere esente da contaminanti attività. Questo è il miglior ottenuta utilizzando solo heterologously espressi, purificate per affinità, enzimi. In secondo luogo, per la maggior parte degli esperimenti, è importante che l'idrolisi enzimatica dei substrati è al completamento. Questo farà sì che la stessa biomassa idrolizzata con il GH stesso dà la stessa impronta in ogni esperimento. Infine, ci dovrebbe essere un eccesso di fluoroforo nella reazione di derivatizzazione. Questo assicura che le estremità riducente disponibili siano etichettate al vicino al 100%. Questo si tradurrà in alta riproducibilità dei risultati, nonché i dati quantitativi.
Gel e reagente di qualità sono fondamentali per garantire dati riproducibili. Buffer di scarsa qualità, soprattutto del pH errato, aria bolle nel gel, e campioni con un eccesso di sale possono tutti fattore di risoluzione e ritenzione effetto di oligosaccaridi. Tuttavia, l'inclusione dei controlli consigliati descritti nella sezione protocollo e risultati permetteranno di risoluzione dei problemi.
RITMO è limitata dalla sua capacità di identificare gli oligosaccaridi. Per alcuni esperimenti, un'impronta digitale semplice è tutto ciò che è necessario. Tuttavia, per veramente quantificare la quantità di glucomannano in un campione di aria, ad esempio, l'identità di tutti gli oligosaccaridi rilasciati è richiesto, che è un processo che richiede tempo. Questo è più semplice per meno polisaccaridi complessi come xilano3. Poiché esistono pochi oligosaccaride standard disponibile in commercio, non essere sempre possibile o desiderabile per identificare tutte le bande. In questo caso, ritmo può fornire dati molto gratuiti alla spettrometria di massa (cioè, MALDI-CID9 o ESI-MS7e NMR6). Per questi metodi, è spesso utile fare una preparazione su larga scala, separare dalla cromatografia di esclusione dimensionale e quindi analizzare ciascuna frazione da entrambi PACE prima del MS o NMR. Mentre è stato segnalato che bande possono essere asportati e identificati dal MALDI-CID, in pratica abbiamo trovato che questo ha un basso tasso di successo (probabilmente a causa di interazioni di oligosaccaridi etichettati con il gel di acrilammide quando esposto ai raggi UV).
L'altra limitazione importante del ritmo è la velocità effettiva. Per ottenere una buona qualità, interpretabile gel con gli opportuni controlli, ogni gel avrà solo ~ 10 campioni sperimentali, e un ricercatore può aspettare eseguire ~ 4 ritmo gel al giorno. Recentemente, una versione del ritmo mediante elettroforesi capillare (CE) è stato sviluppato19, che permette la preparazione di campioni in piastre da 96 pozzetti. Esso è stato utilizzato con successo per caratterizzare le attività enzimatiche glycosyltransferase e polisaccaride strutture6,19, anche se richiede l'accesso a una macchina CE, che possa essere costosa da acquistare e mantenere.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Il metodo ritmo è stato sviluppato e ottimizzato da vari membri del gruppo di Dupree (Università di Cambridge, UK) nel corso degli anni, e apprezziamo tutti i loro contributi. Questo lavoro è stato finanziato nell'ambito del DOE Joint BioEnergy Institute (http://www.jbei.org) sostenuto da u. s. Department of Energy, Office of Science, ufficio di biologico e ricerca ambientale, attraverso contratto DE-AC02-05CH11231 tra Lawrence Berkeley National Laboratory e il u. s. Department of Energy. Ringraziamo anche Thea Pick e Vy Ngo per aiuto per preparare i campioni di csla9 .
Materiali
| Name | Company | Catalog Number | Comments |
| Oligosaccaharide Standards | |||
| Mannose | Sigma-Aldrich | CAS 3458-28-4 | |
| Mannobiose | Megazyme | CAS: 14417-51-7 | |
| Mannotriose | Megazyme | CAS: 28173-52-6 | |
| Mannotetraose | Megazyme | CAS: 51327-76-5 | |
| Mannopentaose | Megazyme | CAS: 70281-35-5 | |
| Mannhexaose | Megazyme | CAS: 70281-36-6 | |
| Glucomannan (Konjac; Low Viscosity) | Megazyme | P-GLCML | |
| Name | Company | Catalog Number | Comments |
| Other specialty chemicals | |||
| 8-Aminonaphthalene-1,3,6-trisulfonic acid | (Molecular probes) Thermo | A350 | |
| 2-picoline borane | TCI | B3018 | |
| 40 % acrylamide/Bis-acrylamide (29:1 acrylamide:Bis) | Bio-rad | 1610146 | |
| Name | Company | Catalog Number | Comments |
| Specialty Equipment | |||
| Gel casting kit | Hoefer | SE660 kit | 18x24 cm glass plates, 0.75 mm spacers |
| Cooling recirculating water bath | Hoefer | RCB20-plus 115v | Needs to be able to maintain temperature at ~10 C |
| G:Box Chemi XRQ Imaging System | Syngene | 05-GBOX-CHEMI-XRQ | Order with filters appropriate to fluorphore, and transilluminator should be fitted with long-wave UV light bulbs |
| High Voltage Power Pack | Thermo | EC1000XL | 1000V |
| Vacuum centrifuge(Speedvac) | Savant | SPD131 | |
| Vertical Gel electrophoresis system | Hoefer | SE660 | |
| Glycosyl hydrolases | |||
| These can be obtained from companies e.g. Megazyme (https://www.megazyme.com/) or Prozomix (http://www.prozomix.com/), or can be expressed in house by requesting the plasmid from the relevant research group. | |||
| Name | Company | Catalog Number | Comments |
| Lab supplies | |||
| 15 ml Centrifuge tube ( Falcon Centrifuge Tubes, Polypropylene, Sterile, Corning) | VWR | 21008-918 | |
| 50 ml Centrifuge tube ( Falcon Centrifuge Tubes, Polypropylene, Sterile, Corning) | VWR | 21008-951 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Gel imaging software ( Genesys) | Syngene |
Riferimenti
- Barton, C. J., et al. Enzymatic fingerprinting of Arabidopsis pectic polysaccharides using polysaccharide analysis by carbohydrate gel electrophoresis (PACE). Planta. 224 (1), 163-174 (2006).
- Goubet, F., Jackson, P., Deery, M. J., Dupree, P. Polysaccharide analysis using carbohydrate gel electrophoresis: A method to study plant cell wall polysaccharides and polysaccharide hydrolases. Anal Biochem. 300 (1), 53-68 (2002).
- Mortimer, J. C. Structural Analysis of Cell Wall Polysaccharides Using PACE. Methods Mol Biol. 1544, 223-231 (2017).
- Pauly, M., Keegstra, K. Cell-wall carbohydrates and their modification as a resource for biofuels. Plant J. 54 (4), 559-568 (2008).
- Lopez-Casado, G., Urbanowicz, B. R., Damasceno, C. M., Rose, J. K. Plant glycosyl hydrolases and biofuels: a natural marriage. Curr Opin Plant Biol. 11 (3), 329-337 (2008).
- Mortimer, J. C., et al. An unusual xylan in Arabidopsis primary cell walls is synthesised by GUX3, IRX9L, IRX10L and IRX14. Plant J. 83 (3), 413-426 (2015).
- Ridlova, G., Mortimer, J. C., Maslen, S. L., Dupree, P., Stephens, E. Oligosaccharide relative quantitation using isotope tagging and normal-phase liquid chromatography/mass spectrometry. Rapid Commun Mass Spectrom. 22 (17), 2723-2730 (2008).
- Busse-Wicher, M., et al. Evolution of Xylan Substitution Patterns in Gymnosperms and Angiosperms: Implications for Xylan Interaction with Cellulose. Plant Physiol. 171 (4), 2418-2431 (2016).
- Mortimer, J., et al. Absence of branches from xylan in Arabidopsis gux mutants reveals potential for simplification of lignocellulosic biomass. Proc Nat Acad Sci USA. 107 (40), 17409-17414 (2010).
- Anders, N., et al. Glycosyl transferases in family 61 mediate arabinofuranosyl transfer onto xylan in grasses. Proc Nat Acad Sci USA. 109 (3), 989-993 (2012).
- Goubet, F., et al. Cell wall glucomannan in Arabidopsis is synthesised by CSLA glycosyltransferases, and influences the progression of embryogenesis. Plant J. 60 (3), 527-538 (2009).
- Rogowski, A., et al. Evidence That GH115 alpha-Glucuronidase Activity, Which Is Required to Degrade Plant Biomass, Is Dependent on Conformational Flexibility. J Biol Chem. 289 (1), 53-64 (2014).
- Rogowski, A., et al. Glycan complexity dictates microbial resource allocation in the large intestine. Nat Commun. 6, 7481 (2015).
- Handford, M. G., et al. Localisation and characterisation of cell wall mannan polysaccharides in Arabidopsis thaliana. Planta. 218 (1), 27-36 (2003).
- Boyes, D. C., et al. Growth stage-based phenotypic analysis of Arabidopsis: a model for high throughput functional genomics in plants. Plant Cell. 13 (7), 1499-1510 (2001).
- . . The Carbohydrate Active Enzyme Database. , (2017).
- Hogg, D., et al. The modular architecture of Cellvibrio japonicus mannanases in glycoside hydrolase families 5 and 26 points to differences in their role in mannan degradation. Biochem J. 371, 1027-1043 (2003).
- Brennan, Y., et al. Unusual microbial xylanases from insect guts. Appl Environ Microbiol. 70 (6), 3609-3617 (2004).
- Li, X., et al. Development and application of a high throughput carbohydrate profiling technique for analyzing plant cell wall polysaccharides and carbohydrate active enzymes. Biotechnol Biofuels. 6, (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon