Method Article
Fabricación de pozos de agarosa personalizado para la siembra de células y tejido anillo autoensamblaje con moldes impresa en 3D
En este artículo
Resumen
Este protocolo describe una plataforma para la fabricación de anillos de tejido automático montado en tamaños variables utilizando un molde de plástico modificado para requisitos particulares impresa en 3D. Negativos PDMS se curan en el molde impreso en 3D; agarosa se echa entonces en los negativos PDMS curados. Las células se siembran en los pozos de agarosa resultante donde agregan en anillos de tejido.
Resumen
Ingeniería de tejidos se utilizan clínicamente para sustitución y reparación de los tejidos y se desarrollan como herramientas para la detección de drogas y modelos de enfermedades humanas. Uno mismo-montado tejidos ofrecen ventajas sobre ingeniería de tejidos base de andamio, como la deposición de matriz mejorada, fuerza y función. Sin embargo, hay algunos métodos disponibles para la fabricación de tejidos 3D sin sembrar las células en o dentro de un andamiaje apoyo. Previamente, hemos desarrollado un sistema para la fabricación de anillos de tejido automático montado por la siembra de células en pozos de agarosa no adhesiva. Un polidimetilsiloxano (PDMS) negativo primero fue fundido en un molde de policarbonato mecanizadas, y luego agarosa se cuajó en el PDMS negativo para crear pozos de siembra de la célula en forma de anillo. Sin embargo, la versatilidad de este enfoque fue limitada por la resolución de las herramientas disponibles para el mecanizado del molde de policarbonato. Aquí, demostramos que plástico impreso en 3D se puede utilizar como alternativa al policarbonato mecanizada para la fabricación de negativos PDMS. El molde 3D impreso y revisado molde diseño es fácil de utilizar, barata producir y requiere considerablemente menos agarosa y PDMS por célula siembra bien. Hemos demostrado que los pozos de agarosa resultante pueden utilizarse para crear tejido uno mismo-montado anillos con diámetros modificado para requisitos particulares de una variedad de diferentes tipos de células. Anillos pueden utilizarse para el análisis mecánico, funcional e histológico, o para la fabricación de tejidos tubulares más grandes y más complejos.
Introducción
Celular uno mismo-Asamblea enfoques para la fabricación de los vasos sanguíneos de ingeniería tisular son una alternativa a los enfoques basados en el andamio. Tejidos uno mismo-montado, libre de andamios pueden tener una mayor densidad celular, deposición de matriz mejorada y fuerza y función biológica mejorada en comparación con tejidos base de andamio de1,2,3,4 . Sin embargo, formando tejidos 3D sin el uso de soporte de andamio exógena con formas y tamaños específicos sigue siendo un desafío. Algunos métodos de fusionan capas de hojas de la célula para formar estructuras más gruesas, aunque este proceso puede ser desperdiciador de tiempo y mano de obra intensiva5. Alternativamente, las células pueden ser sembradas en moldes no adhesiva y permitió a agregado en esferoides, anillos y otras formas de tejido6,7,8.
Anillos de tejido uno mismo-montado requieren menos células, tiempos más cortos de la cultura, y menos reactivos que el más grande tubulares ingeniería de tejidos, pero pueden todavía ser mecánicamente probados, examinados histológico o utilizados para contractilidad y otras pruebas funcionales7 , 9 , 10 , 11. porque pueden ser fabricados rápidamente y fácilmente probados, anillos tejidos son ideales para la detección de gran número de parámetros de la cultura y tiene potencial para el uso como enfermedad modelos11 o herramientas para12de detección de drogas. Además, los anillos se pueden fusionar en estructuras más complejas de tejidos como vasos sanguíneos o tráquea7,13y anillos pueden fundir más completa que otras formas como esferoides14,15.
Agarosa es ampliamente utilizada como material de molde para la fabricación de tejidos uno mismo-montado debido a su biocompatibilidad, permeabilidad y propiedades de adhesión de células no. Por ejemplo, Norotte et al. fabrica moldes de agarosa de Barras extruidas, que permitió un control limitado sobre la forma del molde y equipo especializado requerido15. Tan et al. depositado gotas de alginato como construir unidades para fabricar moldes de hidrogel personalizado en diversas formas (pirámide, cuadrado)16. Sin embargo, el gran diámetro de los esferoides de alginato (300 μm) dio lugar a características con baja resolución. Una baja resolución puede resultar en superficies irregulares que pueden afectar la consistencia de agregación celular. Por otra parte, agarosa puede ser arrojada a negativos de polímero para crear moldes no adhesivo con características lisas y dimensiones específicas6,7,17.
Divulgamos previamente un sistema para la fabricación de pozos de siembra celular agarosa anular medida de un molde negativo de PDMS en un molde de policarbonato molido7,18. Agarosa se vierte en la negativa PDMS y permitió establecer7,18. Las células fueron sembradas después en pozos de agarosa, donde agregan para formar uno montado, anillos de tejido libre de andamio en menos de 24 h7,18. Negativos PDMS son esterilizables en autoclave, pueden reutilizarse muchas veces y son suaves y flexibles, lo que es fácil de quitar los pozos de agarosa solidificada. Cuando este sistema fue inicialmente reportado en Gwyther et al. 7, PDMS negativos fueron echados de fresado de moldes en policarbonato (figura 1A). Después de agarosa del bastidor, los pozos de siembra de células individualmente se recorta y coloca en los pocillos de una placa de 12 pozos7,18. El diseño fue modificado más recientemente que un molde de agarosa solo produce 5 anillos y cabe en un pozo de una placa de 6 pozos, eliminando la necesidad de recortar en pocillos individuales y reducir la cantidad de PDMS y agarosa requerida para producir cada anillo (figura 1B). Una célula más pequeña siembra ancho canal fue utilizada para reducir el número de células sembradas necesaria para lograr la formación del anillo. A pesar de estos cambios, la resolución y la personalización de moldes se restricción a dimensiones fresa estándar disponibles, y microfresado puede ser prohibitivo. Además, equipo mecanizado de control numérico (CNC) puede ser lento y engorroso debido a la necesidad de reservar tiempo en fuertemente utilizados equipos personalizados, software adicional fabricación asistida por ordenador (CAM) para convertir el diseño asistido por ordenador ( Archivo CAD) a una trayectoria de herramienta programable y confiable sujeción de la pieza de policarbonato durante el mecanizado.
En el presente estudio, examinamos el uso de la impresión 3D como alternativa al mecanizado CNC. Impresión 3D es ampliamente utilizada para los implantes personalizados ingeniería, fabricación de material de andamio y para la impresión directa de células y tejido esferoides15,19,20. Hemos utilizado una impresora 3D de alta resolución y 3D especializado impresión material que nos permitió imprimir un molde rígido con un liso, superficie brillante acabado (véase Tabla de materiales). Nuestra técnica permite la fabricación de moldes de plástico altamente personalizados, de alta resolución que puede ser utilizado para la fundición en PDMS negativos y pozos de agarosa. Iteraciones de diseño se resumen en la figura 1. El diseño de molde más fue modificado en la versión de molde 3D impreso para incluir muros exteriores cónicos y un orificio central con el fin de facilitar la eliminación de ambos los negativos PDMS de moldes 3D impreso y los pozos de agarosa de PDMS negativos. Estas características cónicas no pueden lograrse con el estándar de procesos de mecanizado. La distancia desde el fondo de los pozos en el fondo del molde se incrementó en esta iteración, dando por resultado una base debajo de los postes para reducir el riesgo de romper durante la extracción bien agarosa puestos de agarosa más grueso. El procedimiento de fabricación de molde y el anillo se muestra esquemáticamente en la figura 2.
Protocolo
1. preparar el molde impreso en 3D
- Prepare un dibujo del molde de las dimensiones deseadas del CAD.
- Envíe el archivo de CAD a una impresora 3D de alta resolución. Seleccionar el material apropiado de impresión plástico, con acabado brillante.
- Después de la impresión, lave muy bien el molde con agua y detergente.
2. bastidor PDMS negativos
- Mida la cantidad deseada de base PDMS en una balanza. Para un molde de 60 mm de diámetro y 2 mm, bien puestos, utilizar 25 g.
- Agregue el agente endurecedor en un 1:10 (w/w) relación a la base PDMS.
- Revolver vigorosamente hasta que los dos componentes se combinan muy bien. Una mezcla puede resultar en curación incompleta de PDMS, resultando en una superficie "pegajosa".
- Coloque un pedazo de cinta alrededor de la frontera de los moldes 3D impreso, para permitir la formación de una capa base de PDMS sobre los pozos impresos de laboratorio.
- Vierta la mezcla PDMS en el molde y coloque el molde en una cámara de vacío de gas hasta que se liberan todas las burbujas.
- El PDMS a 50 ° C para 2-4 h, o hasta que se solidificó lo suficiente para eliminar de la curación.
- Retire la cinta del laboratorio y cuidadosamente extraer el negativo PDMS.
- Incubar el PDMS en 60 ° C durante una 1 h adicional (después del retiro del molde impreso en 3D) para asegurar ese molde esté completamente seca.
- Lave el PDMS con agua y detergente para eliminar cualquier residuo. Lavado insuficiente puede resultar en la formación del anillo pobre para las primeras aplicaciones de la negativa PDMS.
3. fabricación de pozos de agarosa
- Preparar agarosa pozos 1 día antes de la siembra de las células.
- Hacer una solución de agarosa al 2% (p/v) en DMEM y autoclave.
- Pipetear 4 mL agarosa fundida en un autoclave PDMS negativo. Entonces agarosa pipeta directamente en los postes de PDMS negativos. Eliminar las posibles burbujas de aire con una punta de la pipeta, como burbujas pueden provocar inhomogeneidades en las dimensiones bien.
- Nota: No llene demasiado los moldes; la superficie superior de la agarosa debe ser plana, para que serán nivel sobre retiro de PDMS y la colocación en placas de cultivo de 6 pozos pozos de agarosa. Agarosa sobrante puede ser re-esterilizado y usado otra vez, aunque no más de una vez.
- Después de la agarosa se enfríe (aproximadamente 10 min para 4 mL de agarosa; moldes más grandes pueden necesitar más enfriamiento), cuidadosamente separe los pozos de agarosa de los negativos PDMS usando fórceps romos y transferir a un pozo de una placa de 6 pozos.
- Sumerja los pozos de agarosa en medio de cultivo completo y equilibrar durante la noche en un incubador de 37 ° C antes de usar.
4. siembra de tejido de anillos
- Cultura rata aórtico músculo liso células21 (RaSMCs) en DMEM con 10% suero fetal bovino (FBS), 1% glutamina, 1% no esenciales aminoácidos, piruvato de sodio 1% y 1% penicilina-estreptomicina hasta llegar a confluencia de 70%.
Nota: Se deben cultivar las células en el 5% CO2 y a 37 ° C en placas de cultivo de tejidos de 15 cm. - Después de que moldes están equilibrados (sección 3), preparar RaSMCs para la siembra.
- Enjuague los platos dos veces con 5 mL por placa de tampón fosfato salino (PBS).
- Añadir tripsina de 0.25% de 3 mL por placa de Petri de 15 cm. Mover las placas a una incubadora de 37 ° C por 2 – 3 min, o hasta que las células han levantado fuera del plato.
- Neutralizar la tripsina con un volumen igual (3 mL por placa) completado del medio de cultivo. Resuspender las células para romper grumos.
- Diluir una alícuota de la suspensión celular 1:1 con el tinte azul de tripán y contar las células con un hemocitómetro.
- Centrifugue el volumen total de la suspensión celular por 5 min a 200 x g para que sedimenten las células.
- Resuspender las células a una concentración de 10 millones de células por mL; Esto dará lugar a 500.000 células por μl 50.
Nota: Diferentes tipos de células pueden requerir concentraciones diferentes de la célula. - Aspire el medio todo del molde de agarosa. Tenga cuidado para quitar todo medio de pozos individuales, pero para no perforar el fondo de los pozos.
- Extraiga con pipeta 50 μl de la suspensión en cada pozo.
- Cuidadosamente añadir 2 mL de medio fresco por la parte exterior del molde de agarosa. Tenga cuidado de no dejar medio desbordamiento en los pocillos de la agarosa. Coloque las placas en la incubadora durante la noche (aproximadamente 16 h).
- Después de la incubación durante la noche, aspirar el medio de fuera de los moldes y añadir medio fresco 4,5 mL en cada pocillo de la placa de 6 pozos para que moldes y anillos estén completamente sumergidos. Medio de cambio diariamente.
Resultados
Este sistema permite la simple fabricación modificada para requisitos particulares de agarosa célula siembra pozos que permite a la célula autoensamblado de 3D en forma de anillo diseñado tejidos. Impresión 3D permite mejor resolución y una mayor flexibilidad en diseño de moldes de policarbonato, donde las dimensiones están limitadas por los tamaños disponibles de la herramienta de mecanizado. Con una impresora 3D de alta resolución, pueden imprimirse las paredes tan delgadas como 0,254 mm, y dimensiones del canal son limitadas solamente por la resolución de la impresora (15.2 μm de resolución para estos estudios). Por lo general, fresas CNC a menos de 0,3 mm no son comercialmente disponible, por lo que no es posible crear canales de anchuras más pequeñas. Micro-fresado puede producir características más pequeñas, aunque el equipo necesario puede ser prohibitivamente caro o inaccesible a muchos laboratorios de investigación biomédica. Curvatura y las dimensiones del canal están limitadas también por la forma de la punta de fresa. Además, características tales como ángulo o paredes cónicas no son posibles, y pequeñas características pueden romperse durante el proceso de mecanizado.
Planos CAD pueden modificarse fácilmente para producir moldes 3D impreso y negativos PDMS de dimensiones personalizables. Figura 3 describe las dimensiones de nuestros actual 2 mm post 3D impreso moldes, en comparación a las anteriores iteraciones de diseño. El proceso es barato; 2 mm, 5-anillo impreso en 3D molde costado 44,67 dólares a impresión 3D y cada parte pueden utilizarse para crear múltiples negativos PDMS. Hasta la fecha, hemos creado más de 30 negativos PDMS de un solo molde impreso en 3D. Cada negativo requiere 25 g de PDMS en USD 0,11 por g (USD 2,75 por PDMS negativo). Cada negativo PDMS puede limpiar con detergente, esterilizado y reutilizado por hasta varios años, dependiendo de la frecuencia de uso. Comparado con el original diseño18, el molde impreso 3D compacto utiliza considerablemente menos PDMS y agarosa por anillo de tejido de 2 mm (Figura 1E).
Las células sembraron en los pozos de agarosa equilibrado agregados a los anillos de tejido de forma en menos de dimensiones de 24 h. anillo dependen de las dimensiones de los pozos de agarosa. Aquí, demostramos que se pueden fabricar anillos de célula de músculo liso de rata uno mismo-montado en pozos con 2, 4 o postes de diámetro de 12 mm (figura 4). Anillos en este estudio sólo fueron cultivados durante 3 días, previamente hemos cultivado hSMC anillos de hasta 2 semanas22y anillos de hMSC-cartílago hasta 3 semanas13. Como se informó anteriormente, los anillos pueden funcionar como modelos 3D en vitro de tejidos humanos para la evaluación cuantitativa del tejido función11 y fuerza mecánica13,22y también pueden servir como unidades de construcción modular generar construcciones de tejido en forma de tubo7,13. La célula de las condiciones de siembra y atributos funcionales de anillos de tejido de estos tipos celulares se resumen en la tabla 1.
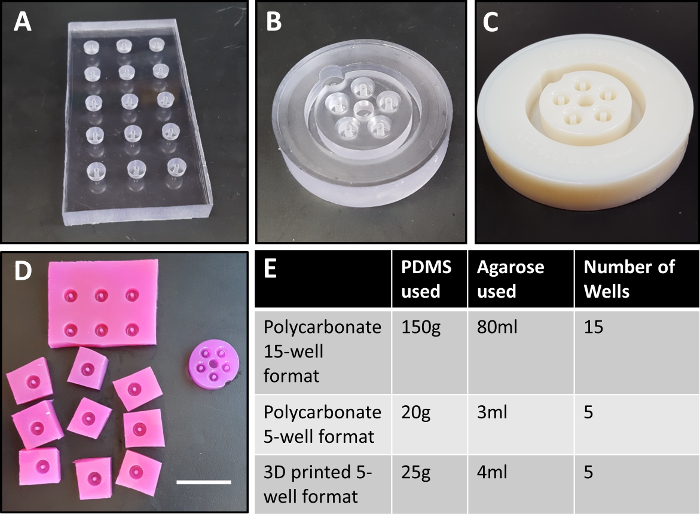
Figura 1: diseños de molde policarbonato. Inicialmente, fueron trabajados a máquina bien 15 moldes en policarbonato (A). Versiones posteriores ofrecen un diseño más compacto (B), con 5 pozos diseñados para caber en un molde de policarbonato simple y dentro de un pozo de una placa de 6 pozos. Aquí, modificó este diseño utilizar plástico impreso en 3D como una alternativa más adaptable a policarbonato mecanizada (C). Se muestra en (D) son pozos de agarosa fabricados a partir de la inicial diseño18 (izquierda) comparado con el actual diseño compacto (derecho), que requiere significativamente menos agarosa y no requiere separación manual de los pozos. Cantidades de PDMS y agarosa necesaria para cada iteración del diseño se muestran en (E). Postes centrales son de 2 mm de diámetro. Molde en (A) es de 6 cm x 12 cm, (B) tiene un diámetro de 5 cm, y (C) tiene un diámetro de 6 cm. Barra de escala (D) = 3 cm. haga clic aquí para ver una versión más grande de esta figura.

Figura 2: fabricación de anillos de tejido uno mismo-montado. Un molde impreso en 3D se utiliza para emitir un resultado negativo PDMS, que se utiliza para los pozos de agarosa (A). Luego se siembran las células directamente en los pozos de agarosa, donde agregan en menos de 24 h a anillos de tejido de forma (B). En (B) las líneas punteadas muestran el contorno bien. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: vista transversal del dibujo impreso en 3D molde CAD. Dimensiones de ancho de canal (A) altura del canal (B), agujero (C), diámetro total (D), labio externo (E) y altura de la pared exterior (F) se muestran. Las paredes exteriores (1), parte superior de los pozos (2) y el agujero central (3) son cónicos (en un ángulo de 5 ° para 1 y 3, 45 ° 2) para mejorar la facilidad de eliminación negativa de PDMS. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: dibujos CAD con negativos PDMS correspondientes y uno mismo-montado SMC con 2 (A), 4 (B) y 12 (C) mm diámetros post. En (A), (1) indica una muesca para proporcionar orientación, (2) indica un agujero central para mejorar la perfusión (3) es un número de archivo, que imprime directamente sobre los negativos PDMS, y (4) se muestra el exterior de la pared, que es cónica para facilitar la eliminación negativa de PDMS. Bares en pozos de agarosa la escala = 1 cm. haga clic aquí para ver una versión más grande de esta figura.
| Tipo de la célula | Células sembradas por anillo | Diámetro del anillo | Duración de la cultura | Análisis funcional realizado |
| Rata de SMC | 0,5, 1 o 3 x 106 | 2, 4 o 12 mm | 3 días | Estudio actual; N / A |
| iPSC derivados SMC 11 | 0.6 x 106 | 2 mm | 17 días | Pruebas de contractilidad, ensayo de tracción uniaxial, análisis histológico |
| SMC humano 22 | 0.4 x 106 | 2 mm | 2, 7 o 14 días | Ensayo de tracción uniaxial, análisis histológico |
| MSC humana 14 | 0.4 x 106 | 2 mm | 21 días | Ensayo de tracción uniaxial, el análisis histológico, anillo fusión y compresión de tubo de prueba, diferenciación en tejido cartilaginoso |
Tabla 1: Número de células necesario para la fabricación de anillo de diferentes tipos de células.
Discusión
Aquí hemos presentado un método versátil para la fabricación rápida de anillos uno mismo-montado tejido con dimensiones modificadas para requisitos particulares fácilmente con impresión 3D. Nuestro método es similar al reportado en Svoronos et al. 6 , donde panal 3D impreso y moldes de cera con forma de hueso de perro fueron utilizados para la fundición en PDMS negativos. Sin embargo, los moldes han sido modificados para contener varias características de diseño único. Una muesca (Figura 4A(1)) proporciona orientación del molde para permitir que cada anillo a ser etiquetados y controlados individualmente. El agujero central (Figura 4A(2)) ayuda a mejorar la difusión del medio en los pozos. Números de archivo CAD se imprimen directamente en el molde; por lo tanto, PDMS negativos están marcados cada uno con número de versión y poste de diámetro (figura 4A3). Las paredes exteriores cónicas (figura 3(1), 5 °), en la parte superior de los canales bien (figura 3(2), 45 °) y agujero central (figura 3(3), 5 °) que sea más fácil quitar negativos PDMS de los moldes 3D impreso , y pozos de agarosa son más fáciles de quitar de los negativos PDMS (Figura 4A(2), A(4)).
Hemos demostrado la versatilidad de este sistema de fabricación uno mismo-montado tejidos en forma de anillo de una variedad de diámetros y tipos de células, incluyendo humanos primarios del músculo liso células (SMCs)18,22, rata aórtica PYME7 , 23, células madre mesenquimales humanas (hMSCs)13y comités derivan de pluripotentes inducidas (iPSCs) células11 (tabla 1). En trabajo en curso, estamos evaluando la formación de anillos de tipos adicionales de la célula tales como células endoteliales y fusión de anillos de cartílago de diferentes tamaños para posibles aplicaciones en reemplazo traqueal. Además de construcciones derivadas de la célula, también hemos utilizado este sistema para fabricar anillos con microesferas de gelatina reticulada incorporado13,22. Las microesferas pueden ser incorporadas dentro de anillos de tejido durante uno mismo-montaje para proporcionar resistencia mecánica adicional, o para localizan suministro de factores de crecimiento13,22.
Cuando fabricación anillos de tejido, optimización del número de células puede ser necesario para diferentes tipos de células. Mínima célula números pueden variar basado en el tamaño y tipo de células. Por ejemplo, se siembran hSMCs derivadas de iPSCs a 600.000 células/anillo11, hMSCs y hSMCs primaria se siembran en 400.000 células/anillo13,22y rata que SMCS aórticas se siembran en 500.000 células/anillo18. Dimensiones del canal también pueden afectar la formación del anillo y el número mínimo de células necesarios para la formación de aro24. Estudios con células humanas y moldes 3D impreso, se utilizó un ancho de canal de 2 mm. Los moldes de policarbonato original tenían un ancho de canal de 3,75 mm, que requería de 750.000 hSMCs para formar una célula de 2 mm anillo18. Con el ancho reducido del canal, hemos sido capaces de reducir el número de células necesarias para la formación del anillo en un 46%, a 400.000 células por anillo25. Cantidades de células sembradas por anillo se resumen en la tabla 1.
Al elegir un material impreso en 3D, muchos factores necesitan ser considerados. Porque el PDMS se cura normalmente a 60 ° C, el material impreso en 3D debe tener un alto suficiente temperatura para evitar daños durante el curado de PDMS de fusión. La temperatura de fusión del material utilizado en este estudio (un material patentado, véase Tabla de materiales) no está disponible. Sin embargo, cuando al horno a 60 ° C durante 1 h, se observó que el material comenzó a producir un olor. Por lo tanto, decidimos bajar la temperatura de curado a 50 ° C y aumentar el tiempo de curado para hornear el PDMS sin dañar el material impreso en 3D. Ajustes de tiempo de curado pueden ser necesarios si moldes se modifican para negativos PDMS mayor forma. Un periodo de curado adicional a 60 ° C después del retiro de PDMS de los moldes 3D impreso evita que el PDMS final negativo queda pegajoso, limitando la temperatura, a que el molde 3D impreso se expone. Tenga en cuenta que algunos materiales inhiben la polimerización de PDMS, así que asegúrese de que el material seleccionado es compatible con PDMS. Por último, también debe considerarse la toxicidad material del molde. Mientras que el molde impreso en 3D no será en contacto directo con las células, es posible que algún residuo del molde puede ser transferida a los PDMS negativos durante el proceso de curado. Se encontró que lavar muy bien con detergente fue suficiente para eliminar cualquier residuo de la negativa de PDMS. Sin embargo, observamos previamente que lavado inadecuado condujo a la formación deficiente del anillo en pozos de agarosa por primera pocos usos de los PDMS negativo. El uso de PDMS emitidos de otros materiales impresos en 3D puede requerir investigación adicional para verificar que el detergente es suficiente para eliminar los residuos del molde, incluyendo cualquier posibles lixiviados. Pruebas periódicas también pueden ser necesario, como es posible que repite calefacción ciclos (hasta 50 ° C) puede dañar el molde con el tiempo y causar aumentos en el residuo después de uso repetido. Hasta la fecha, hemos utilizado un solo molde impreso en 3D para producir más de 30 negativos PDMS que se han utilizado con éxito generar anillos de tejido.
Impresión en general, 3D permite una mayor versatilidad para la fabricación de moldes de agarosa que mecanizado de policarbonato. Proporciona una resolución más alta que es posible con herramientas y diseño de moldes no está limitado por las dimensiones de las herramientas disponibles. Esto permite una mayor personalización y la adición de características tales como la disminución gradual no puede ser posible con trabajar a máquina. Este sistema puede aplicarse a la fabricación de tejidos automático montados en otras formas, además de anillos6,17. Usando el método de fabricación de anillo, hemos desarrollado anillos de tejido de una variedad de tamaños para potenciales aplicaciones en la ingeniería de tejido traqueal13, ingeniería vasos7y modelado de enfermedades vasculares11y tipos de la célula.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos Dr. Erica Stults (investigación académica y científico de aplicación, servicios de tecnología de información WPI) para su ayuda con 3D impresión, Amanda Zoë Reidinger, pH.d. y Chris Nycz Karen Levi, M.E., para su entrada en el diseño del molde, Kathy Suqui y Jennifer Mann para su ayuda prueba diseños de molde y Michael O'Keefe por su ayuda con película. Este trabajo fue financiado por NSF IGERT DGE 1144804 (MWR, ha), NIH R15 HL097332 (MWR, TAH), NSF REU EEC0754996 (BA), NIH 1R01 EB023907 (MWR, tiene) y NIH R15 HL137197 (MWR, ha).
Materiales
| Name | Company | Catalog Number | Comments |
| SeaKem LE Agarose | Lonza | 50040 | |
| PDMS | Dow Corning | Sylgard 184 | |
| DMEM | Corning Cellgro | 15-017-CV | |
| VeroWhite | StrataSys | RGD835 | |
| 3D printer | StrataSys | Objet 260 Connex | |
| DMEM | Corning Cellgro | 15-017-CV | |
| FBS | Thermo Fisher | 16000069 | |
| L-glutamine | Corning Cellgro | 25-015-CI | |
| Non-essential amino acids | Corning Cellgro | 25-025-CI | |
| Sodium pyruvate | Corning Cellgro | 25-000-CI | |
| Pen-strep | Corning Cellgro | 30-002-CI | |
| Trypsin | Corning Cellgro | 25-053-CI | |
| Trypan blue | Corning Cellgro | 25-900-CI | |
| PBS | Lonza | 17-516F | |
| 6-well plate | Corning | 353046 | |
| WKY 3M-22 rat aortic smooth muscle cells | Provided by T. Wight [ref 21] | N/A |
Referencias
- L'Heureux, N., Paquet, S., Labbe, R., Germain, L., Auger, F. A. A completely biological tissue-engineered human blood vessel. FASEB J. 12 (1), 47-56 (1998).
- Adebayo, O., Hookway, T. A., Hu, J. Z., Billiar, K. L., Rolle, M. W. Self-assembled smooth muscle cell tissue rings exhibit greater tensile strength than cell-seeded fibrin or collagen gel rings. J Biomed Mater Res A. 101 (2), 428-437 (2013).
- Hayashi, K., Tabata, Y. Preparation of stem cell aggregates with gelatin microspheres to enhance biological functions. Acta Biomater. 7 (7), 2797-2803 (2011).
- Kelm, J. M., et al. A novel concept for scaffold-free vessel tissue engineering: self-assembly of microtissue building blocks. J Biotechnol. 148 (1), 46-55 (2010).
- McAllister, T. N., et al. Effectiveness of haemodialysis access with an autologous tissue-engineered vascular graft: a multicentre cohort study. Lancet. 373, 1440-1446 (2009).
- Svoronos, A. A., Tejavibulya, N., Schell, J. Y., Shenoy, V. B., Morgan, J. R. Micro-mold design controls the 3D morphological evolution of self-assembling multicellular microtissues. Tissue Eng Part A. 20 (7-8), 1134-1144 (2014).
- Gwyther, T. A., et al. Engineered vascular tissue fabricated from aggregated smooth muscle cells. Cells Tissues Organs. 194 (1), 13-24 (2011).
- Mehesz, A. N., et al. Scalable robotic biofabrication of tissue spheroids. Biofabrication. 3 (2), 025002 (2011).
- Laterreur, V., et al. Comparison of the direct burst pressure and the ring tensile test methods for mechanical characterization of tissue-engineered vascular substitutes. J Mech Behav Biomed Mater. 34, 253-263 (2014).
- L'Heureux, N., et al. Human tissue-engineered blood vessels for adult arterial revascularization. Nat Med. 12 (3), 361-365 (2006).
- Dash, B. C., et al. Tissue-Engineered Vascular Rings from Human iPSC-Derived Smooth Muscle Cells. Stem Cell Reports. 7 (1), 19-28 (2016).
- Heureux, N., et al. A human tissue-engineered vascular media: a new model for pharmacological studies of contractile responses. FASEB J. 15, 515-524 (2001).
- Dikina, A. D., Strobel, H. A., Lai, B. P., Rolle, M. W., Alsberg, E. Engineered cartilaginous tubes for tracheal tissue replacement via self-assembly and fusion of human mesenchymal stem cell constructs. Biomaterials. 52, 452-462 (2015).
- Twal, W. O., et al. Cellularized microcarriers as adhesive building blocks for fabrication of tubular tissue constructs. Ann Biomed Eng. 42 (7), 1470-1481 (2014).
- Norotte, C., Marga, F. S., Niklason, L. E., Forgacs, G. Scaffold-free vascular tissue engineering using bioprinting. Biomaterials. 30 (30), 5910-5917 (2009).
- Tan, Y., et al. 3D printing facilitated scaffold-free tissue unit fabrication. Biofabrication. 6 (2), 1-11 (2014).
- Dean, D. M., Napolitano, A. P., Youssef, J., Morgan, J. R. Rods, tori, and honeycombs: the directed self-assembly of microtissues with prescribed microscale geometries. The FASEB Journal. 21 (14), 4005-4012 (2007).
- Gwyther, T. A., Hu, J. Z., Billiar, K. L., Rolle, M. W. Directed cellular self-assembly to fabricate cell-derived tissue rings for biomechanical analysis and tissue engineering. J Vis Exp. (57), e3366 (2011).
- Zhu, W., et al. 3D printing of functional biomaterials for tissue engineering. Curr Opin Biotechnol. 40, 103-112 (2016).
- Jakab, K., et al. Tissue engineering by self-assembly and bio-printing of living cells. Biofabrication. 2 (2), 022001 (2010).
- Lemire, J. M., Potter-Perigo, S., Hall, K. L., Wight, T. N., Schwartz, S. M. Distinct Rat Aortic Smooth Muscle Cells Differ in Versican/PG-M Expression. Arteriosclerosis, Thrombosis, and Vascular Biology. 16 (6), 821-829 (1996).
- Strobel, H. A., et al. Cellular self-assembly with microsphere incorporation for growth factor delivery within engineered vascular tissue rings. Tissue Eng Part A. 23 (3-4), 143-155 (2017).
- Strobel, H. A., Calamari, E. L., Beliveau, A., Jain, A., Rolle, M. W. Fabrication and characterization of electrospun polycaprolactone and gelatin composite cuffs for tissue engineered blood vessels. JBMR Part B. , (2017).
- Napolitano, A. P., Chai, P., Dean, D. M., Morgan, J. R. Dynamics of the self-assembly of complex cellular aggregates on micromolded nonadhesive hydrogels. Tissue Eng. 13 (8), 2087-2094 (2007).
- Gwyther, T. . Engineered Vascular Tissue Generated by Cellular Self-Assembly. , (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados