Method Article
Análisis del comportamiento de crecimiento de Arabidopsis thaliana en diferentes calidades de luz
En este artículo
Resumen
Aquí, presentamos un protocolo para el estudio de comportamiento de crecimiento de planta y especialmente los fenotipos de una manera reproducible. Mostramos cómo proporcionar al mismo tiempo condiciones luz estable y variable. Análisis adecuados dependen de suficientes números de muestra y evaluaciones estadísticas válidas.
Resumen
Biólogos de la planta a menudo necesitan observar el comportamiento del crecimiento de sus especies solicitadas. Para ello, las plantas necesitan constantes ambientales y estables condiciones de luz, que son preferentemente variables en cantidad y calidad por lo que pueden llevar a cabo estudios bajo diferentes configuraciones. Estos requisitos se cumplen por cámaras climáticas con luz emite luces de diodos (LED), que – en contraste con luces fluorescentes – configurable para diferentes longitudes de onda. Los LED son energía conservación y no emiten prácticamente ningún calor incluso a intensidades de luz, que a menudo constituye un problema con otras fuentes de luz. El protocolo presentado proporciona una guía paso a paso de cómo programar una cámara climática equipado con luces LED variable así como la que describe varios enfoques para en análisis de la profundidad de los fenotipos de crecimiento. Dependiendo de la configuración experimental diversas características de las plantas de crecimiento pueden ser observadas y analizadas. Aquí se describe cómo determinar el peso fresco, área foliar, actividad fotosintética y densidad estomática. Demostramos con el fin de obtener datos fiables y válidas conclusiones es obligatorio utilizar un número suficiente de individuos para la evaluación estadística. Que muy pocas plantas para este tipo de análisis de resultados en alta errores estadísticos y por lo tanto en menos claras interpretaciones de los datos.
Introducción
Arabidopsis thaliana ha sido el organismo modelo para los investigadores de planta de la era molecular durante más de dos décadas. Varias características hacen este pequeño representante de la familia Brassica un candidato ideal para los estudios genéticos y moleculares: tiene un genoma relativamente pequeño con sólo cinco cromosomas (comparados por ejemplo Nicotiana tabacum con 24 cromosomas) y su genoma fue completamente secuenciado en 20001. A. thaliana puede ser fácilmente genéticamente modificada por infección de Agrobacterium 2 y es sensible a incluso las últimas herramientas genéticas como CRISPR/Cas3. Aunque pequeño, el ciclo de crecimiento es lo suficientemente rápido como para hacer experimentos bioquímicos viables donde se necesita una mayor cantidad de material. Las plantas crecen en placas de agar o en el suelo y pueden ser cultivadas como cultivos de líquido4. Arabidopsis se puede cultivar en armarios de controladas climático, por ejemplo de Percival, en cámaras climáticas o en invernaderos. Para poder comparar el comportamiento del crecimiento y analizar los fenotipos de los mutantes es fundamental para proporcionar reproducibles y en el mismo tiempo de crecimiento flexible condiciones5. Dependiendo del problema científico que debe abordarse una puede ser que necesite diferentes temperaturas y condiciones de luz constantes, intensidades de luz diversas o diferentes calidades de luz a la misma temperatura. La luz es un parámetro muy importante en el crecimiento de las plantas y a menudo se estudia su influencia en diversos acercamientos6. Para garantizar la reproducibilidad y la comparabilidad de los datos obtenidos es crucial asegurar una salida estable y aplicar el mismo tipo de fuentes de luz.
Las fuentes de luz habituales en invernaderos y cámaras climáticas consisten en vapor de sodio o lámparas fluorescentes, que promover el crecimiento satisfactorio de las plantas pero tienen varias desventajas. En primer lugar, que envejecen con el tiempo que cambia la salida espectral no sólo en intensidad sino en calidad (observaciones propias). Sin embargo, sólo la intensidad es generalmente supervisada continuamente para que un cambio en la calidad de la luz puede pasar desapercibido pero todavía tiene efectos significativos. En segundo lugar, ambos tipos de lámparas de generaran calor en mayores intensidades de luz, que sí mismo tiene una profunda influencia fisiológica sobre el crecimiento de la planta y podría enmascarar cualquier efecto dependiente de luz. En tercer lugar, la salida espectral de estas fuentes de luz es invariable y muy a diferencia de la luz solar natural7. Todos estos inconvenientes han sido superados en el caso de LEDs)8,9,10,11. Tienen una larga vida útil con apenas cualquier cambio en la emisión, no producen calor residual incluso a muy altas intensidades de luz y son muy flexibles con respecto a su salida espectral.
Aquí ilustramos cómo configurar una cámara climática con separado luces de LED para la luz blanca, roja y azul y seguir distintos parámetros de crecimiento de las plantas con el tiempo. Medimos el peso fresco, área foliar, densidad de estomas y desempeño fotosintético. Al mismo tiempo, nos demuestran la importancia de establecer correctamente las evaluaciones estadísticas.
Protocolo
Este protocolo contiene algunos ejemplos de cómo analizar el comportamiento del crecimiento de las plantas de a. thaliana .
1. preparación
- Antes de empezar, hacer un plan de cuidado cuantas plantas se necesitarán para hacer un análisis estadístico fiable de los experimentos y luego preparan las cantidades apropiadas de potes.
Nota: Siempre deje la posibilidad que algunas semillas no pueden germinar. - Utilice una cámara climática con diferentes niveles de LED programables individualmente para comparar el crecimiento de las plantas bajo las mismas condiciones ambientales generales (tabla de materiales).
2. crecimiento vegetal y configuración de las luces LED
- Preparar el número adecuado (dependiendo de diversas condiciones o mutantes a analizar) de ollas de 6 x 7 cm con tierra y planta una semilla en cada uno de ellos.
Nota: en este caso, se sembraron 36 plantas por condiciones. - Vernalize durante dos días a 4 ° C.
- Ajustar la humedad relativa del aire al 65% y la temperatura a 22 ° C/16 ° C para un día de 16 h / 8 h ciclo noche. Ajustar la luz de todos los niveles a una intensidad de 200 μm/cm2/s1. Hacerlo introduciendo los valores respectivos en un programa a través de la pantalla táctil en el frente de la cámara climática. Para comparar cuatro diferentes calidades de luz establezca los LEDs a los siguientes parámetros como se indica en la tabla 1.
| Identifyier | 395 nm [%] | 440 nm [%] | 3 K [%] | 660 nm [%] | 770 nm [%] |
| "la luz del sol" | 100 | 11 | 100 | 15 | 100 |
| Rojo y azul (RB) | 100 | 15 | 25 | 10 | 100 |
| Azul (B) | 100 | 15 | 25 | 2 | 25 |
| Red (R) | 90 | 2 | 25 | 10 | 100 |
Tabla 1: composición de intensidades de luz emitida por LEDs
- Monitorear la espectral salida continuamente, por ejemplo, utilizando un espectrómetro calibrado incorporado.
- Colocar las plantas en la cámara climática en los diferentes niveles y mantenerlos cubiertos con una tapa transparente hasta que los cotiledones bien desarrollados son accesibles. Asegúrese de que las plantas estén regadas suficientemente.
- Plantas de monitor y documento por el ojo y fotográficamente tan a menudo como apropiado, dependiendo de qué tan rápido las plantas crecen en las condiciones solicitadas, por ejemplo, cada dos días. Asegúrese de utilizar un trípode para la cámara para garantizar la misma distancia entre la cámara y objetos para todos los cuadros y así poder realizar comparaciones. Use una barra de escala cuando sea apropiado.
Nota: El término DAS (días después de la siembra) se refiere a la plantación real de las semillas incluyendo vernalización.
3. determinación del rendimiento PSII
- Utilice un Fluorímetro de pulso modulado. Configurar el cabezal a una distancia apropiada de la planta para que la roseta completa puede verse en la ventana live.
- Al iniciar el software aparece una ventana de "seleccione la unidad". Marque "MINI" y luego "Aceptar". Elegir el color "azul" en la siguiente ventana emergente. Haga clic en "Aceptar".
Nota: La fluorescencia modulada por pulso medición de la luz se enciende automáticamente. En el monitor, la ventana de imagen aparece mostrando los parámetros de fluorescencia Ft. Una planta bajo la cámara puede verse ahora como una imagen naranja. - Para enfocar la imagen y/o elegir regiones específicas de la planta, pase a vivir vídeo marcando la casilla "video en vivo" y gire el anillo de ajuste de la lente del objetivo. Cierre la ventana de Video en vivo haciendo clic en el cuadro de salida en la esquina superior derecha.
- Para medir los parámetros fotosintéticos, definir un área de interés (AOI). Utilice la configuración predeterminada, que es un círculo que aparece automáticamente en el centro de la pantalla. El cuadro rojo al lado de él representa el valor promedio de pies de todos los píxeles dentro de la AOI. Definir el apropiado AOI eligiendo en el cuadro de AOI en el panel derecho, donde hay diferentes formas. Haga clic en "agregar" en la pestaña AOI y coloque el círculo en el área foliar. Repita cinco veces cada una.
- Mantener la configuración (pestaña a la derecha) en los valores por defecto proporcionados por el fabricante (tabla 2).
| Medidas luz | Int. | Frecuencia | |
| 1 | 1 | ||
| Ley. Luz | Int. | Ancho | |
| 8 | 0 | ||
| Correcciones de la imagen | MINI | ||
| Transformación de imagen | Batería | ||
| 16.7V | |||
| Ganancia | 5 | ||
| De amortiguación | 1 | ||
| Pulso de SAT | Int. | No | S intervalo |
| 8 | 1 | 30 | |
| Inducción lenta | S de retraso | Reloj s | S de duración |
| 40 | 20 | 315 | |
| Absortivity | Ganancia de rojo | Intensidad de rojo | Intensidad NIR |
| 340 | 25 | 13 | |
| Pantalla | Color | ||
| PS Límite | 50 | ||
| Inh. AOI de ref. | 1 | ||
| FM Factor (marque) | 1.030 |
Tabla 2: valores iniciales para las mediciones de la PAM como proporcionado por el fabricante.
- Aplicar una saturación luz flash para realizar una medición de los parámetros fotosintéticos por fluorescente Temple análisis (pulso de saturación). Antes de eso, determinar los coeficientes de amortiguamiento midiendo el rendimiento de fluorescencia mínimo y máximo de una planta oscuro-adaptado. Para ello, coloque la planta en la oscuridad (por ejemplo, en un cajón o una caja oscura) durante unos minutos. Luego coloque la planta debajo de la cabeza de cámara, casillas la medida y ML (medidor de luz), en la fila abajo de la imagen seleccionar "Fv/Fm" reloj en el círculo y Fo, Fm en la parte inferior de la pantalla, haga clic en.
Nota: Fo/Fm representa el rendimiento PSII de una planta oscuro-adaptado. Por lo tanto, es el valor que se normaliza la medición después de aplicar la luz. La actual medida de Fo/Fm permanecerá hasta que se active el nuevo registro. Todos los F y Fm' Fo/Fm relacionados con valores determinados por pulsos de saturación y parámetros de amortiguamiento se calcula en consecuencia. - Encontrar estos resultados en la ficha informe y comprobar todas las cajas en el lado derecho que son relevantes para el experimento (por ejemplo. Y(II), qP, qN, etc.).
- Exportar los resultados a un análisis software por ejemplo. Haciendo clic en el botón exportar en la esquina superior izquierda de Excel y guardar bajo el nombre de archivo apropiado. Generar por lo menos cinco AOIs por hoja y medir varias hojas de la planta misma (no olvides poco oscuro adaptar la planta otra vez después de cada medida), así como varias plantas de una condición, que puede entonces ser estadísticamente evaluados.
- Para el análisis estadístico generar valores medios y desviaciones estándar de AOIs todos y al menos tres plantas independientes para todos los puntos y condiciones de tiempo y realizan t-test un estudiante para evaluar si los datos son significativos12. Datos se evalúan como significativamente diferentes cuando los valores de p están por debajo de 0.05.
4. determinación de la densidad de estomas
- Recoge tres hojas en roseta completamente expandido de tres plantas individuales por condición en etanol al 70% en un plato de petri de vidrio y para extraer clorofila. Incubar en este solvente durante la noche a temperatura ambiente o conservar a 4 ° C.
- Para la separación completa de los pigmentos, incubar en la solución de hidrato de cloral (hidrato de cloral: agua: glicerol = 8: 2: 1 w/v/w) hasta hojas aparecen totalmente blancos.
- Tomar interferencia diferencial imágenes de microscopía (DIC) de la superficie abaxial con 40 aumentos. Cuenta de estomas en el campo de visión y extrapolar con la ayuda de la barra de escala a estomas por mm². Repita que este procedimiento para al menos 4 hojas por condiciones. Realizar análisis estadístico, calculando el valor medio para todas las hojas de una condición y de este calcular el error medio.
5. determinación de peso fresco
- Quitar todas las hojas incluyendo pecíolos de rosetas de seis plantas por condición con una cuchilla de afeitar. Pesan las hojas inmediatamente y someter los datos a análisis estadísticos como se describió anteriormente.
6. determinación del área foliar de roseta
- Utiliza imágenes de ocho plantas por condición para analizar gráficamente el área foliar. Combinar imágenes para una condición en una sola imagen y guardar como *.jpeg o * TIFF.
- Descargar el software apropiado (tabla de materiales).
Nota: Es, por supuesto, puede aplicar cualquier otro programa capaz de realizar esta tarea. - Abrir un archivo de imagen. Elija la herramienta "mano libre selección." Rodean incluyendo pecíolos de una roseta de hojas. Haga clic en "Analyze - sets medidas" y "Área", "Min y Max valor gris," "Densidad integrado" y "Valor de gris medio." Elegir decimales apropiados lugares, es mejor dos o tres y haga clic en "Aceptar".
- Para obtener m2 en lugar de píxeles con el comando "set escala". Aplicar la herramienta de selección lineal para hacer una selección de la línea que corresponde a una distancia conocida, por ejemplo, el diámetro de la licencia que es fácil de calcular de la barra de escala de las imágenes, entonces abra el cuadro de diálogo establecer escala e introduzca esta distancia definida y unidad de medición. Luego volver a "analizar" y haga clic en "medida".
- Una nueva ventana aparece titulados "resultados" que contiene los datos relevantes para la roseta actual. Repita este procedimiento con todas las instalaciones de la imagen e inicializar las mediciones de área para cada nueva planta con Ctrl + M.
Nota: Para plantas más pequeñas con hojas superpuestas no puede utilizarse la herramienta"varita" para hacer el proceso más fácil y rápido. Tan pronto como hojas comience cubriendo unos a otros, esta herramienta no da resultados confiables. - Alternativamente, cortar todas las hojas y colocar de manera que un cuadro de resumen se puede tomar y luego utilice la herramienta varita. Tener en cuenta que cuando se utiliza este método, se necesitan más plantas.
- Seleccione "Archivo"-"Guardar como" en la ventana de resultados y generar un nombre de archivo apropiado y una ubicación en el directorio de la computadora. El archivo se guardará automáticamente en formato Excel.
7. preparación de ARN
- Recoger tres muestras de diez plantas individuales para cada condición. Extraer ARN total usando una planta de kit de extracción de RNA según las instrucciones del fabricante. Determinar la concentración, pureza e integridad de RNA utilizando un equipo bioanalyzer. RNA puede utilizarse para aplicaciones posteriores tales como el análisis de expresión de qRT-PCR o gene por ejemplo RNASeq13.
Resultados
Observación y análisis de crecimiento de las plantas y especialmente los fenotipos de plantas mutantes dependen de condiciones ambientales estables y reproducibles. Estos pueden proporcionarse en cámaras climáticas. Cantidad de luz y sobre todo calidad depende críticamente de la fuente de luz empleada, que en este estudio fue proporcionada por las luces de LED.
La figura 1 muestra un ejemplo de una cámara equipada con paneles de LED. Figura 1A se muestra una captura de pantalla del panel de control donde pueden ajustar todas las condiciones climáticas y luz. Dentro de 24 h puede establecerse veinte diferentes marcos de tiempo. En este ejemplo, las condiciones de día largo con 16 h de luz/8 oscuro han sido programadas. Esta cámara cuenta con cuatro niveles que pueden programarse por separado para que el crecimiento de las plantas en cuatro diferentes configuraciones de luz puede ser estudiada bajo exactamente las mismas condiciones ambientales. La izquierda nivel superior se encuentra una salida espectral imitando la luz del sol tanto como sea técnicamente posible, la superior derecha nivel representa elevados rojo (660 nm) y luz azul (440 nm) con la reducción de luz blanca (3K). El nivel inferior izquierdo fue fijado a elevado la luz azul y el inferior nivel a predominante rojo. Figura 1B ilustra los LEDs según las distintas posiciones como un resumen (panel central) y los respectivo zoom-in (pequeños paneles exteriores). La diferencia en calidades de luz visible por el ojo.
Un espectrómetro integrado constantemente mide, monitorea y ajusta la salida espectral. La figura 2 muestra el espectro del nivel superior izquierdo 1.1, que fue creado para imitar la luz del sol. En comparación con una bombilla de luz fluorescente estándar la porción de luz azul y UV es mucho mayor7.
En la figura 3 un ejemplo de a. thaliana plantas de todos los días cuatro condiciones 10, 13 y 17, respectivamente, después de la siembra es representada. Todas las plantas fueron fotografiadas desde la misma distancia, montando la cámara sobre un trípode. La barra de escala representa 1 cm. Después de 10 días, no mucha diferencia en tamaño o color puede discernir, pero después de 17 días es evidente un crecimiento más rápido bajo luz roja. Además de este análisis visual, se realizaron varios análisis fisiológicos.
Figura 4 sigue los pasos diferentes de medidas de PAM, que analiza por ejemplo la capacidad fotosintética. En la Figura 4A una captura de pantalla de vídeo en directo aparece, que es el lugar para poner la planta en foco para asegurar una óptima calidad de las mediciones. En lugar de centrarse en toda la planta, también se puede elegir una sola hoja para analizar. Figura 4B se muestra el rendimiento actual de fluorescente pies de una planta oscuro-adaptado antes de que se inició la medición real. En este caso, se eligieron cinco áreas circulares de interés (AOIs). Los números en las cajas rojas al lado de cada AOI da directamente el resultado numérico, que también se puede guardar en la forma de una tabla. Para iniciar una medición de los parámetros fotosintéticos Fo, Fm necesita establecer. Una captura de pantalla de pies después de hacer esto se muestra en la figura 4. Tenga en cuenta que ahora el botón "Fo Fm" ya no es activado. Para iniciar una nueva medición, "Nuevo registro" debe hacer clic para borrar la normalización anterior. Finalmente, la figura 4 muestra la efectiva producción de quántum PSII Y(II) después de dar un impulso luminoso de saturación ("SAT-pulso"). Cuantificación de los datos del ejemplares se muestra en la figura 5. Las plantas cultivadas bajo luz del sol al 200 μm/cm2/s1 (figura 5A) se analizaron 12, 21 y 28 días después de la siembra, respectivamente. Nuestros datos demuestran que el rendimiento PSII es significativamente mayor en las hojas de las plantas cultivadas durante tres semanas que durante 12 días. La diferencia entre los días 12 y 28 es todavía importante, pero el p-valor es mayor. En la Figura 4B, se compararon rendimientos PSII de plantas cultivadas durante dos semanas de diferentes calidades de luz. Curiosamente, crecimiento permanente bajo la luz que contiene una alta porción de luz azul conduce a un rendimiento significativamente mayor del PSII. Un efecto similar se observó para las plantas cultivadas bajo luz roja enriquecida, pero el incremento fue un poco menor.
Diferentes calidades de luz mostraron efecto estomas desarrollo14. Por lo tanto, se investigó la densidad estomática. Figura 6 muestra la apariencia de una hoja después de la extracción del pigmento. Las células epidérmicas pueden ser bien diferenciadas, y estoma puede ser contado fácilmente. En la figura, los estomas se indican con un asterisco. Datos detallados acerca de la densidad estomática de las plantas de los diferentes ajustes de luz se pueden encontrar en otra parte9.
Además de inspección visual (figura 3) el peso fresco proporciona una buena medida de los progresos de crecimiento. En este ejemplo las hojas de las plantas cultivadas bajo luz del "sol" después de 8, 10 y 12 días después de la siembra, respectivamente, se pesaron. Evaluación estadística de estos datos puede verse en la figura 7. Como era de esperar, el peso fresco aumenta con el tiempo.
Además de peso fresco, el área foliar es una buena medida para el crecimiento. Aquí, el desarrollo de la planta fue seguida de 10, 13 y 17 días después de la siembra (figura 8A). Al menos seis plantas individuales fueron evaluadas sistemáticamente para obtener datos estadísticos fiables. Para demostrar la importancia de un tamaño de muestra elevado, se calculó el error porcentual del valor promedio, de analizar plantas de dos y seis, respectivamente, (figura 8B). Esto significa que se determinó el porcentaje de la desviación estándar con respecto al valor medio. Está muy claro que, en caso de un pequeño tamaño muestral, el error es 5-10% mayor que en el caso de un mayor tamaño de la muestra. Al aumentar el número de plantas que se evalúan, el error se puede minimizar, que hace que la interpretación de datos mucho más claros.

Figura 1: se proporcionan diferentes calidades de luz por LEDs. A) captura de pantalla desde el panel de control de la cámara LED. Duración del día se establece a las 16 h (esquina superior derecha) y la intensidad de luz se establece en 200 μmol cm-2 s-1. La calidad de la luz es diferente en los cuatro niveles: 1.1 representa un espectro como similar a la luz del sol como técnicamente posibles, 1.2 representa un alto porcentaje de rojos y azules las longitudes de onda (RB) luz, 2.1 se establece predominante en azul (B), 2,2 representa principalmente rojo luz (R). B) el panel central muestra una visión general de todos los niveles; los paneles exteriores muestran los niveles individuales en un zoom mayor. Haga clic aquí para ver una versión más grande de esta figura.
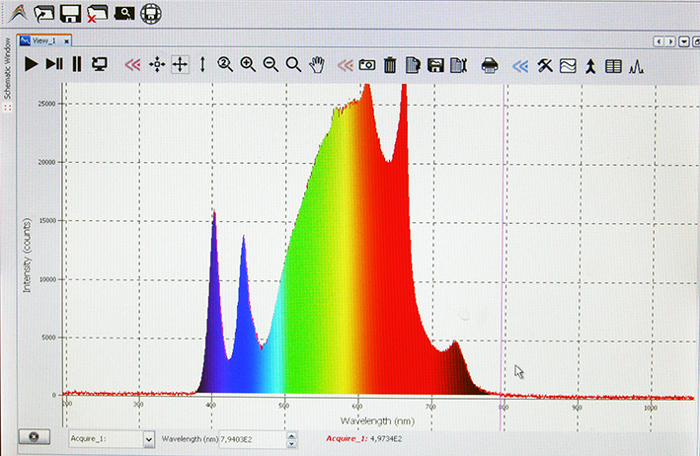
Figura 2: espectro de longitud de onda de configuración de la luz solar simulada. Se muestra una captura de pantalla del espectrómetro incorporado en la cámara de LED, que fue colocada a nivel de 1.1. Haga clic aquí para ver una versión más grande de esta figura.
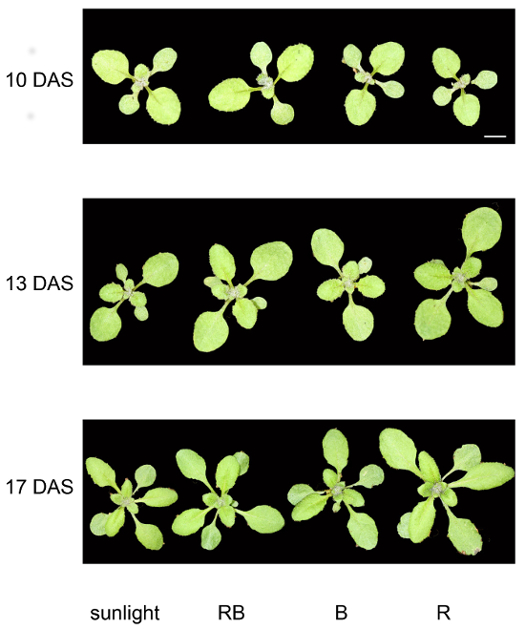
Figura 3: desarrollo de más de una semana de la planta. Representante de a. thaliana plantas de todas las condiciones de luz cuatro de 10, 13 y 17 DAS. Las plantas fueron fotografiadas con una cámara réflex digital en un trípode. Barra de escala representa 1 cm para todas las imágenes. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Imágenes de pasos representativas de las mediciones del PAM de las plantas de a. thaliana . A) captura de pantalla de la vista "Video en vivo" donde se puede ajustar el foco de la imagen. B) rendimiento de fluorescencia actual Ft antes de aplicar cualquier pulsos ligeros. C) rendimiento de fluorescencia actual Ft después de Fo/FM D) producción de quántum de PSII efectuar después un pulso de luz de saturación. Haga clic aquí para ver una versión más grande de esta figura.
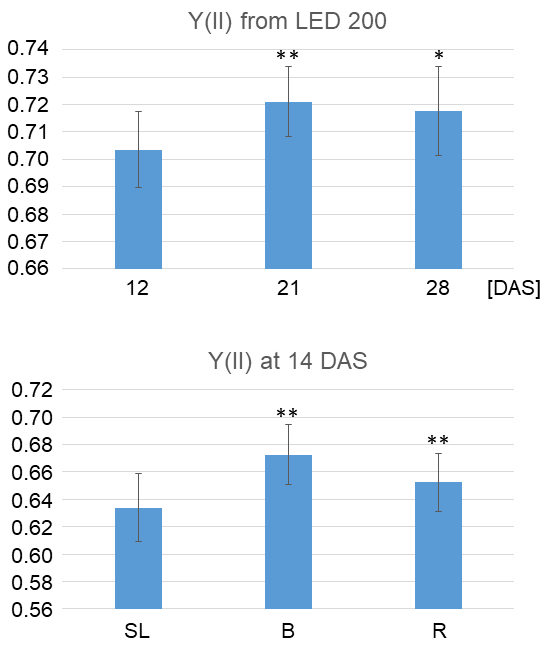
Figura 5: representación gráfica del rendimiento cuántico de efectuar PSII (YII). A) datos de plantas 12, 21 y 28 días después de la siembra y cultiva bajo 200 μmol/cm2/s1 bajo luz del sol simulado ("luz solar") sometidos a análisis de PAM se evaluaron estadísticamente. Se muestran los valores promedio de cinco plantas y cinco AOIs por día. Asterisco indica una diferencia significativa con un valor de p < 0.05 en comparación con el día 12 y dos asteriscos indican diferencias muy significativas con un valor de p < 0.02 según prueba de t de los estudiantes. B) datos de plantas cultivadas en 200 μmol/cm 2/s-1 bajo la luz solar simulada (SL), enriquecido azul (B) o rojo (R) luz, respectivamente, fueron estadísticamente evaluados. Se muestran los valores promedio de cinco plantas y cinco AOIs por día. Se calcularon las diferencias significativas en comparación con "la luz del sol."
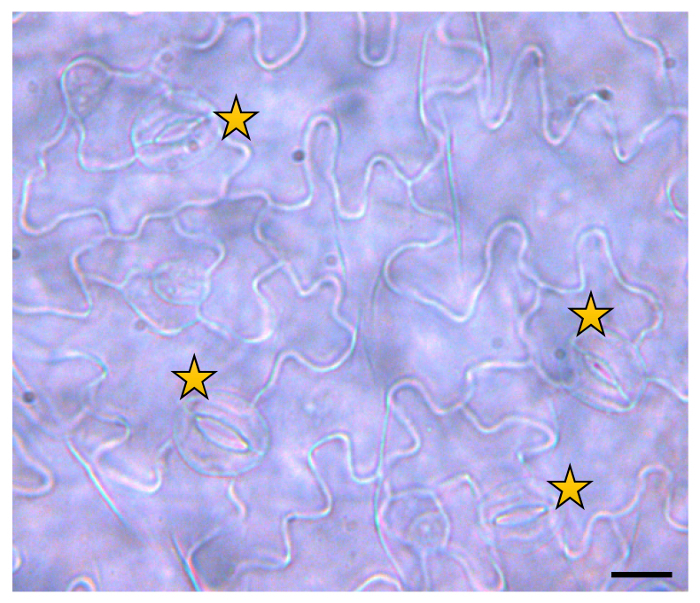
Figura 6: imagen representativa de estomas en el lado abaxial de una hoja de a. thaliana . Hojas prepararon como se describió anteriormente y se analizaron visualmente bajo un microscopio de luz con configuración de DIC en 40 aumentos. Estomas se cuentan en el área visible de al menos 4 hojas por condición. La foto fue tomada con una cámara digital conectada al microscopio tubus. El número de estomas por mm² se calcula con ayuda de la barra de escala. Estrellas indican un único estoma. La barra de escala representa 200 μm. haga clic aquí para ver una versión más grande de esta figura.
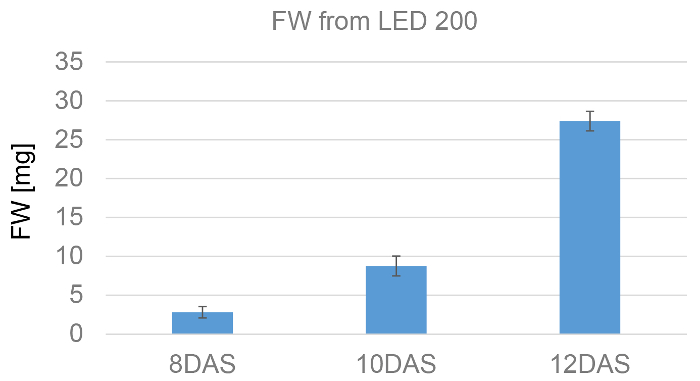
Figura 7: representación gráfica del peso fresco de las plantas de a. thaliana crecido a simula luz solar/200 μmol/cm2/s1. Hojas en roseta fueron cortados de las plantas ocho, diez y doce días después de la siembra. Se muestran los valores promedio en mg de seis plantas por día. Haga clic aquí para ver una versión más grande de esta figura.
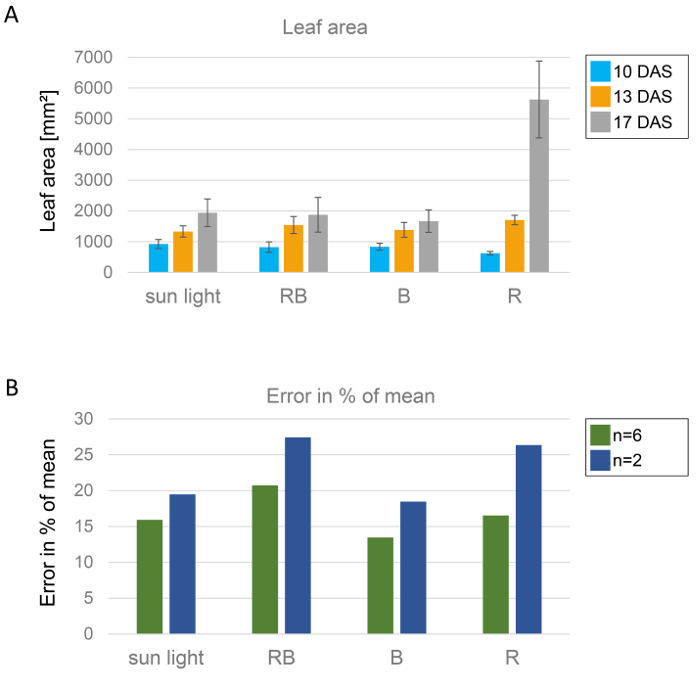
Figura 8: Evaluación estadística de a. thaliana área foliar de las plantas cultivadas bajo diferentes condiciones de luz. A) área de hoja de a. thaliana para 10, 13 y 17 días se determinó gráficamente con ImageJ y datos de n = 6 plantas se evaluaron estadísticamente. El área foliar de todas seis rosetas de cada condición se resume y dividido por seis para obtener el valor medio. Con este valor, se calculó la desviación estándar, y esto está representado por las barras de error. B) área foliar se determinó gráficamente con ImageJ y datos de sea n = 2 o n = 6 plantas, respectivamente, se analizaron estadísticamente como se describe para el panel de A. Entonces el error en porcentaje del valor promedio fue calculado y representado gráficamente. Barras verdes muestran el error porcentual de análisis de n = 6, azul barras de n = 2 plantas. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El primer paso en el estudio de crecimiento de las plantas es configuración de la cámara de acuerdo con las condiciones deseadas. Esto se hace fácilmente escribiendo todas las variables en la máscara de programa del software respectivo (figura 1A). En este paso, se pueden implementar muchas modificaciones cambiando el régimen de luz o temperatura. Asegúrese de monitorear constantemente la temperatura, la humedad y las condiciones de luz (figura 2) para prevenir el fallo técnico de arruinar el experimento. Este es un punto crítico para obtener resultados reproducibles. Aunque esta configuración ofrece muchas variables y puede ajustarse de forma flexible, tiene sus limitaciones. Los LEDs actualmente disponibles no pueden imitar la luz del sol cien por ciento y las condiciones climáticas dentro de una cámara climática pueden reflejar nunca completamente lo que está pasando en el exterior15.
Comparado con el utilizado luces fluorescentes LED son más versátiles, necesitan menos energía y no muestran prácticamente ninguna radiación de calor. Estas ventajas han llevado a la gran industria de cultivo interior para equipar cámaras climáticas e invernaderos con LEDs16. Teniendo en cuenta los enormes éxitos registrados en este campo, la técnica de LED seguramente encontrarán muchas más aplicaciones.
Al observar el fenotipo y especialmente para la determinación del área foliar es importante tener en cuenta que en plantas más viejas hojas de superposición (figura 3). Por lo tanto, evaluación gráfica de rosetas todo tiende a ser imprecisa. En ese caso, es mucho más preciso para cortar todas las hojas e ir de allí.
La evaluación del comportamiento de crecimiento y sobre todo las diferencias de crecimiento y desarrollo en diferentes condiciones dependen de un tamaño de muestra suficiente. En este estudio, por lo menos seis plantas se utilizaron para determinación de e.g. fotosíntesis producción (figura 5), peso fresco (figura 7), y área foliar (figura 8A) pero 30 semillas individuales fueron plantadas al inicio del estudio para que germinan las semillas en primer lugar, suficientes, y en segundo lugar, se puede hacer una selección de plantas "típicas". Incluso dentro de la misma población, es decir, plantas en macetas, solo en la misma bandeja en las mismas condiciones exactas, mostraron distintos fenotipos. Esto es entonces por supuesto reflejado en la desviación estándar durante el análisis estadístico, pero la interpretación de los datos es generalmente más confiable cuando se observan pequeños errores estadísticos (figura 8B).
Medición de desempeño fotosintético por PAM (figura 4, figura 5) se puede hacer por varios parámetros. En este caso, el foco estaba en rendimiento PSII Y(II) como ejemplo pero es posible también determinar por ejemplo el amortiguamiento no fotoquímica, el rendimiento cuántico de la disipación de la energía regulada y no regulada o ligera remisión. Importante aquí es elegir por lo menos cinco AOIs por hoja distribuidos uniformemente en la superficie de la hoja y luego se mide por lo menos seis hojas de diferentes plantas. El inconveniente de este método es que no se pueden detectar efectos en PSI; para ello, se necesitan diferentes equipos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
F.S. reconoce apoyo de Rhenac Green Tec AG a través de este estudio. J.S. y B.B. recibieron fondos del DFG (SFB TR175).
Materiales
| Name | Company | Catalog Number | Comments |
| Climatic chamber equipped with LED panels | Rhenac Green Tec AG | These chambers are custom made. | |
| Spectrometer | OceanOptics | USB-650 | |
| Imaging PAM | Walz | IMAGING-PAM M-Series | There are several suitable models depending on the broader use. |
| Microscope+ 40x objective | Leica | DM1000 | Other companies also produce suitable microscopes. |
| Software ImageJ | Free download from website | ||
| Plant RNA extraction kit | Qiagen | 74903 | |
| Bioanalyser | Agilent | G2939BA | Needs an additional computer |
Referencias
- Arabidopsis Genome Initiative. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana. Nature. 408 (6814), 796-815 (2000).
- An, G., Watson, B. D., Chiang, C. C. Transformation of Tobacco, Tomato, Potato, and Arabidopsis thaliana Using a Binary Ti Vector System. Plant Physiology. 81 (1), 301-305 (1986).
- Schiml, S., Fauser, F., Puchta, H., Murata, M. . Chromosome and Genomic Engineering in Plants: Methods and Protocols. , 111-122 (2016).
- Rivero, L., Sanchez-Serrano, J. J., Salinas, J., et al. . Arabidopsis Protocols. , 3-25 (2014).
- Ubbens, J. R., Stavness, I. Deep Plant Phenomics: A Deep Learning Platform for Complex Plant Phenotyping Tasks. Frontiers in Plant Science. 8 (1190), (2017).
- Cosgrove, D. J. Rapid Suppression of Growth by Blue Light: OCCURRENCE, TIME COURSE, AND GENERAL CHARACTERISTICS. Plant Physiology. 67 (3), 584-590 (1981).
- Seiler, F., Soll, J., Bölter, B. Comparative Phenotypical and Molecular Analyses of Arabidopsis Grown under Fluorescent and LED Light. Plants. 6 (2), 24 (2017).
- Janda, M., et al. Growth and stress response in Arabidopsis thaliana, Nicotiana benthamiana, Glycine max, Solanum tuberosum and Brassica napus cultivated under polychromatic LEDs. Plant Methods. 11 (1), 31 (2015).
- Olle, M., Viršile, A. The effects of light-emitting diode lighting on greenhouse plant growth and quality. Agricultural and food science. 22 (2), 12 (2013).
- Lin, K. -. H., et al. The effects of red, blue, and white light-emitting diodes on the growth, development, and edible quality of hydroponically grown lettuce (Lactuca sativa L. var. capitata). Scientia Horticulturae. 150, 86-91 (2013).
- Castronuovo, D., et al. Light spectrum affects growth and gas exchange of common dandelion and purple coneflower seedlings. International Journal of Plant Biology. , (2016).
- Student, THE PROBABLE ERROR OF A MEAN. Biometrika. 6 (1), 1-25 (1908).
- Database, J. S. E. Essentials of Genetics. RNA-Seq. JoVE. , (2017).
- Klermund, C., et al. LLM-Domain B-GATA Transcription Factors Promote Stomatal Development Downstream of Light Signaling Pathways in Arabidopsis thaliana Hypocotyls. The Plant Cell. 28 (3), 646-660 (2016).
- Annunziata, M. G., et al. Getting back to nature: a reality check for experiments in controlled environments. J Exp Bot. 68 (16), 4463-4477 (2017).
- Palus, S. Japan's Massive Indoor Farm Produces 10,000 Heads of Fresh Lettuce Every Day. Smithonian.com. , (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados