Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Enfoque de un solo paso fabricación de polidimetilsiloxano microfluídicos canales de distintas secciones geométricas por procesos secuenciales aguafuerte mojada
En este artículo
Resumen
Varios métodos están disponibles para la fabricación de canales de secciones no rectangulares encajados dispositivos microfluídicos de polidimetilsiloxano. La mayoría de ellos implica fabricación multietapa y extensa alineación. En este trabajo, un enfoque de un solo paso se divulga para la fabricación de microfluidos canales de diferentes secciones geométricas por polidimetilsiloxano secuencial aguafuerte mojada.
Resumen
Materiales de polidimetilsiloxano (PDMS) son explotados sustancialmente para fabricar dispositivos microfluídicos, mediante técnicas de litografía blanda réplica del moldeo a presión. Canal modificado para requisitos particulares diseño diseños son necesarios para funciones específicas y funcionamiento integrado de dispositivos microfluídicos en numerosas aplicaciones biomédicas y químicas (p. ej., cultivo celular, biosensores, síntesis química y manejo de líquidos). Debido a la naturaleza de enfoques utilizando obleas de silicio con fotoresistencia capas estampadas por Fotolitografía como maestro moldes de moldeo, los canales de microfluidos comúnmente tienen secciones regulares de formas rectangulares con alturas iguales. Por lo general, están diseñados canales con varias alturas o diferentes secciones geométricas poseen funciones particulares y realizar en diversas aplicaciones de microfluídica (p. ej., hydrophoresis se utiliza para la clasificación de las partículas y en flujo continuo para separación de células de la sangre6,7,8,9). Por lo tanto, una gran cantidad de esfuerzo realizada en la construcción de canales con diferentes secciones a través de enfoques de múltiples pasos como Fotolitografía usando varias capas de la fotoresistencia y montaje de diferentes PDMS delgadas hojas. Sin embargo, estos enfoques varios pasos implican generalmente procedimientos tediosos y extenso instrumentación. Además, los dispositivos fabricados no pueden realizar constantemente y los datos experimentales dio como resultados pueden ser impredecibles. Aquí, se desarrolla un enfoque de un solo paso para la fabricación directa de canales de microfluidos con diferentes secciones geométricas a través de procesos de la aguafuerte mojada secuencial de PDMS, que introduce el grabador en canales de diseños de una sola capa previstas encajado en materiales PDMS. En comparación con los métodos existentes para la fabricación de canales de microfluídica PDMS con geometrías diferentes, el enfoque de un paso desarrollado significativamente puede simplificar el proceso para fabricar canales con secciones no rectangulares o varias alturas. En consecuencia, la técnica es una forma de construir canales de microfluidos complejo, que ofrece una solución de fabricación para el avance de sistemas microfluídicos innovador.
Introducción
Técnicas de microfluidos tienen llamado la atención en las últimas décadas debido a sus ventajas intrínsecas para una variedad de investigación biomédica y química y aplicaciones. Varias opciones de uso de material para la construcción de chips de microfluídica están disponibles hoy en día, tales como polímeros, cerámica y materiales de silicio. A lo mejor de nuestro conocimiento, entre los materiales de microfluidos, PDMS es el más común debido a sus propiedades materiales apropiados para diversas investigación microfluídica y aplicaciones, incluyendo su compatibilidad óptica y biológica con partículas, líquidos y los organismos vivos muy pequeños1,2,3,4,5. Además, las superficie química y estructura de propiedades mecánicas de materiales PDMS pueden ajustarse para facilitar estudios microelectromecánicos y mechanobiological mediante la aplicación de tales dispositivos microfluídicos con polímeros10, 11,12. En cuanto a la fabricación de dispositivos microfluídicos con patrones de diseño de canal, métodos de moldeo de réplica de litografía blanda se aplican generalmente a crear los canales de microfluidos utilizando sus correspondientes moldes maestro que se componen de Fotolitografía-patrón fotoresistencia capas y de sustratos de oblea de silicio12. Debido a la naturaleza de moldeo enfoques utilizando obleas de silicio con fotoresistencia con capas, los canales de microfluidos comúnmente tienen secciones regulares de formas rectangulares con alturas iguales.
Recientemente, los investigadores han hecho avances significativos en estudios biomédicos que tratan, por ejemplo, clasificación de partículas y células usando hydrophoresis, separar el plasma de la sangre y enriquecimiento de células blancas de la sangre mediante la aplicación de chips microfluídicos con canales de diferentes alturas o secciones geométricas6,7,8,9. Tal clasificación y separación de funciones de la microfluídica para aplicaciones biomédicas se realizan mediante la personalización de canales con diferentes secciones geométricas. Varios estudios se han dedicado a la fabricación de microfluidos canales con secciones de características diferentes de la geometría de fabricación de moldes maestros con específicos patrones superficiales de varias alturas o secciones no rectangulares. Estos estudios sobre la fabricación del molde incluyen técnicas como Fotolitografía paso múltiples, reflujo de la fotoresistencia y litografía de escala de grises13,14,15. Inevitablemente, las técnicas existentes implican patrones finamente o una alineación precisa de los procesos de fabricación de pasos múltiples, que pueden mejorar sustancialmente los niveles de complejidad de la fabricación correspondiente de microfluidos canales. Hasta ahora, ha habido varios intentos en procesos de fabricación solo paso para microfluidos canales de distintas secciones, pero las técnicas respectivas son altamente restringidas a formas específicas transversales de canales16.
En las últimas dos décadas, además de los métodos de moldeo para la fabricación de PDMS microfluídicos canales con secciones diferentes, técnicas para canales PDMS con características geométricas de la creación de patrones de grabado se han convertido en la fabricación de la opción en una variedad de aplicaciones de microfluídica. Por ejemplo, aguafuerte mojada PDMS se explota junto con PDMS de múltiples capas de la vinculación para la construcción de un dispositivo de cultura celular actuadas neumática de la microfluídica con reconstituido de órgano nivel de pulmón funciones17. El mojado PDMS, técnica de la aguafuerte se emplea junto con bastidor de PDMS en pocillos cilíndricos trabajados a máquina por los sistemas de control automatizado para la fabricación de 3D PDMS microneedle matrices18. Grabado seco PDMS se utiliza para hacer microestructuras PDMS como partes de actuadores electromecánicos micro19,20. Membranas porosas de PDMS con diseños diseñado poro también se fabrican a través de procesos de grabado seco21. La humedad y las técnicas de grabado seco pueden integrarse en patrones películas PDMS con formas geométricas designado22.
Sin embargo, las técnicas de grabado para la formación de PDMS canalizan estructuras con sección compleja formas no han aplicado comúnmente debido a sus limitaciones intrínsecas en la fabricación de microfluidos. En primer lugar, mientras que se han establecido las técnicas de aguafuerte mojada PDMS utilizando flujos laminares de productos químicos para la creación de canales de microfluídica de varias secciones, la formación de la sección de canal posterior es aún restringida debido a las características básicas de la aguafuerte química isotrópica procesos23. Además, aunque parece razonable espacio para el control de las geometrías de sección de canal en una fabricación de microfluidos con el seco PDMS grabado técnicas20, el tiempo de grabado requiere suele ser demasiado largo (en términos de horas) que práctico para la fabricación de chips de microfluídica. Además, la selectividad de grabado entre materiales PDMS y el enmascaramiento correspondiente fotoresistencia capas podrían ser baja en general, y las profundidades de grabado al agua fuerte resultó para los canales, por lo tanto, no son aceptables20.
En este trabajo, desarrollamos un enfoque de un solo paso para fabricar canales de microfluídica de diferentes secciones geométricas por procesos de aguafuerte mojada secuencial de PDMS (en lo sucesivo, SWEP). El SWEP comienzan con un dispositivo de microfluidos PDMS con canales de una sola capa. Con diseños surtidos diseño de los canales, canales de microfluidos con diferentes secciones geométricas de diversos tipos de fabricación puede lograrse a través de procesos secuenciales de la aguafuerte. El aguafuerte secuencial sólo necesita un grabador a introducirse en canales específicos de los diseños de una sola capa previstos encajados materiales PDMS. Comparado con procesos convencionales de fabricación de PDMS, el SWEP requiere sólo un paso más para fabricar canales de microfluídica de secciones no rectangulares o varias alturas. SWEP propuesto proporciona una manera sencilla y simple de la fabricación de canales de microfluidos con varias secciones a lo largo de la dirección del flujo, que puede simplificar significativamente los procesos de los métodos antes mencionados.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. fabricación de dispositivos microfluídicos con diseños de una sola capa canal
Nota: En este papel, la litografía suave método3 se adopta para la fabricación de dispositivos microfluídicos hechos de materiales PDMS, para demostrar cómo para la fabricación de canales con diversas secciones.
-
Creación de moldes maestros para una capa PDMS con características de diseño de la topología
- Diseño de configuraciones de canal de una capa PDMS para un solo proceso de grabado o aguafuerte en secuencia.
- Esbozo de las características de la topología invertida de la capa PDMS diseñada con un programa de dibujo asistido por ordenador.
- Entregar el archivo de dibujo a una instalación de fotolitografía para obtener un photomask modelada con las características de la topología invertido de alta precisión de los diseños de canal impresas sobre una transparencia24.
- Utilizar alcohol isopropílico (2-Propanol (IPA), ≥ 99,9%), acetona (Propan-2-one, ≥ 99.5%) y óxido tamponado etch (BOE, NH4F:HF (v/v) = 6:1) en la superficie de una oblea de silicio de 4 pulgadas para eliminar el polvo o residuos y evitar contaminaciones.
- Use aproximadamente 500 mL de agua desionizada para lavar la oblea de silicio para un pulido final y luego con gas nitrógeno para la oblea de lavado en seco.
- Coloque una fotoresistencia de tono negativo de alrededor de 20 g en la oblea. Luego vuelta cubrir la oblea en 500 rpm por 15 s y 2.000 rpm para 30 s para producir una capa de photoresist de alrededor de 75 μm de espesor.
Nota: Fotoresistencia diferentes espesores pueden lograrse utilizando materiales fotoresistentes tono negativo con números de producto diferentes y con capa de giro diferente, horneado y condiciones de desarrollo, según los manuales de usuario25,26. - Suave, hornee la oblea calentando sobre una placa caliente a 65 ° C por 3 min y luego a 95 ° C por 9 min.
- Puso la oblea en una máquina de alineador de fotomáscara junto con la transparencia estampada de paso 1.1.3 como una máscara.
- En la máquina del alineador, aplicar la luz ultravioleta (UV) en 300 mJ/cm2 para exponer la oblea por la transparencia.
- Después de la exposición a la luz UV, la oblea como poner sobre una placa caliente a 65 ° C por 2 min y luego a 95 ° C por 7 min post-exposición cueza al horno (PEB).
- Tras la Junta, fuertemente agita la oblea en un desarrollador de fotoresistencia de tono negativo, o colocar la oblea sumergida en un baño ultrasónico (37 kHz, potencia efectiva de 180 W) durante 7 minutos.
- Limpie la oblea entera otra vez con alcohol para eliminar cualquier desarrollador restante en la superficie de la oblea.
- Para evitar la indeseada de la vinculación, silanize la superficie de la oblea por poner la oblea junto con 100 μl de 97% silano (1H, 1H, 2H, 2H- perfluorooctyl-triclorosilano) en una placa de Petri en un desecador de 6 cm.
- Conecte el desecador a una bomba de vacío y la presión de vacío en 760 mmHg.
- A continuación, encienda la bomba para el interruptor de apagado y a continuación dejo la oblea para descansar en un vacío en el desecador durante 30 minutos a 15 minutos.
PRECAUCIÓN: El silano evaporado es extremadamente perjudicial para los seres humanos; así, la pasivación superficial oblea entera debe llevarse a cabo en una campana de humos. - Buscar la oblea silanizada, que atravesaba la pasivación superficial. Fijar la oblea en una placa de Petri para el uso adicional de 15 cm.
Nota: La oblea del modelado está lista para ser utilizado como molde para replicar los diseños de canal diseñado inversamente por materiales PDMS.
-
Fabricación de diseños de canal PDMS replicando la topología invertida en los moldes
- Poner la base PDMS (monómero) junto con el correspondiente catalizador (agente de curado) en una proporción de volumen de 10:1 en un vaso de plástico limpio y de un solo uso.
- Mezclar homogéneamente la mezcla prepolímero de PDMS (del paso 1.2.1) mediante el uso de un agitador eléctrico.
- Poner la taza en el desecador conectado a la bomba de vacío de 60 minutos para eliminar las posibles burbujas atrapadas en la mezcla PDMS.
- Vierta 20 g (sección 2) o 8 g (para la sección 3) de la mezcla de prepolímero de PDMS en la parte superior del molde maestro (hecho en el paso 1.1) con las características de la topología invertida de los planos de diseño de canal y eliminar cualquier posible burbuja incrustado en los materiales PDMS utilizando t desecador de (para 60 min).
- Poner el molde con la mezcla PDMS en una estufa a 60 ° C por 4 h para curar los materiales prepolímero líquidos silicón-basado.
- Después de enfriar la oblea junto con PDMS a temperatura ambiente durante aproximadamente 20 minutos, quitar el PDMS curado del molde con un bisturí y pinzas.
- Adaptar la capa PDMS separada a la cubierta de un área (aproximadamente 6 x 6 cm2 de sección 2 o 2 x 7,5 cm2 de sección 3) los diseños de canal entero con un bisturí.
- Crear puertos de acceso de canal (entradas y salidas) con un punch de biopsia de 1,5 mm de diámetro.
Nota: Los números y las posiciones de las entradas y salidas están diseñadas en base a los procesos de la aguafuerte para la fabricación de canales específicos microfluídicos. - Verter 30 g de la mezcla de prepolímero de PDMS en una placa Petri y luego eliminar cualquier posible burbuja incrustado en los materiales PDMS usando el desecador (para 60 min).
- Poner el plato Petri con la mezcla PDMS en una estufa a 60 ° C por más de 4 h para curar los materiales prepolímero líquidos.
- Después de enfriar la placa de Petri junto con PDMS a temperatura ambiente durante aproximadamente 20 minutos, quitar el PDMS curado del plato con un bisturí y pinzas.
- Con un bisturí, adaptar la capa PDMS independiente sin ningunas características de dimensiones iguales a las de la mencionada capa PDMS (aproximadamente 6 x 6 cm2 de sección 2 o 2 x 7,5 cm2 de sección 3).
- Activar las superficies de ambas capas PDMS (hechos en los pasos 1.2.7 y 1.2.12) con los planos de diseño de canal y sin ningunas características exponiendo los materiales PDMS superior al plasma de oxígeno en una máquina de tratamiento de superficies en 90 W 40 s.
- Bond el 2 PDMS capas haciendo contacto entre sus superficies tratadas después de la activación superficial del plasma de oxígeno. A continuación, dejo las capas PDMS de servidumbre en un horno a 60 ° C durante más de 30 minutos.
Nota: no hay límite de tiempo para salir de las capas PDMS de servidumbre en el horno. - Después de consolidado el 2 capas PDMS se han enfriado, recortar el exceso de materiales PDMS de dispositivo fabricado para un posterior montaje experimental.
2. el enfoque de un solo paso para fabricación de PDMS microfluídicos canales de diferentes secciones
Nota: Para caracterizar el PDMS mojado tipo de grabado, un dispositivo de microfluidos con un canal de una sola capa y recto de las formas rectangulares sugiere ser explotados para la identificación de tasas de grabado específico correspondiente a determinados valores experimentales.
-
Caracterización experimental de PDMS mojado grabado
- Preparar una solución de reactivo mediante la mezcla de fluoruro de tetra-n-butilamonio (TBAF, una solución de 1 M en tetrahidrofurano (THF)) con el 1-metil-2-pyrrolidinone (NMP) a una velocidad de v: v = 1:10.
Nota: NMP es capaz de disolver eficientemente residuos químicos inducidos por los grabadores. En general, materiales PDMS se hinchan ligeramente por el NMP, y los dispositivos de microfluidos PDMS son todavía capaces de preservar sus formas, volúmenes y las condiciones del sello. - Dibujar los etchants TBAF/NMP mezclado en una jeringa de 10 mL conectada a una aguja Roma de acero inoxidable (16 G).
- Configurar una bomba de la jeringuilla como regulador de los líquidos basados en la presión en los canales.
- Conecte el embotado agujas de las jeringas con la solución de reactivo al puerto del canal del citado dispositivo simple y guiar al puerto respectivo de la salida del tubo a un contenedor de residuos como se muestra en la figura 1.
- Funcionar la bomba de la jeringuilla con la jeringa que contiene la solución mixta de grabador TBAF/NMP en una 150 μL/min velocidad de flujo para la caracterización de los PDMS mojado grabado.
- Utilizar vistas microscópicas de campo brillante y asegúrese de que el canal grabado a lo largo de la dirección de flujo tiene una anchura uniforme, por lo tanto confirmar que el volumen de proporción de los grabadores y el caudal de reactivo son adecuados.
- Capturar las imágenes de series de tiempo del canal transversal bajo un microscopio invertido con 4 aumentos durante el PDMS proceso de grabado.
- Analizar las imágenes almacenadas mediante la aplicación de la función de medición básica en un análisis 2D del programa de procesamiento de imagen para recoger una secuencia temporal de los números para el ancho de canal durante el mojado grabado proceso de materiales de PDMS.
- Evaluar las tasas de grabado de la serie de tiempo a través de la ecuación se muestra en la figura 2, que está dividiendo el 50% del cambio de ancho de canal (ΔW / 2) por la duración de la aguafuerte de PDMS (t).
- Realizar una regresión lineal de los puntos de datos para calcular un total tasa de grabado de los etchants TBAF/NMP mezclado con el volumen específico cociente de 1:10 para los materiales PDMS de mezcla como se muestra en la figura 2.
- Preparar una solución de reactivo mediante la mezcla de fluoruro de tetra-n-butilamonio (TBAF, una solución de 1 M en tetrahidrofurano (THF)) con el 1-metil-2-pyrrolidinone (NMP) a una velocidad de v: v = 1:10.
-
PDMS alternativamente mojado aguafuerte para la fabricación de microfluidos canales de distintas secciones geométricas
- Diseño de un arreglo de las entradas del grabador para el diseño de canal PDMS de una sola capa que sirve los correspondientes procesos de la aguafuerte en secuencia, por lo que se puede fabricar un tipo de canal específico de diferentes formas de sección transversales como se muestra en la figura 3 .
- Siga los procedimientos descritos en los pasos 2.1.1 - 2.1.7 para el mojado PDMS grabado de enfoque.
Nota: El caudal se define como 50 μL/min. - Mientras que los grabadores TBAF/NMP están fluyendo, inspeccionar los canales grabados bajo el microscopio para ver si existen problemas importantes tales como una notable cantidad de burbujas, un restante de varios residuos químicos inducidos por los grabadores, una fuga de los grabadores, o un flujo de grabadores en un plano inclinado.
- Observar la variación del espesor de la pared del canal de microfluidos por microscopia invertida y mojado aguafuerte el proceso para garantizar la geometría del canal apropiado es el tiempo.
3. el diseño de un mezclador de microfluidos
Nota: Un diseño de la mezcladora de microfluidos que eficientemente puede mezclar 2 líquidos diferentes se demuestra aquí para mostrar una aplicación ventajosa de microfluidos canales con diferentes secciones.
-
Fabricación de un mezclador de microfluidos con secciones de diferentes canales
- Hacer un dispositivo PDMS con un canal microfluídico monocapa del diseño que se muestra en la figura 4 por la réplica de litografía suave moldeado técnica (sección 2).
- En el diseño de canal microfluídico monocapa, introducir la solución de reactivo TBAF/NMP preparada siguiendo el procedimiento descrito en el paso 2.1.1 desde el puerto marcado como "salida" con un caudal de 20 μl/min en la figura 4.
- Observar la variación de espesor de pared de microfluidos canal bajo el microscopio y el tiempo mojado aguafuerte el proceso para garantizar las geometrías de canal adecuado según lo representado en la figura 5 se.
-
Caracterización experimental de la mezcladora de microfluidos
- Después se realiza el canal microfluídico con secciones de diferentes formas en un patrón alternativo, 2 diferentes fluidos incluyendo una solución de sodio de la fluoresceína de sal con una concentración de 50 μg/mL y agua destilación a 2 canales separados a un 20 μl/min. tasa de flujo.
- Fluorescencia imágenes de microscopio del canal en la vista superior en las posiciones marcadas como A, B, C y D bajo un microscopio invertido (4 aumentos) para los 2 mezcladores con uniforme (antes grabado) y diferentes geométricas secciones (después de 2 h de SWEP), respectivamente) Figura 6).
Nota: Las imágenes de microscopio de fluorescencia se toman mientras que ocurren los flujos estables, en el punto de tiempo de 5 minutos, contados a partir de los momentos de comienzo de la mezcla a través de los canales del mezclador. - Analizar las imágenes fluorescentes mediante un programa de procesamiento de imágenes para estimar la correspondiente mezcla números de eficiencia definidos por la mezcla residual (Señor, 0.5 = mezclar, 0 = completamente mezclado) en la siguiente ecuación27, 28:
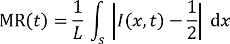
Aquí,
t es el tiempo de grabado,
L es el ancho de canal en una posición determinada de interés,
Es un segmento de línea a través del canal en la posición, y
Es la distribución de intensidad de fluorescencia sobre S t. - Trazar la distribución de intensidad de fluorescencia sobre S a través del canal en las posiciones marcadas como A, B, C y D para 2 mezcladores con uniforme (antes grabado) y diferentes geométricas secciones (después de 2 h de SWEP), respectivamente. Estimar al Señor correspondiente como se muestra en la figura 6.
Access restricted. Please log in or start a trial to view this content.
Resultados
Recientemente, se han realizado un gran número de estudios sobre la fabricación de dispositivos microfluídicos con canales de diferentes secciones por réplica de litografía moldeo13,14,15 y PDMS grabado técnicas17 , 18 , 19 , 20 , 21
Access restricted. Please log in or start a trial to view this content.
Discusión
En las últimas décadas, ha ofrecido la microfluídica prometedores medios por los cuales pueden ser plataformas experimentales para la investigación química y biomédica sistemáticamente construcción1,2,3,4, 5. Las plataformas presentan también sus capacidades de investigación de varias funciones celulares in vivo bajo condiciones del microam...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que declarar.
Agradecimientos
Los autores reconocen con gratitud el apoyo proporcionado por los institutos Nacional de investigación salud (INDH) en Taiwan bajo la innovadora investigación Grant (IRG) (EX106-10523EI), el Ministerio de Taiwán de la ciencia y tecnología (más 104-2218-E-032-004, 104 - 2221 - E-001-015-MY3, 105-2221-E-001-002-MY2, 105-2221-E-032-006, 106-2221-E-032-018-MY2) y el Premio de Academia Sinica carrera desarrollo. Los autores desean agradecer a Heng Hua Hsu por revisión del manuscrito.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 1-Methyl-2-Pyrrolidinone | Tedia, Fairfield, OH | ME-1962 | NMP |
| 10 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302151 | |
| 150 mm Petri dish | Dogger Science | DP-43151 | |
| 1H,1H,2H,2H- Perfluorooctyltrichlorosilane | Alfa Aesar, Ward Hill, MA | L16606 | 97 % silane |
| 4'' Silicon Dummy Wafer | Wollemi Technical, Taoyuan, Taiwan | - | |
| Acetone | ECHO Chemical, Miaoli, Taiwan | AH3102-000000-72EC | |
| AG Double Expose Mask Aligner | M&R Nano Technology, Taoyuan, Taiwan | AG500-4D-D-V-S-H | |
| Biopsy Punch | Miltex, Plainsboro, NJ | 33-31 | |
| Blunt Needle | Jensen Global, Santa Barbara, CA | Gauge 16 | |
| Buffered Oxide Etch | ECHO Chemical, Miaoli, Taiwan | PH3101-000000-72EC | |
| Desicattor | A-VAC Industries, Anaheim, CA | 35.10001.01 | |
| Fluorescein Sodium Salt Water | Sigma-Aldrich Co., St Louis, MO | F6300 | |
| ImageJ | National Institutes of Health, Bethesda, MD | Ver. 1.51 | Imaging Processing Program |
| Inverted Fluorescence Microscope | Leica Microsystems, Wetzlar, Germany | DMI 6000 B | |
| Isopropyl Alcohol (IPA) | ECHO Chemical, Miaoli, Taiwan | CMOS112-00000-72EC | |
| Leica Application Suite | Leica Microsystems GmbH | LAS X | |
| MATLAB | MathWorks, Natick, MA | R2015b | Programming for MR evaluation |
| Mechanical Convention Oven | ThermoFisher Scientific,Waltham, MA | Lindberg Blue M MO1450C | |
| Plasma Tretment System | Nordson MARCH, Concord CA | PX-250 | Oxygen plasma surface treatment |
| Polydimehtylsiloxane (PDMS) | Dow Corning, Midland, MI | SYLGARD 184 | |
| Polyethylene Tubing | Becton-Dickinson and Company, Sparks, MD | 427446 | PE 205, 10' |
| Spin Coater | ELS Technology, Hsinchu, Taiwan | ELS 306MA | |
| Negative Tone Photoresist | MicroChem, Westborough, MA | SU-8 2050 | |
| Negative Tone Photoresist Developer | MicroChem, Westborough, MA | Y020100 | SU-8 Developer |
| Surgical Blade | Feather, Osaka, Japan | 5005093 | PDMS cutting |
| Syringe Pump | Chemyx, Houston, TX | Fusion 400 | |
| Tetra-n-butylammonium Fluoride (TBAF) | Alfa Aesar, Ward Hill, MA | A10588 |
Referencias
- Tung, Y. -C., et al. Optofluidic Detection for Cellular Phenotyping. Lab on a Chip. 12, 3552-3565 (2012).
- Lu, Y., Yang, L., Wei, W., Shi, Q. Microchip-based Single-cell Functional Proteomics for Biomedical Applications. Lab on a Chip. 17, 1250-1263 (2017).
- Jensen, K. F., Reizman, B. J., Newman, S. G. Tools for Chemical Synthesis in Microsystems. Lab on a Chip. 14, 3206-3212 (2014).
- Chang, C. -W., et al. A Polydimethylsiloxane-polycarbonate Hybrid Microfluidic Device Capable of Generating Perpendicular Chemical and Oxygen Gradients for Cell Culture Studies. Lab on a Chip. 14, 3762-3772 (2014).
- Mosadegh, B., et al. Integrated Elastomeric Components for Autonomous Regulation of Sequential and Oscillatory Flow Switching in Microfluidic Devices. Nature Physics. 6, 433-437 (2010).
- Choi, S., Park, J. -K. Tuneable Hydrophoretic Separation Using Elastic Deformation of Poly(Dimethylsiloxane). Lab on a Chip. 9, 1962-1965 (2009).
- Choi, S., Song, S., Choi, C., Park, J. -K. Microfluidic Self-Sorting of Mammalian Cells to Achieve Cell Cycle Synchrony by Hydrophoresis. Analytical Chemistry. 81, 1964-1968 (2009).
- VanDelinder, V., Groisman, A. Separation of Plasma from Whole Human Blood in a Continuous Cross-Flow in a Molded Microfluidic Device. Analytical Chemistry. 78, 3765-3771 (2006).
- VanDelinder, V., Groisman, A. Perfusion in Microfluidic Cross-Flow: Separation of White Blood Cells from Whole Blood and Exchange of Medium in a Continuous Flow. Analytical Chemistry. 79, 2023-2030 (2007).
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Material Science. 28, 153-184 (1998).
- Mello, A. Plastic Fantastic? Lab on a Chip. 2, 31N-36N (2002).
- Choi, S., Park, J. -K. Two-step Photolithography to Fabricate Multilevel Microchannels. Biomicrofluidics. 4, 046503(2010).
- Zhong, K., Gao, Y., Li, F., Zhang, Z., Luo, N. Fabrication of PDMS Microlens Array by Digital Maskless Grayscale Lithography and Replica Molding Technique. Optik. 125, 2413-2416 (2013).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. Journal of Visualized Experiments. (119), e55276(2017).
- Lai, D., et al. Simple Multi-level Microchannel Fabrication by Pseudo-grayscale Backside Diffused Light Lithography. RSC Advances. 3, 19467-19473 (2013).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328, 1662-1668 (2010).
- Deng, Y. -L., Juang, Y. -J. Polydimethyl Siloxane Wet Etching for Three-Dimensional Fabrication of Microneedle Array and High-Aspect-Ratio Micropillars. Biomicrofluidics. 8, 026502(2014).
- Tung, Y. -C., Kurabayashi, K. Nanoimprinted Strain-controlled Elastomeric Gratings for Optical Wavelength Tuning. Applied Physics Letters. 86, 161113(2005).
- Tung, Y. -C., Kurabayashi, K. A Single-Layer PDMS-On-Silicon Hybrid Microactuator with Multi-Axis Out-Of-Plane Motion Capabilities-Part II: Fabrication and Characterization. Journal of Microelectromechanical Systems. 14, 558-566 (2005).
- Chen, W., Lam, R. H. W., Fu, J. Photolithographic Surface Micromachining of Polydimethylsiloxane (PDMS). Lab on a Chip. 12, 391-395 (2012).
- Balakrisnan, B., Patil, S., Smela, E. Patterning PDMS Using a Combination of Wet and Dry Etching. Journal of Micromechanics and Microengineering. 19, 047002(2009).
- Takayama, S., et al. Topographical Micropatterning of Poly(dimethylsiloxane) Using Laminar Flows of Liquids in Capillaries. Advanced Materials. 13, 570-574 (2001).
- Friend, J., Yeo, L. Fabrication of Microfluidic Devices Using Polydimethylsiloxane. Biomicrofluidics. 4, 026502(2010).
- NANO SU-8 2000 Negative Tone Photoresist formulations 2002-2025. , MicroChem Corporation. Newton, MA. Available from: https://www.seas.upenn.edu/~nanosop/documents/SU8_2002-2025.pdf (2000).
- NANO SU-8 2000 Negative Tone Photoresist formulations 2035-2100. , MicroChem Corporation. Newton, MA. Available from: https://www.seas.upenn.edu/~nanosop/documents/SU8_2035-2100.pdf (2000).
- Hardt, S., Schönfeld, F. Laminar Mixing in Different Interdigital Micromixers: II. Numerical Simulations. AIChE Journal. 49, 578-584 (2003).
- Hessel, V., Löwe, H., Schönfeld, F. Micromixers-A Review on Passive and Active Mixing Principles. Chemical Engineering Science. 60, 2479-2501 (2005).
- Damiati, S., Kompella, U., Damiati, S., Kodzius, R. Microfluidic Devices for Drug Delivery Systems and Drug Screening. Genes. 9, 103(2018).
- Wang, C. -K., et al. Single Step Sequential Polydimethylsiloxane Wet Etching to Fabricate a Microfluidic Channel with Various Cross-Sectional Geometries. Journal of Micromechanics and Microengineering. 27, 115003(2017).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados