Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Fabricación de un hidrogel de derivados de matriz extracelular renal corteza
En este artículo
Resumen
Aquí presentamos un protocolo para fabricar un riñón corteza extracelular derivado de matriz hidrogel para mantener la composición de la matriz extracelular (ECM) riñón nativo estructurales y bioquímicos. Se describen el proceso de fabricación y sus aplicaciones. Finalmente, se discute una perspectiva sobre el uso de este hidrogel para apoyar la bioingeniería y la regeneración celular y tejido renal específica.
Resumen
Matriz extracelular (ECM) proporciona importantes señales biofísicas y bioquímicas para mantener la homeostasis del tejido. Hidrogel sintético actual ofrece soporte mecánico robusto en vitro cultura de célula pero carecen de la composición de proteína y de ligando necesaria para provocar el comportamiento fisiológico de las células. Este manuscrito describe un método de fabricación de un hidrogel de ECM-derivado de corteza renal con robustez mecánica adecuada y apoyo composición bioquímica. El hidrogel es fabricado por la homogeneización y solubilización de corteza de riñón humano decellularized ECM mecánicamente. La matriz conserva proporciones de riñón nativo corteza ECM proteínas permitiendo también gelificación a dureza mecánica fisiológica. El hidrogel es un sustrato al que riñón células procedentes de la corteza pueden ser mantenidas bajo condiciones fisiológicas. Además, se puede manipular la composición hidrogel para modelar un ambiente enfermo que permite el estudio de enfermedades renales.
Introducción
Matriz extracelular (ECM) proporciona importantes señales biofísicas y bioquímicas para mantener la homeostasis del tejido. La composición molecular compleja regula propiedades estructurales y funcionales del tejido. Proteínas estructurales proporcionan células con conciencia espacial y permitan la adhesión y la migración1. Consolidados ligandos interactúan con receptores de superficie celular para controlar el comportamiento de la célula2. Riñón ECM contiene una gran cantidad de moléculas cuya composición y estructura varía según la localización anatómica, etapa de desarrollo y enfermedad estado3,4. Recapitulando la complejidad de la ECM es un aspecto clave en el estudio de las células renales derivadas in vitro.
Anteriores intentos de reproducir a microambientes de ECM se han centrado en decellularizing todo tejido para crear andamios capaces de recelularización. Descelularización se ha realizado con detergentes químicos como sulfato dodecyl de sodio (SDS) o detergentes no iónicos, y utiliza el órgano entero perfusión o inmersión y agitación métodos5,6,7 ,8,9,10,11,12,13. Los andamios presentados preservar los indicios estructurales y bioquímicos encontrados en tejido nativo ECM; Además, recelularización con las células donantes-específicas tiene importancia clínica en cirugía reconstructiva14,15,16,17,18, 19. sin embargo, estos andamios carecen de flexibilidad estructural y, por tanto, incompatibles con muchos dispositivos actuales utilizados para estudios en vitro . Para superar esta limitación, muchos grupos han procesado más decellularized ECM en hidrogeles20,21,22,23,24. Estos hidrogeles son compatibles con bioink y moldeo por inyección y eluden micrómetro escala espacial las limitaciones que decellularized lugar de andamios en las células. Además, composición molecular y ratios encontradas ECM nativa se conservan3,25. Aquí se demuestra un método para fabricar un hidrogel que se deriva de la corteza renal ECM (kECM).
El propósito de este protocolo es producir un hidrogel que se replica el microambiente de la región cortical del riñón. Tejido de la corteza renal es decellularized en una solución de SDS 1% bajo agitación constante a eliminar la materia celular. SDS se utiliza comúnmente para decellularize tejido debido a su capacidad de eliminar rápidamente el material celular inmunológica6,7,9,26. El kECM es entonces objeto de homogeneización mecánica y liofilización5,6,9,11,26. Solubilización en un ácido fuerte con pepsina da lugar a un hidrogel final solución20,27. Proteínas de kECM nativas que son importantes para estructural soporte y señal de transducción se conservan3,25. El hidrogel se puede también cuajó a dentro de un orden de magnitud de riñón humano nativo corteza28,29,30. Esta matriz provee un ambiente fisiológico que se ha utilizado para mantener la quietud de las células específicas del riñón en comparación con hidrogeles de otras proteínas de la matriz. Además, la composición de la matriz puede ser manipulada, por ejemplo, mediante la adición de colágeno-I, a los ambientes de la enfermedad modelo para el estudio de la fibrosis renal y otras enfermedades de riñón31,32.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Los riñones humanos se aislaron por LifeCenter Northwest siguiendo pautas éticas establecidas por la Asociación de organizaciones de adquisiciones órgano. Este protocolo sigue animal cuidado y célula pautas cultura por la Universidad de Washington.
1. preparación del tejido de riñón humano
- Preparación de solución de descelularización
- Esterilizar un vaso de precipitado de 5000 mL y una barra de agitación de 70 x 10 mm.
- 1: 1000 (peso: volumen) sodio dodecil sulfato (SDS) en agua desionizada en autoclave en el vaso de la mezcla. Dejar la solución en una placa de agitación en aproximadamente 200 rpm por 24 h o hasta que el SDS se disuelva completamente.
Nota: Típicamente, 2500 mL de la solución de SDS 1% es suficiente para decellularize un solo riñón humano. - Transferir la solución a un filtro de vacío estéril de 500 mL y filtrar en contenedores herméticos esterilizados.
- Procesamiento de tejido renal
- Lavado y autoclave un par de pinzas, pinza hemostática dos pinzas, un par de servicios generales grado tijeras, dos asas de la hoja de bisturí, un vaso de precipitados de 1000 mL cubierto con papel de aluminio y una barra de agitación de 36 x 9 mm.
- Línea de una campana de cultivo de tejidos con Empapador. Coloque el vaso, un plato de cultivo estériles para tejidos (150 x 25 mm) y el órgano riñón entero en la campana. Llene el vaso con 500 mL de solución al 1% SDS.
Nota: Los riñones humanos fueron recibidos en el hielo de LifeCenter NorthWest. - Coloque el riñón en la placa de cultivo de tejido estéril (figura 1A). Retire toda la grasa perirrenal por afeitar ligeramente alrededor de la cápsula renal con un bisturí (figura 1B).
- Haga una incisión superficial de 8-10 cm con el bisturí, sólo lo suficientemente profunda como para romper la cápsula renal sin dañar el tejido de la corteza subyacente, en el extremo superior del riñón. Retire la cápsula renal por pelar lejos el tejido de corteza con dos mordazas de la pinza (figura 1).
- Biseca el riñón a lo largo del plano coronal utilizando el bisturí a lo largo de la parte lateral del riñón (figura 1). Aislar el tejido de la corteza de ambos hemisferios por talla hacia fuera de la región medular con el bisturí (Figura 1E) y cortar el tejido de la corteza en trozos de 0,5 cm3 (Figura 1F). Retire cualquier vasos visibles.
- Aislamiento de la matriz extracelular
- En una campana de cultivo de tejidos, llene un vaso de precipitados de 1000 mL con 500 mL de solución al 1% SDS. Coloque la barra de tejido y revuelva de corteza picada en el vaso de precipitados que contenga solución de SDS. Cubrir el vaso con papel de aluminio esterilizado y coloque en una placa de agitación en aproximadamente 400 rpm fuera de la campana de cultivo de tejidos.
- Después de que el tejido de la corteza ha sido en la placa de agitación durante 24 h, poner el vaso en una campana de cultivo de tejidos y añadir un filtro de 40 μm células estériles con malla de nylon. Llene un vaso de precipitados de 1000 mL separadas con 200 mL de lejía y colóquelo en la campana de cultivo de tejidos.
- Pipetear la solución de SDS a través de la coladera de la célula en el vaso de precipitados que contenga blanqueador. Pipetear a toda solución de SDS hasta que queden sólo tejido decellularized y el filtro de la célula en el vaso.
Nota: El filtro de la celda debe impedir que cualquier tejido siendo eliminados durante la aspiración de la solución. - Deje el filtro de la célula en el vaso y llénelo con 500 mL de solución fresca de SDS. Cubrir el vaso con el mismo papel de aluminio y coloque en un plato mezclar a la misma velocidad que antes.
- Repita los pasos 1.3.1-1.3.3 cada 24 horas con solución fresca de SDS para un total de cinco días.
- Tejido de enjuague decellularized con autoclave DI agua cada 24 h durante 3 días total, siguiendo la técnica se indica en pasos 1.3.1-1.3.3.
- Tejido decellularized de enjuague con agua de grado de cultura de célula cada 24 h durante 2 días total, siguiendo la técnica se indica en pasos 1.3.1-1.3.3.
- Repita los pasos 1.3.1-1.3.2. Transferir el tejido decellularized (denominado kECM desde este punto a) en una 30 mL autónomo tubo cónico y llenarlo con agua de grado cultivo celular hasta que el tejido quede sumergido.
2. fabricación de solución Stock de hidrogel
- Proceso mecánico de tejido decellularized
- En una campana de cultivo de tejidos, mecánicamente homogeneizar la kECM dentro del tubo cónico con un homogeneizador de tejidos por 2 min.
Nota: KECM homogeneizada debe parecerse una solución opaca sin pedazos visibles de ECM. - Sumerja el tubo cónico que contiene kECM en nitrógeno líquido hasta ebullición que rodea el tubo ya no persiste. Guarde el kECM en-4 ° c durante la noche.
- En una campana de cultivo de tejidos, mecánicamente homogeneizar la kECM dentro del tubo cónico con un homogeneizador de tejidos por 2 min.
- Liofilización de tejido congelado decellularized
- Afloje ligeramente la tapa del tubo cónico para permitir intercambio del gas y coloque el tubo en una máquina de liofilización. Liofilizar el kECM durante tres días o hasta que se asemeja a un fino polvo blanco. Tienda a-4 ° c.
- Digestión química y solubilización de gel
- Autoclave de un vial de centelleo de 20 mL y tapa, una barra de agitación de 15.9 x 7.9 mm y un par de pinzas de punta fina.
- Pesar el kECM liofilizado y calcular el volumen de ácido clorhídrico y la masa de pepsina necesaria para solubilizar el kECM a una solución de 3% (30 mg/mL) usando las siguientes ecuaciones, donde m lapepsina es la masa de pepsina, tejido de m es la masa de tejido liofilizado y VHCl es el volumen de HCl N 0.01:
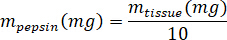
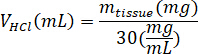
- En una campana de cultivo de tejidos, agrega pepsina gástrica porcina, 0.01 N HCl y la barra de agitación para el vial de centelleo y dejarlo en un plato mezclar a aproximadamente 500 rpm hasta que se disuelva la pepsina. KECM liofilizado de transferencia al vial de centelleo y dejar la solución en una placa de agitación a aproximadamente 500 rpm durante tres días.
3. hidrogel gelificación
- Preparación del hidrogel de riñón ECM
- El hidrogel del gel mediante la mezcla de la solución madre de hidrogel de kECM con 1 N NaOH, 10 x suplemento de medios de comunicación (M199) y medios de cultivo de células. Mantenga todas las soluciones en el hielo.
Nota: Gel Final concentraciones de 7,5 mg/mL fueron utilizadas para el cultivo celular. 1 mL de gel de kECM era suficiente para experimentos de cultivo celular presentados. - Determinar el volumen de gel realizable kECM producido y el volumen de hidrogel kECM stock necesario utilizando la siguiente ecuación, donde Vfinal es el volumen de gel creado, VkECM común es el volumen de hidrogel kECM stock necesario, Cacciones kECM es la concentración de la hidrogel de acción kECM, y Cfinal es la concentración del gel final:
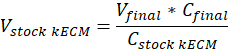
- Determinar el volumen de neutralizar reactivos necesarios utilizando las siguientes ecuaciones, donde VNaOH es el volumen de 1 N NaOH, 10 X de V es el volumen de M199 suplen 10 medios X y V1 X es la volumen de medios de cultivo celular:
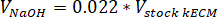
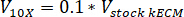
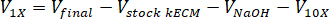
- En una campana de cultivo de tejidos, pipetear los reactivos neutralizantes (NaOH M199 y medios de cultivo celular) en un estéril 30 mL autónomo tubo cónico. Mezcle la solución de reactivo neutralizante con una microspatula.
- Utilice una jeringa estéril de 1 mL para transferir el volumen apropiado de hidrogel kECM acciones para la solución de reactivo neutralizante. Utilice un microspatula para mezclar suavemente la solución hasta obtener una homogénea en solución del color del hidrogel.
Nota: Evitar la introducción de burbujas de aire agitando lentamente y suavemente. - Para incorporar las células en el hidrogel kECM, reste 10 μl de medio de cultivo celular (V1 X) de los cálculos de volumen de solución neutralizante en paso 3.1.1.3.
- Suspender las células en 10 μl de medio de cultivo celular. Determinar el número de células suspensión utilizando la siguiente ecuación, donde #células implica el número de células en suspensión yfinal de V es el volumen de gel creado:
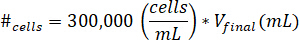
Nota: 300.000 células/mL es la concentración de células en el gel de kECM. - Pipetear 10 μl de solución celular suspendido en el gel de kECM final después de la solución kECM se ha mezclado con una solución de reactivo que neutraliza. Agitar la solución con un microspatula hasta que las células se distribuyen uniformemente.
- Suspender las células en 10 μl de medio de cultivo celular. Determinar el número de células suspensión utilizando la siguiente ecuación, donde #células implica el número de células en suspensión yfinal de V es el volumen de gel creado:
- El hidrogel del gel mediante la mezcla de la solución madre de hidrogel de kECM con 1 N NaOH, 10 x suplemento de medios de comunicación (M199) y medios de cultivo de células. Mantenga todas las soluciones en el hielo.
- Utilice una jeringa de 1 mL para llenar un dispositivo de la cultura de célula deseada con el hidrogel de kECM.
- Permita que el gel fijar a 37 ° c durante 1 hora antes de transferir o células de la galjanoplastia.
Access restricted. Please log in or start a trial to view this content.
Resultados
El hidrogel de kECM proporciona una matriz para el cultivo celular de riñón con composición química similar como el microambiente del riñón nativo. Para fabricar el hidrogel, tejido de la corteza renal es mecánicamente aislada de un órgano riñón entero y picado (figura 1). Descelularización con un detergente químico (figura 2A.1-A.3) seguido por enjuagues con agua para eliminar partículas de detergen...
Access restricted. Please log in or start a trial to view this content.
Discusión
Matrices proporcionan importantes señales mecánicas y químicas que rigen el comportamiento de la célula. Hidrogeles sintéticos son capaces de apoyar complejo dibujo 3 dimensiones pero no proporciona las señales extracelulares diversas encontradas en microambientes matriz fisiológica. Hidrogeles derivados de ECM nativa son materiales ideales para los estudios tanto en vivo como en vitro . Estudios previos han utilizado hidrogeles decellularized de ECM para recubrir biomateriales sintéticos para e...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean reconocer la Lynn y Mike Garvey imagen laboratorio del Instituto de células madre y medicina regenerativa y LifeCenter NorthWest. También les gustaría reconocer el apoyo financiero de subvenciones de los institutos nacionales de salud, TR000504 UH2/UH3 (a J.H.) y DP2DK102258 (a Y.Z.), beca de formación de NIH T32 DK0007467 (a R.J.N.) y un regalo sin restricción de los centros de riñón de noroeste a la Instituto de investigación del riñón.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Preparation of Kidney Tissue | |||
| 5000 mL Beaker | Sigma-Aldrich | Z740589 | |
| Sodium Dodecyl Sulfate (SDS) | Sigma-Aldrich | 436143 | |
| Sterile H2O | Autoclaved DI H2O | ||
| Stir Bar (70 x 10 mm) | Fisher Science | 14-512-128 | |
| 500 mL Vacuum Filter | VWR | 97066-202 | |
| Stir Plate | Sigma-Aldrich | CLS6795420D | |
| 1000 mL Beaker | Sigma-Aldrich | CLS10031L | |
| Forceps | Sigma-Aldrich | F4642 | Any similar forceps may be used |
| Scissor-Handle Hemostat Clamp | Sigma-Aldrich | Z168866 | |
| Dissecting Scissors | Sigma-Aldrich | Z265977 | |
| Scalpel Handle, No. 4 | VWR | 25859-000 | Any similar scalpel handle may be used |
| Scalpel Blade, No. 20 | VWR | 25860-020 | Any similar scalpel blade may be used |
| Stir Bar (38.1 x 9.5 mm) | Fisher Science | 14-513-52 | |
| Absorbent Underpad | VWR | 82020-845 | |
| Petri Dish (150 x 25 mm) | Corning | 430597 | |
| Autoclavable Biohazard Bag | VWR | 14220-026 | |
| Sterile Cell Strainer (40 um) | Fisher Science | 22-363-547 | |
| Cell Culture Grade Water | HyClone | SH30529.03 | |
| 30 mL Freestanding Tube | VWR | 89012-778 | |
| Fabrication of ECM Gel | |||
| Tissue Homogenizer Machine | Polytron | PCU-20110 | |
| Freeze Dryer | Labconco | 7670520 | |
| 20 mL Glass Scintillation Vials and Cap | Sigma-Aldrich | V7130 | |
| Stir Bar (15.9 x 8 mm) | Fisher Science | 14-513-62 | |
| Pepsin from Porcine Gastric Mucosa | Sigma-Aldrich | P7012 | |
| 0.01 N HCl | Sigma-Aldrich | 320331 | Dilute to 0.01 N HCl with cell culuture water |
| Kidney ECM Gelation | |||
| 1 N NaOH (Sterile) | Sigma-Aldrich | 415413 | Dilute to 1 N in cell culture grade water |
| Medium 199 | Sigma-Aldrich | M4530 | |
| 15 mL Conical Tube | ThermoFisher | 339651 | |
| Cell Culture Media | ThermoFisher | 11330.032 | Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 (DMEM/F12) |
| Fetal Bovine Serum (FBS) | Gibco | 10082147 | |
| Antibiotic-Antimycotic 100X | Life Technologies | 15240-062 | |
| Insulin, Transferrin, Selenium, Sodium Pyruvate Solution (ITS-A) 100X | Life Technologies | 51300-044 | |
| 1 mL Syringe | Sigma-Aldrich | Z192325 | |
| Microspatula | Sigma-Aldrich | Z193208 |
Referencias
- Lelongt, B., Ronco, P. Role of extracellular matrix in kidney development and repair. Pediatric Nephrology. 18 (8), 731-742 (2003).
- Yue, B. Biology of the Extracellular Matrix: An Overview. Journal of Glaucoma. 23, S20-S23 (2014).
- Miner, J. H. Renal basement membrane components. Kidney International. 56 (6), 2016-2024 (1999).
- Petrosyan, A., et al. Decellularized Renal Matrix and Regenerative Medicine of the Kidney: A Different Point of View. Tissue Engineering Part B. 22 (3), 183-192 (2016).
- Caralt, M., et al. Optimization and Critical Evaluation of Decellularization Strategies to Develop Renal Extracellular Matrix Scaffolds as Biological Templates for Organ Engineering and Transplantation. American Journal of Transplantation. 15 (1), 64-75 (2015).
- Nakayama, K. H., Batchelder, C. A., Lee, C. I., Tarantal, A. F. Decellularized rhesus monkey kidney as a three-dimensional scaffold for renal tissue engineering. Tissue Engineering Part A. 16 (7), 2207-2216 (2010).
- Nakayama, K. H., Lee, C. C. I., Batchelder, C. A., Tarantal, A. F. Tissue Specificity of Decellularized Rhesus Monkey Kidney and Lung Scaffolds. Public Library of Science ONE. 8 (5), (2013).
- Orlando, G., et al. Production and implantation of renal extracellular matrix scaffolds from porcine kidneys as a platform for renal bioengineering investigations. Annals of Surgery. 256 (2), 363-370 (2012).
- Sullivan, D. C., et al. Decellularization methods of porcine kidneys for whole organ engineering using a high-throughput system. Biomaterials. 33 (31), 7756-7764 (2012).
- Choi, S. H., et al. Development of a porcine renal extracellular matrix scaffold as a platform for kidney regeneration. Journal of Biomedical Materials Research Part A. 103 (4), 1391-1403 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
- Nagao, R. J., et al. Decellularized Human Kidney Cortex Hydrogels Enhance Kidney Microvascular Endothelial Cell Maturation and Quiescence. Tissue Engineering Part A. 22 (19-20), 1140-1150 (2016).
- Gupta, S. K., Mishra, N. C., Dhasmana, A. Decellularization Methods for Scaffold Fabrication. Methods in Molecular Biology. , 1-10 (2017).
- Hudson, T., et al. Optimized Acellular Nerve Graft is Immunologically Tolerated and Supports Regeneration. Tissue Engineering. 10 (11), 1641-1651 (2004).
- Atala, A., Bauer, S. B., Soker, S., Yoo, J. J., Retik, A. B. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 367 (9518), 1241-1246 (2006).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B., et al. Organ reengineering through development of a transplantable recellularied liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Nagao, R. J., et al. Preservation of Capillary-beds in Rat Lung Tissue Using Optimized Chemical Decellularization. Journal of Materials Chemistry B. 1 (37), 4801-4808 (2013).
- Song, J. J., et al. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Medicine. 19 (5), 646-651 (2013).
- Freytes, D. O., Martin, J., Velankar, S. S., Lee, A. S., Badylak, S. F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials. 29 (11), 1630-1637 (2008).
- Wolf, M. T., et al. A hydrogel derived from decellularized dermal extracellular matrix. Biomaterials. 33 (29), 7028-7038 (2012).
- Fisher, M. B., et al. Potential of healing a transected anterior cruciate ligament with genetically modified extracellular matrix bioscaffolds in a goat model. Knee Surgery, Sports Traumatology, Arthroscopy. 20 (7), 1357-1365 (2012).
- Ghuman, H., et al. ECM hydrogel for the treatment of stroke: Characterization of the host cell infiltrate. Biomaterials. 91, 166-181 (2016).
- Rijal, G. The decellularized extracellular matrix in regenerative medicine. Regenerative Medicine. 12 (5), 475-477 (2017).
- Lennon, R., et al. Global Analysis Reveals the Complexity of the Human Glomerular Extracellular Matrix. Journal of the American Society of Nephrology. 25 (5), 939-951 (2014).
- Bonandrini, B., et al. Recellularization of Well-Preserved Acellular Kidney Scaffold Using Embryonic Stem Cells. Tissue Engineering Part A. 20 (9-10), 1486-1498 (2014).
- O'Neill, J. D., Freytes, D. O., Anandappa, A. J., Oliver, J. A., Vunjak-Novakovic, G. V. The regulation of growth and metabolism of kidney stem cells with regional specificity using extracellular matrix derived from kidney. Biomaterials. 34 (38), 9830-9841 (2013).
- Streitberger, K. -J., et al. High-resolution mechanical imaging of the kidney. Journal of Biomechanics. 47 (3), 639-644 (2014).
- Bensamoun, S. F., et al. Stiffness imaging of the kidney and adjacent abdominal tissues measured simultaneously using magnetic resonance elastography. Clinical Imaging. 35 (4), 284-287 (2011).
- Moon, S. K., et al. Quantification of Kidney Fibrosis Using Ultrasonic Shear Wave Elastography. Journal of Ultrasound in Medicine. 34, 869-877 (2015).
- Genovese, F., Manresa, A. A., Leeming, D. J., Karsdal, M. A., Boor, P. The extracellular matrix in the kidney: a source of novel non-invasive biomarkers of kidney fibrosis? Fibrogenesis & Tissue Repair. 7 (1), (2014).
- Hewitson, T. D. Fibrosis in the kidney: is a problem shared a problem halved? Fibrogenes & Tissue Repair. 5 (1), S14(2012).
- Wolf, M. T., et al. Polypropylene surgical mesh coated with extracellular matrix mitigates the host foreign body response. Journal of Biomedical Materials Research Part A. 102 (1), 234-246 (2014).
- Faulk, D. M., et al. ECM hydrogel coating mitigates the chronic inflammatory response to polypropylene mesh. Biomaterials. 35 (30), 8585-8595 (2014).
- Jeffords, M. E., Wu, J., Shah, M., Hong, Y., Zhang, G. Tailoring Material Properties of Cardiac Matrix Hydrogels To Induce Endothelial Differentiation of Human Mesenchymal Stem Cells. ACS Applied Materials & Interfaces. 7 (20), 11053-11061 (2015).
- Kim, M. -S., et al. Differential Expression of Extracellular Matrix and Adhesion Molecules in Fetal-Origin Amniotic Epithelial Cells of Preeclamptic Pregnancy. Public Library of Science ONE. 11 (5), e0156038(2016).
- Paduano, F., Marrelli, M., White, L. J., Shakesheff, K. M., Tatullo, M. Odontogenic Differentiation of Human Dental Pulp Stem Cells on Hydrogel Scaffolds Derived from Decellularized Bone Extracellular Matrix and Collagen Type I. Public Library of Science ONE. 11 (2), e0148225(2016).
- Viswanath, A., et al. Extracellular matrix-derived hydrogels for dental stem cell delivery. Journal of Biomedical Materials Research Part A. 105 (1), 319-328 (2017).
- Uriel, S., et al. Extraction and Assembly of Tissue-Derived Gels for Cell Culture and Tissue Engineering. Tissue Engineering Part C Methods. 15 (3), 309-321 (2009).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissues: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Faust, A., et al. Urinary bladder extracellular matrix hydrogels and matrix-bound vesicles differentially regulate central nervous system neuron viability and axon growth and branching. Journal of Biomaterials Applications. 31 (9), 1277-1295 (2017).
- Pouliot, R. A., et al. Development and characterization of a naturally derived lung extracellular matrix hydrogel. Journal of Biomedical Materials Research Part A. 104 (8), 1922-1935 (2016).
- Pati, F., et al. Printing three-dimensional tissue analogues with decellularized extracellular matrix bioink. Nature Communications. 5, 3935(2014).
- Pati, F., et al. Biomimetic 3D tissue printing for soft tissue regeneration. Biomaterials. 62, 164-175 (2015).
- Wang, R. M., Christman, K. L. Decellularized myocardial matrix hydrogels: In basic research and preclinical studies. Advanced Drug Delivery Reviews. 96, 77-82 (2016).
- Jang, J., et al. 3D printed complex tissue construct using stem cell-laden decellularized extracellular matrix bioinks for cardiac repair. Biomaterials. 112, 264-274 (2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (Pt 24), 4195-4200 (2010).
- Mouw, J. K., Ou, G., Weaver, V. M. Extracellular matrix assembly: a multiscale deconstruction. Nature Reviews Molecular Cell Biology. 15 (12), 771-785 (2014).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Hinderer, S., Layland, S. L., Schenke-Layland, K. ECM and ECM-like materials - Biomaterials for applications in regenerative medicine and cancer therapy. Advanced Drug Delivery Reviews. 97, 260-269 (2016).
- Uriel, S., et al. The role of adipose protein derived hydrogels in adipogenesis. Biomaterials. 29 (27), 3712-3719 (2008).
- Singelyn, J. M., et al. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering. Biomaterials. 30 (29), 5409-5416 (2009).
- Medberry, C. J., et al. Hydrogels derived from central nervous system extracellular matrix. Biomaterials. 34 (4), 1033-1040 (2013).
- Loneker, A. E., Faulk, D. M., Hussey, G. S., D'Amore, A., Badylak, S. F. Solubilized liver extracellular matrix maintains primary rat hepatocyte phenotype in-vitro. Journal of Biomedical Materials Research Part A. 104 (4), 957-965 (2016).
- Hill, R. C., Calle, E. A., Dzieciatkowska, M., Niklason, L. E., Hansen, K. C. Quantification of extracellular matrix proteins from a rat lung scaffold to provide a molecular readout for tissue engineering. Molecular & Cellular Proteomics. 14 (4), 961-973 (2015).
- Li, Q., et al. Proteomic analysis of naturally-sourced biological scaffolds. Biomaterials. 75, 37-46 (2016).
- Tanaka, T., Yada, R. Y. N-terminal portion acts as an initiator of the inactivation of pepsin at neutral pH. Protein Engineering. 14 (9), 669-674 (2001).
- Ligresti, G., et al. A Novel Three-Dimensional Human Peritubular Microvascular System. Journal of the American Society of Nephrology. 27 (8), 2370-2381 (2016).
- Mozes, M. M., Böttinger, E. P., Jacot, T. A., Kopp, J. B. Renal expression of fibrotic matrix proteins and of transforming growth factor-beta (TGF-beta) isoforms in TGF-beta transgenic mice. Journal of the American Society of Nephrology. 10 (2), 271-280 (1999).
- Romanowicz, L., Galewska, Z. Extracellular matrix remodeling of the umbilical cord in pre-eclampsia as a risk factor for fetal hypertension. Journal of Pregnancy. 2011, 542695(2011).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados