Method Article
Establecimiento y análisis de segmento de Tumor explantes como prerrequisito para la prueba de diagnóstico
En este artículo
Resumen
Nos proporcionan un método para la generación, cultivo y análisis sistemático de rebanadas organotypic derivadas de tumores de pulmón murino. También se describe cómo optimizar el grosor de corte y cómo seleccionar las concentraciones de la droga para el tratamiento de rodajas de tumor.
Resumen
Culturas de explante primario del tejido Organotypic, que incluyen cortes de precisión de corte, representan la arquitectura del tejido tridimensional (3D), así como las interacciones multicelulares de tejido propio. Rebanadas de tejido cortadas inmediatamente de recién resecados tumores preservan aspectos espaciales de la heterogeneidad intratumor, así haciéndolos útiles sustitutos de la biología en vivo . Cuidadosa optimización de condiciones de preparación y cultivo de rodaja de tejido es fundamental para el potencial diagnóstico predictivo del tumor rebanada de explantes. En este sentido, los modelos murinos son valiosos, ya que esto proporciona un flujo constante de material tumoral para realizar experimentos reproducibles y repetición. Este protocolo describe el cultivo de rebanadas de tumor derivado del tejido pulmonar murino utilizando una rotación unidad de incubación, un sistema que permite la exposición intermitente de los tejidos de oxígeno y nutrientes. Nuestro trabajo previo demostró que el uso de unidades de incubación de rotación mejora la viabilidad del tejido en comparación con otros métodos de cultivo, particularmente flotante rebanadas y filtro estancada es compatible. Aquí, mostramos más que grosor de corte influye en la viabilidad de sectores cultivados, sugiriendo que optimización de grosor de corte debe hacerse para los tipos de tejido diferentes. Pronuncia ITH en funciones oncogénicas, como señalización de actividades, infiltración de células estromales o expresión de marcadores de diferenciación, exige una evaluación de rebanadas de tejido adyacente para la expresión de marcadores alterados por el tratamiento de drogas o cultivo de sí mismo. En Resumen, este protocolo describe la generación de rebanadas de tumor de pulmón murinas y su cultura en una rotación unidad de incubación y demuestra cómo sectores deben analizarse sistemáticamente para la expresión de marcadores de tejido heterogéneo, como requisito previo antes de estudios de la respuesta del fármaco.
Introducción
Tejidos de tumor sólido, incluyendo el cáncer de pulmón, exhiben heterogeneidad genética y fenotípica y albergan complejos microambientes1,2. La interacción entre las células del tumor y su influencia de microambiente circundante en drogas mecanismos de sensibilidad y resistencia3. Esto destaca la necesidad de modelos preclínicos que puede modelar con precisión la complejidad biológica y funciones actúan en tumores nativos. Precisión de corte rebanadas inmediatamente derivadas de tumores frescos proporcionan un recurso único, ya que tienen una capacidad principal para representar en vivo la biología, al menos por un corto período de tiempo, incluyendo fenotipos espacialmente distribuidos en un tumor individual. Resecado tumores clínicos son uno de los pocos ejemplares personalizados que pueden obtenerse de un paciente de cáncer, y su uso diagnóstico merece escrutinio.
La historia de las culturas organotypic remonta alsiglo temprano 19, cuando tumores intracraneales humanos fueron cortados a mano en trozos de tejido y culta con el supuesto de suspensión el método de caída. Fragmentos de tejido fueron conectados a un cubreobjetos y permitió sumergir en plasma humano heparinizado, después de lo cual el cubreobjetos fueron invertidas, se sellan y cultivados durante varias semanas4. Cortar manualmente tumor puesto que han sido cultivados utilizando una variedad de otros métodos, tales como el plasma coágulos5, en medios líquidos6, o de 0.45 μm de poro de filtros de tamaño6. El término "organotypic" primero fue utilizado en 1954, en un estudio sobre la diferenciación retiniana del polluelo embrión ojo7. Esto fue seguido por estudios que utilizaron explantes de tejido de pulmón y corazón derivados de embriones de pollo8y explantes de cerebro de ratas adultas9.
Varios métodos de corte han sido helicópteros descrito, a saber, manual10,11, Krumdieck tejido cortar12,13y vibratomes11,14,15, 16. La máquina de cortar de tejido Krumdieck genera núcleos de tejido cilíndrico, que entonces se rebanan en rodajas circulares tejido utilizando un micrótomo. Un vibratome, por el contrario, utiliza un microtomo de cuchilla vibrante. En un estudio sobre rebanadas de hígado, fue demostrado que la Leica vibratome genera más rebanadas consistente y reproducibles en comparación con la máquina de cortar de Krumdieck15. Se han utilizado espesores de rebanada que van desde 250 a 500 μm, y estudios informan mantenimiento de viabilidad y características morfológicas hasta 16 días14,10,17,18. Sin embargo, los tumores tienen variable perfiles metabólicos que pueden afectar los requerimientos de nutrientes, y pueden influir en parámetros como la composición de rigidez y matriz de tejido de aireación y flujo de nutrientes. Por lo tanto es probable que cada tipo de tejido requiere optimización de condiciones de corte y la cultura.
Métodos de cultivo diferentes han sido utilizados para apoyar las culturas rebanada: i) cultura de interfase inmóvil, también llamada cultura apoyo estancada, en la que rodajas se colocan encima de un inserto de membrana semi poroso sumergido en el medio de cultivo. En este sentido, la parte superior de las láminas es expuesta al aire, mientras que la parte inferior se complementa con nutrientes a través de la inserción porosa14,19; II) el método de paleta, originalmente desarrollado para órganos toda cultura o rebanadas de tejido embrionario. En este sentido, rodajas se colocan encima de una hoja de algodón o filtro apoyada por una red metálica, y el filtro se empapa en el medio de cultivo. Para mantener los tejidos húmedos, se agrega una capa delgada de medio encima de las rebanadas20,21,22. Estos dos primeras son denominados culturas de la interfase aire-líquido; III) culturas de tubo rodillos, rodajas se colocan dentro de la parte plana de un tubo plástico que contiene medio y tubo lenta rotación asegura que el tejido es cubierto con medio durante la primera parte de un ciclo, o aireado durante el segundo23; IV) unidades de incubación, en la que rodajas están expuestas intermitentemente al medio con nutrientes y aireación de la rotación. Diferentes de los tubos del rodillo, en este método de rebanadas se colocan encima de las rejillas de titanio poroso colocadas en placas de 6 pocillos con medio de cultivo24.
Rebanadas de tejido derivado de resecado tumores sólidos lógicamente presentes un modelo atractivo ex vivo en el que poner a prueba la respuesta al tratamiento de agentes contra el cáncer, pues permiten la evaluación de viabilidad, dirigido vía actividad y perfiles moleculares de un tumor específico en presencia de su microambiente tumoral nativo. Sin embargo, para evaluar las respuestas de medicamentos medidas en rebanadas tumor predicción de respuestas en situ , es importante evaluar qué rebanadas de tejido de punto preservar las funciones biológicas del tumor-específicas tales como proliferación celular, diferenciación de la célula de histopatología específica o las actividades de señalización oncogénicas. El impacto del estrés mecánico sacado durante la preparación de rebanada, slice manejo o adaptaciones inducidas por la cultura de la calidad y funciones biológicas de rebanadas de tejido son cuestiones fundamentales, estrechamente ligados a la capacidad de implementar derivadas de tumor láminas para el diagnóstico funcional.
Nuestro proyecto de consorcio financiado por la IMI PREDECT (http://www.predect.eu) propone sistemáticamente dirección estas preguntas fundamentales, mediante el estudio de explantes de la rebanada de una variedad de fuentes. Utilizando láminas derivadas de modelos de cáncer de mama, próstata y pulmón, este esfuerzo conjunto utilizado lectura cualitativa como cuantitativa hematoxilina y lecturas de eosina (H & E) - basado en demostrar un requerimiento de oxígeno atmosférico y filtro estancada soportes para mantener la viabilidad de sectores cultivados hasta 72 h. Además, análisis de inmunohistoquímica (IHQ) en rebanadas cultivados revelaron gradientes de viabilidad intra-slice, evidenciados como gradientes de necrosis en sectores derivados de cáncer de pulmón murino de células no pequeñas (CPCNP), receptor de estrógeno (ER), HIF1α y γH2AX 25rodajas de gradientes en rebanadas de cáncer de mama, o gradientes de expresión de receptor (AR) de andrógenos en el cáncer de próstata. Curiosamente, gradientes de viabilidad intra-rebanada en cultivos de 24 h de CPCNP murino fueron rescatados por los cultivos en una rotación unidad de incubación, y nuestro reciente estudio demostró que la viabilidad se extendió a 72 h26. Particularmente en el lado superior seguía siendo más viable26, avalando que análisis de respuesta de drogas en rebanadas se realizan mejor en este lado del tejido.
Aunque sigue siendo una cuestión de cómo mucho rebanadas de tejido pueden recapitular en situ las funciones de tumor, se han utilizado para probar las respuestas a los agentes contra el cáncer, incluyendo drogas específicas, anticuerpos monoclonales y agentes de la quimioterapia 10,11,13,14,18,27. Recientemente demostramos que rodajas de CPCNP murinos muestran cambios dinámicos en la proliferación y rebanadas de actividades señalización oncogénicas tras cultivo comparado con recién cortado 0 h26. Esto indica que es importante investigar si las funciones biológicas específicas en situ se conservan adecuadamente durante el cultivo, antes de los estudios de perturbación. A pesar de estos hallazgos, hemos demostrado que rodajas de tumor pueden modelar espacial respuesta a terapias dirigidas, medio drogas tratamientos siguen siendo breve (24 h) y se inician en el inicio de cultivo26. El siguiente protocolo describe validación importantes aspectos relevantes para el establecimiento y análisis de las culturas de rebanada de tumor, antes de su aplicación en las pruebas de drogas farmacológicas.
Protocolo
Todos los experimentos de ratón se describe en este estudio fueron realizados siguiendo las directrices de la Junta Nacional finlandés de Experimentación Animal y fueron aprobados por el Comité de Animal Experimental de la Universidad de Helsinki y el Estado Provincial Oficina del sur de Finlandia (licencia número ESAVI/9752/04.10.07/2015).
1. preparativos antes de cortar
- Mantenga los siguientes materiales: vibratome mordazas, vibratome tampón bandeja, placa de cultivo de 10 cm, placa de 24 pozos, pipeta de 10 mL, pipeta muchacho, bolsa para residuos, 70% EtOH en un tubo de 50 mL para desinfectar los instrumentos y pegamento de tejido.
- Preparar el vibratome: Limpie el sujetador de la cuchilla con el 70% EtOH, instale un disco nuevo y realizar un vibrocheck según las instrucciones proporcionadas en el manual (http://photos.labwrench.com/equipmentManuals/10103-3895.pdf).
Nota: Es importante realizar el paso vibrocheck, ya que reduce al mínimo la desviación vertical de la hoja y garantiza rebanadas de buena calidad. - Llene cada uno bien de la placa de 24 pozos con 1 mL de Hanks balanceada sal solución (HBSS) suplementados con 100 U/mL de penicilina y 100 de μg/mL estreptomicina (HBSS + P/S); Mantenga la placa de hielo.
- Preparar medio de cultivo de F12 suplementado con 100 U/mL penicilina, estreptomicina μg/mL 100, 2 mM glutamax, 22 mM de glucosa y 10% suero bovino fetal (FBS).
Nota: Tumor rebanada medio de cultivo y factor de crecimiento de los suplementos pueden variar dependiendo del tejido tumoral del25. - Preparar la cantidad requerida de medio de F12 para el tratamiento de drogas, usando la misma composición, como se describe en el paso 1.4, pero omitiendo el FBS.
Nota: Desde factores de crecimiento en el suero pueden afectar señalización oncogénica en rebanadas cultivadas, medio sin suero se recomienda para estudios de perturbación a corto plazo de drogas sobre rebanadas de tumor. Si se analizan culturas rebanada a más largo plazo, es importante primero evaluar el efecto de medio sin suero en tejido viabilidad y expresión de marcadores tumorales en culturas rebanada sin tratar.
2. colección de pulmones con tumores
- Eutanasia a un ratón con tumores por dislocación cervical cuando muestra síntomas de respiración forzada y la pérdida de peso corporal.
Nota: CO2-mediada de la eutanasia se sabe para inducir condiciones hipóxicas en los pulmones, que pueden tener un efecto sobre la viabilidad de la rebanada o actividades oncogénicas a través de suscitar una respuesta hipóxica. - Estirar el ratón eutanasia sobre una tapa de espuma de poliestireno mediante la inserción de agujas de 30 G en todas las cuatro patas, para que el pecho se expone.
- Corte la piel del abdomen hacia el pecho y hasta la región del cuello. Corte la caja torácica y el diafragma para exponer el pulmón y el corazón. Mantenga las tijeras en posición inclinada para evitar daño tisular.
- Diseccionar los pulmones con tumores junto con el corazón y colocarlos en un tubo de 50 mL que contenga 30 mL de helado HBSS + P/S; Mantenga el tubo bien fría y proceder con el siguiente paso lo antes posible.
Nota: Retrasos en el tratamiento de los tumores pulmonares pueden alterar funciones oncogénicas, señalando por ejemplo actividades de camino.
3. generación de Tumor pulmonar de precisión de corte corta
- Transferencia de los pulmones con tumores en HBSS + P/S en una placa de cultivo de tejidos de 10 cm guardada dentro de una campana laminar. Separar los lóbulos pulmonares utilizando pinzas y tijeras estériles y lóbulos con tumores en la superficie para cortar, seleccione.
Nota: Los tumores > 3 mm en tamaño son apropiados para cortar. Desde el tejido pulmonar normal circundante los compromisos de tumor grande el corte debido a las diferencias en la rigidez del tejido, tejido tumoral sometidos a corte debe ser separado de los tejidos normales, tales que una región despejada tumor enfrenta la hoja vibratome. - Generar una superficie de la pieza de tejido plano por parte de la corte del tejido pulmonar normal que rodea el tumor con un bisturí estéril y sumergir el portaobjetos plano en una gota de cianoacrilato. Montar este otro soporte de espécimen de vibratome para que el tumor enfrenta a la hoja en posición vertical. Deje que el pegamento seco de 2 a 3 minutos.
Nota: El tejido del pulmón normal pegado al titular de la muestra no interfiere con corte de tejido de tumor, y de corte se detiene antes de alcanza el tejido normal. El tejido del tumor a veces curvas debido a la textura esponjosa del tejido pulmonar normal pegado a las mordazas, comprometer su posición vertical. Si esto sucede, pegue un pedazo de tejido de soporte pulmonar normal adicional junto al tejido pulmonar normal preinstalada para conservar el tumor en posición vertical (figura 1A iii). - Coloque el soporte del espécimen en la bandeja de metal buffer y llenarlo con frío HBSS + P/S hasta que el tejido está inmerso en el búfer. Ponga la charola de metal buffer en el baño de hielo blanco y agregue hielo para refrescarse mientras que corte el tejido.
- Fije la bañera de hielo blanco al vibratome. Seleccione Ajustes de corte adecuados: amplitud que oscila entre 2.5-2.8, rebanar velocidad entre 0.10-0.14 ms y un espesor de corte que oscilan entre los 160 – 250 μm.
Nota: Configuración de corte deben ajustarse según la dureza del tejido. Tejido duro es más fácil cortar que el tejido más suave y más suave tejidos requiere cortar con velocidad más baja (0,1 – 0,12 ms) y amplitud mayor (2.6-2.8). Un tumor grande de 4 – 5 mm proporciona típicamente 15-20 rebanadas de 200 μm de grosor. Para el cultivo a corto plazo, se pueden rebanar tumores murinos bajo condiciones semi estériles fuera de la campana laminar. Sin embargo, tumores clínicos deben siempre ser en rodajas dentro de una campana de laminar clase II bioseguridad para evitar la exposición a posibles agentes infecciosos en el tejido humano. - Utilizando pinzas estériles, recoger las rodajas en 1 mL de HBSS en pocillos distintos de una placa de 24 pocillos en hielo, de cerca hacer el seguimiento de la orden en el que son rebanadas rebanadas. Cada marca de la placa de 24 pocillos según el plan experimental. Por ejemplo, la marca secuencial pocillos de una placa de 24 pocillos como momentos de cultura o como h 0, control del vehículo (C), droga tratado (T) (figura 1B ii).
Nota: No molestar o sacar el tejido del tumor durante la percepción de un segmento, como esto cambiará la orientación del tumor en relación con el ángulo de la hoja, conduciendo a las inconsistencias en los espesores de las láminas posteriores. - Cuando se recogen todos los sectores, transferirlas sobre rejillas de titanio (2-3 rodajas por cuadrícula) colocadas en una placa de 6 pozos que contienen 2,5 mL de medio de cultivo por pozo. Asegúrese de que no hay burbujas de aire se forman entre la red de titanio y el medio.
- Para cargar un segmento en la red, mantenga la placa de la pozo 6 en posición inclinada para que una porción del medio cubre la rejilla y coloque la rebanada en el medio de la red; utilizar pinzas para difundir el segmento si lo rizos. Carga de las placas de 6 pozos en la unidad de incubación giratorio dentro de una incubadora humidificada mantenida a 37 ° C con 95% aire y 5% CO2y comenzar el ciclo de rotación (figura 1 i-ii).
Nota: Rejillas metálicas y las placas de 6 pozos necesitan ser exactamente equilibrado antes de encender la unidad giratoria. Es importante colocar las rodajas en el centro de la rejilla para que se completamente alterna entre las fases líquidas durante los ciclos de rotación y aire. Rodajas que se colocan demasiado bajos o altos no están adecuadamente expuestos a oxígeno o nutrientes (figura 1 ), que pueden comprometer la viabilidad del tejido. Es importante seguir la posición de la rodaja en la parrilla durante el cultivo, como la rebanada de vez en cuando puede resbalar hacia abajo. Si esto ocurre dentro de 1-2 h de inicio de la cultura, su posición correcta y anote que esta muestra puede ser dañada. Sectores que son mispositioned por un período prolongado de tiempo deben ser desechados, como viabilidad del tejido es afectada significativamente por la oxigenación inadecuada y fuente nutriente.
- Para cargar un segmento en la red, mantenga la placa de la pozo 6 en posición inclinada para que una porción del medio cubre la rejilla y coloque la rebanada en el medio de la red; utilizar pinzas para difundir el segmento si lo rizos. Carga de las placas de 6 pozos en la unidad de incubación giratorio dentro de una incubadora humidificada mantenida a 37 ° C con 95% aire y 5% CO2y comenzar el ciclo de rotación (figura 1 i-ii).
- Recoger un trozo de tejido adyacente a los sectores cultivados como una h 0, inculto, referencia. Recoger rebanadas de referencia por lo menos tres para representar a la parte superior, media y centro del tejido es cortado. Fijar el proceso y rebanadas de 0 h inmediatamente según lo descrito en 5.1.
Nota: Si el número de rebanadas es limitado, por ejemplo, si se realizan múltiples tratamientos compuestos o repeticiones técnicas, comparaciones de cada muestra tratada con su vecina muestra 0 h pueden ser difíciles. En tales casos, utilice el trozo de 0 h más cercano (por lo menos 400 – 600 μm aparte) para evaluar viabilidad relativa de tejido o expresión de marcadores relevantes en el inicio de la cultura. - Para el cultivo a largo plazo, reponer el medio de cultivo cada día. Levante la rejilla con las rebanadas de tejido con pinzas estériles y se coloca en un pozo vacío de la placa de 6 pozos; sustituir el 70% del medio con medio de cultivo fresco y volver a colocar la rejilla en el medio. Continuar el ciclo de rotación como se explica en el paso 3.6.
4. tratamiento del Tumor rebanadas con inhibidores de molécula pequeña
- Preparar las concentraciones requeridas de compuestos en el medio de tratamiento. Por lo general, una 10 veces mayor concentración de la droga en comparación con el IC50s mide en cultivos celulares es necesaria para lograr la inhibición de la blanco en rebanadas del tejido. Para evitar la citotoxicidad inespecífica, probar un rango de concentraciones para obtener concentración mínima efectiva para cada uno de ellos. Aquí probamos 0.1-1 μm de la dactolisib del inhibidor de PI3K/mTOR y 0.05-0.5 μm de la MEK inhibidor selumetinib sobre rebanadas de CPCNP murinos.
- Añadir 2,5 mL de medio con el fármaco diluido o DMSO u otro control de vehículo en la placa de 6 pozos. Coloque las rejillas de titanio en los pozos.
- Coloque las rebanadas de tejido en las rejillas como se describe en el paso 3.6.
- Realizar tratamientos de vehículo o drogas para 24 h. proceder con la fijación de tejido y procesamiento de las rodajas en bloques de parafina como se describe en la sección 5.
Nota: Duración de la farmacoterapia puede ser optimizado dependiendo del objetivo del experimento, teniendo en cuenta la capacidad de rebanadas de tejido para retener en situ tejido las funciones analizadas durante el período de cultivo.
5. fijación y procesamiento de las láminas de tejido
- Levante con cuidado la referencia inculto 0 h o rebanada cultivada sobre un papel de filtro empapado en PBS.
- Para ello, añadir 2-3 mL de PBS en una placa de 10 cm, deje que el flotador de corte en PBS y 'pescarlo' levantando el segmento sobre el papel de filtro con un par de pinzas.
- Transferir el papel filtro en un histocassette y añadir una gota de hematoxilina diluida (1:1 en agua desionizada) encima de la rebanada de tejido visiblemente marcar la posición de la corte durante las etapas de procesamiento posterior (figura 1).
- Cerrar el cassette y transferir en solución de formalina tamponada neutra de 4%. Fijar los tejidos durante la noche a 4 ° C.
Nota: Mientras coloca la rodaja en la parte superior el papel de filtro, asegúrese de que la parte superior de la rodaja es hacia arriba; Esto es necesario seguir la parte superior, media y sección inferior de una porción durante el seccionamiento y el análisis como se describe en el paso 6.3.
- Al día siguiente, transferir los cassettes en el 70% EtOH y proceder inmediatamente con el paso de proceso de tejido de inclusión en parafina.
- Antes del procesamiento de tejido, lave los histocasettes 100% EtOH 2 x durante 10 minutos. En este caso, use una estación de microondas para el procesamiento de tejidos. Seleccione el programa que se utiliza para 1 mm de espesor de tejido y siga las instrucciones proporcionadas en el manual (https://www.totaltissuediagnostics.com/images/MM073-005_-_KOS__Operator_Manual.pdf).
Nota: Cuando se utilizan otros tejidos máquinas de procesamiento, utilice el programa adecuado para las muestras de tejido fino. - Para inclusión en parafina, abrir una histocassette y utilice un bisturí para levantar cuidadosamente el fragmento del papel de filtro. Descartar el papel de filtro y transferir el trozo en un molde con parafina líquida.
- Presione el tejido contra el fondo del molde de inclusión, por ejemplo con un peso plano, para seccionamiento incluso. Coloque la parte inferior de la histocasette en la parte superior del molde, deje enfriar el molde en un paté frío por 30 min y separar el molde del bloque de parafina.
Nota: Como alternativa a la integración horizontal, es posible embeber el segmento de tumor verticalmente colocando el segmento en posición vertical. Las secciones verticales permiten fácilmente análisis de gradientes en la viabilidad o la expresión del marcador funcional en una sola sección 25. Análisis de gradiente con rebanadas horizontalmente integrado requiere parafina secciones como se describe en el paso 6.2.
- Presione el tejido contra el fondo del molde de inclusión, por ejemplo con un peso plano, para seccionamiento incluso. Coloque la parte inferior de la histocasette en la parte superior del molde, deje enfriar el molde en un paté frío por 30 min y separar el molde del bloque de parafina.
6. procesamiento y análisis de fijados con formol y embebido en parafina (FFPE) los tejidos
- Preparación de secciones delgadas de 4 μm de los bloques de corte de tejido FFPE usando un micrótomo. Cuando seccionamiento, ajustar el ángulo del bloque para que la superficie del bloque está orientada horizontalmente con respecto a la cuchilla. Esto es necesario para obtener secciones incluso en todo el tejido.
- Para habilitar la captura de un gradiente potencial viabilidad inducida por la cultura, la migración de la célula a través de láminas, o gradientes en la expresión de biomarcadores a través de sectores cultivados, recoger secciones de las capas superior, centro e inferior de cada una de las rebanadas de tejido en las diapositivas de objeto como se explica a continuación.
- Recoger primero las secciones de tejido secuencial de la rodaja de tejido parafina-encajado en la parte superior de las diapositivas de cristal. Continuar recogiendo las secciones de las capas más profundas del tejido a la mitad, seguida por la parte inferior del portaobjetos (Figura 1E).
Nota: Para dar cabida a tres secciones en un portaobjetos de vidrio, recorte el exceso de parafina alrededor de la rodaja de tejido embebido. - Permiten las secciones secas durante la noche a 37 ° C y proceder con tinción H & E o inmunohistoquímica, como se describe a continuación.
Nota: Puede ocurrir pérdida de antigenicidad cuando secciones FFPE se almacenan a altas temperaturas o durante períodos prolongados de tiempo. Secciones de la parafina se recomiendan almacenar a 4 ° C, y deben realizarse dentro de 6 meses después de la sección Análisis de IHQ.- Para la tinción de H & E, Desparafinizar y rehidratar las secciones de parafina como sigue: xileno 3 x 5 min, 100% EtOH 3 x 1 min, 96% EtOH 2 x por 1 min, 70% EtOH 1 x 1min y el agua desionizada 2 x durante 1 minuto.
- Incubar las secciones de solución de hematoxilina recién filtrada por 10 min y lavar con agua corriente por 5 min de inmersión las secciones en alcohol ácido (1% ácido clorhídrico en el 70% EtOH) por 2 veces y lavado con agua corriente durante 5 minutos seguido por incubación con eosina 0,5% m 2 en.
- Tras el paso de la eosina, deshidratar las secciones sumergiendo los portaobjetos en soluciones de alcohol y el xileno, como sigue: 96% EtOH 2 x 15 s, 100% EtOH 3 x durante 30 s, xileno 3 x durante 1 minuto. Por último, incorporar las secciones en un medio de montaje con xileno.
7. Análisis de la viabilidad del tejido y la expresión de biomarcadores
- Adquirir imágenes de alta resolución generando exploraciones diapositiva todo de H & E manchado diapositivas utilizando un escáner. Evaluar la viabilidad del tejido, tomar instantáneas de las exploraciones de tejido que representan las secciones superior, medio e inferior de las láminas.
- Usando software de manipulador de fotos, dibujar manualmente máscaras en las áreas necróticas de los tejidos, seguidas por la cuantificación de las regiones necróticas usando MATLAB.
- Calcular la viabilidad relativa de los sectores cultivados por diferentes puntos temporales en comparación con el segmento más cercano de 0 h como hecho en nuestro anterior estudio (Närhi et al., Figura S2B y C)26. Asimismo, evaluar posibles gradientes de viabilidad intra segmento mediante la cuantificación de viabilidad en la sección superior, medio e inferior de una rebanada cultivada y calcular la viabilidad relativa de cada sección a su sector más cercano de 0 h.
Nota: Mientras que el mero cultivo de rebanadas de CPCNP murinos induce la muerte celular necrótica, respuestas biológicas a ex vivo las condiciones de cultivo varían según el tejido del tumor. Por ejemplo, degradados en HIF1α, ER y macrófagos marcados por F4/80 se detectaron en rebanada admite filtro de cultivos derivados de un modelo de cáncer de mama25. Por lo tanto, H & E - como análisis basados en IHC de sectores cultivados deben considerarse para cada tipo de tejido.
- Realizar IHQ en las secciones de parafina. El siguiente protocolo IHC es un punto de partida y requiere más optimización de otros anticuerpos. Brevemente, Desparafinizar y rehidratar las secciones de parafina como sigue: xileno 3 x 5 min, 100% EtOH 3 x 1 min, 96% EtOH 2 x por 1 min, 70% EtoH 1 x 1 min, y agua desionizada 2 x durante 1 minuto.
- Para exponer los epítopos antigénicos, realizar recuperación de antígeno mediada por calor usando 10 mM ácido cítrico a pH 6 en un módulo de PT, seguido por bloqueo con 1% albúmina de suero bovino (BSA) y el 10% de suero Normal de cabra (NGS) en PBS 1 x durante 30 min a temperatura ambiente (21-23 ° C).
- Incubar el anticuerpo primario diluido en 1% de BSA y un 5% NGS en PBS 1 x, ya sea para 1 – 2 h a temperatura ambiente. Incubar con el anticuerpo secundario anti-conejo, durante 30 min a temperatura ambiente, seguido de detección con 3, 3 '-diaminobenzidina (DAB).
- Las secciones son contratinción con hematoxilina (diluida a 1:10 en agua desionizada) de 30 s y el lavado con agua del grifo durante 5 min, seguido de deshidratación sumergiendo los portaobjetos en soluciones de alcohol y el xileno, como sigue: 70% EtOH 1 x, 96% EtOH 2 x, 100% EtOH 3 x xileno 3 x ( Paso 1 min cada uno). Por último, incorporar las secciones en un medio de montaje con xileno.
- Adquirir exploraciones todo slide de diapositivas manchadas de IHC, exportarlos como imágenes TIFF en una relación de magnificación de 1:4 utilizando el utilizando un visor de imágenes y realizar cuantificaciones con ImageJ.
Nota: como alternativa al escáner, imágenes microscópicas en 20 X o 40 X de ampliación pueden ser adquiridas para cuantificaciones. Ampliación de imagen puede ser elegida según el marcador para ser cuantificada; imágenes de gran aumento se recomiendan para tinción nuclear, mientras que el citoplasmático o marcadores de membrana pueden ser cuantificados usando imágenes de X 20.- Para la cuantificación de marcadores nucleares, en este caso expresión de NKX2-1, convertir cada imagen en imágenes de 16 bits con ImageJ de Fiji y subir imágenes para análisis de imagen.
- Personalizar la tubería de análisis de imagen según el análisis. En este protocolo, utilizar la siguiente tubería para la cuantificación de núcleos positivos NKX2-1: identificar los principales objetos de | Medición de intensidad del objeto | Filtrar objetos (valor mínimo = 0.0025) | Calcular matemáticas Los resultados se representan como porcentajes de núcleos teñidos de lenguado del número total de núcleos.
Resultados
La figura 1 representa el flujo de trabajo para la generación, cultivo y análisis de rebanadas de tejido de corte de precisión derivado de tumores murinos de NSCLC. Para esta demostración, utilizamos tumores de un modelo de ratón genéticamente (GEMM) albergando activación condicional de KrasG12D junto con la pérdida de Lkb1 (también conocido como serina/treonina quinasa 11), en lo sucesivo Mal Iniciación de ratón cría y del pulmón tumor fue realizado como se describe en26,28. Figura 2A muestra el efecto del grosor de corte de tejido sobre la viabilidad de sectores cultivados durante 24 horas utilizando una rotación unidad de incubación. Los resultados muestran que 160 μm rebanadas contienen grandes áreas necróticas en el segmento. Además, rodajas finas de 250 μm muestran una necrosis degradado en el segmento en comparación con rodajas finas de 200 μm. Es probable que la pobre viabilidad general del μm 160 más delgado es causada por manipulación técnica durante la colocación de las rodajas encima de las rejillas, ya que son frágiles y tienden a rizarse. Por otro lado, cuando rodajas demasiado gruesas, pueden ser propensos a deficiencias de oxígeno o nutrientes difusión a través de las láminas, que en el CPCNP murino explantes se evidencia como gradiente de muerte necrótica25. Sin embargo, cabe señalar que pueden generarse cortes con espesores variables de un tumor, a pesar de uso de vibratome idéntica configuración. Por lo tanto se recomienda analizar múltiples repeticiones de muestras tumorales diferentes. Lo importante es que, cada tipo de tejido requiere optimización de espesor rebanada para lograr la máxima viabilidad, ya que el tejido textura y dureza pueden afectar la oxigenación y el flujo de nutrientes. Figura 2B -2C ilustra el análisis de IHQ cuantitativos de la expresión de NKX2-1, un marcador de adenocarcinoma bien diferenciado de pulmón (CA) en muestras cultivadas hasta 72 h y empareja rebanadas de 0 h. Los resultados muestran que expresión de NKX2-1 no se altera significativamente en sectores cultivados en comparación con 0 HS rebanadas incultos, lo que sugiere que el proceso de cultivo no afecta abiertamente el estado de diferenciación del tejido tumoral de AC. Figura 2D muestra la utilidad de rebanadas de tejido del tumor para evaluar la efectividad de los fármacos específicos. Recientemente demostró que Kras mutante murino ACs exposición alta expresión de ERK1/2 fosforilado (mayor actividad MAPK camino marcado) en comparación con los tumores Adenoescamoso (ASC), mientras que la expresión de 4EBP1 fosforilada (marcando la actividad de mTOR ) del mismo modo se expresa en tumores CA y ASC. Para comprobar si estas vías pueden ser efectivamente objeto de rebanadas de tejido, rebanadas de tejido KL AC fueron tratados con DMSO o contiene cantidades de compuestos, es decir, 0.1-1 μm dactolisib a la vía de mTOR o 0.05 – 0.5 μm selumetinib atacar la vía MAPK. Resultados muestran que 1 μm dactolisib o 0,5 μm de selumetinib son eficaces en la inhibición de la fosforilación de ERK1/2, o de 4EBP1 respectivamente. Además, la inhibición dosis dependiente de las fosfoproteínas específicas indica que rebanadas de tejido también pueden ser utilizados para validar los anticuerpos específicos de fosforilación.

Figura 1: representación esquemática del flujo de trabajo para el establecimiento y análisis de explantes de rebanada tumor derivado de CPCNP murinos. (A) diagrama esquemático que describe la colección y preparación de los pulmones con tumores para rebanar. Lóbulos del pulmón se cosechan de un ratón y se diseca tejido tumoral de tejido normal. La flecha negra y asterisco indican aproximadamente 4 mm y los tumores de 1 mm, respectivamente. La punta de flecha blanca indica tejido pulmonar pegado a la superficie de las mordazas. Los puntos de la flecha roja en una pieza adicional de tejido de soporte pulmonar normal para mantener el tumor en una posición vertical. (B) Vibratome corte y colección de rebanadas de tejido. Flecha blanca indica la dirección de corte. Colección de Cortes secuenciales en una placa de 24 pocillos que contienen frío HBSS + P/S. Las rodajas pueden ser cultivadas para diferentes puntos temporales (aquí, 24 – 72 h) para evaluar la expresión de marcadores tumorales durante el cultivo (fila superior), o pueden utilizarse para realizar tratamientos con fármacos. C: control del vehículo de, T: tratamiento contra las drogas. (C) colocar la rodaja de tejido para cultivo mediante rotación unidades de incubación. Incline la placa de 6 pozos para que algún medio cubre la parte superior de la cuadrícula, coloque la rebanada de tejido en el centro de la rejilla en la parte superior del medio y unta la rebanada con unas pinzas. Asegurar que las placas de 6 pozos peso equilibrado para un ciclo de rotación suave. X: indica incorrecta, y  : indica la colocación correcta de la rebanada. (D) fotografía del bloque FFPE de una porción del tumor. Puntos de la flecha negra en el segmento de tejido parafina-encajado teñidas con hematoxilina. (E) esquema que muestra el orden de seccionamiento de las rebanadas en bloques FFPE; Estas secciones se pueden procesar para evaluar la viabilidad del tejido y la expresión de biomarcadores tumorales. Haga clic aquí para ver una versión más grande de esta figura.
: indica la colocación correcta de la rebanada. (D) fotografía del bloque FFPE de una porción del tumor. Puntos de la flecha negra en el segmento de tejido parafina-encajado teñidas con hematoxilina. (E) esquema que muestra el orden de seccionamiento de las rebanadas en bloques FFPE; Estas secciones se pueden procesar para evaluar la viabilidad del tejido y la expresión de biomarcadores tumorales. Haga clic aquí para ver una versión más grande de esta figura.
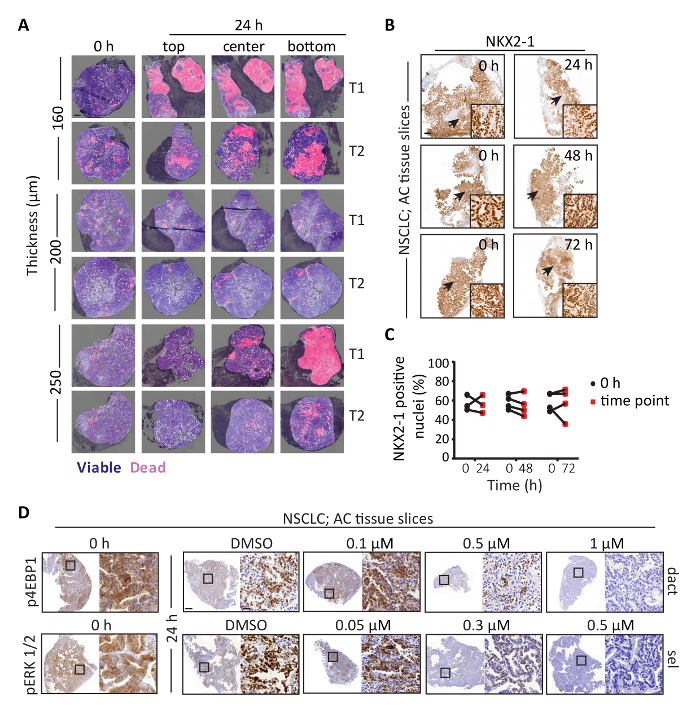
Figura 2: evaluación de expresión de marcador de viabilidad y histotype específicos y tratamiento específicos en segmentos de tejido de CPCNP. (A) representante de H & E imágenes de rebanadas de NSCLC de CA de los espesores indicados se cultivan para rodajas finas de 24 h. 200 μm mantienen mejor viabilidad en comparación con 160 μm o rodajas de 250 μm. Azul oscuro representa H & E tinción de tejido viable, y rosa indica regiones necróticas pseudocolored. Luz azul indica regiones excluidas del análisis, debido a la presencia de estroma fibroso o tejido pobre calidad. T1 y T2 representan repeticiones biológicos derivados de dos tumores diferentes. Barra de escala = 500 μm. (B) IHC representativas imágenes de la expresión de NKX2-1 en rodajas AC se cultivan para los puntos de tiempo indicado. La flecha indica la zona que se muestra en la ampliación más alta. Los resultados muestran que la expresión de NKX2-1 no se altera en los sectores cultivados comparados con rebanadas de 0 h. Barra de escala = 500 μm y 50 μm para los aumentos bajos y altos, respectivamente. (C) la cuantificación de los datos que se muestra en (B). (D) representante IHC imágenes de 4EBP1 fosforilada o expresión pERK1/2 en 0 h rodajas o rebanadas tratados con DMSO o contiene cantidades de dactolisib (dact, fila superior) o fosforila pERK1/2 expresión en 0 h sector, o sectores tratados con DMSO o selumetinib (sel, fila inferior). Cajas cuadradas negras indican las áreas indicadas en mayor aumento. Barra de escala = 1 mm o 50 μm para un aumento bajo o alto, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Varios complejos en vitro modelos de tumores, incluyendo culturas 3D y organoides, se han desarrollado para recapitular la arquitectura y funciones oncogénicas en vivo 29,del tejido tumoral en30. Sin embargo, el establecimiento de culturas 3D u organitas implica disociación de tejidos y crecimiento selectivo de un solo tipo de células o cocultivo un selecto pocos tipos de células en un ambiente artificial. En consecuencia, tales modelos incompleto captan las complejidades de las interacciones de heterogeneidad y tumor de estroma del tumor. Organotypic rebanadas de tumor, por el contrario, mantienen el tejido arquitectura biológica complejidades y el tumor en situ sin manipulación extensa. Esta capacidad de rebanadas de tejido a células tumorales de modelo en su microambiente nativa hace particularmente atractivo para los estudios preclínicos. Divulgamos previamente un flujo de trabajo optimizado para el establecimiento y análisis de cortes de precisión de corte tumor, y demostró que, en comparación con los soportes del filtro, una unidad de incubación rotatoria mejorar la viabilidad a corto plazo murino NSCLC rebanada culturas25 , 31. sin embargo, el cultivo en rotación unidades es técnicamente difícil y requiere supervisión constante. Aquí presentamos un protocolo para tumor tejido sector generación y uso práctico de una rotación unidad de incubación para los de la cultura, así como acompañando a métodos para monitorear la capacidad de rebanadas para capturar en situ la biología del tumor, un prerrequisito antes de drogas pruebas de respuesta.
Varios pasos críticos en el protocolo de aseguran integridad del tejido y la viabilidad de las rebanadas del tumor. Si el tumor rodea a tejido pulmonar normal, el vibratome puede generar sectores con grosor inconsistente o dañar las láminas, debido a diferencias en la textura y rigidez entre los tejidos normal y tumoral. Así, es importante eliminar el tejido pulmonar normal circundante antes de corte del tumor. Otro paso fundamental es el grosor de corte, que debe ser cuidadosamente optimizado para cada tipo de tejido. Además, una vez cortado, es crítico que la rodaja se coloca aproximadamente en el centro de la red, para garantizar la exacta intermitente en medio de cultivo y exposición al oxígeno. Por último, es importante seguir la posición de un sector durante su periodo de rotación, como una rebanada puede caer el medio; Si esto sucede, más acciones se pueden tomar como se explica en el paso 3.6 del protocolo.
Además de manejo para asegurar la integridad del tejido, también hay pasos críticos en el análisis de IHQ para interpretar cómo la rebanada asemeja al tejido nativo. Nuestro estudio anterior demostró que tumores NSCLC murinos exhiben heterogeneidad espacial pronunciado intra-tumor oncogénico señalización actividades26. Esto significa que el uso del tejido espacial distinto rebanadas para controles o las muestras tratadas con drogas pueden afectar la interpretación de datos experimentales fiables, y por lo tanto rodajas estrechamente adyacentes se deben utilizar como controles y las muestras de prueba. Además demostramos que mientras proliferación o expresión oncogénica fosfoproteína en rebanadas recién cortada inculto 0 h fueron similares en situ tumores, sectores cultivados demostraron alteración oncogénica fosfoproteína expresión, específicamente alterado p4EBP1 pSRC, así como proliferación alterada por IHC Ki67. P4EBP1 alterada expresión similar fue detectada en 24 h NSCLC humano y el cáncer de próstata cortar culturas (Narhi et al., suplementario figura S3B-S3C S5 y S7)26. Estos resultados avalan que comparación de sectores cultivados con su rebanada inculto más cercano de 0 h es esencial para evaluar la preservación de en situ las funciones tumor en rebanadas cultivadas.
A pesar de mejorar la viabilidad de organotypic rodajas25, existen limitaciones con el sistema del rotor en términos de tecnicismos. Colocar las rebanadas de tejido sobre rejillas de titanio es más difícil en comparación con los partes movibles del filtro, y una unidad de incubación rotatoria puede no estar disponible. Como alternativa, pueden utilizar soportes de filtro estancada, pero en ese caso sólo el lado expuesto de aire de las rebanadas debe ser analizado, como gradientes de filtro de aire en la viabilidad y la hipoxia por HIF1α expresión se forman rápidamente en apoyo de filtro laminar culturas (Davies et al., figura 5 y Figura 7A-7B)25. Además hemos demostrado que las culturas de rebanada de tumor pueden exhibir proliferación alterada y actividades de señalización oncogénicas en comparación con los tumores nativo26, posiblemente debido a las respuestas de cicatrización o adaptación metabólica de las rodajas a ex vivo 32de la cultura. Aunque brutas características morfológicas de los tumores murinas del NSCLC se mantuvieron durante el cultivo de 72 h, cambios proliferativos inducido por la cultura pueden afectar clasificación precisa de los sectores cultivados. Por lo tanto, sólo deben utilizarse rebanadas de tejido para estudios funcionales a corto plazo.
Uso de una unidad de incubación rotatoria rescata por lo menos parcialmente intra-slice viabilidad o biomarcadores gradientes de expresión, particularmente durante las primeras 24 h de cultivo. Una vez validado por la integridad y función, proporciona material de tejido para estudios funcionales, tales como estudios de tratamiento de drogas. Además de drogas perfiles de respuesta, expresión objetivo alterado después del tratamiento de drogas también puede beneficiarse validación de anticuerpo. Esto es particularmente relevante para la detección de epítopos murino con anticuerpos monoclonales de ratón, ya que estos tienden a dar alta fondo tinción. Además, anticuerpos validados debe conseguir datos fiables y reproducibles en contextos clínicos y de diagnóstico. Así, la modulación de la abundancia o la fosforilación de los epitopos pertinentes siguiendo tratamiento farmacológico en cortes de tejidos proporciona una aplicación práctica útil en la validación de anticuerpo. Una ventaja importante de las culturas de rebanada de tumor es la capacidad para modelo espacial distribuido funciones, incluyendo actividades de señalización oncogénicas o respuesta del fármaco en el tumor o las células estromales, que hace un modelo atractivo ex vivo . Sin embargo, rebanadas giran durante el cultivo y el proceso de cultivo puede dañar más el tejido especialmente en los bordes. Es por lo tanto un reto a recubrimiento precisamente las imágenes IHC teñido de biomarcadores de rebanadas de 0 h con las regiones necróticas en rebanadas cultivadas, que compromete la capacidad precisamente vincular las actividades de biomarcadores espacial a la respuesta de la droga. Además, las respuestas necróticas tumor intrínseco, inducida por la cultura y droga-inducida son indistinguibles por lo menos en murinos rebanadas de tejido de CPCNP, comprometer la cuantificación precisa de las respuestas de droga espacial. Finalmente, el uso de culturas de corte del tumor permite un investigador a prueba múltiples compuestos en el tumor mismo, sin necesidad de tratar a los animales, así refinar, reducir y sustituir los experimentos en animales de laboratorio.
Como una aplicación futura, el protocolo descrito puede ser adoptado para las muestras clínicas tumor sólido. Otras modificaciones de depende del tipo de tejido u optimizaciones son probablemente necesarias, a partir de ajustes a la configuración de vibratome incluyendo rebanada grueso y vibración de velocidad para optimizar estos para textura de tumor o rigidez. Además, requerimiento de nutrientes y factor de crecimiento puede variar para los tejidos del tumor diferentes. Por ejemplo, rodajas de cáncer de mama han sido cultivadas con la insulina en el medio13,18. Dado que el material tejido limitada se obtiene durante la cirugía o biopsia, optimización de las culturas de rebanada de tumor derivados del paciente puede ser difícil debido a las dificultades en la obtención de un número suficiente de muestras replicadas. Además, reproducibilidad de datos está cuestionada también por una pronunciada heterogeneidad de la muestra de paciente a paciente, particularmente en el porcentaje de células del tumor versus regiones fibróticas o stromal infiltra, así como componentes de tejido necrótico. Por último, aplicación de rodajas de tumor en configuración diagnóstico requeriría investigación del grado a que droga respuestas en explantes de rebanada de biopsias pre-tratamiento coincide con respuestas después del tratamiento en vivo .
Divulgaciones
Autores no declaran ningún conflicto de interés.
Agradecimientos
Esta investigación trabajo recibió apoyo financiero de la iniciativa de medicinas innovadoras empresa común otorgar acuerdo no 115188, el programa de doctorado de Universidad de Helsinki en becas Biomedicina (A.S.N.) y la Sigrid Juselius y Orion-Farmos fundaciones (E.W.V.). Agradecemos sinceramente a nuestros miembros del consorcio plataforma PREDECT tejido rebanada (Taija af Hällström y Siv Knaappila para apoyo en el sistema de rotor y Riku Turkki para la ayuda con el análisis MATLAB. Jouko Siro se agradece para capturar las fotografías de la figura 1. Agradecemos al equipo de FIMM WebMicroscope para escanear diapositivas histológicas, y el centro de animales de laboratorio para la cría de apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| Hank’s Balanced salt solution (HBSS) | Sigma | H6648 | |
| Penicillin Streptomycin solution | Thermo Fischer Scientific | 15140-122 | |
| Ham's F-12 medium | Thermo Fischer Scientific | 21765-037 | |
| Glucose | VWR | 101174Y | |
| FBS | Thermo Fischer Scientific | 10270-106 | |
| Glutamine 200mM | Thermo Fischer Scientific | 25030-024 | |
| Cyanoacrylate adhesive (GLUture) | Abbott | 32046-90-1 | |
| Leica VT1200 S vibrating blade microtome | Leica Biosystems | 14048142066 | |
| Slicing blade | VWR | PERS60-0138 | |
| Titanium grids | Albamma Research and Development | MA0036 | |
| Slice incubation unit | Albamma Research and Development | MD2500 | |
| 10 cm tissue culture plate | Sarstedt | 83.1802 | |
| 24-well plate | Sarstedt | 83.1836 | |
| 6-well plate | Sarstedt | 83.1839 | |
| Neolus Hypodermic Needles | Terumo Neolus | NN2525R | |
| 50 mL falcon tube | Greiner | 227261 | |
| PBS | Lonza | BE17-517Q | |
| Formaldehyde | Fisher | F/1501/PB08 | |
| Trifold histo cassette paper | Cancer Diagnostics | DX26280 | |
| Histo cassettes | VWR | 720-2199 | |
| KOS The microwave multifunctional tissue processor | Milestone SRL | CAT307EN-003 | |
| Microtome | Thermo Fischer Scientific | HM355S | |
| Superfrost Ultra plus slides | VWR | 631-0099 | |
| BSA | Sigma | A2153 | |
| NGS | Thermo Fischer Scientific | 16210-064 | |
| Citric acid | Sigma | C1909 | |
| PT-Module | Thermo Fischer Scientific | A80400012 | |
| Hematoxylin for H&E staining | Merck | 1.09249.0500 | |
| Hematoxylin for counter staining | Dako | S3309 | |
| Eosin | Sigma | E4382 | |
| NKX2-1 antibody | Abcam | ab133638 | Lot Number: GR98031-12 |
| pERK 1/2 antibody | Cell Signaling Technologies | CST 4370 | Lot Number: 17 |
| p4EBP1 antibody | Cell Signaling Technologies | CST 2855 | Lot Number: 20 |
| BrightVision poly-HRP Goat anti-rabbit secondary antibody | ImmunoLogic | VWRKDPVR-110HRP | |
| Mounting medicum pertex | VWR | MEDT41-4021-00 | |
| DAB | ImmunoLogic | VWRKBSO4-110 | |
| Dactolisib (NVP BEZ-235) | Selleckchem | S1009 | |
| Selumetinib (AZD2644) | Selleckchem | S1008 | |
| Pannoramic 250 slide scaner | 3DHISTECH | ||
| MATLAB | MathWorks | https://se.mathworks.com/products/matlab.html | |
| 3DHISTECH PANNORAMIC VIEWER | 3DHISTECH | https://www.3dhistech.com/pannoramic_viewer | |
| Adobe Photoshop CS6 | Adobe | https://www.adobe.com/products/photoshop.html?sdid=KKQIN&mv=search&s_kwcid=AL!3085!3!247821564908!e!!g!!adobe%20photoshop&ef_id=U8T1GwAABVTK3gDR:20180712103259:s | |
| Fiji-ImageJ | ImageJ | https://imagej.net/Fiji | |
| CellProfiler | CellProfiler cell image analysis software | http://cellprofiler.org/ |
Referencias
- Bruin, E. C., McGranahan, N., Swanton, C. Analysis of intratumor heterogeneity unravels lung cancer evolution. Molecular and Cellular Oncology. 2 (3), e985549 (2015).
- Travis, W. D., et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. Journal of Thoracic Oncology. 10 (9), 1243-1260 (2004).
- Junttila, M. R., de Sauvage, F. J. Influence of tumour micro-environment heterogeneity on therapeutic response. Nature. 501 (7467), 346-354 (2013).
- Kredel, F. E. Tissue Culture of Intracranial Tumors with a Note on the Meningiomas. The American Journal of Pathology. 4 (4), 337-340 (1928).
- Wright, J. C., et al. Further investigation of the relation between the clinical and tissue culture response to chemotherapeutic agents on human cancer. Cancer. 15, 284-293 (1962).
- Roller, M. R., Owen, S. P., Heidelberger, C. Studies on the organ culture of human tumors. Cancer Research. 26 (4), 626-637 (1966).
- Reinbold, R. [Organotypic differentiation of the eye of the chick embryo in vitro]. Comptes rendus des séances de la Société de biologie et de ses filiales. 148 (15-18), 1493-1495 (1954).
- Loffredo Sampaolo, C., Sampaolo, G. [Organotypic cultures of chick embryo lung; some histologic and histochemical aspects]. Bollettino della Societa Italiano di Biologia Sperimentale. 32 (7-8), 797-801 (1956).
- Bousquet, J., Meunier, J. M. [Organotypic culture, on natural and artificial media, of fragments of the adult rat hypophysis]. Comptes rendus des séances de la Société de biologie et de ses filiales. 156, 65-67 (1962).
- Merz, F., et al. Organotypic slice cultures of human glioblastoma reveal different susceptibilities to treatments. Neuro-Oncology. 15 (6), 670-681 (2013).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. The British Journal of Cancer. 110 (2), 479-488 (2014).
- Estes, J. M., et al. Efficacy of anti-death receptor 5 (DR5) antibody (TRA-8) against primary human ovarian carcinoma using a novel ex vivo tissue slice model. Gynecologic Oncology. 105 (2), 291-298 (2007).
- Kuip, H., et al. Short term culture of breast cancer tissues to study the activity of the anticancer drug taxol in an intact tumor environment. The British Journal of Cancer. 6, 86 (2006).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proceedings of the National Academy of Sciences. 107 (18), 8352-8356 (2010).
- Zimmermann, M., et al. Improved reproducibility in preparing precision-cut liver tissue slices. Cytotechnology. 61 (3), 145-152 (2009).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American journal of physiology. Heart and circulatory physiology. 308 (9), H1112-H1125 (2015).
- Jaamaa, S., et al. DNA damage recognition via activated ATM and p53 pathway in nonproliferating human prostate tissue. Cancer Research. 70 (21), 8630-8641 (2010).
- Naipal, K. A., et al. Tumor slice culture system to assess drug response of primary breast cancer. The British Journal of Cancer. 16, 78 (2016).
- Gahwiler, B. H., Thompson, S. M., Muller, D. Preparation and maintenance of organotypic slice cultures of CNS tissue. Current protocols in neuroscience. , (2001).
- Alfaqeeh, S. A., Tucker, A. S. The slice culture method for following development of tooth germs in explant culture. Journal of Visualized Experiments. 10 (81), (2013).
- Rak-Raszewska, A., Hauser, P. V., Vainio, S. Organ In Vitro Culture: What Have We Learned about Early Kidney Development?. Stem Cells International. , 959807 (2015).
- Trowell, O. A. The culture of mature organs in a synthetic medium. Experimental Cell Research. 16 (1), 118-147 (1959).
- Gahwiler, B. H., Capogna, M., Debanne, D., McKinney, R. A., Thompson, S. M. Organotypic slice cultures: a technique has come of age. Trends in Neurosciences. 20 (10), 471-477 (1997).
- Kiviharju-af Hallstrom, T. M., et al. Human prostate epithelium lacks Wee1A-mediated DNA damage-induced checkpoint enforcement. Proceedings of the National Academy of Science. 104 (17), 7211-7216 (2007).
- Davies, E. J., et al. Capturing complex tumour biology in vitro: histological and molecular characterisation of precision cut slices. Scientific Reports. 5, 17187 (2015).
- Narhi, K., et al. Spatial aspects of oncogenic signalling determine the response to combination therapy in slice explants from Kras-driven lung tumours. The Journal of Pathology. 245 (1), 101-113 (2018).
- Majumder, B., et al. Predicting clinical response to anticancer drugs using an ex vivo platform that captures tumour heterogeneity. Nature Communications. 6, 6169 (2015).
- Nagaraj, A. S., et al. Cell of Origin Links Histotype Spectrum to Immune Microenvironment Diversity in Non-small-Cell Lung Cancer Driven by Mutant Kras and Loss of Lkb1. Cell Reports. 18 (3), 673-684 (2017).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Weeber, F., Ooft, S. N., Dijkstra, K. K., Voest, E. E. Tumor Organoids as a Pre-clinical Cancer Model for Drug Discovery. Cell Chemical Biology. 24 (9), 1092-1100 (2017).
- Hoogt, R., et al. Protocols and characterization data for 2D, 3D, and slice-based tumor models from the PREDECT project. Scientific Data. 4, 170170 (2017).
- Davidson, S. M., et al. Environment Impacts the Metabolic Dependencies of Ras-Driven Non-Small Cell Lung Cancer. Cell Metabolism. 23 (3), 517-528 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados