Method Article
Alta resolución con motivos Biofilm deposición utilizando pDawn-Ag43
En este artículo
Resumen
Demostrar un método para depositar biofilms bacterianos de Escherichia coli en patrones espaciales arbitrarios con una alta resolución utilizando la estimulación óptica de una construcción de superficie de adherencia genéticamente codificada.
Resumen
Diseño y estructura espacial juegan un papel importante en biopelículas bacterianas. Aquí se demuestra un método accesible para el cultivo de biofilms de e. coli en patrones espaciales arbitrarios en alta resolución espacial. La técnica utiliza una construcción genéticamente codificado optogenetic-pDawn-Ag43 — que parejas formación de biofilms de e. coli a la estimulación óptica con luz azul. Detallamos el proceso para la transformación de e. coli con pDawn-Ag43, preparando el montaje óptico requiere y el protocolo para el cultivo de biofilms modelados utilizando bacterias pDawn Ag43. Mediante este protocolo, biofilms con una resolución espacial por debajo de 25 μm puede ser modelados en diversas superficies y ambientes, incluyendo cámaras cerradas, sin necesidad de microfabricación, instalaciones de salas limpias o tratamiento previo superficial. La técnica es conveniente y apropiado para uso en aplicaciones que investigar el efecto de la estructura del biofilm, proporcionando control armonioso sobre patrones de biofilm. En términos más generales, también tiene potenciales aplicaciones en bio-arte, educación y biomateriales.
Introducción
Biofilms son comunidades une superficie de microbios y son bien sabidos para su acoplamiento fuerte estructura y función. Geometría espacial y el patrón de los biofilms juegan un papel importante en funciones generales de la comunidad (y viceversa)1. La longitud pequeña escala participan en la estructura del biofilm, del orden de decenas de micras2— hacer armonioso y cómodo control de biofilm patrones un problema desafiante. Aquí demostramos un protocolo que permite biofilms que precisamente modelada en geometrías arbitrarias, basados en iluminación óptica.
El protocolo presentado aquí utiliza pDawn-Ag433, un constructo optogenetic que formación de biopelículas en la bacteria e. coli a la iluminación óptica conduciendo a la expresión de Ag43 (un adhesina gene responsable de la adherencia superficial y biofilm formación) bajo el control de pDawn4 (un regulador transcripcional controlado por iluminación óptica). El método es cómodo de usar y puede patrón biofilms en diferentes ambientes, incluyendo cámaras cerradas cultura (transparente) la superficie. En comparación con los existentes métodos de deposición de células, tales como la deposición de gotas5 o superficie prepatterning/tratamiento6, pDawn-Ag43 no requiere instalaciones de microfabricación o sala limpia y no requiere de materiales más allá de las disponible a un laboratorio de Microbiología típico. Es capaz de patrón con una resolución espacial por debajo de 25 μm, acercándose a las dimensiones espaciales de microcolonias en naturalmente existentes de biofilms2. En general, esta técnica proporciona la habilidad de manipular la estructura del biofilm, que abre muchas avenidas para estudiar microecology en comunidades bacterianas7. Además, modelados biofilms puede proporcionar una plataforma conveniente sobre la cual diseñar biomateriales útiles8,9. En este artículo, discutimos el protocolo básico requerido para patrones biofilms con pDawn-Ag43 y dirección posibles modificaciones y resolución de problemas relacionados con el método.
Protocolo
1. preparación de las cepas bacterianas de pDawn-Ag43
- PDawn-Ag43 se transforman en una cepa de e. coli de interés (figura 1).
- Cultivar una cepa clonación hosting pDawn Ag43 plásmido (disponibles en un repositorio de plásmido) al inocular la cepa en caldo LB suplementado con espectinomicina de 50 μg/mL (LB + spec) en un tubo de cultivo (durante la noche en un incubador de agitación a 250 rpm, 37 ° C). A continuación, utilice un kit de miniprep para cosechar el plásmido purificado pDawn-Ag43 del10.
- Elegir una cepa de e. coli de interés para ser modelado. Hasta el momento, pDawn-Ag43 ha sido verificada en MG16553 y BW25113.
- Utilizar un protocolo establecido para generar competentes (por ejemplo, químicamente competentes11 o espectro12) las existencias de los elegidos e. coli cepa (p. ej., MG1655).
- Transformar pDawn Ag43 plásmido en la bacteria competente11,12, seguidas de la recuperación de 1 h y placa de LB + las placas de agar especificaciones. Permitir que las colonias al crecer durante la noche a 37 ° C.
- Tienda pDawn-Ag43 transforma las cepas.
- Inocular una colonia única de pDawn-Ag43 de una LB + espec. placa de agar en LB + especificaciones caldo en un tubo de cultivo y crecer en un incubador de agitación (a 250 rpm, 37 ° C) a la fase exponencial (OD600 ~0.4 - 0.8).
- Preparar la bolsa para almacenar la tensión transformada de pDawn-Ag43 a-80 ° C a largo plazo mezclando 1 mL de cultivo con 1 mL de glicerol estéril de 50% en un cryo-tubo para obtener un 25% de glicerol acción de congelador. Guarde en un congelador de-80 ° C.
- Si plásmidos adicionales (p. ej., plásmidos reportero fluorescente) necesitan transformarse, crear células competentes11,12 de pDawn-Ag43 transforma la tensión y repetir el proceso de transformación11 , 12 para plásmidos adicionales según sea necesario.
Nota: Si utiliza la electroporación8, es posible cotransform múltiples plásmidos (incluyendo pDawn-Ag43) simultáneamente; sin embargo, una transformación simultánea no se recomienda métodos de transformación química, como el de gran tamaño (> 10 kB) de pDawn-Ag43 se reduce la eficiencia de transformación.
2. preparación de la configuración óptica del proyector para iluminar las bacterias
- Obtener una incubadora bacteriana con paredes no transparentes y un orificio para pasar cables, un proyector portátil capaz de montaje y funcionamiento dentro de la incubadora bacteriana, y un ordenador portátil equipado con el software para presentación de proyección (véase tabla de Materiales). Al elegir el proyector y la incubadora, asegúrese de que la distancia de enfoque mínima del proyector está a menos de la altura interior de la incubadora.
- Coloque el proyector dentro de la incubadora en la parte inferior, con la abertura apuntando directamente hacia arriba, al techo, donde la cámara de cultura del biofilm está había conectado (figura 2).
- Fijar el proyector en su lugar mediante la construcción de una instalación con una placa óptica base conectado a un poste vertical, a su vez conectado a un poste horizontal que tornillos en el proyector (figura 2). Tenga en cuenta que esta configuración puede modificarse dependiendo de las piezas del proyector/disponible. En definitiva, el requisito clave es que el proyector se fija sólidamente en la parte inferior de la incubadora, con la abertura hacia arriba.
- Conecte la laptop mediante el cable de la pantalla (por ejemplo, HDMI) el proyector dentro de la incubadora.
- Si las superficies — especialmente el techo, del interior de la incubadora son reflexivo (p. ej., superficie de metal pulida), cubrir con superficies mates oscuras para reducir al mínimo reflexiones.
- Utilice cinta para conectar un plato vacío de cultura 'dummy' para el techo de la incubadora. Tenga en cuenta que, como con el proyector, hay múltiples maneras aceptables para colocar una placa de cultivo; Asegúrese de que la superficie del fondo transparente de la cámara de la cultura, donde se produce la iluminación, no está cubierta.
- Ajuste el enfoque del proyector girando la perilla de enfoque para que los plano de enfoque coincide con la superficie inferior de la placa de cultivo de biofilm (p. ej., un plato bien) en el techo de la incubadora (figura 2). El proyector debe iluminar una imagen fuerte, no borrosa en la parte inferior de la placa de cultivo. Retire la placa de cultivo 'dummy' una vez que se ha optimizado la proyección.
- Utilizando el software de la laptop, directo del proyector para iluminar todo el campo de visión con iluminación azul máxima (p. ej., RGB = [0, 0, 255]) mediante la presentación de una diapositiva completa azul.
- Medir la intensidad de iluminación del proyector usando un medidor de potencia óptica colocando la cabeza del fotodetector en el techo de la incubadora y lectura de la intensidad en el medidor de energía correspondiente, calibrada a luz de longitud de onda 460 nm. Siga las instrucciones de conectar y calibrar el fotodetector para el medidor de potencia específica utilizado.
- Reducir la luz ambiental (por ejemplo, apagar luces de la habitación, o colocar la incubadora lejos de fuentes de luz) tanto como sea posible antes de realizar la iluminación medidas de intensidad.
- Ajustar la intensidad de iluminación utilizando un filtro de densidad neutra ajustable colocado en la abertura del proyector. Gire el filtro para ajustar la intensidad de iluminación, medida por el medidor de energía, hasta que la intensidad de iluminación en el centro de la región proyectada luz azul 50 μW/cm2.
Nota: Mientras que es posible ajustar la intensidad de iluminación mediante los valores RGB azul inferiores en el extremo de software, utilizando un filtro mientras que maximiza el valor RGB azul tiene la ventaja de maximizar el contraste óptico del sistema entre iluminados vs . las regiones oscuras. - Dibujar patrones arbitrarios usando el software de presentación/proyector en el ordenador portátil y mostrar estos patrones en el techo de la incubadora, utilizando el proyector.
Nota: Regiones de formación de Biofilm deben extraerse con máxima iluminación azul (p. ej., RGB = [0, 0, 255]), regiones de formación de biofilm no con ninguna iluminación (p. ej., RGB = [0, 0, 0]).
3. cultivos con biopelículas
- Antes de la iluminación, preparar las bacterias pDawn-Ag43, a partir de la acción de congelador de glicerol, para que ellos se inducen confiablemente en la última fase de crecimiento exponencial para la iluminación (Figura 3A).
- Raya una cepa de pDawn-Ag43 de stock de glicerol en LB + las placas de agar especificaciones. Permitir que las colonias que crecen durante la noche (37 ° C).
Nota: Desde aquí hasta el paso de la cultura de la iluminación, asegúrese de que las células permanecen en la oscuridad tanto como sea posible, breves períodos en el ambiente iluminación (por ejemplo, para subdilution) son aceptables. - Inocular una colonia de bacterias pDawn-Ag43 de una placa de agar en LB + caldo de especificaciones y crecer la cultura de la noche a la fase estacionaria (en un incubador de agitación a 250 rpm, 37 ° C, ~ 16 h).
- Subdilute la cultura en una relación de 1:1,000 con LB + caldo de especificaciones (p. ej., añadir 1 μL de la cultura durante la noche a 1 mL de LB fresco + spec).
- Permita que la cultura subdiluted a crecer hasta la última fase estacionaria exponencial temprano (OD ~ 1.0, ~ 6 h en un incubador de agitación a 250 rpm, 37 ° C).
- Espera de la cultura crecer, preparar medios M63 1 x M63 sales 1 mM MgSO4, glucosa 0,2%, 0,1% casamino ácidos y espectinomicina 50 μg/mL en agua (Asegúrese de que las partes constituyentes son estériles).
- Subdilute la cultura de la última fase exponencial en una proporción de 1: 100 con medios M63 suplementados con 50 espectinomicina μg/mL. Luego, introducir la dilución en una placa de cultivo de biofilm (p. ej., pipetear la muestra diluida en una placa bien).
Nota: Los volúmenes requeridos para este subdilution de 1: 100 dependen de la placa de cultivo se utiliza (por ejemplo, si utiliza una placa poliestireno 6-bien de bien [no--cultivo de tejidos Tratado], una sola muestra requiere agregar 20 μL de cultivo 2 ml de M63 + spec, como la volumen pozo de una placa de 6 pozos es de ~ 2 mL).
- Raya una cepa de pDawn-Ag43 de stock de glicerol en LB + las placas de agar especificaciones. Permitir que las colonias que crecen durante la noche (37 ° C).
- Como las muestras están ahora listas para la iluminación, cinta de la placa de cultivo en el techo de la incubadora, asegurándose de que la superficie en la parte inferior del plato es transparente para la iluminación desde abajo por el proyector.
Nota: Es importante asegurarse de que el techo de la incubadora no es reflexivo, para reducir al mínimo la iluminación callejero. Iluminación callejero también puede reducirse mediante el uso de las placas de pared negro como platos de la cultura, aunque no es estrictamente necesario, si utiliza tales placas, asegurar la superficie inferior es transparente. - Permiten las biopelículas a la cultura en la incubadora durante la noche (16 h con ninguna agitación a 37 ° C). Tenga en cuenta que algunos proyectores se convierten en menos confiables a temperaturas más altas. Si es el caso, cultura a temperaturas más bajas (p. ej., 30 ° C), teniendo en cuenta que el tiempo de incubación puede necesitar ser aumentada, dependiendo de la cepa de e. coli .
4. proyección de imagen de estampado Biofilms
- Después del crecimiento durante la noche de las muestras de la biopelícula, retire la placa de cultivo de la incubadora. El plato tendrá biofilm las bacterias a su superficie inferior que ha sido iluminado, así como bacterias planctónicas dispersadas en el medio líquido anterior.
- Deseche las células planctónicas quitando el medio líquido de la placa de cultivo (por ejemplo, aspirando suavemente con una pipeta).
- Enjuague la muestra 2 x con una solución de tampón fosfato salino (PBS) para eliminar las células planctónicas restantes (figura 3B) transfiriendo suavemente en PBS, seguido de aspiración.
- Si las células se han etiquetado fluorescente, imagen directamente las muestras usando fluorescencia microscopía13 (p. ej., todo el campo13, confocal 3D14, etc.).
Nota: Biofilms fluorescentes puede también conservarse usando un medio de montaje autoendurecible. Aplique una gota de los medios de comunicación a una muestra de biofilm de montaje, cubrir con un cubreobjetos de vidrio, teniendo cuidado de no para capturar las burbujas por debajo y a endurecerse durante la noche antes de la proyección de imagen. - Si las células bacterianas no son etiquetadas fluorescente, aplique cristal violeta colorante técnica15 (figura 3B) para mejorar el contraste de la biopelícula antes de la proyección de imagen.
5. Protocolo de modificaciones/alternativas
- Crecen las bacterias pDawn-Ag43 sobre diferentes superficies.
- Poner cristal o poli-Dimetil-Siloxano (PDMS) cupones (por ejemplo, cubreobjetos o tiras delgadas de PDMS) en placas de pozos antes de la adición de una muestra bacteriana/iluminación y seguir el mismo protocolo como antes a patrón pDawn ag43 biofilms en vidrio y PDMS.
- Crecen bacterias pDawn Ag43 dentro de una cámara transparente, incluida la cultura.
- Generar un molde de la cámara de cultura para PDMS.
- Para un compartimiento de la cultura básica, generar molde colocando un prisma rectangular, duro a una superficie plana (el prisma se convertirá en una cavidad en el PDMS que sirve como el compartimiento de la cultura una vez que el molde se echa). Tenga en cuenta que más intrincada cultura cámara moldes pueden fabricarse utilizando litografía blanda16.
- Molde una cavidad PDMS de PDMS que vierte en el molde y dejar que se cure (un protocolo detallado de litografía blanda, ver base de datos de ciencia educación16 de JoVE).
- Después de curar, recortar cualquier exceso PDMS, perforar canales de entrada y salida en la cámara de la cavidad/de la cultura y de bonos de la cavidad a una superficie plana (p. ej., vidrio/poliestireno) apretando con fuerza el PDMS en la superficie plana, dejando la cavidad entre la superficie y el techo de PDMS como la cámara de cultura del biofilm.
Nota: También se puede utilizar la vinculación más permanente basada en plasma tratamiento16 , pero los chips no serán reutilizables. - Seguir el protocolo de la cultura como antes, utilizando una jeringa con agujas de punta Roma (en vez de una pipeta) para introducir la muestra bacteriana en el cámara de cultura/enjuague con tampón PBS (figura 3).
- Si usa una cavidad temporal servidumbre, use presión negativa sólo tirar líquido en/fuera de la cámara, para asegurarse de que la cavidad no sea no adherente de la superficie de vidrio/poliestireno subyacente.
- Generar un molde de la cámara de cultura para PDMS.
- Crecer pDawn Ag43 bacterias usando un photomask película para iluminación estructurada.
- Diseño de un modelo de biofilm mediante software CAD compatible con un servicio de impresora e impresión de película photomask. El diseño de la película de fotomáscara debe ser claro en las regiones donde el biofilm está destinado a ser impreso y negro/opaco en otros lugares. Cuando termine, envíe el archivo de fotomáscara al servicio de impresión de la impresora y esperan el regreso de la fotomáscara física.
- Instruir el proyector para iluminar un campo de visión completo con iluminación azul máxima (p. ej., RGB = [0, 0, 255]) utilizando el software de ordenador portátil.
- Recortar una región de interés de la más grande película photomask y cinta directamente a la parte inferior de la cultura de biofilm del plato antes de la introducción de la muestra bacteriana para la iluminación durante la noche (figura 3D). Cultura los biofilms como antes y el photomask después cultivo, antes de la proyección de imagen.
Resultados
Como se ve en la Figura 4A, pDawn-Ag43 bacterias se utilizaron para generar biopelículas con motivos en poliestireno bien placas con iluminación proyector (el proyector nace para iluminar un patrón de lunares), reflejada a través de microscopía brightfield con cristal mancha violeta como un agente de contraste y microscopia de fluorescencia utilizando bacterias de expresión de la proteína fluorescente roja. Muestras de biopelícula fluorescentes también pueden ser reflejadas utilizando microscopía confocal14 para obtener imágenes de la biopelícula en 3-d (Figura 4B). En la figura 4, ilustramos el patrón alta resolución posible utilizando un photomask película para proporcionar iluminación modelada a la muestra de biofilm. Finalmente, en la figura 4 y 4E, demostramos ejemplos de modelar en vidrio y superficies PDMS, así como cerrados PDMS cultura cámaras — éstos ilustran los diferentes tipos de ambientes donde se pueden aplicar patrones de pDawn-Ag43.
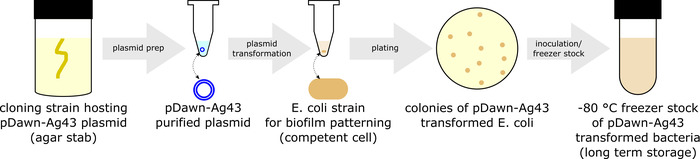
Figura 1: preparación de Ag43 de pDawn bacterias (protocolo sección 1). Preparación pDawn-Ag43 bacterias capaces de la formación de biofilm de luz regulado implica purificación plásmidos pDawn Ag43 desde una clonación de tensión, transformándola en una cepa de e. coli de interés y crear acción bacteriana congelador para a largo plazo almacenamiento de información. Haga clic aquí para ver una versión más grande de esta figura.
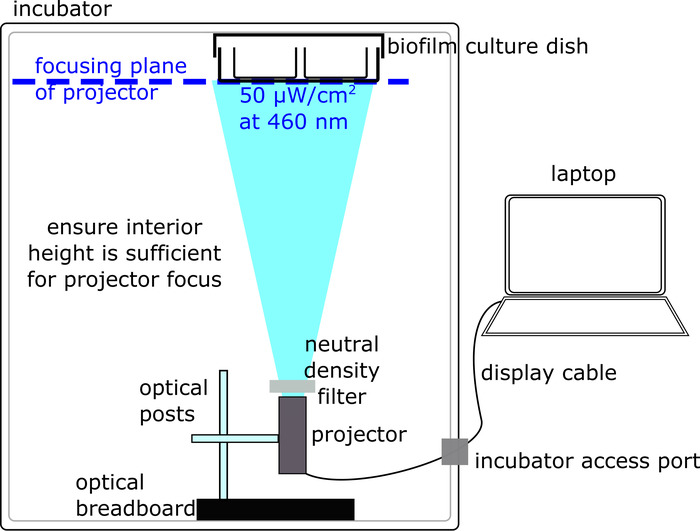
Figura 2: preparación de un montaje óptico para la iluminación de la muestra de biofilm (Protocolo, artículo 2). La configuración óptica se encuentra dentro de una incubadora de bacteria y consiste en un proyector de ordenador conectado iluminar una muestra de biofilm. Haga clic aquí para ver una versión más grande de esta figura.
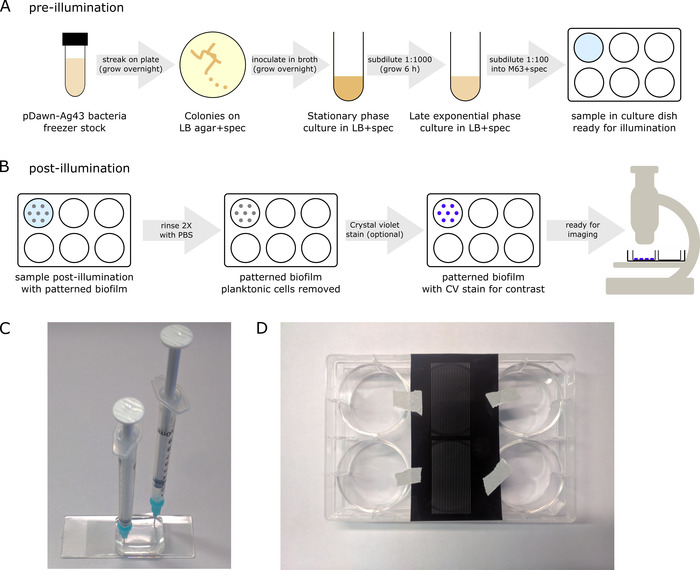
Figura 3: protocolo para patrones biofilms (artículo 3 del Protocolo) de la cultura. (A) previo a la iluminación, pDawn-Ag43 bacterias se preparan antes de patrones que confiablemente son inducidos en la fase de crecimiento adecuada. (B) después de una noche iluminada de crecimiento, un biofilm con motivos estará presente en la parte inferior de la placa de cultivo, junto con las células planctónicas en el medio líquido, y después de alguna transformación posterior, el biofilm está listo para la proyección de imagen. (C) como una alternativa a las placas, los biofilms puede cultivarse en cámaras de cultivo cerrado como una cavidad moldeada de PDMS. En este caso, pueden utilizarse jeringas a las agujas de punta Roma para introducir la muestra y eliminar líquidos fuera de la cámara. (D) como una alternativa a los patrones de iluminación basada en proyector, patrones también pueden ser generados por grabar patrones de película directamente a la parte inferior de la cámara de cultura del biofilm. En este caso, se debe configurar el proyector para iluminar luz azul a través del campo completo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: resultados representativos de los biofilms con dibujos utilizando pDawn-Ag43. Todos los resultados se obtuvieron empleando una cepa de host MG1655 e. coli . (A) pDawn-Ag43 bacterias se utilizaron para generar biopelículas con motivos en poliestireno bien placas con iluminación proyector (el proyector nace para iluminar un patrón de lunares), reflejada a través de microscopía brightfield con tinción de cristal violeta como un agente de contraste y microscopia de fluorescencia utilizando bacterias de expresión de la proteína fluorescente roja. (B) muestras de biopelícula fluorescente son imágenes con microscopía confocal para obtener imágenes 3D de la biopelícula. (C) alta resolución biofilms puede estampados con un photomask película para proporcionar iluminación modelada a la muestra de biofilm. (D) Biofilms puede estampados en vidrio y superficies PDMS. (E) Biofilms puede modelados en cámaras de cultivo cerrado. Esta figura ha sido adaptada del trabajo anterior3. Haga clic aquí para ver una versión más grande de esta figura.
| Problema | Posibles causas y soluciones |
| Transformando pDawn-Ag43 en variedad de host - sin colonias | Baja concentración de plásmido - verificar concentración de plásmido en el espectrómetro. Un típico miniprep de pDawn-Ag43 debe producir al menos 100 ng/μL; utilizar hasta 10-100 ng de transformación |
| Cheque/remake células competentes: las células competentes deben tener eficiencia de transformación por lo menos 10 ^ 6 UFC/μg verificado usando un plásmido estándar como pUC19 - si no, las células competentes remake | |
| Antibiótico incorrecto (nivel de) en placa de agar LB - Asegúrese de que utilizar 50 espectinomicina μg/mL para la selección | |
| Iluminación proyector enciende apagado / inconsistente durante la noche | Desactive el software de problemática tales como: actualización de software/OS durante la noche automática, filtro de luz azul de noche |
| Proyector puede ser sobrecalentamiento - set incubadora a una temperatura más baja mientras el proyector esté encendido (p. ej. 30 ° C en lugar de 37 ° C) - proyector de nota como fuente de calor puede sobrecalentar la incubadora más allá del punto de ajuste | |
| Quitar fuentes innecesarias de humedad de la incubadora, ya que puede afectar electrónica proyector | |
| No baja los niveles del biofilm forman después de la iluminación durante la noche, no hay crecimiento de las células planctónicas o (es decir, líquido claro) | Antibiótico incorrecto (nivel) - utilizar espectinomicina μg/mL 50 |
| Compruebe que todo se agrega a la receta M63 correctamente | |
| No baja los niveles del biofilm forman después de la iluminación durante la noche, sólo las células planctónicas (es decir líquido está nublado) | Echa luz, proyector debe ser iluminar luz azul a 50 μW/cm ^ 2 en longitud de onda de 460 nm |
| Trate de dejar las bacterias crecer por más corto/más tiempo después de 1: 1000 LB paso de subdilution antes de M63 | |
| Restreak las bacterias en la placa LB, a partir de Colonia fresca para generar cultura de fase estacionaria durante la noche | |
| Asegurar el proyector está trabajando constantemente durante la noche - ver punto anterior | |
| Patrones de biofilm Fuzzy, altos niveles de ruido de fondo | Reducir la luz del sistema de iluminación óptica, cubrir superficies reflectantes en el interior de la incubadora |
| Considere el uso de iluminación estructurada basada en fotomáscara (frente a base de proyector) | |
| Proyector de control se centra correctamente en la superficie inferior de la cámara de cultura del biofilm |
Tabla 1: Común problemas.
Discusión
A la luz de la necesidad de herramientas de investigación que permite para el control de la estructura de biopelícula, hemos presentado un protocolo fácil de usar para el dibujo biopelículas bacterianas mediante la construcción de optogenetic de pDawn-Ag43. Con esta técnica, biofilms de e. coli puede ser ópticamente con dibujos en varios ambientes superficiales, incluyendo cámaras cerradas, con una resolución espacial por debajo de 25 μm.
En general, este protocolo puede dividirse en cuatro secciones principales: (1) la preparación de las bacterias pDawn-Ag43, (2) la preparación de la óptica y cultura configuración hardware, (3) los pasos del crecimiento bacteriano de la iluminación y (4) la iluminación posterior los enjuagues y la proyección de imagen.
La parte crítica de la sección 1 es la exitosa transformación del plásmido pDawn-Ag43 en la cepa de e. coli de interés. Esto es facilitado por el aislamiento de plásmidos purificados de alta calidad y la generación de células competentes de alta calidad para la transformación (cuadro 1, solución de problemas).
La parte crítica de la sección 2 es la optimización de la configuración del proyector para que la intensidad de iluminación se ajusta a 50 μW/cm2 en la longitud de onda de 460 nm, y el proyector se centra correctamente a la altura de la muestra de biofilm. Tenga en cuenta que en el presente Protocolo, se describe una configuración de iluminación invertida donde el proyector ilumina desde abajo, hacia arriba hacia la muestra de biofilm. La ventaja de esta configuración es que la luz sólo necesita viajar a través de la parte inferior de la placa de cultivo antes de llegar a la superficie de la formación de biofilm. Iluminación desde arriba significa que la luz tendría que viajar a través de los medios líquidos sobre la superficie del biofilm, que, durante el curso del crecimiento, con las células planctónicas. Además de estas preocupaciones, también es importante minimizar la luz en la configuración óptica tanto como sea posible, por ejemplo, cubriendo las superficies reflectantes en el interior de la incubadora, esto ayuda a obtener biofilms con motivos más agudos. En una nota relacionada, más patrones de biofilm pueden obtenerse también mediante el uso de un photomask para controlar patrones de iluminación (figura 3D, figura 4). Problemas comunes que requieren solución de problemas incluyen problemas de confiabilidad de proyector en temperaturas más altas (por ejemplo, 37 ° C), que pueden ser minimizados por el crecimiento de biofilm en temperaturas más bajas (p. ej., 30 ° C) de incubación, así como de programas informáticos que hace actualizaciones del sistema operativo o luz azul durante el crecimiento durante la noche (tabla 1). También es importante tener en cuenta que, dependiendo del modelo de proyector incubadora usado, también es posible que el calor generado por el proyector resultará en una temperatura interior más alta que la incubadora temperatura, que puede necesitar ser corregido.
La parte crítica de la sección 3 es la obtención de las muestras bacterianas confiables y repetibles antes que son inducidos por iluminación. Por esta razón, se recomienda obtener colonias clonales de pDawn-Ag43 bacterias por las rayas en una placa de agar y luego siguiendo los pasos de cultivo líquido para asegurar que las bacterias son iluminados, inducido en la última fase de crecimiento exponencial en una repetición manera.
Finalmente, la parte crítica de la sección 4 está bien, pero también suavemente, lavar las células planctónicas restante después de la biopelícula patrones de protocolo; por lo tanto, se recomienda realizar múltiples pasos de enjuagado suave con PBS.
En comparación con las técnicas existentes para celular dibujos5,6, óptica biofilm patrones basado en pDawn-Ag43 tiene una razonablemente baja barrera de entrada a utilizar, en que no requiere de microfabricación, instalaciones de salas limpias, complejo química o tratamiento previo superficial, sin embargo, es todavía capaz de patrón con la alta resolución (μm 25) generalmente asociada con técnicas de microfabricación. El método extiende a trabajos previos en Fotolitografía bacteriana para el control de la expresión de gen17. Actualmente, pDawn Ag43 plásmido se limita a e. coli, ya que utiliza un origen basado en el pUC de la replicación, pero pDawn y Ag43 son ambos compatibles en otras especies bacterianas (bacterias Gram negativas). Técnicas genéticas disponibles para introducir potencialmente la formación de biopelículas regulado de la luz a diferentes especies bacterianas y representa una posible dirección para la investigación futura. Otra limitación potencial de la técnica es que funciona mediante el aumento de formación de biopelículas en cepas con formación de biofilm nativas débiles (p. ej., MG1655 e. coli). Sin embargo, cepas con formación de biopelículas nativo fuerte tienen forma biofilms independientemente de las condiciones de iluminación, imposibilitando la formación de biopelículas modelado utilizando pDawn-Ag43 como se describe aquí; sin embargo optogenetic técnicas todavía pueden resultar aplicables en la regulación de la formación de biopelículas. Observamos que en otros contextos, métodos alternativos de diseño de biofilm pueden estar disponibles, como la via óptica modulación c-di-GMP18.
En general, pDawn-Ag43 basado en patrones será apropiado para su uso en aplicaciones que investigar el efecto de la estructura de la biopelícula en función1 y, por lo tanto, podrían beneficiarse de armonioso control de biofilm patrones — particularmente relevante ejemplo a destacar es el estudio de la ecología microbiana en biofilms2. Direcciones futuras incluyen la fabricación de biomateriales con8,9 o comunidades bacterianas estructuradas. Aplicaciones alternativas del presente Protocolo accesible también incluyen bio-art19, dado el potencial estético claro, como ciencias formales e informales de la vida educación20,21,22. Desde una perspectiva educativa, el protocolo descrito aquí combina muchas técnicas pertinentes (cultivo bacteriano, transformación, óptica/optogenetics) y también es modular extensible (por ejemplo, incluyen la microfluídica).
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a vidrio D. H. Kim, N. Cira, A. Choksi, S. Rajan y B. claves para sus sugerencias y el laboratorio Spormann para acceder a su microscopio confocal. Además, los autores reconocen el apoyo de Stanford Bio-X Bowes y PGS NSERC becas, el Instituto Nacional de salud (AI-R21-139941) y la American Cancer Society (RSG-14-177-01).
Materiales
| Name | Company | Catalog Number | Comments |
| DH5alpha/pDawn-Ag43 | Addgene | 107742 | DH5alpha cloning strain hosting pDawn-Ag43 plasmid - plasmid needs to be moved to E. coli strain of interest prior to use |
| MG1655 E. coli | Coli Genetic Stock Center - Yale University | CGSC #6300 | MG1655 was used as E. coli strain of interest in this paper's representative results |
| RFP expression plasmid | iGEM biobricks | J04450-pSB4K5bb | Many options exist to obtain fluorescent bacteria - if using plasmid, ensure backbone does not conflict with colE1 ori of pDawn-Ag43 |
| Plasmid miniprep kit | Qiagen | 27104 | |
| LB broth powder | Affymetrix | 75852 | Add 20 g/L to water, autoclave, add 50 μg/mL spectinomycin to get sterile LB+spec |
| LB agar powder | Affymetrix | 75851 | Add 35 g/L to water, autoclave, add 50 μg/mL spectinomycin, pour into petri dishes to get sterile LB+spec plates |
| Petri dishes | Fisherbrand | 431760 | |
| Spectinomycin hydrochloride pentahydrate | abcam | ab141968 | Make 1000x stock 50mg/mL in water, filter sterilize and dilute into media as needed |
| Glycerol | Sigma-Aldrich | G5516 | Mix at 1:1 ratio with water, sterilize by autoclave or filter to obtain 50% glycerol |
| M63 media salts 5X solution | Bio-world | 705729 | Add cas-amino acids, glucose and MgSO4, bring to 1X salts concentration by adding sterile water |
| Casamino acids | Amresco | J851 | Make 20% stock in water, filter sterilize and add to M63 as supplement (final concentration 0.1%) |
| D-glucose | Sigma-Aldrich | G8270 | Make 20% stock in water, filter sterilize and add to M63 as supplement (final concentration 0.2%) |
| Magnesium sulfate | Sigma-Aldrich | M7506 | Make 1 M stock in water, autoclave and add to M63 as supplement (final concentration 1 mM) |
| Crystal violet | Acros organics | 212120250 | Dilute to 0.1% in water prior to use |
| Self-hardening mounting media (Shandon immumount) | Thermo Scientific | 9990402 | Use to preserve samples over long term for fluorescence imaging |
| Phosphate buffered saline (PBS) solution | Gibco | 10010023 | Can also use PBS prepared from powder / tablets |
| 6 well plate | Fisherbrand | 351146 | Used as biofilm culture dish for representative results |
| PDMS kit | Dow | SYLGARD 184 | Can be used to make enclosed microchamber cavities using soft lithography |
| 1 mL syringe | BD syringe | 309659 | For use with liquid handling with enclosed microchambers |
| Blunt tip needle | CML supply | 901-23-050 | Attaches to 1 mL syringe |
| Lab tape | Fisherbrand | 15-901 | Use to attach culture chamber to incubator ceiling |
| Bacterial incubator | Sheldon Manufacturing | SMI6 | Ensure interior height of incubator is tall enough to focus projector at the ceiling |
| Portable projector | Ivation | IV-PJ-PRO-4-1 | Many portable projector models exist, pDawn-Ag43 has been tested with multiple models including LED/laser based, with blue light channel ranging from 450-460nm central wavelength |
| Optical breadboard base | ThorLabs | MSB6 | Base for optical setup to hold projector - many other setups possible, just need to hold projector firmly at bottom of incubator, pointing upwards |
| Optical post | ThorLabs | TR8 | 2 posts needed - one to be set up vertically extending out of breadboard base, one horizontally attached via right-angle clamp |
| Optical post right-angle clamp | ThorLabs | RA90 | Connects vertical and horizontal posts |
| Mounting base | ThorLabs | BA1S | Connects optical breadboard base and vertical post |
| 1/4"-20 screw | ThorLabs | SH25S050 | Attaches vertical post to mounting base, mounting base to breadboard base |
| 1/4"-20 set-screw | ThorLabs | SS25E63D | Connects horizontal post to projector via tripod screw-hole |
| Optical power meter | Newport | 840 | Use with power meter detector to measure projector illumination intensity - many power meter models exist, using one that has extendable detector will facilitate measurement |
| Optical power meter detector | Newport | 818-UV | Connects to power meter (above) - UV detector not strictly necessary as blue light is within visible range |
| Adjustable ND filter | K&F Concept | SKU0689 | Adjustable (by rotating) neutral density filter - place above projector aperture |
| Presentation-projector software | Microsoft | Powerpoint | Any software that allows drawing / presentation will suffice |
| CAD software | Autodesk | AutoCAD | Used for designing photomasks, many mask printing services are compatible with AutoCAD files |
| Film photomask | Fineline Imaging | n/a | Many photomask printer services exist for high resolution (>30000DPI) film photomask printing |
Referencias
- Costerton, J. W., Lewandowski, Z., Caldwell, D. E., Korber, D. R., Lappin-Scott, H. M. Microbial Biofilms. Annual Review of Microbiology. 49 (1), 711-745 (1995).
- Christensen, B. B., Haagensen, J. A. J., Heydorn, A., Molin, S. Metabolic commensalism and competition in a two-species microbial consortium. Applied and environmental microbiology. 68 (5), 2495-2502 (2002).
- Jin, X., Riedel-Kruse, I. H. Biofilm Lithography enables high-resolution cell patterning via optogenetic adhesin expression. Proceedings of the National Academy of Sciences of the United States of America. 115 (14), 3698-3703 (2018).
- Ohlendorf, R., Vidavski, R. R., Eldar, A., Moffat, K., Möglich, A. From dusk till dawn: one-plasmid systems for light-regulated gene expression. Journal of Molecular Biology. 416 (4), 534-542 (2012).
- Xu, T., et al. Construction of high-density bacterial colony arrays and patterns by the ink-jet method. Biotechnology and Bioengineering. 85 (1), 29-33 (2004).
- Gu, H., Hou, S., Yongyat, C., Detore, S., Ren, D. Patterned Biofilm Formation Reveals A Mechanism for Structural Heterogeneity in Bacterial Biofilms. Langmuir: the ACS Journal of Surfaces and Colloids. 29 (35), 11145-11153 (2013).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews: MMBR. 64 (4), 847-867 (2000).
- Nguyen, P. Q., Botyanszki, Z., Tay, P. K. R., Joshi, N. S. Programmable biofilm-based materials from engineered curli nanofibres. Nature Communications. 5, 4945 (2014).
- Chen, A. Y., et al. Synthesis and patterning of tunable multiscale materials with engineered cells. Nature Materials. 13, 515-523 (2014).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Plasmid Purification. Journal of Visualized Experiments. , (2018).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: The Heat Shock Method. Journal of Visualized Experiments. , (2018).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: Electroporation. Journal of Visualized Experiments. , (2018).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to Fluorescence Microscopy. Journal of Visualized Experiments. , (2018).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2010).
- O'Toole, G. A. Microtiter Dish Biofilm Formation Assay. Journal of Visualized Experiments. 47, e2437 (2011).
- JoVE Science Education Database. Bioengineering. Soft Lithography. Journal of Visualized Experiments. , (2018).
- Levskaya, A., Weiner, O. D., Lim, W. A., Voigt, C. A. Spatiotemporal control of cell signalling using a light-switchable protein interaction. Nature. 461 (7266), 997-1001 (2009).
- Huang, Y., Xia, A., Yang, G., Jin, F. Bioprinting Living Biofilms through Optogenetic Manipulation. ACS Synthetic Biology. 7 (5), 1195-1200 (2018).
- Kac, E. . Signs of Life: Bio Art and Beyond. , (2007).
- Lee, S. A., et al. Trap it!: A Playful Human-Biology Interaction for a Museum Installation. Proceedings of the 33rd Annual ACM Conference on Human Factors in Computing Systems. , 2593-2602 (2015).
- Cira, N. J., et al. A Biotic Game Design Project for Integrated Life Science and Engineering Education. PLOS Biology. 13 (3), e1002110 (2015).
- Bybee, R. W. The next generation science standards and the life sciences. Science and Children. 50 (6), 7 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados