Method Article
Investigación de la ruptura de la barrera intestinal en los organoides vivos
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí describimos una técnica para cuantificar la integridad de la barrera de los pequeños organoides intestinales. El hecho de que el método se base en organoides vivos permite la investigación secuencial de diferentes sustancias moduladoras de la integridad de la barrera o combinaciones de las mismas de una manera resuelta en el tiempo.
Resumen
Los organoides y los cultivos celulares tridimensionales (3D) permiten la investigación de mecanismos biológicos complejos y regulaciones invitro, lo que antes no era posible en las monocapas clásicas de cultivo celular. Además, los cultivos celulares monocapa son buenos sistemas de modelos in vitro, pero no representan los complejos procesos y funciones de diferenciación celular que se basan en la estructura3D. Esto hasta ahora sólo ha sido posible en experimentos con animales, que son laboriosos, consumen mucho tiempo y son difíciles de evaluar mediante técnicas ópticas. Aquí describimos un ensayo para determinar cuantitativamente la integridad de la barrera con el tiempo en los pequeños organoides intestinales vivos. Para validar nuestro modelo, aplicamos interferón gamma (IFN-o) como un control positivo para la destrucción de barreras y organoides derivados de los ratones del receptor 2 de IFN-o noquear como un control negativo. El ensayo nos permitió determinar el impacto de la IFN- en la integridad de la barrera intestinal y la degradación inducida por IFN-o de las proteínas de unión apretada claudin-2, -7 y -15. Este ensayo también podría utilizarse para investigar el impacto de compuestos químicos, proteínas, toxinas, bacterias o sondas derivadas del paciente sobre la integridad de la barrera intestinal.
Introducción
La integridad de la barrera epitelial se mantiene mediante el complejo de unión apical (AJC), que consiste en proteínas de unión estrecha (TJ) y unión de adherencia (AJ)1. La estructura polarizada del AJC es crucial para su función in vivo. La desregulación de la AJC está presente en diversas enfermedades y se sospecha que es un importante desencadenante de la patogénesis inflamatoria intestinal. La pérdida de la función de barrera intestinal representa el evento iniciador de la enfermedad. La siguiente translocación de bacterias comensales y respuestas inflamatorias son las consecuencias dolorosas2.
Se han desarrollado varios modelos in vitro e in vivo para investigar la regulación delAJC. El ensayo Transwell se basa en monocapas celulares bidimensionales (2D) que se derivaron de líneas celulares tumorales. Estos sistemas son buenos para evaluar por métodos ópticos y bioquímicos y permiten el análisis de muchas muestras al mismo tiempo, pero carecen de muchas características de las células primarias y los procesos de diferenciación presentes invivo. La investigación de la integridad de la barrera también es posible en modelos animales. En los experimentos terminales, se pueden cuantificar los efectos de tratamientos específicos in vivo en la permeabilidad de todo el intestino. Sin embargo, estos modelos requieren un gran número de animales, y no permiten una visualización detallada de los procesos moleculares subyacentes. Hoy en día están disponibles modelos 3D in vitro mejorados que recapitulan estrechamente los procesos de diferenciación celular, polarización celular y representan la estructura crypt-villus del intestino3. La aplicación de organoides intestinales 3D para análisis funcionales requiere la adaptación de los métodos disponibles a partir de modelos 2D. Aquí describimos un modelo para investigar la integridad de la barrera intestinal en los pequeños organoides del ratón intestinal vivo. El ensayo se estableció para investigar el efecto de IFN-o en la integridad de la barrera y las proteínas de unión estrecha respectivas8.
A diferencia de la técnica aplicada por Leslie4, Zietek5o Pearce6, que mide la fluorescencia después de eliminar el amarillo lucifer (LY) del medio, nuestro enfoque permite cuantificar la toma luminal del fluoróforo a lo largo del tiempo. Por lo tanto, el resultado representa una absorción cinética dinámica y nuestro ensayo permite la aplicación de estímulos o inhibidores adicionales durante el transcurso del experimento. El hecho de que ambos ensayos midan la toma desde el lado basolateral exterior hasta la superficie apical interior está en claro contraste con la situación in vivo. En un modelo descrito por Hill et al.7, se exploró este tema. Tras la microinyección del fluoróforo en el lumen del organoide, se cuantificó la fluorescencia. La dirección de difusión representa la dirección presente in vivo. El esfuerzo técnico de la microinyección reduce claramente el rendimiento de este método. A diferencia del modelo descrito aquí, el método de microinyección permite la medición de efectos que requieren activación biológica en la superficie epitelial apical.
El modelo de integridad de la barrera organoide que se presenta aquí se basa en la microscopía de células vivas y permite el análisis de cambios dinámicos dentro de la regulación AJC a lo largo del tiempo. La configuración se puede aplicar para probar el impacto farmacológico de las sustancias que inducen e inhiben la integridad de la barrera intestinal. Además, los modelos basados en organoides ayudan a reducir el número de animales utilizados para estudios farmacológicos.
Protocolo
Todas las medidas se completaron de acuerdo y de conformidad con todas las directrices reglamentarias e institucionales de cuidado de animales pertinentes.
1. Revestimiento de organoides
- Aísle los organoides como se describió anteriormente3. El procedimiento se describe brevemente a continuación.
- Recoger los intestinos delgados de los ratones.
- Abra los intestinos delgados longitudinalmente y retire las puntas de vellosidades raspando el tejido intestinal interno con un cubreobjetos.
- Cortar el tejido intestinal en trozos pequeños usando tijeras.
- Lave las piezas 5 veces en solución salina con fosfato frío (PBS) pipeteando las piezas 10 veces arriba y abajo con una pipeta de 25 ml.
- Incubar las piezas de tejido en frío 2 mM solución EDTA sobre hielo durante 30 minutos en una plataforma de agitación horizontal. Deje que las piezas de tejido se sedimenten.
- Reemplace la solución EDTA con tampón PBS una vez que las piezas de tejido se asienten en la parte inferior. Deseche el sobrenadante y agregue 20 ml de PBS.
- Libere las criptas intestinales del tejido pipeteando vigorosamente 10 veces arriba y abajo con una pipeta de 10 ml.
- Recoger el sobrenadante en los tubos de centrifugación e inspeccionarlo mediante microscopía de contraste de fase. Para ello, agregue una gota del sobrenadante a una placa de cultivo de celda de pozo 96. Mantenga los tubos de centrifugación en hielo.
- Repita los pasos 1.1.6–1.1.8 hasta que disminuya el número de criptas intestinales en el sobrenadante recogido.
- Pasar las fracciones que contienen la mayoría de las criptas a través de un colador de células de 70 m.
- Centrifugar la suspensión de la cripta a 300 x g,4 oC durante 5 min.
- Deseche el sobrenadante y resuspenda el pellet en PBS frío para lavar las criptas. A continuación, repita el paso de centrifugación como se describe en 1.1.11.
- Resuspende el pellet en un total de 25 l por pozo de una mezcla 1:1 de solución de matriz celular y medio de cultivo organoides murinos y placa los organoides en un 48 placas de cultivo celular de pozo.
- Incubar los organoides a 37oC, 5% CO2,, durante 20 min para permitir la solidificación de la solución de matriz celular.
- Cubrir los organoides con 300 ml de medio organoides murino por poca.
- Cultivar los organoides a 37oC, 5% CO2,cambiando el medio cada 2-3 días.
- Utilice los organoides para experimentos después de 7 días de cultivo.
- Prepare los organoides para la medición de la integridad de la barrera.
- Recubrir todos los tubos de centrifugación que se utilizarán para almacenar los organoides durante el proceso de chapado con albúmina sérica bovina (BSA) añadiendo suficiente de una solución de BSA al 0,1% en PBS para cubrir todas las superficies de plástico. A continuación, retire de nuevo la solución de BSA y guarde los tubos de centrifugación en hielo.
- Descongelar la solución de matriz celular y el medio de cultivo organoide sobre hielo.
- Para separar los organoides, retire cuidadosamente el medio de cultivo y resuspenda los organoides de un pozo de una placa de 48 pocillos en 1 ml de PBS frío. Disolver la matriz celular mediante pipeteo vigoroso. Mantenga siempre la suspensión organoide en tubos de centrifugación prerevestidos con BSA y mantenga siempre en hielo.
NOTA: La densidad, el tamaño y la posición de los organoides dentro de la diapositiva de cubierta con cámara están influenciados por la relación de división, la concentración de la solución de matriz celular y el manejo de la suspensión de matriz de células organoides. Se recomienda practicar el manejo de la solución de matriz celular de antemano. Por lo general, ocho cubiertas de vidrio bien con cámara son adecuados para el ensayo. Los organoides derivados de un pozo de una placa de 48 pocillos confluentes se pueden dividir en dos pocillos de ocho cubreobjetos bien encámarados (40 l del pellet de matriz de células organoides por poca). - Centrifugar la suspensión organoide a 300 x g a 4 oC durante 5 min.
- Deseche cuidadosamente el sobrenadante y vuelva a suspender el pellet con 1 ml de PBS frío.
- Centrifugar la suspensión organoide a 300 x g,4 oC durante 5 min.
- Deseche completamente el sobrenadante y resuspenda los organoides derivados de un pozo de una placa de 48 pocillos en un medio frío de 40 ml. Fragmente las estructuras organoides grandes pipeteando la suspensión organoide 5 veces a través de una punta de pipeta de 10 l para recoger estructuras con un tamaño de 40-60 m para la sembración.
NOTA: Utilice la punta de 10 l en una punta de pipeta de 100 ml para la fragmentación de las estructuras organoides, y practique el paso 1.7 de antemano para asegurar resultados consistentes. Controlar el tamaño de los organoides mediante microscopía de contraste de fase dentro del tubo de centrifugación. Asegúrese de que no haya más organoides multibrancidos presentes y que los fragmentos organoides sean de aproximadamente 40-60 m de largo. - Una vez que los organoides hayan obtenido el tamaño deseado, mézclalos con 40 ml de la solución de matriz celular (medio:solución de matriz celular 1:1).
NOTA: La relación de solución de matriz media a celular debe mantenerse constante para lograr resultados consistentes. La dilución de la solución de matriz celular reduce la rigidez de la mancha organoide y afecta a sus propiedades de difusión. Utilice puntas de pipeta preenfriadas (-20 oC) para todas las suspensiones que contengan solución de matriz celular. - Coloque 40 l de la suspensión de la solución de matriz de células organoides en el centro de cada pocal de un cubreobjetos de 8 cámaras bien.
- Mantenga el tobogán en una bolsa de hielo durante 5 minutos. Esto preserva el líquido de suspensión organoide de la matriz celular y aumenta la concentración organoide en la superficie de cobertura por gravedad.
- Incubar durante 20 min a 37oC y 5% CO2 para permitir la polimerización de la mancha de matriz de células organoides.
- Añadir 150 ml de medio de cultivo organoide por poca e incubar durante 24 h a 37oC y 5%CO2 antes de proceder al tratamiento experimental.
- Utilice este período para tratar los organoides y modular su integridad de barrera de acuerdo con la hipótesis científica correspondiente. Para el control positivo, trate los organoides durante 48 horas con IFN- para investigar la degradación de la unión estrecha asociada a IFN- y el aumento de la permeabilidad. Estimular el control positivo con 10 U/ml (10 ng/ml) recombinante murno IFN- . Deje los organoides de un bien bien tratado.
- Organoides de cultivo a 37oC y 5%CO2 hasta 48 h.
2. Ensayo organoidPermeabilidad
- Lleve la cámara de incubación del microscopio a 37 oC al menos 2 h antes de iniciar el experimento para reducir la deriva térmica mientras se toma imágenes de los organoides.
- Prepare una solución de 100 mM de LY en PBS. Almacenar en hielo protegido de la luz.
- Prepare una solución de 200 mM de EGTA en PBS. Guárdalo en hielo.
- Transfiera la cubierta con cámara, incluidos los organoides, a la cámara de incubación de un microscopio confocal invertido y encienda la incubación deCO2 (5%). Asegúrese de que el cubreobjetos con cámara esté firmemente fijado dentro de la etapa del microscopio.
- Usando los organoides en uno bien como referencia, ajuste los ajustes de imagen del microscopio. Añadir LY (3 l de 100 mM de LY en 150 ml de medio) para obtener un volumen final de 1 mM de LY en 300 ml de medio. Incubar en el microscopio durante 1 h y ajustar el enfoque para la toma de imágenes del lumen de los organoides. Definir la energía láser requerida para la excitación LY (488 nm) y la sensibilidad de detección respectiva del instrumento e intentar tomar imágenes de la fluorescencia LY en el 30-40% del rango dinámico disponible del instrumento que se está utilizando.
NOTA: Ajuste la energía de excitación láser y la eficiencia de detección en organoides no tratados 70 min después de la adición de LY. Asegúrese de que la energía de excitación sea lo suficientemente alta como para obtener una imagen bien expuesta. Para evitar la saturación de la fluorescencia LY dentro de las imágenes microscópicas, se recomienda ajustar estos ajustes después de que la difusión de LY alcance un estado estable. - Definir la posición de los organoides mediante imágenes en vivo de contraste de interferencia diferencial (DIC). Trate de crear imágenes de organoides con diámetros comparables (80 x 30 m) y concéntrese en la rebanada central de los organoides para tomar imágenes de su lumen. Defina aproximadamente 10 organoides por poca y trate de crear imágenes solo organoides cerca de la superficie de la cubierta con una estructura esférica.
NOTA: El número de organoides que se pueden crear imágenes por corrida depende de la velocidad del microscopio. Se recomienda tomar imágenes de los organoides en un intervalo de 5 minutos. En un microscopio de escaneo láser regular, 40 posiciones en total son un punto de partida razonable. - Registre el DIC y la fluorescencia LY de cada posición para documentar la forma y la autofluorescencia del organoide antes de agregar el LY a los pozos, utilizados para el ensayo de integridad de barrera.
- No idee órganos organoides que muestren una alta autofluorescencia. Esto se debe a la acumulación de células muertas dentro del lumen del organoide, y los resultados de los organoides autofluorescentes son difíciles de analizar después.
- Diluir 3 l de la solución LY preparada (100 mM LY en 150 ml de medio) y añadir esto cuidadosamente a cada pocal sin tocar el cubreobjetos con cámara. La concentración recomendada de LY por pozo es de 1 mM. El volumen final por pozo debe ser de 300 l.
- Compruebe rápidamente el enfoque de las posiciones definidas y corrija si es necesario.
NOTA: LY se difunde rápidamente a través de la matriz celular. Por lo tanto, la toma de imágenes confocales debe iniciarse dentro de los 3 minutos posteriores a la adición del fluoróforo. - Inicie una toma de imágenes de lapso de tiempo en el microscopio. Tome una imagen de fluorescencia de cada posición cada 5 min para un total de 70 min.
NOTA: Los organoides fueron visualizados en intervalos de 5 minutos para visualizar la aceptación de LY con el tiempo. Para medir la descomposición de la barrera intestinal, es suficiente para registrar la fluorescencia antes y 60 min después de la adición de LY y una vez más 10 min después de la adición de EGTA. - Añadir 3 l de la solución EGTA preparada por poca sin tocar el cubreobjetos con cámara. La concentración recomendada dentro de la cubierta de EGTA con cámara es de 2 mM. El volumen total por pozo debe ser de 300 s.
- Comience un segundo lapso de tiempo. Registre de nuevo la fluorescencia de los organoides definidos con un intervalo de 5 min para un total de 30 min.
- Deseche todo de acuerdo con las normas de seguridad locales.
NOTA: El protocolo se puede pausar aquí.
3. Análisis de datos
- Sólo analizar los resultados de los organoides que tomaron LY después de la adición de EGTA.
- Los resultados se pueden cuantificar con Fiji ImageJ.
- Abra el conjunto de datos en ImageJ haciendo clic en Archivo . Abra y seleccione los datos de imagen. En el siguiente cuadro de diálogo Opciones de importación de formatos BIO, seleccione Ver pila con: Hyperstack.
- Abra el administrador de la región de interés (ROI) haciendo clic en Analizar ? Herramientas ? ROI Manager.
- Dibuje un ROI ovalado haciendo clic en el botón de selección Oval en la barra de menús ImageJ. Dibuje una selección que contenga el lumen interno del organoide. A continuación, pulse Agregar en el Administrador de ROI.
- Repita los pasos para tres áreas representativas fuera del organoide.
- Haga clic en Analizar en la barra de menús y seleccione Establecer medidas. Habilite solo el valor medio de gris y deshabilite cualquier otra medición. A continuación, haga clic en Aceptar.
- Asegúrese de que todos los ROI están seleccionados en el Administrador de ROI. En el Administrador de ROI, haga clic en Más . Multi medida. En el cuadro de diálogo de opciones, seleccione Medir todos los sectores [...] y Una fila por sector. A continuación, haga clic en Aceptar.
- Seleccione todos los valores en la ventana Resultados y cópielos en una aplicación de hoja de cálculo para su posterior análisis.
NOTA: Si la posición del organoide se movió durante la toma de imágenes de lapso de tiempo, el ROI debe ajustarse en consecuencia. Para ello, seleccione el ROI correcto en el gestor de ROI y muévalo a la nueva posición. A continuación, haga clic en Actualizar en el administrador de ROI. Realice la medición de cada punto de tiempo individualmente haciendo clic en Medir en el gestor de ROI y, a continuación, cambie al siguiente punto de tiempo en la ventana de imagen utilizando la barra de la parte inferior. Recopile todas las mediciones en una hoja de cálculo. La forma individual y el movimiento de los organoides durante el período de imagen requieren el análisis de los datos de manera manual. - Calcule el valor de intensidad media de los tres ROI fuera del organoide para cada punto de tiempo.
- Divida la intensidad del ROI dentro del lumen del organoide por la intensidad media del ROI exterior y la intensidad media dentro del organoide.
- Para calcular el aumento relativo de la fluorescencia organoide luminal, divida la fluorescencia relativa (véase el paso 3.11) en cada punto de tiempo que se muestra por la fluorescencia relativa mínima.
NOTA: Utilice la fluorescencia relativa mínima, porque a veces la difusión del fluoróforo puede ser lenta al principio del experimento.
Resultados
Para validar la aplicación de los pequeños organoides del ratón intestinal 3D como modelo para cuantificar el efecto de los compuestos que regulan la integridad de la barrera intestinal, aplicamos IFN-o. Para ello, aislamos y cultivamos organoides derivados del tipo salvaje con capacidad de respuesta IFN-o y de los8ratones noqueadores IFN-receptor-2, que no responden a IFN-8 . Tras el tratamiento durante 48 horas con IFN-o o PBS (control), todos los organoides fueron expuestos a LY e fotoquines mediante microscopía de células vivas de disco giratorio confocal en intervalos de 5 minutos durante un período de 70 min. La integridad funcional de la barrera intestinal en este modelo dio lugar a la exclusión de LY del lumen del organoide, mientras que la acumulación intraluminal de LY significó la destrucción del TJ. Las imágenes microscópicas representativas de fluorescencia después de 70 minutos de incubación con LY demuestran claramente que la fluorescencia IS intraluminal sólo era visible en organoides de animales de tipo silvestre tratados con IFN-o. En los controles no estimulados (PBS) ni en los organoides derivados de animales noqueados (IFN-R2-IEC, Figura 1), no hubo fluorescencia IS intraluminal después de 70 min.
La adición de EGTA causa una descomposición inespecífica de la integridad de la barrera intestinal mediante la secuestración de cofactores TJ. Este control siempre se utilizó al final del experimento para demostrar la capacidad del organoide respectivo para tomar LY(Figura 1). Si no se detectó fluorescencia LY intraluminal en el tratamiento con EGTA, el organoide fue excluido del experimento.
Para la evaluación cuantitativa de los resultados microscópicos, se midió la fluorescencia LY dentro del lumen del organoide y fuera del organoide. Se calcularon los valores de intensidad relativos (fluorescencia interior/fluorescencia exterior + interior) y se muestran para cada punto de tiempo de la imagen. Se recomienda evitar la toma de imágenes de organoides de diferentes tamaños. Elegimos centrarnos en los organoides con un diámetro de 80 a 30 m(Figura 2). En la Figura 3se muestra un esquema del protocolo con imágenes representativas. Algunos problemas importantes y técnicas de solución de problemas se muestran y se discuten en la Figura 4.
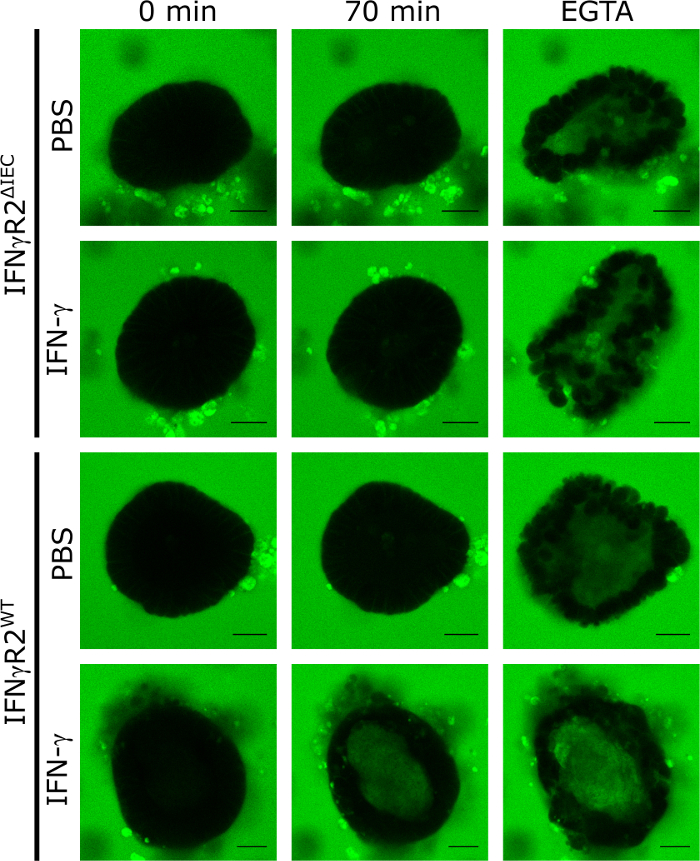
Figura 1: La integridad de la barrera intestinal se puede analizar en organoides del ratón. Los organoides intestinales de IFN-R2WT y IFN--R2-IEC se cultivaron en presencia de IFN-o durante 48 h o no se trataron.ΔIEC Para investigar la integridad de la barrera intestinal, se añadió LY (457 Da) y se capturaron imágenes fluorescentes confocales en intervalos de 5 minutos para un total de 70 min. Imágenes representativas en el punto de tiempo 0 min, 70 min, y después de la adición de EGTA se muestran (verde - Lucifer amarillo; Barra de escala a 20 m). Esta cifra ha sido modificada de Bardenbacher et al.8. Haga clic aquí para ver una versión más grande de esta figura.
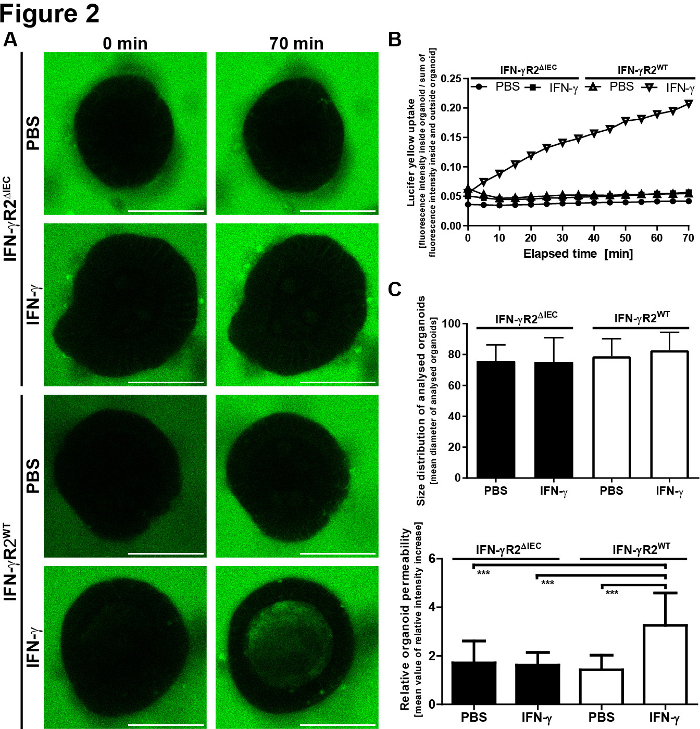
Figura 2: El modelo de integridad de la barrera organoide intestinal pequeña proporciona resultados cuantitativos. (A) SE determinó la fluorescencia LY dentro y fuera del organoide. Se calcularon los valores de intensidad relativa (dentro/fluorescencia exterior + interior) en relación con la intensidad relativa inicial + SEM y se muestran para cada punto de tiempo. (B) Distribución del tamaño de los organoides analizados. Para reducir la desviación estándar y los errores debidos a los cambios en la relación superficie-volumen, solo analizamos organoides con un diámetro de 80 a 30 m. Se muestran los valores medios de los diámetros organoides respectivos + SD (IFN-R2WT,n a 20; IFN--R2- IEC, n a 18). Los valores medios de diámetro no variaron significativamente entre los diferentes grupos (ANOVA unidireccional). (C) La permeabilidad de los organoides se determinó 70 min después de la adición de LY. Se definió dividiendo las intensidades de fluorescencia intraluminal después de 70 min por las intensidades de fluorescencia relativas mínimas medidas durante el período de observación. Cada barra representa valores medios + SD, medidos en 10 organoides derivados de dos experimentos independientes (IFN-R2WT, n a 20; IFN--R2- IEC, n a 18). El IFN-o aumentó significativamente la aceptación de LY sólo en los organoides de la IFN-R2WT. valor p <0.001 en la prueba t del estudiante. Esta cifra ha sido modificada de Bardenbacher et al.8. Haga clic aquí para ver una versión más grande de esta figura.
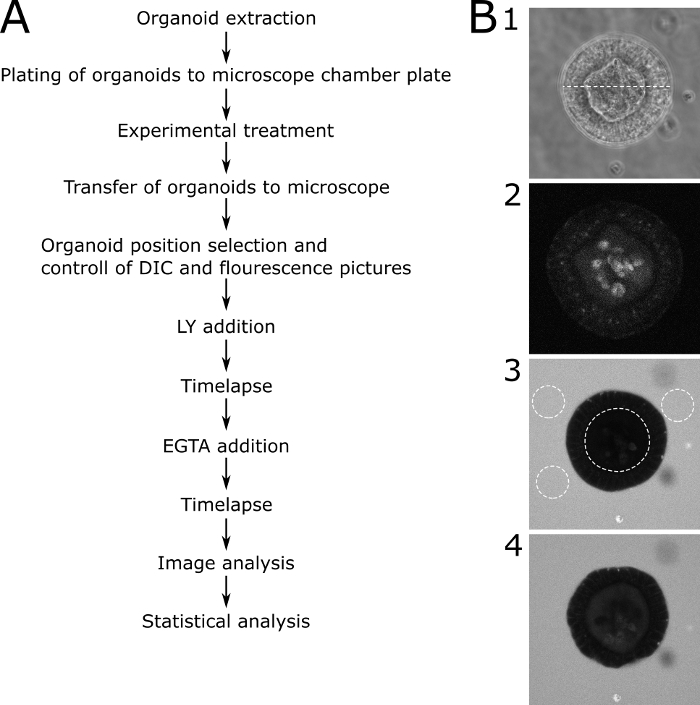
Figura 3: Protocolo esquemático con imágenes representativas. (A) Descripción esquemática de los pasos principales del protocolo. (B) Representación de las principales etapas del protocolo. (B1) Imagen de microscopía DIC de una rebanada central a través de un organoide adecuado que fue seleccionado para el análisis de permeabilidad. La línea punteada representa una anchura de 89 m. (B2) Imagen de microscopía de fluorescencia del mismo organoide en (B1) antes de añadir LY. La imagen muestra la autofluorescencia del organoide. (B3) Un organoide 70 min después de la adición de LY. El organoide representado no muestra la asunción de LY y, por lo tanto, una función de barrera intacta. Las líneas de puntos muestran los ROI para su posterior análisis. Se marcan el lumen interno del organoide y tres áreas representativas alrededor del organoide. (B4) Un organoide después de la adición de EGTA. El organoide es utilizable para análisis posteriores porque muestra la ingesta de LY después del tratamiento con EGTA. Haga clic aquí para ver una versión más grande de esta figura.
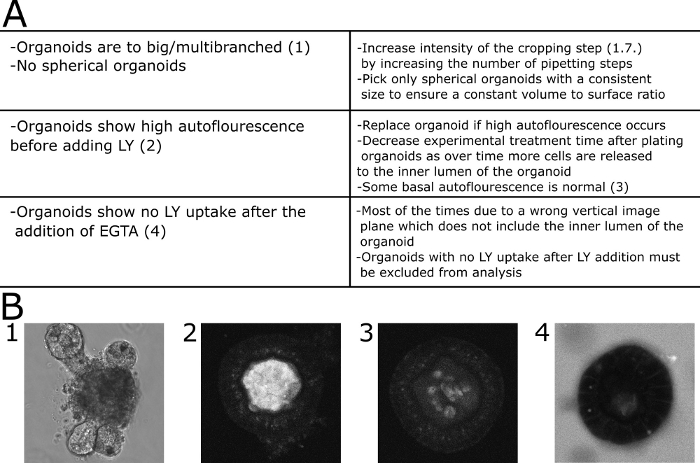
Figura 4: Solución de problemas comunes. (A) Tabla con problemas y soluciones comunes. (B) Imágenes ejemplares. (B1) Imagen DIC de un gran organoide multibrancido que no es adecuado para este ensayo. (B2). Imagen confocal de un organoide que presenta alta autofluorescencia antes de que SE añadiera LY al medio. El organoide fue excluido de la cuantificación. (B3) Imagen confocal de un organoide que presenta baja autofluorescencia antes de que SE añadiera LY al medio. La fluorescencia se cuantificó en este caso. (B4) Organoide que no muestre una ingesta LY desde el medio 30 min después de la adición de EGTA y, por lo tanto, se excluye de la cuantificación. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este ensayo ofrece una técnica para estudiar la integridad de la barrera intestinal dentro de los organoides vivos. Todo el ensayo se basa en pequeños organoides intestinales del ratón y microscopía de células vivas confocales. Por lo tanto, es obligatorio practicar el manejo adecuado de los organoides con antelación. Tras el aislamiento, los organoides se pueden dividir y almacenar rutinariamente mediante criocongelación3,9. Para este ensayo recomendamos dividir los organoides 48 h antes de iniciar el tratamiento. Este período da a los organoides la oportunidad de cerrar totalmente y formar estructuras esféricas. La sembración de los organoides para el experimento es un paso crítico dentro del ensayo. Para reducir las variaciones de manejo individuales, recomendamos un procedimiento de rutina para el proceso de sembrado. Este paso es crucial, y un protocolo de manejo rutinario reduce claramente las variaciones experimentales.
Durante el procedimiento de sembrado (paso 1.7), los organoides se fragmentan por el paso repetitivo a través de una punta de pipeta estándar de 10 ml. El tamaño de los poros de este producto varía de una empresa a una empresa. Este procedimiento debe practicarse con antelación, y el resultado siempre debe comprobarse mediante microscopía de contraste de fase. Una vez que los organoides obtenidos alcanzan el tamaño deseado, no cambie el procedimiento.
La sembración de los organoides debe optimizarse y adaptarse para la configuración microscópica disponible. Para poder cultivar e imágenes organoides durante al menos 48 h, se requiere una cámara de microscopio incubada. Elija un cubreobjetos con cámara que se adapte a sus necesidades. Al sembrar los organoides, asegúrese de concentrar los organoides en la superficie de la cubierta. Esto es posible manteniendo el cubreobjetos con cámara en una bolsa de hielo durante 5 minutos después de colocar la suspensión matriz celular-organoide. Este paso es importante para aumentar la calidad de las imágenes de células vivas confocales. La resolución axial y la distancia de trabajo de las lentes de microscopio confocal es especialmente limitada. Cuanto más se acerca la muestra a la lente, mejor se puede imaginar y se necesita menos energía láser para excitar la fluorescencia LY.
La fototaxis es un tema importante cuando se trata de microscopía celular viva. Dentro de este ensayo excluimos esta opción. Un AJC funcional es visible por exclusión de LY del lumen del organoide(Figura 1,PBS). La adición de EGTA al final del experimento provoca el secuestro de iones bivalentes, que son cofactores para las proteínas AJC. LY se excluye del lumen del organoide sólo en organoides vitales con un complejo AJC funcional. En general, las moléculas fluorescentes se pueden utilizar para medir la integridad de la barrera intestinal. Elegimos LY en lugar de otros fluoróforos de uso común como fluoresceína etiquetada dextran porque se transportan transcelularmente en las células intestinales desde el basal hasta el compartimiento apical9. También elegimos LY debido a su pequeño tamaño. LY tiene un peso molecular de 457 Da y por lo tanto facilita la investigación de la permeabilidad de la barrera para moléculas pequeñas. La molécula fluorescente tiene que ser elegida dependiendo de la pregunta científica investigada. Debido a que hay defectos aJC fototóxicos, la energía de excitación láser debe reducirse o extenderse el intervalo de imágenes. La técnica de imagen confocal óptima para este ensayo es la microscopía de disco giratorio. Los instrumentos respectivos permiten imágenes confocales con un tiempo de exposición corto a baja potencia láser.
Ya se han desarrollado diferentes modelos para estudiar la integridad de la barrera intestinal in vitro. Mientras que el uso de ensayos basados en monocapas de línea celular o experimentos in vivo están disminuyendo, los métodos basados en organoides están aumentando. A diferencia de los métodos descritos anteriormente4,5,6,7, nuestro método permite la cuantificación de la función de barrera en el tiempo. Esto permite la exposición de los organoides a estímulos adicionales en el transcurso del experimento. Aquí aplicamos EGTA como un segundo estímulo al final del experimento como un control positivo.
En contraste con la situación in vivo, en nuestro ensayo LY se añade en el medio y penetra el organoide desde el lado epitelial basolateral exterior hacia el lumen apical interior. El LY es pequeño y sólo se utiliza para visualizar la tensión de la barrera intestinal. Las moléculas y estímulos que modulan la capa epitelial en la superficie apical deben inyectarse en ellumen7 del organoide. Para reducir el esfuerzo experimental y poder medir la integridad de la barrera de muchos organoides al mismo tiempo, optamos por aplicar el tinte fluorescente desde el exterior.
Usamos el ensayo para investigar la función de IFN-o en la unión estrecha de pequeños organoides intestinales del ratón. El hecho de que pudiéramos analizar la integridad de la barrera en los organoides vivos ofrece posibilidades futuras para aplicar esta técnica para describir los inhibidores de la descomposición inducida por la inflamación de la barrera intestinal. Las sustancias que contrarrestan la función de barrera deteriorada causada por el IFN-o podrían ser candidatas para el tratamiento de enfermedades inflamatorias intestinales, en las que la función de barrera deteriorada es uno de los factores patógenos10.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por subvenciones de la Fundación Alemana de Investigación (DFG) [KFO257, proyecto 4 a M.S. y proyecto 1 a C.B.; FOR2438, proyecto 2 a M.S. y E.N. y proyecto 5 a C.B.; Proyecto SFB1181 C05 a C.B.; TRR241, proyecto A06 a N.B.L. y M.S., proyecto A03 a C.B., BR5196/2-1 a N.B.L. y BE3686/2 a C.B.]; el Centro Interdisciplinario de Investigación Clínica (IZKF) del Centro Clínico Erlangen (a M.S., E.N., y M.B.), el W. Lutz Stiftung (a M.S.) y el Forschungsstiftung Medizin del Centro Clínico Erlangen (a M.S.). El presente trabajo se realizó en el cumplimiento (parcial) de los requisitos para obtener el grado Dr. Med. de Marco Bardenbacher.
Materiales
| Name | Company | Catalog Number | Comments |
| 48-well culture plate | Thermo Fisher Scientific | #150687 | |
| 8-well chamber slides | Ibidi | #80826 | |
| 96-well culture plate | Greiner Bio-One | #655101 | |
| Axio Observer.Z1 - spinning disc | Zeiss | excitation laser 488 nm / emission filter 525/25 | |
| Bovine serum albumin | Sigma-Aldrich | A3059-100G | |
| Cell strainer | Falcon | 352350 | |
| Centrifugation tube 15 mL | Thermo Fisher Scientific | 11507411 | |
| Centrifugation tube 50 mL | Thermo Fisher Scientific | 10788561 | |
| EDTA | Sigma-Aldrich | 431788-25g | |
| EGTA | Sigma-Aldrich | 431788 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, growth factor reduced, phenol red free | Corning | 356231 | Cell matrix solution |
| Mice | The Jackson Laboratory | M. musculus C57/Bl6 | |
| Microscope coverslip | 24 mm x 60 mm | ||
| Organoid Growth Medium mouse | Stemcell Technologies | #06005 | |
| Phosphate buffered saline | Biochrom | L182-05 | |
| Recombinant murine IFN-γ | Biolegend | Cat#575304 |
Referencias
- López-Posadas, R., Stürzl, M., Atreya, I., Neurath, M. F., Britzen-Laurent, N. Interplay of GTPases and Cytoskeleton in Cellular Barrier Defects during Gut Inflammation. Frontiers in Immunology. 8, 1240 (2017).
- Zhang, Y. Z., Li, Y. Y. Inflammatory bowel disease: pathogenesis. World Journal of Gastroenterology. 20 (1), 91-99 (2014).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Leslie, J. L., et al. Persistence and toxin production by Clostridium difficile within human intestinal organoids result in disruption of epithelial paracellular barrier function. Infection and Immunity. 83 (1), 138-145 (2015).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 16831 (2015).
- Pearce, S. C., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Hill, D. R., Huang, S., Tsai, Y. H., Spence, J. R., Young, V. B. Real-time Measurement of Epithelial Barrier Permeability in Human Intestinal Organoids. Journal of Visualized Experiments. (130), e56960 (2017).
- Bardenbacher, M., et al. Permeability analyses and three dimensional imaging of interferon gamma-induced barrier disintegration in intestinal organoids. Stem Cell Research. 35, 101383 (2019).
- Tomita, M., Hotta, Y., Ohkubo, R., Awazu, S. Polarized transport was observed not in hydrophilic compounds but in dextran in Caco-2 cell monolayers. Biological and Pharmaceutical Bulletin. 22 (3), 330-331 (1999).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature Reviews: Immunology. 9 (11), 799-809 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados