Method Article
Investigando a quebra da barreira intestinal em organóides vivos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui descrevemos uma técnica para quantificar a integridade da barreira de pequenos organóides intestinais. O fato de o método ser baseado em organóides vivos permite a investigação sequencial de diferentes substâncias moduladoras de integridade de barreira ou combinações dos mesmos de forma resolvida pelo tempo.
Resumo
Organóides e culturas celulares tridimensionais (3D) permitem a investigação de mecanismos e regulamentos biológicos complexos invitro, o que anteriormente não era possível em monocamadas de cultura celular clássica. Além disso, as culturas de células de monocamada são bons sistemas de modelo in vitro, mas não representam os complexos processos e funções de diferenciação celular que dependem da estrutura3D. Isso só foi possível até agora em experimentos em animais, que são trabalhosos, demorados e difíceis de avaliar por técnicas ópticas. Aqui descrevemos um ensaio para determinar quantitativamente a integridade da barreira ao longo do tempo em pequenos organóides de camundongos intestinais vivos. Para validar nosso modelo, aplicamos interferon gama (IFN-γ) como um controle positivo para destruição de barreiras e organóides derivados do receptor IFN-γ 2 nocautear camundongos como um controle negativo. O ensaio nos permitiu determinar o impacto do IFN-γ na integridade da barreira intestinal e na degradação induzida pelo IFN-γ das proteínas de junção apertada claudin-2, -7 e -15. Este ensaio também pode ser usado para investigar o impacto de compostos químicos, proteínas, toxinas, bactérias ou sondas derivadas do paciente na integridade da barreira intestinal.
Introdução
A integridade da barreira epitelial é mantida pelo complexo juncional apical (AJC), que consiste em junção apertada (TJ) e adesão às proteínas1. A estrutura polarizada da AJC é crucial para sua função in vivo. A desregulação da AJC está presente em várias doenças e suspeita-se ser um importante gatilho da patogênese inflamatória intestinal. A perda da função de barreira intestinal representa o início da doença. As seguintes translocação de bactérias commensal e respostas inflamatórias são as dolorosas consequências2.
Vários modelos in vitro e in vivo foram desenvolvidos para investigar a regulação daAJC. O ensaio Transwell é baseado em monocamadas celulares bidimensionais (2D) que foram derivadas de linhas celulares tumorais. Esses sistemas são bons para avaliar por métodos ópticos e bioquímicos e permitem a análise de muitas amostras ao mesmo tempo, mas faltam muitas características das células primárias e dos processos de diferenciação presentes invivo. Investigar a integridade da barreira também é possível em modelos animais. Em experimentos terminais, os efeitos de tratamentos específicos in vivo sobre a permeabilidade de todo o intestino podem ser quantificados. No entanto, esses modelos requerem um grande número de animais, e eles não permitem uma visualização detalhada dos processos moleculares subjacentes. Atualmente, modelos 3D in vitro melhorados estão disponíveis que recapitulam processos de diferenciação celular, polarização celular e representam a estrutura cripto-villus do intestino3. A aplicação de organóides intestinais 3D para análises funcionais requer a adaptação dos métodos disponíveis a partir de modelos 2D. Aqui descrevemos um modelo para investigar a integridade da barreira intestinal em pequenos organóides de camundongos intestinais vivos. O ensaio foi estabelecido para investigar o efeito do IFN-γ na integridade da barreira e nas respectivas proteínas de junção apertada8.
Em contraste com a técnica aplicada por Leslie4, Zietek5, ou Pearce6, que mede a fluorescência após a remoção do amarelo lúcifer (LY) do meio, nossa abordagem permite quantificação da captação luminal do fluoróforo ao longo do tempo. Portanto, o resultado representa uma captação dinâmica cinética e nosso ensaio permite a aplicação de estímulos adicionais ou inibidores durante o curso do experimento. O fato de ambos os ensaios medirem a captação do lado basolateral externo para a superfície apical interna está em claro contraste com a situação in vivo. Em um modelo descrito por Hill et al.7, este tema foi explorado. Após a microinjeção do floróforo no lúmen do organóide, a fluorescência foi quantificada. A direção da difusão representa a direção presente in vivo. O esforço técnico da microinjeção reduz claramente o throughput deste método. Em contraste com o modelo descrito aqui, o método de microinjeção permite a medição de efeitos que requerem ativação biológica na superfície epitelial apical.
O modelo de integridade da barreira organóide aqui apresentado baseia-se na microscopia celular viva e permite a análise de mudanças dinâmicas dentro da regulação da AJC ao longo do tempo. A configuração pode ser aplicada para testar o impacto farmacológico de substâncias que induzem e inibem a integridade da barreira intestinal. Além disso, modelos à base de organóides ajudam a reduzir o número de animais utilizados para estudos farmacológicos.
Protocolo
Todas as etapas foram concluídas de acordo com todas as diretrizes regulatórias e institucionais de cuidado com os animais relevantes.
1. Chapeamento de Organóides
- Isole organóides como descrito anteriormente3. O procedimento é brevemente descrito abaixo.
- Colete os intestinos pequenos de ratos.
- Abra os intestinos delgados longitudinalmente e remova as pontas de villi raspando o tecido intestinal interno com um deslizamento de cobertura.
- Corte o tecido intestinal em pequenos pedaços usando uma tesoura.
- Lave as peças 5x em solução salina tamponada com fosfato frio (PBS) encanando as peças 10x para cima e para baixo com uma pipeta de 25 mL.
- Incubar os pedaços de tecido em solução EDTA de 2 mM frio no gelo por 30 min em uma plataforma de agitação horizontal. Deixe os pedaços de tecido sedimentarem.
- Substitua a solução EDTA por tampão PBS assim que as peças de tecido se fixarem na parte inferior. Descarte o sobrenadante e adicione 20 mL de PBS.
- Solte as criptas intestinais do tecido, pipetando vigorosamente 10x para cima e para baixo com uma pipeta de 10 mL.
- Coletar o sobrenadante em tubos de centrifugação e inspecioná-lo por microscopia de contraste de fase. Para fazer isso, adicione uma gota do sobrenadante a uma placa de cultura de célula sénica de 96 poços. Mantenha os tubos de centrifugação no gelo.
- Repita as etapas 1.1.6-1.1.8 até que o número de criptas intestinais no sobrenadante coletado diminua.
- Passe as frações que contêm mais criptas através de um filtro de células de 70 μm.
- Centrifugar a suspensão cripta a 300 x g, 4 °C por 5 min.
- Descarte o sobrenadante e resuspenda a pelota em PBS frio, a fim de lavar as criptas. Em seguida, repita a etapa de centrifugação conforme descrito em 1.1.11.
- Resuspender a pelota em um total de 25 μL por poço de uma mistura de 1:1 de solução de matriz celular e meio de cultura organoide murina e emplacar os organóides em uma placa de cultura de 48 poços.
- Incubar os organóides a 37 °C, 5% CO2, por 20 min para permitir que a solução da matriz celular se solidifique.
- Cubra os organóides com 300 μL de meio organóide murina por poço.
- Cultura os organóides a 37 °C, 5% CO2, mudando o meio a cada 2-3 dias.
- Use os organóides para experimentos após 7 dias de cultura.
- Prepare os organóides para a medição da integridade da barreira.
- Pré-revestir todos os tubos de centrifugação que serão usados para armazenar os organóides durante o processo de chapeamento com albumina de soro bovino (BSA) adicionando o suficiente de uma solução BSA de 0,1% na PBS para cobrir todas as superfícies plásticas. Em seguida, remova novamente a solução BSA e armazene os tubos de centrifugação no gelo.
- Descongele a solução da matriz celular e o meio de cultura organóide no gelo.
- Para separar os organóides, remova cuidadosamente o meio de cultura e resuspenda os organóides de um poço de uma placa de 48 poços em 1 mL de PBS frio. Dissolva a matriz celular por pipetting vigoroso. Mantenha sempre a suspensão organóide em tubos de centrifugação pré-revestidos com BSA e mantenha sempre no gelo.
NOTA: A densidade, o tamanho e a posição dos organóides dentro do deslizamento de cobertura câmara são influenciados pela razão de divisão, concentração da solução da matriz celular e manuseio da suspensão da matriz organóide-célula. Recomenda-se praticar o manuseio da solução da matriz celular com antecedência. Normalmente, oito tampas de vidro bem câmaradas são adequadas para o ensaio. Organóides derivados de um poço de uma placa de poço confluente de 48 podem ser divididos em dois poços de uma cobertura de oito câmaras (40 μL da pelota da matriz organóide-célula por poço). - Centrifugação a suspensão organóide a 300 x g a 4 °C por 5 min.
- Descarte cuidadosamente o sobrenadante e resuspenda a pelota com 1 mL de PBS frio.
- Centrifugação a suspensão organóide a 300 x g, 4 °C por 5 min.
- Descarte o sobrenadante completamente e resuspenda os organóides derivados de um poço de uma placa de 48 poços em 40 μL de meio frio. Fragmente grandes estruturas organóides através da pipetação da suspensão organóide 5x através de uma ponta de pipeta de 10 μL para coletar estruturas com um tamanho de 40-60 μm para semeação.
NOTA: Use a ponta de 10 μL em uma ponta de pipeta de 100 μL para a fragmentação das estruturas organóides e pratique a etapa 1.7 com antecedência para garantir resultados consistentes. Controle o tamanho dos organóides por microscopia de contraste de fase dentro do tubo de centrifugação. Certifique-se de que não há mais organóides multifiliados presentes e que os fragmentos organóides têm cerca de 40-60 μm de comprimento. - Uma vez que os organóides tenham obtido o tamanho desejado, misture-os com 40 μL da solução da matriz celular (solução média:matriz celular = 1:1).
NOTA: A relação entre a solução de matriz média e celular deve ser mantida constante para alcançar resultados consistentes. A diluição da solução da matriz celular reduz a rigidez da bolha organóide e impacta suas propriedades de difusão. Use pontas de pipeta pré-resfriadas (-20 °C) para todas as suspensões que contenham solução de matriz celular. - Coloque 40 μL da suspensão da solução da matriz organoide-célula no centro de cada poço de um deslizamento de cobertura de 8 câmaras.
- Mantenha o slide em uma bolsa de gelo por 5 min. Isso preserva o líquido de suspensão organoide da matriz celular e aumenta a concentração organóide na superfície do deslizamento de cobertura pela gravidade.
- Incubar por 20 min a 37 °C e 5% de CO2 para permitir a polimerização da bolha da matriz organoide-célula.
- Adicione 150 μL de meio de cultura organóide por poço e incubar por 24 h a 37 °C e 5% CO2 antes de prosseguir com o tratamento experimental.
- Use esse período para tratar os organóides e modular sua integridade de barreira de acordo com a hipótese científica correspondente. Para o controle positivo, trate os organóides por 48 h com IFN-γ, a fim de investigar a degradação da junção estreita associada ao IFN-γ e o aumento da permeabilidade. Estimule o controle positivo com 10 U/mL (10 ng/mL) murina recombinante IFN-γ. Deixe os organóides de um bem não tratado.
- Organóides de cultura a 37 °C e 5% DE CO2 por até 48 h.
2. Ensaio de OrganoidPermeability
- Leve a câmara de incubação do microscópio a 37 °C pelo menos 2h antes de iniciar o experimento para reduzir a deriva térmica durante a imagem dos organóides.
- Prepare uma solução de 100 mM de LY na PBS. Armazene gelo protegido da luz.
- Prepare uma solução de 200 mM de EGTA em PBS. Armazená-lo no gelo.
- Transfira o deslizamento de cobertura câmara, incluindo os organóides para a câmara de incubação de um microscópio confocal invertido e ligue a incubação de CO2 (5%). Certifique-se de que o deslizamento de cobertura com câmara está bem trancado dentro do estágio do microscópio.
- Usando os organóides em um bem como uma referência, ajuste as configurações de imagem do microscópio. Adicione LY (3 μL de 100 mM LY em 150 μL de meio) para obter um volume final de 1 mM LY em 300 μL de meio. Incubar no microscópio por 1h e ajustar o foco para a imagem do lúmen dos organóides. Defina a energia laser necessária para excitação LY (488 nm) e a respectiva sensibilidade de detecção do instrumento e tente visualizar a fluorescência LY em 30-40% do alcance dinâmico disponível do instrumento em uso.
NOTA: Ajuste a energia de excitação a laser e a eficiência de detecção em organóides não tratados 70 min após a adição de LY. Certifique-se de que a energia de excitação é alta o suficiente para obter uma imagem bem exposta. Para evitar a saturação da fluorescência LY dentro das imagens microscópicas, recomenda-se ajustar essas configurações após a difusão LY atingir um estado estável. - Defina a posição dos organóides por imagem ao vivo de contraste de interferência diferencial (DIC). Tente imaginar organóides com diâmetros comparáveis (80 ± 30 μm) e foque na fatia central dos organóides para visualizar seu lúmen. Defina cerca de 10 organóides por poço e tente imaginar apenas organóides perto da superfície do deslizamento com uma estrutura esférica.
NOTA: O número de organóides que podem ser imagempor corrida depende da velocidade do microscópio. Recomenda-se a imagem dos organóides dentro de um intervalo de 5 minutos. Em um microscópio de varredura a laser regular, 40 posições no total são um ponto de partida razoável. - Registre o DIC e a fluorescência LY de cada posição para documentar a forma e autofluorescência do organoide antes de adicionar o LY aos poços, usado suscitado para o ensaio de integridade da barreira.
- Não faça imagens de organóides que exibem alta autofluorescência. Isso se deve ao acúmulo de células mortas dentro do lúmen do organóide, e os resultados dos organóides autofluorescentes são difíceis de analisar depois.
- Diluir 3 μL da solução LY preparada (100 mM LY em 150 μL de meio) e adicione-o cuidadosamente a cada poço sem tocar no deslizamento de cobertura com câmara. A concentração recomendada de LY por poço é de 1 mM. O volume final por poço deve ser de 300 μL.
- Verifique rapidamente o foco das posições definidas e corrija se necessário.
NOTA: LY se difunde rapidamente através da matriz celular. Portanto, a imagem confocal deve ser iniciada dentro de 3 minutos após a adição do flúor. - Inicie uma imagem de lapso de tempo no microscópio. Pegue uma imagem de fluorescência de cada posição a cada 5 min para um total de 70 min.
NOTA: Os organóides foram captados em intervalos de 5 minutos para visualizar a captação de LY ao longo do tempo. Para medir a quebra da barreira intestinal, basta registrar a fluorescência antes e 60 min após a adição de LY e mais uma vez 10 min após a adição de EGTA. - Adicione 3 μL da solução EGTA preparada por poço sem tocar no deslizamento de cobertura com câmara. A concentração recomendada dentro do deslizamento de cobertura câmarado de EGTA é de 2 mM. O volume total por poço deve ser de 300 μL.
- Comece um segundo lapso de tempo. Registre a fluorescência dos organóides definidos novamente com um intervalo de 5 min para um total de 30 minutos.
- Descarte tudo de acordo com as normas de segurança locais.
NOTA: O protocolo pode ser pausado aqui.
3. Análise de Dados
- Analise-se apenas os resultados dos organóides que assumiram a LY após a adição de EGTA.
- Os resultados podem ser quantificados com fiji ImageJ.
- Abra o conjunto de dados no ImageJ clicando em File | Abra e selecione dados de imagem. Na seguinte caixa de diálogo Bio-Formats Importar, selecione Exibir pilha com: Hyperstack.
- Abra o gerente da região de interesse (ROI) clicando em Analisar | Ferramentas | Gerente de ROI.
- Desenhe um ROI oval clicando no botão de seleção Oval na barra de menus ImageJ. Desenhe uma seleção contendo o lúmen interno do organóide. Em seguida, pressione Adicionar no gerenciador de roi.
- Repita os passos para três áreas representativas fora do organóide.
- Clique em Analisar na barra de menus e selecione Definir medidas. Habilite apenas o Valor Médio cinza e desative qualquer outra medição. Em seguida, clique em OK.
- Certifique-se de que todos os ROIs estão selecionados no GERENCIADOR DE ROI. No ROI Manager, clique em Mais | Multimedidas. Na opção diálogo selecione Medir todas as fatias [...] e uma linha por fatia. Em seguida, clique em OK.
- Selecione todos os valores na janela Resultados e copie-os em um aplicativo de planilha para análise posterior.
NOTA: Se a posição do organóide se moveu durante a imagem de lapso de tempo, o ROI deve ser ajustado de acordo. Para isso, selecione o ROI correto no gerenciador de ROI e mova-o para a nova posição. Em seguida, clique em Atualizar no gerenciador de ROI. Execute a medição para cada ponto de tempo individualmente clicando em Medir no gerenciador de ROI e, em seguida, mude para o próximo ponto de tempo na janela de imagem usando a barra na parte inferior. Coletar todas as medidas em uma planilha. A forma individual e o movimento dos organóides durante o período de imagem requer a análise dos dados de forma manual. - Calcular o valor médio de intensidade dos três ROIs fora do organóide para cada ponto de tempo.
- Divida a intensidade do ROI dentro do lúmen do organóide pela intensidade média do ROI lá fora e pela intensidade média dentro do organóide.
- Para calcular o aumento relativo da fluorescência organoide luminal, divida a fluorescência relativa (ver passo 3.11) em cada ponto de tempo, imagem pela fluorescência relativa mínima.
NOTA: Use a fluorescência relativa mínima, porque às vezes a difusão do flúor pode ser lenta no início do experimento.
Resultados
Para validar a aplicação de organóides de camundongos intestinais 3D como modelo para quantificar o efeito de compostos que regulam a integridade da barreira intestinal, aplicamos IFN-γ. Para isso, isolamos e cultivamos organóides derivados do tipo selvagem responsivo IFN-γ e de camundongos eliminatórios IFN-γ-receptor-2, que não respondem aos ifn-γ8. Após o tratamento por 48 h com IFN-γ ou PBS (controle), todos os organóides foram expostos ao LY e foram imagem por microscopia celular de disco giratório confocal em intervalos de 5 minutos por um período de 70 minutos. A integridade funcional da barreira intestinal nesse modelo resultou na exclusão da LY do lúmen do organóide enquanto o acúmulo intraluminal de LY significou a destruição do TJ. As imagens microscópicas de fluorescência representativa após 70 minutos de incubação com LY demonstram claramente que a fluorescência ly intraluminal só era visível em organóides de animais do tipo selvagem tratados com IFN-γ. Nos controles não estimulados (PBS) nem em organóides derivados de animais de nocaute (IFN-γR2ΔIEC, Figura 1), nenhuma fluorescência ly intraluminal estava presente após 70 min.
A adição de EGTA causa uma quebra inespecífica da integridade da barreira intestinal ao sequestrar cofatores tj. Esse controle sempre foi utilizado no final do experimento para demonstrar a capacidade do organóide respectivo de assumir a LY (Figura 1). Se não foi detectada fluorescência ly intraluminal no tratamento eGTA, o organóide foi excluído do experimento.
Para a avaliação quantitativa dos resultados microscópicos, a fluorescência LY foi medida dentro do lúmen do organóide e fora do organóide. Os valores de intensidade relativa foram calculados (fluorescência interna/ fluorescência externa + interna) e são mostrados para cada ponto de tempo. Recomenda-se evitar imagens de organóides de tamanhos variados. Optamos por focar em organóides com diâmetro de 80 ± 30 μm(Figura 2). Um esquema do protocolo com imagens representativas é mostrado na Figura 3. Alguns dos principais problemas e técnicas de solução de problemas são mostrados e discutidos na Figura 4.
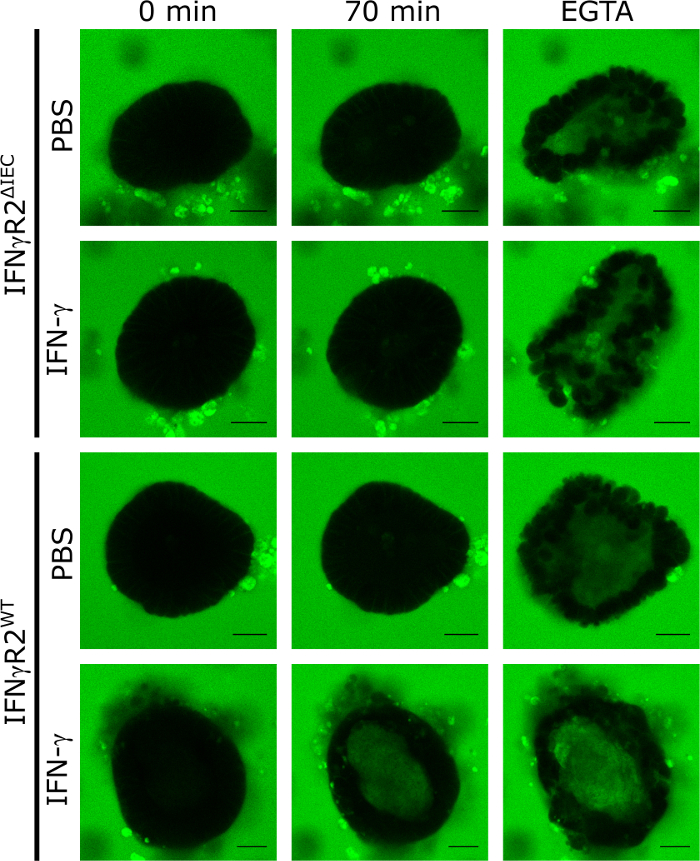
Figura 1: A integridade da barreira intestinal pode ser analisada em organóides de camundongos. Organóides intestinais do IFN-γR2WT e IFN-γR2ΔIEC foram cultivados na presença de IFN-γ por 48 h ou não tratados. Para investigar a integridade da barreira intestinal, foi adicionado LY (457 Da) e imagens fluorescentes confocais foram capturadas em intervalos de 5 minutos para um total de 70 min. Imagens representativas no ponto de tempo 0 min, 70 min, e após adição de EGTA são mostradas (verde = amarelo Lúcifer; Barra de escala = 20 μm). Esta figura foi modificada de Bardenbacher et al.8. Clique aqui para ver uma versão maior desta figura.
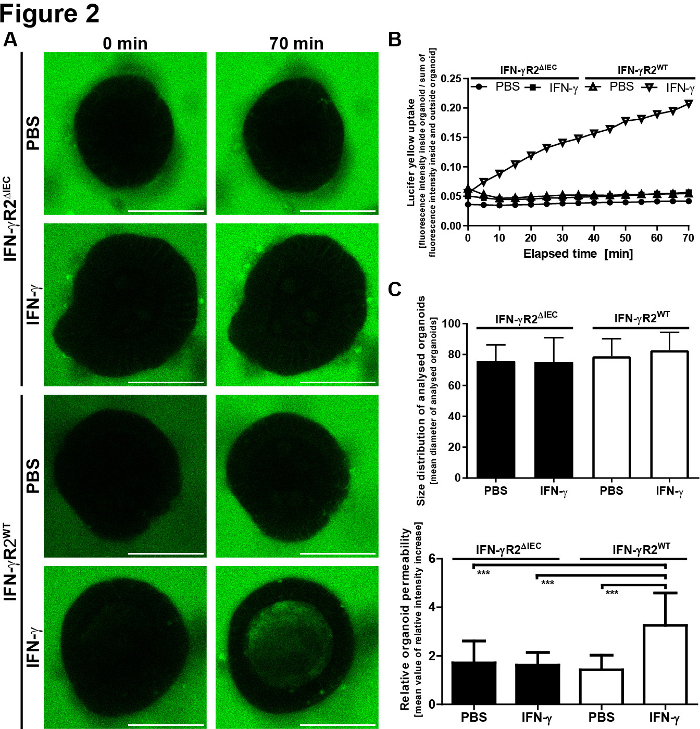
Figura 2: O modelo de integridade da barreira organóide intestinal pequena fornece resultados quantitativos. (A) Afluorescência LY foi determinada dentro e fora do organóide. Foram calculados valores de intensidade relativa (dentro/fluorescência externa + interna) em relação à intensidade relativa inicial + SEM e são mostrados para cada ponto de tempo. (B) Distribuição de tamanho de organóides analisados. Para reduzir o desvio padrão e os erros devido a alterações na relação superfície-volume, foram analisados apenas organóides com diâmetro de 80 ± 30 μm. Os valores médios dos respectivos diâmetros organóides são mostrados + SD (IFN-γR2WT, n = 20; IFN-γR2ΔIEC, n = 18). Os valores médios de diâmetro não variaram significativamente entre os diferentes grupos (ANOVA unidirecional). (C) A permeabilidade dos organóides foi determinada 70 min após a adição de LY. Foi definido dividindo as intensidades de fluorescência intraluminal após 70 min pelas intensidades mínimas de fluorescência relativa medidas durante o período de observação. Cada barra representa valores médios + SD, medidos em 10 organóides derivados de dois experimentos independentes (IFN-γR2WT, n = 20; IFN-γR2ΔIEC, n = 18). Ifn-γ aumentou significativamente a captação de LY apenas em organóides IFN-γR2WT. p-value <0,001 no teste t do Aluno. Esta figura foi modificada de Bardenbacher et al.8. Clique aqui para ver uma versão maior desta figura.
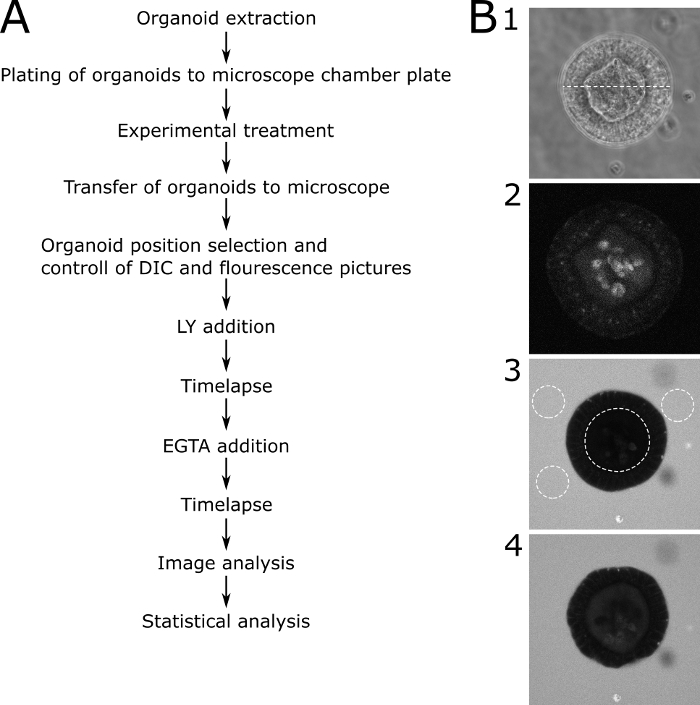
Figura 3: Protocolo esquemático com imagens representativas. (A) Descrição esquemmática dos principais passos do protocolo. (B) Fotos representativas dos principais passos do protocolo. (B1) Imagem de microscopia DIC de uma fatia central através de um organóide adequado que foi selecionado para análise de permeabilidade. A linha pontilhada representa uma largura de 89 μm.(B2) imagem de microscopia de fluorescência do mesmo organóide em (B1) antes de adicionar LY. A imagem mostra a autofluorescência do organóide. (B3) Um organóide 70 min após a adição de LY. O organóide retratado não mostra nenhuma captação de LY e, portanto, uma função de barreira intacta. Linhas pontilhadas mostram os ROIs para análise suplementar. O lúmen interno do organóide e três áreas representativas ao redor do organóide estão marcados. (B4) Um organóide após a adição de EGTA. O organóide é utilizável para análise suplementar porque mostra a captação de LY após o tratamento eGTA. Clique aqui para ver uma versão maior desta figura.
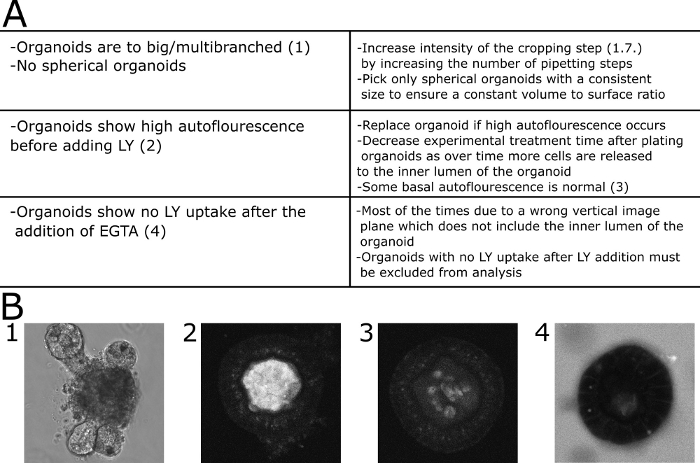
Figura 4: Solução de problemas comuns. (A)Tabela com problemas e soluções comuns. (B) Imagens exemplares. (B1) Imagem DIC de um organóide multiramificado grande que não é adequado para este ensaio. (B2). Imagem confocal de um organóide exibindo alta autofluorescência antes de LY foi adicionada ao meio. O organóide foi excluído da quantificação. (B3) Imagem confocal de um organóide exibindo baixa autofluorescência antes de LY foi adicionada ao meio. A fluorescência foi quantificada neste caso. (B4) Organóide não mostrando captação LY a partir do meio de 30 min após adição de EGTA e, portanto, excluído da quantificação. Clique aqui para ver uma versão maior desta figura.
Discussão
Este ensaio oferece uma técnica para estudar a integridade da barreira intestinal dentro de organóides vivos. Todo o ensaio é baseado em pequenos organóides de camundongos intestinais e microscopia de células vivas confocais. Portanto, é obrigatório praticar o manejo adequado dos organóides com antecedência. Após o isolamento, os organóides podem ser rotineiramente divididos e armazenados por criocongelamento3,9. Para este ensaio recomendamos a divisão dos organóides 48 h antes do início do tratamento. Esse período dá aos organóides a chance de fechar totalmente e formar estruturas esféricas. A semeação dos organóides para o experimento é um passo crítico dentro do ensaio. Para reduzir as variações individuais de manuseio, recomendamos um procedimento de rotina para o processo de semeação. Este passo é crucial, e um protocolo de manuseio de rotina reduz claramente as variações experimentais.
Durante o procedimento de semeação (passo 1.7) os organóides são fragmentados por passagem repetitiva através de uma ponta de pipeta padrão de 10 μL. O tamanho dos poros deste produto varia de empresa para empresa. Este procedimento deve ser praticado com antecedência, e o resultado deve ser sempre verificado por microscopia de contraste de fase. Uma vez que os organóides obtidos atinjam o tamanho desejado, não altere o procedimento.
A semeação dos organóides deve ser otimizada e adaptada para a configuração microscópica disponível. Para ser capaz de cultivar e imagem organóides por pelo menos 48 h, uma câmara de microscópio incubada é absolutamente necessária. Escolha um deslizamento de cobertura com câmara que corresponda aos seus requisitos. Ao semear os organóides, certifique-se de concentrar os organóides na superfície da cobertura. Isso é possível mantendo o deslizamento de cobertura em uma camada de gelo por 5 min depois de colocar a suspensão cell matrix-organoid. Este passo é importante para aumentar a qualidade da imagem celular viva confocal. A resolução axial e a distância de trabalho das lentes de microscópio confocal são especialmente limitadas. Quanto mais perto você traz a amostra para a lente, melhor você pode imaginá-la e menos energia laser é necessária para excitar a fluorescência LY.
Fototáxié uma questão importante quando se trata de microscopia celular viva. Dentro deste ensaio excluímos essa opção. Um AJC funcional é visível pela exclusão do LY do lúmen do organóide(Figura 1, PBS). A adição de EGTA no final do experimento causa o seqüeremento de íons bivalentes, que são cofatores para as proteínas AJC. A LY é excluída do lúmen do organóide apenas em organóides vitais com complexo aJC funcional. Em geral, moléculas fluorescentes podem ser usadas para medir a integridade da barreira intestinal. Escolhemos ly em vez de outros fluoróforos comumente usados, como fluoresceína rotulada dextran porque estes são transportados transcelularmente em células intestinais do basal para o compartimento apical9. Também escolhemos a LY por causa de seu pequeno tamanho. Ly tem um peso molecular de 457 Da e, portanto, facilita a investigação da permeabilidade da barreira para pequenas moléculas. A molécula fluorescente deve ser escolhida dependendo da questão científica investigada. Como os defeitos fototóxicos do AJC estão presentes, a energia de excitação a laser deve ser reduzida ou o intervalo de imagem estendido. A técnica de imagem confocal ideal para este ensaio é a microscopia do disco giratório. Os respectivos instrumentos permitem imagens confocais com pouco tempo de exposição a baixa potência laser.
Diferentes modelos já foram desenvolvidos para estudar a integridade da barreira intestinal in vitro. Enquanto o uso de ensaios baseados em monocamadas de linha celular ou experimentos in vivo estão diminuindo, os métodos baseados em organóides aumentam. Em contraste com os métodos descritos anteriormente44,5,6,7, nosso método permite quantificação da função de barreira ao longo do tempo. Isso permite a exposição dos organóides a estímulos adicionais ao longo do experimento. Aqui aplicamos o EGTA como um segundo estímulo no final do experimento como um controle positivo.
Em contraste com a situação invivo, em nosso ensaio LY é adicionado ao meio e penetra o organóide do lado epitelial basolateral externo em direção ao lúmen apical interior. O LY é pequeno e é usado apenas para visualizar o aperto da barreira intestinal. Moléculas e estímulos que modulam a camada epitelial na superfície apical precisam ser injetados no lúmen do organóide7. Para reduzir o esforço experimental e ser capaz de medir a integridade da barreira de muitos organóides ao mesmo tempo, optamos por aplicar o corante fluorescente de fora.
Usamos o ensaio para investigar a função do IFN-γ na junção apertada de pequenos organóides de camundongos intestinais. O fato de termos sido capazes de analisar a integridade da barreira em organóides vivos oferece possibilidades futuras de aplicação dessa técnica para descrever inibidores para a quebra induzida por inflamação da barreira intestinal. Substâncias que neutralizam a função de barreira prejudicada causada pelo IFN-γ poderiam ser candidatas ao tratamento de doenças inflamatórias intestinais, nas quais a função de barreira prejudicada é um dos fatores patogênicos10.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Este trabalho foi apoiado por subsídios da Fundação Alemã de Pesquisa (DFG) [KFO257, projeto 4 para M.S. e projeto 1 para C.B.; FOR2438, projeto 2 para M.S. e E.N. e projeto 5 para C.B.; Projeto SFB1181 C05 para C.B.; TRR241, projeto A06 para N.B.L. e M.S., projeto A03 para C.B., BR5196/2-1 para N.B.L. e BE3686/2 para C.B.]; o Centro Interdisciplinar de Pesquisa Clínica (IZKF) do Centro Clínico Erlangen (para M.S., E.N., e M.B.), o W. Lutz Stiftung (para M.S.) e o Forschungsstiftung Medizin do Centro Clínico Erlangen (para M.S.). O presente trabalho foi realizado em (parcial) cumprimento dos requisitos para obtenção do diploma Dr. Med. de Marco Bardenbacher.
Materiais
| Name | Company | Catalog Number | Comments |
| 48-well culture plate | Thermo Fisher Scientific | #150687 | |
| 8-well chamber slides | Ibidi | #80826 | |
| 96-well culture plate | Greiner Bio-One | #655101 | |
| Axio Observer.Z1 - spinning disc | Zeiss | excitation laser 488 nm / emission filter 525/25 | |
| Bovine serum albumin | Sigma-Aldrich | A3059-100G | |
| Cell strainer | Falcon | 352350 | |
| Centrifugation tube 15 mL | Thermo Fisher Scientific | 11507411 | |
| Centrifugation tube 50 mL | Thermo Fisher Scientific | 10788561 | |
| EDTA | Sigma-Aldrich | 431788-25g | |
| EGTA | Sigma-Aldrich | 431788 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, growth factor reduced, phenol red free | Corning | 356231 | Cell matrix solution |
| Mice | The Jackson Laboratory | M. musculus C57/Bl6 | |
| Microscope coverslip | 24 mm x 60 mm | ||
| Organoid Growth Medium mouse | Stemcell Technologies | #06005 | |
| Phosphate buffered saline | Biochrom | L182-05 | |
| Recombinant murine IFN-γ | Biolegend | Cat#575304 |
Referências
- López-Posadas, R., Stürzl, M., Atreya, I., Neurath, M. F., Britzen-Laurent, N. Interplay of GTPases and Cytoskeleton in Cellular Barrier Defects during Gut Inflammation. Frontiers in Immunology. 8, 1240 (2017).
- Zhang, Y. Z., Li, Y. Y. Inflammatory bowel disease: pathogenesis. World Journal of Gastroenterology. 20 (1), 91-99 (2014).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Leslie, J. L., et al. Persistence and toxin production by Clostridium difficile within human intestinal organoids result in disruption of epithelial paracellular barrier function. Infection and Immunity. 83 (1), 138-145 (2015).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 16831 (2015).
- Pearce, S. C., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Hill, D. R., Huang, S., Tsai, Y. H., Spence, J. R., Young, V. B. Real-time Measurement of Epithelial Barrier Permeability in Human Intestinal Organoids. Journal of Visualized Experiments. (130), e56960 (2017).
- Bardenbacher, M., et al. Permeability analyses and three dimensional imaging of interferon gamma-induced barrier disintegration in intestinal organoids. Stem Cell Research. 35, 101383 (2019).
- Tomita, M., Hotta, Y., Ohkubo, R., Awazu, S. Polarized transport was observed not in hydrophilic compounds but in dextran in Caco-2 cell monolayers. Biological and Pharmaceutical Bulletin. 22 (3), 330-331 (1999).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature Reviews: Immunology. 9 (11), 799-809 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados