Method Article
Método invasivo semiseminal para inducir el infarto de miocardio en ratas y la evaluación de la función cardíaca mediante un sistema cardíaco de trabajo aislado
En este artículo
Resumen
Este artículo presenta un método eficiente para realizar isquemia miocárdica y posterior reperfusión crónica en ratas utilizando un enfoque mínimamente invasivo. Además, la función hemodinámica ventricular izquierda de las ratas se evalúa mediante ecocardiografía y métodos aislados del corazón de trabajo.
Resumen
El infarto de miocardio sigue siendo el principal contribuyente a la morbilidad y mortalidad en todo el mundo. Por lo tanto, la investigación sobre este tema es obligatoria. Se requiere un procedimiento de inducción de MI fácil y altamente reproducible para obtener más información y una mejor comprensión de los cambios patológicos subyacentes. Este procedimiento también se puede utilizar para evaluar los efectos o la potencia de los tratamientos nuevos y prometedores (como fármacos o intervenciones) en la MI aguda, la remodelación posterior y la insuficiencia cardíaca (HF). Después de la intubación y preparación preoperatoria del animal, se realizó un protocolo anestésico con isoflurano, y el procedimiento quirúrgico se llevó a cabo rápidamente. Usando un enfoque mínimamente invasivo, la arteria descendente anterior izquierda (LAD) fue localizado y ocluido por una ligadura. La oclusión se puede realizar agudamente para la reperfusión posterior (lesión de isquemia/reperfusión). Alternativamente, el vaso puede ser ligado permanentemente para investigar el desarrollo de MI crónica, remodelación o IC. A pesar de los escollos comunes, las tasas de deserción son mínimas. Se pueden examinar varios tratamientos, como el acondicionamiento isquémico remoto, para detectar su potencial cardioprotector de forma pre, peri y postoperatoria. La recuperación postoperatoria fue rápida, ya que la anestesia se controló con precisión y la duración de la operación fue corta. La analgesia postoperatoria se administró durante tres días. El procedimiento mínimamente invasivo reduce el riesgo de infección e inflamación. Además, facilita una rápida recuperación. Las mediciones del "corazón de trabajo" se realizaron ex vivo y permitieron un control preciso de la precarga, la carga posterior y el flujo. Este procedimiento requiere equipo específico y capacitación para un rendimiento adecuado. Este manuscrito proporciona una introducción detallada paso a paso para realizar estas mediciones.
Introducción
Aunque la incidencia está disminuyendo continuamente, el infarto agudo de miocardio (MI) sigue siendo el principal contribuyente a la morbilidad y mortalidad en todo el mundo1. Existen restricciones para evaluar la eficacia de los tratamientos potenciales como medicamentos o procedimientos quirúrgicos que previenen y tratan la MI aguda. Antes de que sus efectos puedan examinarse en seres humanos, estos tratamientos deben analizarse de antemano para detectar riesgos de antemano, incluidos los exámenes in vivo en animales. No hay mejor oportunidad para estudiar una patología que en condiciones in vivo. Por lo tanto, la inducción de MI en ratas o ratones e incluso grandes modelos animales (cerdos u ovejas) permite la investigación de cambios a corto (agudo) y largo plazo (crónicos) debido a la isquemia en las arterias coronarias y el miocardio circundante, así como cambios sistémicos debido a cambios cardíacos deteriorados. El tamaño del infarto era anteriormente el objetivo principal, pero más recientemente los procesos posteriores de remodelación cardíaca en MI aguda o lesión de isquemia/reperfusión, así como en insuficiencia cardíaca consecutiva (HF) se han vuelto de gran interés. Por lo tanto, se requiere un método comparable y fácilmente reproducible para alcanzar resultados consistentes.
Mientras que el uso de la crio-ablación para ganar MI se ha reportado2, nuestro método se basa en otros estudios en los que los investigadores ocluyen la arteria descendente anterior izquierda (LAD) por una sola ligadura de puntada. En comparación con los procedimientos (hemi-)esternotomía, el enfoque mínimamente invasivo que se presentará en este artículo, permite una recuperación postoperatoria más rápida y reduce notablemente el tiempo de operación. Un paso común de otros procedimientos quirúrgicos es el levantamiento del corazón del tórax para realizar la puntada cardíaca3. El enfoque de este método hace que este paso sea innecesario. Dependiendo del protocolo, se pueden realizar dos procedimientos diferentes: una oclusión temporal utilizando un torniquete para inducir isquemia/reperfusión durante un tiempo definido; o una oclusión permanente de la arteria mediante la fijación de la ligadura. El éxito de la oclusión se puede evaluar con electrocardiograma (ECG) y los cambios macroscópicos en el ventrículo izquierdo (LV), así como su paling.
Otro paso importante antes de la cirugía es la intubación. Mientras que en la mayoría de los casos, la intubación se realiza a través de traqueotomía o mediante inserción oral del tubo bajo visión por una incisión cutánea en la garganta, este protocolo describe la intubación endotraqueal del animal anestesiado que reduce las dificultades respiratorias o infecciones postoperatoriamente4,5. Para evitar complicaciones postoperatorias, se extrae aire del tórax a través de una jeringa antes de cerrar el pecho.
La segunda tarea de este artículo es la evaluación de la función hemodinámica a través de un modelo experimental aislado del corazón de trabajo, cómo se utiliza en otros proyectos dentro de nuestro instituto6,,7. Si bien la ecocardiografía, la resonancia magnética cardíaca (RM) y la cuantificación invasiva de los bucles de volumen de presión son métodos bien conocidos y ampliamente utilizados para evaluar la función cardíaca in vivo, se sabe que tienen algunas limitaciones. Los enfoques invasivos, como el uso de catéteres para examinar la función global o parámetros específicos del corazón, se utilizan comúnmente y representan el estándar de oro de las mediciones cardíacas. Por el contrario, el aparato cardíaco de trabajo ex vivo rara vez se utiliza debido a su complejidad y costo. Hay muchos aspectos importantes, desde la mezcla del perate hasta la cannulación adecuada del corazón, que son cruciales para una evaluación exitosa. El aparato aislado del corazón de trabajo fue descrito en primer lugar por Oskar Langendorff en 18978 y ha sido modificado en las últimas décadas9. Hoy en día, hay dos modelos utilizados: el modo Langendorff (LD) y el modo de corazón de trabajo (WH). En nuestro estudio, el modo LD se utiliza para aclimatar el corazón a su nuevo entorno (alrededor de 15 min). En este modo, el corazón se puedeular a través de la aorta y las arterias coronarias se perfunden de forma anperrograda, suministrando adecuadamente el miocardio. En el modo LD, el corazón no está realizando ningún trabajo de volumen de presión. Por el contrario, en el modo WH, la aurícula izquierda se canula a través de una vena pulmonar, a través de la cual el perfuso entra en la aurícula izquierda. El corazón entonces bombea este perfuiológico fisiológicamente contra una carga posterior predefinida. Al aumentar la carga posterior con el tiempo, la función cardíaca se puede medir continuamente. Se pueden medir parámetros como el flujo coronario, la salida cardíaca (CO), el volumen de carrera (SV) y el trabajo, el flujo auricular y las presiones sistólicas y diastólicas del VI. El impacto de varios tratamientos directa y exclusivamente en el corazón se puede investigar6,10. Una revisión de Liao y Podesser9 presentó el uso generalizado de este método en la evaluación de los efectos farmacológicos sobre la función cardíaca y el metabolismo, así como en la exploración de diversas enfermedades como MI, IC, obesidad y diabetes.
En resumen, este protocolo presenta un método reproducible para realizar mimis o lesión de isquemia/reperfusión miocárdica (MIR) in vivo. Además, permite la caracterización de la función de LV (dis-) en un corazón de rata aislado después de MI. Este protocolo presenta una combinación única de tratamiento y análisis.
Protocolo
El protocolo experimental que dio los resultados descritos en este artículo ha sido aprobado por el Comité regional de ética para experimentos animales de laboratorio en la Universidad Médica de Viena y el Ministerio Federal de Educación, Ciencia e Investigación de Austria (BMWFW-66.009/0023-WF/V/3b/2016). Todos los experimentos se ajustan a la Guía para el Cuidado y Uso de Animales de Laboratorio, publicada por los Institutos Nacionales de Salud de los Estados Unidos (Publicación de la NIH No 85-23, revisada en 1996).
NOTA: Se utilizan ratas Sprague Dawley macho de 10 a 12 semanas de edad de 250 a 300 g de peso corporal (BW). Como los siguientes procedimientos y tratamientos se realizan en un ambiente estéril de un quirófano (OR), use exfoliantes, guantes, máscaras faciales y capuchas al manipular animales. Antes de entrar en el quirófano, asegúrese de que las manos estén lavadas y desinfectadas. Si la intención es operar a varios animales en una sesión quirúrgica, lavar y desinfectar, o autoclave los instrumentos entre operaciones. Estas directrices higiénicas son válidas para todos los procedimientos presentados en la sección de protocolo.
1. Preparación preoperatoria y anestesia
- Inicie la anestesia preoperatoria inyectando una mezcla de xilazina (4 mg/kg BW) y ketamina (100 mg/kg BW) intraperitonealmente.
- Intubar las ratas con un tubo de 14 G y ventilación controlada por volumen con una mezcla de O2,aire e isoflurano (1-2,5%) a 75-85 golpes/min, 100 mL/stroke/BW (Figura 1A). Si es necesario, para una mejor vista durante la intubación: aplicar Xylocain a través de una punta de lana de algodón en la faringe inferior para lograr la relajación local.
- Coloque las ratas en una mesa de operaciones calentada en una posición supina y fije las extremidades delanteras con cinta(Figura 1B).
- Mida la temperatura rectal con una sonda.
NOTA: Debe mantenerse entre 37,5 y 38,5 oC. - Afeitar el tórax y limpiar el área de operación con solución de yodo de povidona antiséptica. Aplicar pomada para los ojos a la rata para evitar el secado de los ojos.
- Administrar analgesia intraoperatoria inyectando piritramida (0,1 ml/kg BW) por vía intraperitoneal.
- Coloque las sondas ECG por vía subcutánea en las extremidades del animal.
- Compruebe los reflejos de la cola y los dedos de los dedos antes de iniciar el procedimiento quirúrgico.
2. Procedimiento quirúrgico-inducción de isquemia miocárdica
- Realice la incisión cutánea con un bisturí. Asegúrese de iniciar 2 mm parasternal en el tórax izquierdo en el nivel del 3er espacio intercostal y continuar a la línea axilar anterior en el nivel del 5o espacio intercostal (Figura 1C).
- Sustituya los músculos superficiales suavemente para hacer visibles las costillas(Figura 1D).
- En caso de sangrado menor, utilice un cauter para destruir o desconectar el tejido circundante.
- Realizar la toracotomía a nivel del 4o espacio intercostal e insertar un retractor para ganar visibilidad del corazón y el pulmón (Figura 1E). Abra cuidadosamente la pleura para evitar el sangrado.
- Ocluir temporalmente el LAD utilizando un torniquete para inducir isquemia/reperfusión (MIR) durante un tiempo definido; o o permanentemente (MI) ocluirlo haciendo 6 x 7 nudos usando una sutura 6-0 para cerrar la ligadura (Figura 1F,G).
NOTA: El punto correcto para la oclusión del LAD se encuentra a unos 2 x 3 mm por debajo de la aurícula izquierda en el margen lateral ventral/izquierdo del corazón. La oclusión exitosa se asocia con cambios de ECG (elevación del segmento ST) y cambios macroscópicos en el LV como paling. - En el caso del modelo de isquemia/reperfusión, vuelva a abrir el LAD mediante la extracción del torniquete después de 30 minutos de oclusión.
- Cierre el tórax con tres suturas de un solo botón utilizando una sutura monofilamento simple de 4-0 (Figura 1H). Antes de apretar la última sutura, retire cualquier aire residual del tórax con una jeringa de 10 ml para evitar un neumotórax (Figura 1I).
- Reposicione los músculos y apague la anestesia volátil.
- Suturar la piel con una sutura continua utilizando una sutura 4-0 (Figura 1J).
- Administrar un aerosol antiséptico para proteger contra infecciones y mordeduras de la sutura por ratas.
3. Criterios de tratamiento postoperatorio y exclusión
- Mantenga a las ratas en la mesa de calentamiento hasta que despierten. Extubar a las ratas tan pronto como comiencen a respirar espontáneamente.
- Coloque las ratas extubadas en una jaula debajo de una lámpara de calefacción para evitar que se enfríen.
- Devolver las ratas a las casas de animales en condiciones estandarizadas cuando comienzan a comportarse normalmente de nuevo.
- Añadir 2 ampollas de piritramida y 30 ml de 5% de glucosa a 250 ml de agua para la analgesia postoperatoria durante tres días.
- Compruebe la aptitud y el comportamiento de las ratas con la lista de verificación y los criterios de exclusión (Tabla 1). Observar a los animales dos veces al día durante la semana siguiente, luego dos veces por semana.
NOTA: De acuerdo con las normas internacionales, presente a los veterinarios cualquier animal que sufra, o animales que ganen hasta 6 puntos en la evaluación con la lista de verificación, tome decisiones relacionadas con la terapia. Los animales que ganen 7 o más puntos deben ser sacrificados inmediatamente con una sobredosis de ketamina y xilazina.
| Examinación | Observación | Puntuación |
| Peso corporal | Estable | 0 |
| 10% de pérdida | 4 | |
| 15% de pérdida durante 48 h | 7 | |
| 18% de pérdida | 7 | |
| normal (pelaje plano y brillante) | 0 | |
| Apariencia externa | piloerection | 1 |
| Hematoma | 2 | |
| heridas/cortes/marcas de mordeduras de la piel | 2 | |
| severamente reducido acicalamiento | 4 | |
| (orificios sucios/coagulados o húmedos) | 7 | |
| irritaciones o heridas graves en la piel | 7 | |
| postura encorvada >2 h | 7 | |
| distensión abdominal significativa (ascitis) | 7 | |
| Comportamiento | normal (dormir, curioso, contactos sociales, reacción cuando se toca) | 0 |
| comportamiento inusual, por ejemplo, la actividad deteriorada | 2 | |
| autoaislamiento, hiperactividad pronunciada o estereoticia | 4 | |
| letargia para <6 h | 4 | |
| letargia durante 6 h a 8 h | 7 | |
| apathia >8 h | 7 | |
| estereotipa ininterrumpida durante >10 min. y aún persistiendo después de 2 h | 7 | |
| signos de dolor cuando se toca | 7 | |
| automutilación | 7 | |
| Digestión | Normal | 0 |
| diarrea (heces blandas) | 3 | |
| diarrea durante 72 h o acuosa | 7 | |
| heces ensangrentadas | 7 |
Tabla 1: Lista de verificación y criterios de exclusión. Esta tabla contiene los exámenes que deben observarse y la puntuación correspondiente. Por consiguiente, debe adaptarse el tratamiento postoperatorio del animal o consultar a un veterinario.
4. Mediciones de ecocardiografía
NOTA: La ecocardiografía generalmente se realiza dos veces, antes de la inducción de MI y antes de que se cosechan los órganos.
- Inyectar ratas con una mezcla de xilazina (4 mg/kg BW) y ketamina (100 mg/kg BW) por vía intraperitoneal.
- Coloque las ratas en una posición supina en una bandeja de calentamiento. Aplique gel de eco en el pecho, lo que ayuda a las ondas de ultrasonido a viajar mejor y reduce las interferencias de la señal.
- Obtener vistas de eje corto parasternal de la cavidad DEL VI a nivel del músculo papilar.
- Realice la ecocardiografía del modo M para medir la fracción de eyección ventricular izquierda y la morfología.
5. Recolección de órganos (sin corazón de trabajo)
- Administrar xilazina (4 mg/kg BW) y ketamina (100 mg/kg BW) por vía intraperitoneal antes de la recolección de órganos. Asegúrese de que los reflejos sean negativos.
NOTA: No se requiere intubación ya que el procedimiento no dura más de 1 min. - Usa un bisturí para hacer una incisión cutánea debajo del xifoide y extiéjalo paralelamente a las costillas de ambos lados usando tijeras.
- Cortar las costillas en la línea axilar frontal y agarrar el xifoide para levantar el pecho hacia arriba (Figura 2A).
- Retire las adherencias anatómicas o fibrosas rompiendo cuidadosamente el tejido con dos pares de fórceps.
- Tomar muestras de sangre (para la evaluación de gases sanguíneos o análisis moleculares) de la vena cava inferior con una jeringa de 5 ml.
- Realizar la escisión de todo el corazón en el nivel de entrada y salida (Figura 2B). Si es necesario, proceda con la evaluación del corazón de trabajo como se describe en la sección 6.
- Cosecha los órganos, los escarcha en nitrógeno líquido y guárdalos en -80 oC para análisis moleculares adicionales, o en formaldehído con fines histológicos.
6. Mediciones hemodinámicas ex vivo a través de un sistema cardíaco de trabajo
NOTA: La configuración general y los componentes del aparato se han descrito previamente11. El siguiente protocolo describe el manejo del corazón del animal y los pasos necesarios para evaluar la función LV.
- Anestfetizar ratas como se describe en el paso 5.1 e inyectar 200 UI de heparina por vía intravenosa (vena femoral).
- Abra el tórax a través de una incisión debajo del arco costal con un bisturí y extiéndalo a ambas líneas axilares anteriores con tijeras y eleve el esternón.
- Cortar los grandes recipientes cerca de su salida o entrada al corazón para extirparlo(Figura 2B).
- Sumergir el corazón en el amortiguador Krebs-Henseleit helado y montarlo en el sistema cardíaco aislado perfundido por eritrocitos a través de la aorta cannulando la aorta (Figura 3A).
- Comience con el modo LD con una carga constante de 60 mmHg (período de estabilización).
- Después de 15 minutos del modo LD, cambie al modo WH. Por lo tanto, puede poblar la aurícula izquierda a través de una vena pulmonar(Figura 3B). A continuación, cambie la dirección del flujo en el sistema abriendo el clip que ocluye la cánula auricular. Esto resulta en una perfusión de la aurícula izquierda y un flujo sanguíneo fisiológico en el corazón izquierdo11.
- Registre las mediciones hemodinámicas durante 20 minutos en el modo WH.
- Recoger gotas de sangre de los coronarios con una jeringa de 2 ml para medir el flujo coronario (CF, ml/min) cada 5 min.
NOTA: Cf se mide como la diferencia entre el flujo auricular izquierdo (LAF) y el flujo aórtico (AF). - Realice mediciones continuas de LAF (equivalente a salida cardíaca) y AF con una sonda de flujo.
NOTA: La sonda se inserta a través del aparato WH en el LV. Todos los datos se registran continuamente. - Si el protocolo en curso lo solicita, inserte un catéter de alta fidelidad retrógrado a través de la válvula aórtica en el LV y mida la presión sistólica del ventrículo izquierdo (LVSP).
- Para evaluar el trabajo de presión-volumen realizado por minuto, calcule el volumen del accidente cerebrovascular como salida cardíaca dividida por frecuencia cardíaca.
- Calcular el trabajo cardíaco externo (EHW) de acuerdo con la siguiente fórmula: CO x LVSP(g x m/min) normalizado al peso cardíaco.
Resultados
Pilz et al.6. Con este procedimiento quirúrgico preciso, se puede investigar el efecto cardioprotector del percondicionamiento isquémico remoto (RIPerc). Este es un nuevo tratamiento potencial para los pacientes que sufren de MI aguda o MIR y posterior remodelación ventricular, que en muchos casos conduce a la IC consecutiva. Imitar los cambios fisiopatológicos de MI/MIR es un paso obligatorio en la evaluación de los tratamientos como los estudios in vitro o ex vivo no proporcionan el entorno fisiológico. En este protocolo, los animales fueron sometidos a 30 minutos de oclusión laD seguida de reperfusión (es decir, MIR).
Para probar la reproducibilidad del procedimiento, se realizaron cortes y manchas histológicas(Figura 4A). Estaba claro que la cicatriz fibrosa en los animales tratados con MIR+RIPerc era comparable con la formación de cicatrices de los animales Sham, mientras que la comparación de fibrosis entre los grupos Sham y MIR fue significativa (Figura 4B). Además, los animales tratados con MIR+RIPerc mostraron fibrosis significativamente reducida en comparación con los animales tratados con MIR. Sin embargo, las imágenes histológicas representativas aclaran la potencia de este procedimiento quirúrgico, ya que el infarto se sostiene explícitamente en el grupo MIR(Figura 4A). El uso de la ecografía in vivo, la fracción de eyección, los diámetros diastólicos extremos y sistólicos extremos del LV (LVEDD y LVESD) se midieron y mostraron una reducción significativa de la función cardíaca debido al tratamiento MIR, mientras que los parámetros hemodinámicos fueron preservados por RIPerc (Figura 4C-F). Los datos hemodinámicos ex vivos mostraron la eficacia del procedimiento, ya que el grupo MIR mostró disminuciones significativas en la LVSP, la salida cardíaca (CO), el volumen de la carrera (SV) así como el trabajo cardíaco externo (EHW) (Figura 5A-G).
Una búsqueda de literatura sobre este procedimiento quirúrgico no reportó comentarios y resultados negativos o insatisfactorios cuando se realizó adecuadamente. Sin embargo, es necesario evitar los escollos mencionados en la introducción y el debate, y la formación es obligatoria para adquirir un nivel estable de rendimiento y obtener resultados comparables.
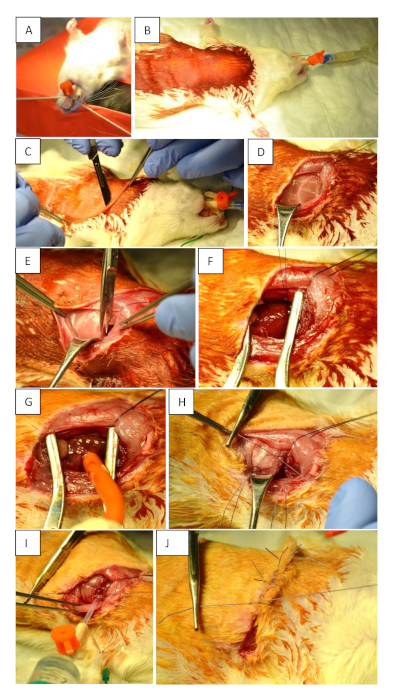
Figura 1: Preparación preoperatoria y procedimiento quirúrgico. (A) Intubación del animal utilizando un tubo de 14 G. (B) Posicionamiento y desinfección supina del campo quirúrgico. (C) Incisión cutánea (2 mm parasternal en el tórax izquierdo a nivel del 3er espacio intercostal). La incisión debe alcanzar la línea axilar anterior en el nivel del 5o espacio intercostal. (D) Desplazar los músculos para hacer visibles las costillas. (E) Apertura del tórax. (F) Oclusión permanente de LAD utilizando 6 x 7 nudos. (G) Oclusión transitoria de LAD utilizando un torniquete. (H) Cierre del tórax después de la isquemia miocárdica y la reperfusión mediante la colocación de tres suturas de un solo nudo alrededor de las costillas. (I) Cierre adecuado del tórax. Utilice una jeringa de 10 ml para extraer cualquier aire residual del tórax antes de fijar el último nudo firmemente. Esto es integral para prevenir un neumotórax. (J) Sutura de la piel. Haga clic aquí para ver una versión más grande de esta figura.
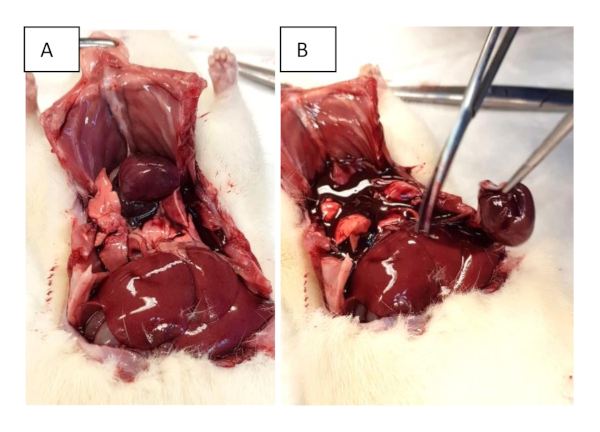
Figura 2: Recolección de órganos. (A) Abra el pecho con cortes sub xifoideales y extiéndalos a ambas líneas axilares medias. Se realizan cortes adicionales a través de las costillas para facilitar la elevación del esternón. (B) Escisión del corazón. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Aparato cardíaco aislado. (A) Modo Langendorff. El corazón se monta en el aparato WH a través de la cánula de la aorta. (B) Modo corazón de trabajo. El sistema se puede cambiar al modelo WH para evaluar la función cardíaca mediante la culación de la aurícula izquierda. Haga clic aquí para ver una versión más grande de esta figura.
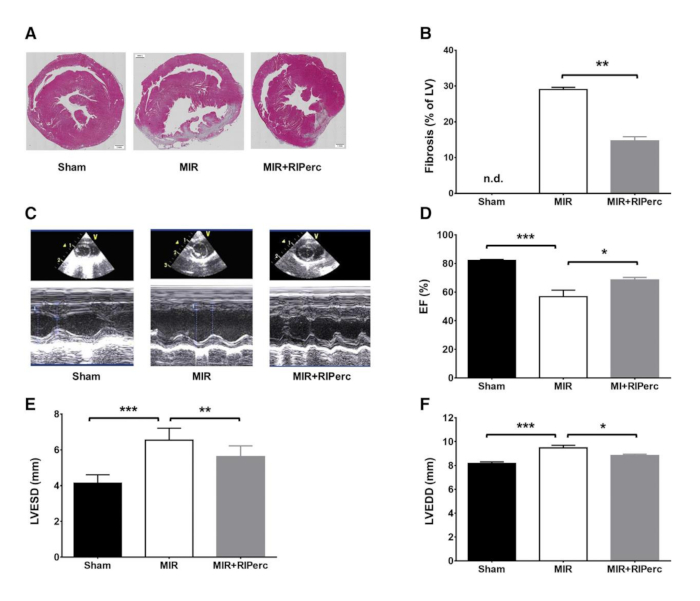
Figura 4: Efecto del acondicionamiento isquémico remoto en la formación de cicatrices, la función ventricular izquierda y la remodelación. (A) Rebanadas histológicas de LV cosechadas en el día 14 después de la reperfusión miocárdica. (B) Resultados cuantificados de la fibrosis en gráficos de barras. (C) Ecocardiogramas representativos en modo M. (D) Fracción de eyección (EF) cuantificada en gráficos de barras. (E) Diámetro end-sistólico LV (LVESD) cuantificado en gráficos de barras. (F) Diámetro diastólico final (LVEDD) LV cuantificado en gráficos de barras. MIR, isquemia-reperfusión miocárdica; RIPerc, acondicionado isquémico remoto. Los datos se expresan como medias : SEM. *p < 0.05; **p < 0.01; p < 0.001. Reimpreso de Pilz et al.6 con permiso de Elsevier. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Efecto de RIPerc en la función hemodinámica LV. (A) Los resultados de la presión sistólica del VI (LVSP), (B) de la salida cardíaca (CO) y (C) del volumen de carrera (SV) se obtuvieron del corazón de trabajo aislado el día 14 de la reperfusión post-miocárdica. (D) CO se representa como una función de la carga posterior; (F) trabajo cardíaco externo en función de la carga posterior, resultados cuantificados en el gráfico de barras (E y G). Los datos se expresan como medias: SEM y n a 4-7 por grupo. *p < 0.05; **p < 0.01; p < 0.001. MIR, isquemia/reperfusión miocárdica; RIPerc, preacondicionamiento isquémico remoto; EHW, trabajo externo del corazón; SV, volumen de carrera; AUC, área bajo la curva. Reimpreso de Pilz et al.6 con permiso de Elsevier. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La remodelación adversa después de mi se considera un mecanismo clave en el desarrollo de la insuficiencia cardíaca. Por lo tanto, para garantizar la continuidad de la investigación cardiovascular, los procedimientos y técnicas experimentales deben ser reproducibles. Un protocolo experimental comprensible y claramente definido es un elemento fundamental de reproducibilidad. La reproducibilidad se refiere a resultados que pueden ser repetidos por múltiples científicos y son validados en todos los laboratorios. Este estudio tenía como objetivo presentar un método semi-mínimamente invasivo para inducir MI crónica o re-perfundida y evaluar la función hemodinámica cardíaca en ratas.
Estos resultados y otros datos publicados muestran la alta potencia de este método quirúrgico y su importancia en la investigación sobre MI, remodelación y IC. Mientras que la isquemia/lesión por reperfusión se puede utilizar para entender los cambios en la MI con la reperfusión posterior, la oclusión permanente permite una mayor comprensión de los procesos de remodelación a corto y largo plazo del miocardio. Otros enfoques quirúrgicos causan más daño tisular y los animales muestran mayores riesgos de desarrollar infecciones y neumotórax, lo que resulta en mayores tasas de deserción. Por el contrario, este procedimiento tiene como objetivo reducir la mortalidad mediante mejoras específicas en la configuración y el manejo. Además, muestran variaciones en la expansión de la cicatriz fibrosa debido a la oclusión de LAD inestable.
Nuestro protocolo proporciona un método fácil para la intubación, que es uno de los pasos más críticos de todo el procedimiento. A diferencia de varias otras publicaciones12,la traqueotomía no se realiza en nuestro procedimiento. Esto mejora el despertar y la rehabilitación de los animales postoperatoriamente, lo que conduce al desarrollo de los cambios fisiopatológicos que se pretenden por este procedimiento quirúrgico antes de que los animales se sometan a mediciones postoperatorias. Obviamente, si se trata de un protocolo que no es de supervivencia, la traqueotomía se realiza bajo visión y, por lo tanto, es más fácil de realizar. Además, el cierre de la traqueotomía en un protocolo de supervivencia no es aplicable. Si se abre el tórax, es obligatorio ventilar el pulmón para evitar el colapso. Por lo tanto, las ratas se intubar antes del procedimiento quirúrgico. El enfoque mínimamente invasivo no corta las costillas o el esternón, manteniendo así la compacidad y estabilidad del tórax. En consecuencia, la recuperación de los animales mejora, y el riesgo de neumotórax espontáneo o sangrado es relativamente bajo.
Como se mencionó anteriormente, mientras que la intubación es de clara ventaja, es difícil de realizar y puede causar una mayor tasa de abandono al comienzo de los experimentos. Este problema se puede mitigar con capacitación y algunos conocimientos anatómicos. Es importante insertar el tubo en el ángulo correcto y estirar el cuerpo del animal hasta que la luz brille a través de los labios vocales después de lo cual el tubo se puede empujar suavemente hacia adelante. Tenga cuidado de no dañar los labios vocales, ya que esto puede causar hinchazón, oclusión posterior de la glotis y asfixia.
También es importante que el LAD se liga correctamente. La pequeña ventana quirúrgica, el corazón latiendo rápido y el pulmón ventilado (evitar tocarlo tanto como sea posible, ya que cada contacto puede resultar en sangrado en el pulmón) hacen que el vaso no sea claramente visible. Por lo tanto, el conocimiento anatómico es indispensable. La aurícula izquierda es indispensable para ayudar a estandarizar tanto el área en riesgo como para posicionar la ligadura alrededor del LAD. La puntada debe realizarse por vía intramural, no transmuralmente en el LV, ya que esto puede causar una reducción del diámetro y volumen de la cámara LV que no se debe a los procesos patológicos. La oclusión exitosa se asocia con la cianosis del área miocárdica en riesgo y elevación del segmento ST en el ECG. La principal limitación de este procedimiento es el posicionamiento correcto de la sutura. Para lograr resultados comparables, los puntos deben estar al mismo nivel y deben utilizar cantidades similares de tejido. Esto requiere un alto nivel de entrenamiento y se deben tener en cuenta los diferentes pesos de los animales. Otro punto a considerar es la eliminación adecuada del neumotórax antes del cierre del espacio intercostal. Si esto no se realiza con precisión, los animales mostrarán dificultades para respirar, ya que la inflación del pulmón izquierdo se verá obstaculizada por un neumotórax. Como se mencionó anteriormente, esto se puede mitigar mediante el uso de una jeringa para eliminar cualquier aire residual del tórax.
Actualmente, este procedimiento de MI es un método de uso común que garantiza resultados comparables y una alta tasa de supervivencia si los pasos críticos se realizan con alta precisión. Los proyectos futuros en diversos tratamientos, dispositivos o fármacos en MI, HF o remodelación cardíaca pueden ser evaluados mediante la realización de esta técnica mínimamente invasiva.
Las mediciones WH, como se mencionó anteriormente, no se utilizan comúnmente ya que su mantenimiento y manejo requiere equipos y conocimientos específicos. Para adquirir datos representativos y comparables, deben evitarse los escollos. Los pasos más críticos son el montaje del corazón y el cambio del modelo D al modo WH. Si el corazón no se extirpa adecuadamente, el montaje puede ser difícil, ya que se requiere suficiente longitud de tejido aórtico para fijar el corazón al aparato. Poco después de conectarse al modo LD, la frecuencia cardíaca puede disminuir debido al lavado en tampón frío, la desconexión de sus estímulos fisiológicos en el cuerpo o la reperfusión con sangre de otra especie por el aparato. En tales casos, se debe aplicar un marcapasos para restaurar y preservar la frecuencia fisiológica. Esto garantiza resultados comparables en todos los animales. Como el volumen sanguíneo dentro del aparato es un múltiplo del volumen fisiológico en ratas, se utilizan glóbulos rojos bovinos en una suspensión basada en tampón Krebs-Henseleit.
El cambio del modo LD al modo WH es sinónimo de un cambio del trabajo pasivo al corazón activo. El modo LD se utiliza para acostumbrar el corazón a su nuevo entorno. En el modo WH, el corazón debe realizar sus funciones de eyección fisiológica. Por lo tanto, se requiere una fase de adaptación corta a las nuevas circunstancias antes de la evaluación mediante el aumento de la carga posterior.
Otro paso crítico que comúnmente se olvida es la preparación y el mantenimiento adecuados del aparato y el perfuto. El volumen preciso de cada compuesto debe mezclarse y la temperatura dentro del sistema debe ser controlada y ajustada. Sin embargo, el WH es un método elegante para evaluar la salida cardíaca, el volumen del accidente cerebrovascular, la presión sistólica ventricular izquierda y el flujo coronario simultáneamente.
Este procedimiento altamente reproducible para inducir a MI y los datos de representación adquiridos por el aparato WH están demostrando su capacidad ellos mismos. El enfoque semi-mínimamente invasivo, el nivel de oclusión LAD y el método de intubación facilitan la recuperación rápida y baja variabilidad en el tamaño del infarto. Además, el análisis de la función cardíaca en corazones de trabajo aislados proporciona valiosos resultados hemodinámicos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen al equipo de teatro de operaciones y a los técnicos del Centro de Investigación Biomédica por su contribución, asistencia técnica, valiosa aportación y asesoramiento. Los proyectos están financiados por el Instituto Ludwig Boltzmann, Cluster for Cardiovascular Research (proyecto REM).
Materiales
| Name | Company | Catalog Number | Comments |
| ANAESTHESIA & ANALGESIA | |||
| Isoflurane | Zoetis | TU061219 / 8-00487 | |
| Ketamine | Dr. E. Gräub AG | 100 mg/kg of bodyweight | |
| Piritramide | Hameln-Pharma Plus GmbH | 2 ampulles with 30 ml of Glucose 5% in 250ml water | |
| Xylazine | Bayer | 4 mg/kg of bodyweight | |
| INTUBATION | |||
| Air | |||
| Oxygen (pure) | |||
| Ventilation machine | Hugo Sachs Electronics | UGO Basile S.R.L. | Respirator |
| 14-gauge tube | Dickinson and Company | BD Venflon | |
| PREPARATION | |||
| Anti-septic povidine iodine solution | Mundipharma | Betaisodona solution | |
| Eye ointment | Fresenius Kabi Austria | Oleovital with Vitamin A + Dexpanthenol | |
| Shaver | |||
| SURGICAL INSTRUMENTS | |||
| Anatomical forceps | Martin | 12-272-15 | |
| Anatomical forceps small | Martin | 24-386-16 | |
| Anatomical forceps thin | Odelga | RU4042-15 | |
| Cautery Fine Tip | High Temp | bvi-Accu-Temp | |
| Cup (small, for liquids) | Martin | 56-231/11 | |
| Mensur | MTI | 29-260/25 | |
| Mosquito clamps | MTI | 05-055/12 | |
| Needleholder short | Martin | 20-658-14 | |
| Needleholder thin | Martin | ||
| Round hook | BT-190 | ||
| Scalpell size 3 | Swann Morton | No.10, 0301 | |
| Scissors for tissue preparation | Aesculap | BC259R | |
| Sharp scissors | MTI | 01-010/10 | |
| Small retractor | Alm | AM.416.10 | |
| Surcigal forceps | Martin | 12-321-13 | |
| Surgical scissors | |||
| SUTURES | |||
| PermaHand Silk 4-0 | Johnson & Johnson Medical Products GmbH | K891H | |
| Vicryl 4-0 | Johnson & Johnson Medical Products GmbH | JV2024 | single monofil suture |
| Vicryl 6-0 | Johnson & Johnson Medical Products GmbH | V301G | polyethylene suture |
| COMPUTER PROGRAMS & APPARATUS | |||
| Labchart 7 Pro | ADInstruments | v7.3.2 | Labchart Software |
| PowerLab System | ADInstruments | Powerlab 8/30 | |
| EX VIVO HEMODYNAMICS | |||
| Flowmeter Narcomatic RT-500 | Narco Bio-Systems | flow probe | |
| Isolated heart apparatus | Hugo Sachs Electronics | ||
| Labchart 7 Pro | ADInstruments GmbH | v7.3.2 | Labchart Software |
| Millar SPR-407 | Millar Instruments Inc. | 840-4079 | high-fidelity MicroTip catheter |
| Needle electrodes via Animal bio Amp | ADInstruments GmbH | MLA1203 | |
| Physiological Pressure Transducer (MLT844) with Clip-on BP Domes | ADInstruments GmbH | MLT844 | |
| PowerLab System | ADInstruments GmbH | Powerlab 8/30 |
Referencias
- WHO. Global Health Estimates 2015: Deaths by Cause, Age, Sex, by Country and by Region, 2000-2015. World Health Organization. , (2016).
- Jaquet, K., et al. Reduction of myocardial scar size after implantation of mesenchymal stem cells in rats: what is the mechanism. Stem Cells and Development. 14 (3), 299-309 (2005).
- Liu, P., Xu, B., Cavalieri, T. A., Hock, C. E. Age-related difference in myocardial function and inflammation in a rat model of myocardial ischemia-reperfusion. Cardiovascular Research. 56 (3), 443-453 (2002).
- Kolk, M. V. V., et al. LAD-Ligation: A Murine Model of Myocardial Infarction. Journal of Visualized Experiments. (32), e1438 (2009).
- Lugrin, J., Parapanov, R., Krueger, T., Liaudet, L. Murine Myocardial Infarction Model using Permanent Ligation of Left Anterior Descending Coronary Artery. Journal of Visualized Experiments. (150), e59591 (2019).
- Pilz, P. M., et al. Remote ischemic perconditioning attenuates adverse cardiac remodeling and preserves left ventricular function in a rat model of reperfused myocardial infarction. International Journal of Cardiology. 285, 72-79 (2019).
- Santer, D., et al. In vivo and ex vivo functional characterization of left ventricular remodelling after myocardial infarction in mice. ESC Heart Failure. 2 (3), 171-177 (2015).
- Langendorff, O. Untersuchungen am überlebenden Säugetierherzen II. Über den Einfluss von Wärme und Kälte auf das Herz der warmblütigen Tiere. Pflügers Archiv für die gesamte Physiologie des Menschen und der Tiere. 66 (67-68), 355-400 (1897).
- Liao, R., Podesser, B. K., Lim, C. C. The continuing evolution of the Langendorff and ejecting murine heart: new advances in cardiac phenotyping. American Journal of Physiology-Heart and Circulatory Physiology. 303 (2), 156-167 (2012).
- Podesser, B. K., et al. The erythrocyte-perfused "working heart" model: hemodynamic and metabolic performance in comparison to crystalloid perfused hearts. Journal of Pharmacological and Toxicological Methods. 41 (1), 9-15 (1999).
- Kiss, A., et al. Argon preconditioning enhances postischaemic cardiac functional recovery following cardioplegic arrest and global cold ischaemia. European Journal of Cardio-Thoracic Surgery. 54 (3), 539-546 (2018).
- Kiss, A., et al. Vagal nerve stimulation reduces infarct size via a mechanism involving the alpha-7 nicotinic acetylcholine receptor and downregulation of cardiac and vascular arginase. Acta Physiologica. 221 (3), 174-181 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados