Method Article
Méthode invasive semi-minimale pour induire l’infarctus du myocarde chez les rats et l’évaluation de la fonction cardiaque par un système cardiaque de travail isolé
Dans cet article
Résumé
Cet article présente une méthode efficace pour effectuer l’ischémie myocardique et la reperfusion chronique suivante chez les rats utilisant une approche mini-invasive. En outre, la fonction hémodynamique ventriculaire gauche des rats est évaluée par échocardiographie et méthodes cardiaques de travail isolées.
Résumé
L’infarctus du myocarde (MI) demeure le principal facteur de morbidité et de mortalité dans le monde. Par conséquent, la recherche sur ce sujet est obligatoire. Une procédure d’induction de MI facilement et hautement reproductible est nécessaire pour obtenir une meilleure compréhension et une meilleure compréhension des changements pathologiques sous-jacents. Cette procédure peut également être utilisée pour évaluer les effets ou la puissance de nouveaux traitements prometteurs (comme médicaments ou interventions) dans l’IM aigu, le remodelage ultérieur et l’insuffisance cardiaque (HF). Après l’intubation et la préparation préopératoire de l’animal, un protocole anesthésique avec l’isoflurane a été exécuté, et la procédure chirurgicale a été conduite rapidement. À l’aide d’une approche minimalement invasive, l’artère descendante antérieure gauche (LAD) a été localisée et occluse par une ligature. L’occlusion peut être exécutée avec acuité pour la reperfusion suivante (blessure d’ischémie/reperfusion). Alternativement, le navire peut être ligaté de façon permanente pour étudier le développement de l’IM chronique, le remodelage ou HF. Malgré les pièges courants, les taux d’abandon sont minimes. Divers traitements tels que le conditionnement ischémique à distance peuvent être examinés pour leur potentiel cardioprotecteur pré-, péri- et post-opératoire. La récupération post-opératoire a été rapide car l’anesthésie a été précisément contrôlée et la durée de l’opération était courte. L’analgésie postopératoire a été administrée pendant trois jours. La procédure mini-invasive réduit le risque d’infection et d’inflammation. En outre, il facilite la récupération rapide. Les mesures du « cœur de travail » ont été effectuées ex vivo et ont permis un contrôle précis de la préchargement, du chargement et du débit. Cette procédure nécessite un équipement spécifique et une formation pour une performance adéquate. Ce manuscrit fournit une introduction détaillée étape par étape pour effectuer ces mesures.
Introduction
Bien que l’incidence diminue continuellement, l’infarctus aigu du myocarde (MI) demeure le principal facteur de morbidité et de mortalité dans le monde1. Il existe des restrictions sur l’évaluation de l’efficacité des traitements potentiels en tant que médicaments ou interventions chirurgicales qui préviennent et traitent l’IM aiguë. Avant que leurs effets puissent être examinés chez l’homme, ces traitements doivent être testés à l’avance pour les risques, y compris les examens in vivo chez les animaux. Il n’y a pas de meilleure occasion d’étudier une pathologie que dans des conditions in vivo. Par conséquent, l’induction de MI chez les rats ou les souris et même les grands modèles animaux (porcs ou moutons) permet l’étude des changements à court (aigu) et à long terme (chroniques) dus à l’ischémie dans les artères coronaires et le myocarde environnant, ainsi que des changements systémiques dus à la fonction cardiaque altérée. La taille d’infarctus était précédemment l’objectif principal, mais plus récemment les processus suivants de remodelage cardiaque dans les dommages aigus de MI ou d’ischémie/reperfusion aussi bien que dans l’arrêt du coeur consécutif (HF) sont devenus de grand intérêt. Par conséquent, une méthode comparable et facilement reproductible est nécessaire pour atteindre des résultats cohérents.
Tandis que l’utilisation de cryo-ablation pour gagner MI a été rapportée2, notre méthode s’appuie sur d’autres études dans lesquelles les investigateurs occludent l’artère descendante antérieure gauche (LAD) par une ligature de point simple. Par rapport aux procédures (hemi-)sternotomie, l’approche minimalement invasive qui sera présentée dans cet article, permet une récupération postopératoire plus rapide et réduit nettement le temps d’opération. Une étape commune d’autres procédures chirurgicales est l’ascenseur du coeur du thorax pour effectuer le point de coeur3. L’approche de cette méthode rend cette étape inutile. Selon le protocole, deux procédures différentes peuvent être effectuées : une occlusion temporaire à l’aide d’un tourniquet pour induire l’ischémie/reperfusion sur un temps défini; ou une occlusion permanente de l’artère en fixant la ligature. Le succès de l’occlusion peut être évalué avec l’électrocardiogramme (ECG) et les changements macroscopiques dans le ventricule gauche (LV) ainsi que son paling.
Une autre étape importante avant la chirurgie est l’intubation. Alors que dans la plupart des cas, l’intubation est effectuée par trachéotomie ou par insertion orale du tube sous la vision par une incision cutanée à la gorge, ce protocole décrit l’intubation endotrachée de l’animal anesthésié qui réduit les difficultés respiratoires ou les infections postopératoirement4,5. Pour éviter les complications postopératoires, l’air est retiré du thorax par une seringue avant de fermer la poitrine.
La deuxième tâche de cet article est l’évaluation de la fonction hémodynamique via un modèle expérimental cardiaque de travail isolé, comment il est utilisé dans d’autres projets au sein de notre institut6,7. Bien que l’échocardiographie, l’imagerie par résonance magnétique cardiaque (IRM) et la quantification invasive des boucles de volume de pression soient des méthodes bien connues et largement utilisées pour évaluer la fonction cardiaque in vivo, on sait qu’elles ont certaines limites. Les approches invasives, telles que l’utilisation de cathéters pour examiner la fonction globale ou des paramètres spécifiques du cœur, sont couramment utilisées et représentent l’étalon-or des mesures cardiaques. En revanche, l’appareil cardiaque ex vivo est rarement utilisé en raison de sa complexité et de son coût. Il y a beaucoup d’aspects importants, du mélange du perfusate à la cannulation adéquate du coeur, qui sont cruciaux pour l’évaluation réussie. L’appareil cardiaque de travail isolé a d’abord été décrit par Oskar Langendorff en 18978 et a été modifié au cours des dernières décennies9. Aujourd’hui, il y a deux modèles utilisés : le mode Langendorff (LD) et le mode coeur de travail (WH). Dans notre étude, le mode LD est utilisé pour acclimater le cœur à son nouvel environnement (environ 15 min). Dans ce mode, le cœur est cannulé par l’intermédiaire de l’aorte et les artères coronaires sont perfused antérogradely, fournissant adéquatement le myocarde. En mode LD, le cœur n’effectue aucun travail de volume de pression. En revanche, dans le mode WH, l’atrium gauche est cannilé par une veine pulmonaire, à travers laquelle le perfusate pénètre dans l’atrium gauche. Le cœur pompe alors ce perfusate physiologiquement contre une charge après prédéfinie. En augmentant le chargement après le temps, la fonction cardiaque peut être mesurée en permanence. Des paramètres tels que le flux coronaire, la sortie cardiaque (CO), le volume de course (SV) et le travail, le flux auriculaire et les pressions systoliques et diastoliques de LV peuvent être mesurés. L’impact de divers traitements directement et uniquement sur le cœur peut être étudié6,10. Un examen par Liao et Podesser9 a présenté l’utilisation répandue de cette méthode dans l’évaluation des effets pharmacologiques sur la fonction cardiaque et le métabolisme ainsi que dans l’exploration de diverses maladies telles que l’IM, HF, l’obésité et le diabète.
En résumé, ce protocole présente une méthode reproductible pour effectuer des blessures in vivo d’ischémie/reperfusion (MIR) de MI ou de myocarde.... En outre, il permet la caractérisation de LV (dys-)fonction sur un coeur de rat isolé après MI. Ce protocole présente une combinaison unique de traitement et d’analyse.
Protocole
Le protocole expérimental qui a fourni les résultats décrits dans cet article a été approuvé par le Comité régional d’éthique pour les expériences animales de laboratoire à l’Université médicale de Vienne et le Ministère fédéral autrichien de l’éducation, de la science et de la recherche (BMWFW-66.009/0023-WF/V/3b/2016). Toutes les expériences sont conformes au Guide for the Care and Use of Laboratory Animals, publié par les National Institutes of Health des États-Unis (publication n° 85-23 des NIH, révisée en 1996).
REMARQUE : On utilise des rats Sprague Dawley mâles de 10 à 12 semaines de 250 à 300 g de poids corporel (BW). Comme les procédures et les traitements suivants sont effectués dans un environnement stérile d’une salle d’opération (OU), portez des gommages, des gants, des masques et des hottes lors de la manipulation des animaux. Avant d’entrer dans la salle d’opération, assurez-vous que les mains sont lavées et désinfectées. Si l’intention est d’opérer plusieurs animaux dans une session chirurgicale, soit laver et désinfecter, ou autoclave les instruments entre les opérations. Ces directives d’hygiène sont valables pour toutes les procédures présentées dans la section protocole.
1. Préparation préopératoire et anesthésie
- Initier l’anesthésie préopératoire en injectant un mélange de xylazine (4 mg/kg BW) et de kétamine (100 mg/kg BW) intrapéritoneally.
- Intuber les rats avec un tube de 14 G et une ventilation à volume contrôlée avec un mélange d’O2,d’air et d’isoflurane (1−2,5%) à 75−85 coups/min, 100 mL/stroke/BW (figure 1A). Si nécessaire, pour une meilleure vue tout en intubating: appliquer Xylocain via une pointe de coton-laine sur le pharynx inférieur pour atteindre la relaxation locale.
- Placez les rats sur une table d’opération chauffée en position supinante et fixez les membres antérieurs avec du ruban adhésif (figure 1B).
- Mesurer la température rectale à l’aide d’une sonde.
REMARQUE : Il doit être maintenu entre 37,5−38,5 °C. - Raser le thorax et nettoyer la zone d’opération avec une solution antiseptique d’iode povidone. Appliquer l’onguent oculaire sur le rat pour éviter le séchage des yeux.
- Administrer l’analgésie intraopératoire en injectant du piritramide (0,1 mL/kg BW) intrapéritoneally.
- Placez les sondes ECG sous-cutanéement dans les extrémités de l’animal.
- Vérifiez les réflexes de la queue et des orteils avant d’entreprendre la procédure chirurgicale.
2. Intervention chirurgicale - induction de l’ischémie myocardique
- Effectuer l’incision de la peau à l’aide d’un scalpel. Assurez-vous de commencer 2 mm parasternal sur le thorax gauche au niveau du 3ème espace intercostal et continuer à la ligne axillaire antérieure au niveau de l’espace intercostal 5ème (Figure 1C).
- Remplacer doucement les muscles superficiels pour rendre les côtes visibles (Figure 1D).
- Dans le cas d’un saignement mineur, utilisez un cauter pour effacer ou déconnecter les tissus environnants.
- Effectuer la thoracotomie au niveau du 4ème espace intercostal et insérer un rétractateur pour gagner la visibilité du cœur et du poumon (Figure 1E). Ouvrez soigneusement la pleura pour éviter les saignements.
- Occluser temporairement le LAD à l’aide d’un tourniquet pour induire l’ischémie/reperfusion (MIR) sur une période définie; ou en permanence (MI) l’occluse en faisant 6−7 noeuds en utilisant une suture de 6-0 pour fermer la ligature (Figure 1F,G).
REMARQUE : Le bon endroit pour l’occlusion du LAD est situé à environ 2−3 mm sous l’auricule gauche sur la marge latérale ventrale/gauche du cœur. L’occlusion réussie est associée aux changements d’ECG (élévation de segment de ST) et aux changements macroscopiques dans le LV comme palage. - Dans le cas du modèle ischémie/reperfusion, rouvrir le LAD par l’enlèvement du tourniquet après 30 min d’occlusion.
- Fermez le thorax avec trois sutures à bouton unique à l’aide d’une suture monofilament unique 4-0 (Figure 1H). Avant de serrer la dernière suture, retirer tout air résiduel du thorax à l’aide d’une seringue de 10 mL pour éviter un pneumothorax (figure 1I).
- Repositionnez les muscles et éteignez l’anesthésie volatile.
- Suturer la peau avec une suture continue à l’aide d’une suture 4-0 (Figure 1J).
- Administrer un spray antiseptique pour se protéger contre les infections et les morsures de la suture par les rats.
3. Critères de traitement et d’exclusion postopératoires
- Gardez les rats sur la table chauffante jusqu’à ce qu’ils se réveillent. Extubate les rats dès qu’ils commencent à respirer spontanément.
- Mettez les rats extubés dans une cage sous une lampe chauffante pour les empêcher de refroidir.
- Renvoyez les rats dans les maisons d’animaux dans des conditions normalisées lorsqu’ils recommencent à se comporter normalement.
- Ajouter 2 ampules de piritramide et 30 mL de glucose de 5% à 250 mL d’eau pour l’analgésie postopératoire pendant trois jours.
- Vérifiez la condition physique et le comportement des rats avec la liste de contrôle et les critères d’exclusion (Tableau 1). Observez les animaux deux fois par jour pendant la semaine suivante, puis deux fois par semaine.
REMARQUE : Conformément aux normes internationales, présentez aux vétérinaires les animaux souffrants, ou les animaux qui gagnent jusqu’à 6 points dans l’évaluation avec la liste de contrôle, pour qu’ils prennent des décisions liées à la thérapie. Tous les animaux qui gagnent 7 points ou plus doivent être immédiatement sacrifiés avec une surdose de kétamine et de xylazine.
| Examen | Observation | Score |
| Poids corporel | Stable | 0 |
| Perte de 10% | 4 | |
| Perte de 15% pour 48 h | 7 | |
| Perte de 18% | 7 | |
| normal (manteau plat et brillant) | 0 | |
| Apparence externe | piloerection | 1 |
| Hématome | 2 | |
| blessures/coupures/marques de morsure | 2 | |
| toilettage sévèrement réduit | 4 | |
| (orifices impurs/coagulés ou humides) | 7 | |
| irritations ou blessures cutanées graves | 7 | |
| posture bossue >2 h | 7 | |
| distension abdominale significative (ascite) | 7 | |
| Comportement | normal (sommeil, curieux, contacts sociaux, réaction lorsqu’il est touché) | 0 |
| comportement inhabituel, p. ex. | 2 | |
| l’auto-isolement, l’hyperactivité prononcée ou les stéréotypes | 4 | |
| léthargie pour <6 h | 4 | |
| léthargie pour 6 h à 8 h | 7 | |
| apathie >8 h | 7 | |
| stéréotypes ininterrompues pour >10 min. et persistent encore après 2 h | 7 | |
| signes de douleur lorsqu’il est touché | 7 | |
| automutilation | 7 | |
| Digestion | Normal | 0 |
| diarrhée (excréments mous) | 3 | |
| diarrhée pour 72 h ou aqueuse | 7 | |
| selles sanglantes | 7 |
Tableau 1 : Liste de contrôle et critères d’exclusion. Ce tableau contient les examens à observer et la note correspondante. Par conséquent, le traitement postopératoire de l’animal doit être adapté, ou un vétérinaire doit être consulté.
4. Mesures d’échocardiographie
REMARQUE : L’échocardiographie est habituellement effectuée deux fois, avant l’induction de l’IM et avant que les organes ne soient récoltés.
- Injectez aux rats un mélange de xylazine (4 mg/kg BW) et de kétamine (100 mg/kg BW) intrapéritoneally.
- Placer les rats en position supination sur un plateau chauffant. Appliquez du gel d’écho sur la poitrine, ce qui aide les ondes ultrasoniques à mieux voyager et réduit les interférences du signal.
- Obtenir des vues parasternal à axe court de la cavité LV au niveau du muscle papillaire.
- Effectuer l’échocardiographie en mode M afin de mesurer la fraction d’éjection ventriculaire gauche et la morphologie.
5. Récolte d’organes (sans cœur de travail)
- Administrer la xylazine (4 mg/kg BW) et la kétamine (100 mg/kg BW) dans l’intraperitonone avant la récolte des organes. Assurez-vous que les réflexes sont négatifs.
REMARQUE : Aucune intubation n’est requise car la procédure ne dure pas plus d’une minute. - Utilisez un scalpel pour faire une incision cutanée sous le xiphoide et l’étendre parallèlement aux côtes des deux côtés à l’aide de ciseaux.
- Couper les côtes dans la ligne axillaire frontale et saisir le xiphoide pour soulever la poitrine vers le haut (Figure 2A).
- Enlever les adhérences anatomiques ou fibrotiques des tissus en brisant soigneusement le tissu avec deux paires de forceps.
- Prenez des échantillons de sang (pour l’évaluation des gaz sanguins ou des analyses moléculaires) de la vena cava inférieure avec une seringue de 5 mL.
- Effectuer l’excision de tout le cœur au niveau de l’entrée et de la sortie (figure 2B). Si nécessaire, procéder à l’évaluation cardiaque de travail telle que décrite à l’article 6.
- Récolter les organes, les choquer dans l’azote liquide et les stocker à -80 °C pour d’autres analyses moléculaires, ou dans le formaldéhyde à des fins histologiques.
6. Mesures hémodynamiques ex vivo via un système cardiaque de travail
REMARQUE : La configuration générale et les composants de l’appareil ont déjà été décrits11. Le protocole suivant décrit la manipulation du cœur de l’animal et les étapes nécessaires pour évaluer la fonction LV.
- Anesthétiser les rats tel que décrit à l’étape 5.1 et injecter 200 UI de l’héparine par voie intraveineuse (veine fémorale).
- Ouvrez le thorax par une incision sous l’arc costal avec un scalpel et étendez-le aux deux lignes axillaires antérieures avec des ciseaux et élèvez le sternum.
- Couper les grands récipients près de leur sortie ou de l’entrée au cœur pour l’exciser (figure 2B).
- Plongez le cœur dans le tampon de Krebs-Henseleit glacé et montez-le sur le système cardiaque isolé érythrocyte-perfusé par l’intermédiaire de la cannilate de l’aorte (Figure 3A).
- Commencez par le mode LD avec une charge constante de 60 mmHg (période de stabilisation).
- Après 15 min de mode LD, passez au mode WH. Par conséquent, cannuler l’atrium gauche par une veine pulmonaire (Figure 3B). Ensuite, modifiez la direction du flux dans le système en ouvrant le clip qui occluse la canule auriculaire. Il en résulte une perfusion de l’atrium gauche et un flux sanguin physiologique dans le cœur gauche11.
- Enregistrez les mesures hémodynamiques pendant 20 min en mode WH.
- Recueillir les gouttes de sang des coronaires à l’aide d’une seringue de 2 mL pour mesurer le débit coronaire (CF, mL/min) toutes les 5 minutes.
REMARQUE : Les FC sont mesurées comme la différence entre le débit auriculaire gauche (LAF) et le débit aortique (AF). - Effectuer des mesures continues de LAF (équivalent à la sortie cardiaque) et AF avec une sonde de flux.
REMARQUE : La sonde est insérée par l’intermédiaire de l’appareil WH dans la LV. Toutes les données sont enregistrées en permanence. - Si le protocole en cours demande, insérez un cathéter haute fidélité rétrogradement par l’intermédiaire de la valve aortique dans le LV et mesurez la pression systolique de ventricule gauche (LVSP).
- Pour évaluer le travail sous pression-volume effectué par minute, calculer le volume de l’AVC comme sortie cardiaque divisée par la fréquence cardiaque.
- Calculer le travail cardiaque externe (EHW) selon la formule suivante : CO x LVSP (g x m/min) normalisé au poids cardiaque.
Résultats
Les résultats suivants ont été publiés par Pilz et coll.6. Avec cette procédure chirurgicale précise, l’effet cardioprotecteur du perconditioning ischémique à distance (RIPerc) peut être étudié. Il s’agit d’un nouveau traitement potentiel pour les patients souffrant de MI aigu ou MIR et de remodelage ventriculaire subséquent, qui dans de nombreux cas conduit à HF consécutif. Imiter les changements pathophysiologiques de MI/MIR est une étape obligatoire dans l’évaluation des traitements car les études in vitro ou ex vivo ne fournissent pas l’environnement physiologique. Dans ce protocole, les animaux ont été soumis à 30 min d’occlusion LAD suivie de la reperfusion (c.-à-d. MIR).
Pour prouver la reproductibilité de la procédure, des coupures histologiques et des taches ont été effectuées (Figure 4A). Il était clair que la cicatrice fibrotique chez les animaux traités par MIR+RIPerc était comparable à la formation de cicatrices des animaux Sham, tandis que la comparaison de la fibrose entre les groupes Sham et MIR était significative (Figure 4B). En outre, les animaux traités par MIR+RIPerc ont montré une fibrose significativement réduite par rapport aux animaux traités au MIR. Cependant, les images histologiques représentatives clarifient la puissance de cette intervention chirurgicale car l’infarctus est explicitement soutenu dans le groupe MIR (Figure 4A). À l’aide de l’échographie in vivo, la fraction d’éjection, les diamètres diastoliques finaux et systoliques finaux (LVEDD et LVESD) ont été mesurés et ont montré une fonction cardiaque significativement réduite due au traitement mir tandis que les paramètres hémodynamiques ont été préservés par RIPerc (Figure 4C−F). Les données hémodynamiques ex vivo ont montré l’efficacité de la procédure, car le groupe MIR a montré des diminutions significatives du LVSP, de la production cardiaque (CO), du volume des accidents vasculaires cérébraux (SV) ainsi que du travail cardiaque externe (EHW) (Figure 5A−G).
Une recherche de littérature au sujet de cette procédure chirurgicale n’a rapporté aucun commentaire négatif ou insatisfaisant et des résultats quand il a été convenablement exécuté. Néanmoins, les pièges mentionnés dans l’introduction et la discussion doivent être évités et la formation est obligatoire pour obtenir un niveau de rendement stable et obtenir des résultats comparables.
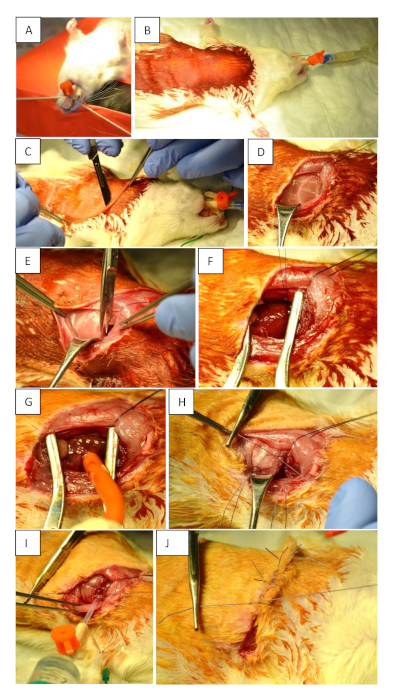
Figure 1 : Préparation préopératoire et intervention chirurgicale. (A) Intubation de l’animal à l’aide d’un tube de 14 G. (B) Positionnement et désinfection de la supination du champ chirurgical. (C) Incision cutanée (parasternal de 2 mm sur le thorax gauche au niveau du 3ème espace intercostal). L’incision doit atteindre la ligne axillaire antérieure au niveau du 5ème espace intercostal. (D) Déplacer les muscles pour rendre les côtes visibles. (E) Ouverture du thorax. (F) Occlusion permanente de LAD à l’aide de 6−7 nœuds. (G) Occlusion transitoire de LAD à l’aide d’un tourniquet. (H) Fermeture de la poitrine après l’ischémie myocardique et la reperfusion en plaçant trois sutures à un nœud autour des côtes. (I) Fermeture appropriée du thorax. Utilisez une seringue de 10 mL pour enlever tout air résiduel du thorax avant de fixer le dernier nœud de façon serrée. Ceci fait partie intégrante de la prévention d’un pneumothorax. (J) Suture de peau. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
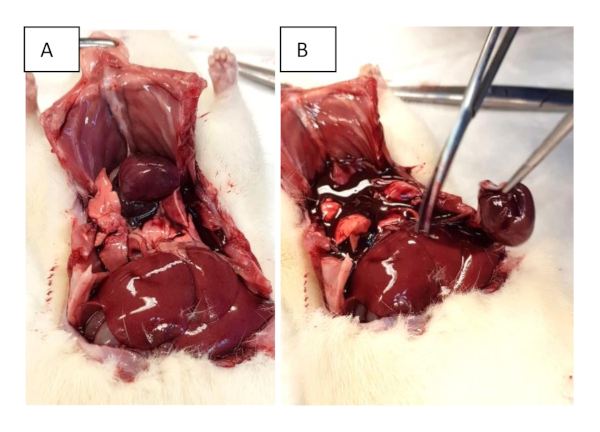
Figure 2 : Récolte d’organes. (A) Ouvrez la poitrine avec des coupes sous-xiphoidal et étendez-les aux deux lignes axillaires moyennes. D’autres coupes dans les côtes sont effectuées pour faciliter le levage du sternum. (B) Excision du cœur. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Appareil cardiaque isolé. (A) Mode Langendorff. Le cœur est monté à l’appareil WH par cannulation de l’aorte. (B) Mode coeur de travail. Le système peut être commuté au modèle WH pour évaluer la fonction cardiaque en cannuléssant l’atrium gauche. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
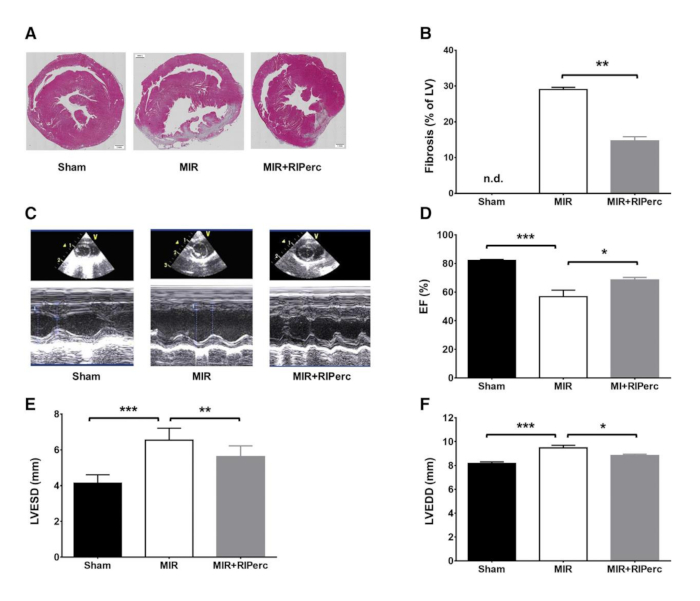
Figure 4 : Effet du conditionnement ischémique à distance sur la formation des cicatrices, la fonction ventriculaire gauche et le remodelage. (A) Tranches histologiques de LV récoltées le jour 14 de la reperfusion post-myocardique. (B) Résultats quantifiés de la fibrose dans les graphiques à barres. (C) Échocardiogrammes représentatifs en mode M. (D) Fraction d’éjection (EF) quantifiée dans des graphiques à barres. (E) Diamètre systolique de LV (LVESD) quantifié dans des graphiques de barre. (F) Diamètre lv en diatolique (LVEDD) quantifié dans les graphiques à barres. MIR, ischémie myocardique-reperfusion; RIPerc, perconditionnement ischémique à distance. Les données sont exprimées en moyenne ± SEM. *p < 0,05; **p < 0,01; p < 0,001. Réimprimé de Pilz et coll.6 avec la permission d’Elsevier. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Effet du RIPerc sur la fonction hémodynamique LV. (A) LV pression systolique (LVSP), (B) sortie cardiaque (CO), et (C) volume d’AVC (SV) résultats ont été obtenus à partir du cœur de travail isolé le jour 14 reperfusion post-myocardique. (D) Le CO est représenté comme fonction de la charge après; (F) travail cardiaque externe en fonction de la charge après charge, les résultats quantifiés dans le graphique à barres (E et G). Les données sont exprimées en moyenne ± SEM et n = 4–7 par groupe. *p < 0,05; **p < 0,01; p < 0,001. MIR, ischémie myocardique/reperfusion; RIPerc, condition préalable ischémique à distance; EHW, travail cardiaque externe; SV, volume de course; AUC, zone sous la courbe. Réimprimé de Pilz et coll.6 avec la permission d’Elsevier. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Le remodelage défavorable post-MI est considéré comme un mécanisme clé dans le développement de l’insuffisance cardiaque. Par conséquent, pour assurer la continuité de la recherche cardiovasculaire, les procédures expérimentales et les techniques doivent être reproductibles. Un protocole expérimental compréhensible et clairement défini est un élément fondamental de la reproductibilité. La reproductibilité fait référence aux résultats qui peuvent être répétés par plusieurs scientifiques et qui sont validés dans les laboratoires. Cette étude visait à présenter une méthode semi-mini-invasive pour induire l’IM chronique ou re-perfusée et évaluer la fonction hémodynamique cardiaque chez les rats.
Ces résultats et d’autres données publiées montrent la puissance élevée de cette méthode chirurgicale et son importance dans la recherche sur MI, remodelage et HF. Tandis que la blessure d’ischémie/reperfusion peut être employée pour comprendre les changements dans MI avec la reperfusion suivante, l’occlusion permanente permet une meilleure compréhension des processus de remodelage à court et à long terme du myocarde. D’autres approches chirurgicales causent plus de lésions tissulaires et les animaux présentent des risques plus élevés de développer des infections et du pneumothorax, ce qui entraîne des taux d’abandon plus élevés. En revanche, cette procédure vise à réduire la mortalité par des améliorations spécifiques dans la configuration et la manipulation. En outre, ils montrent des variations dans l’expansion de cicatrice fibrotique due à l’occlusion instable de LAD.
Notre protocole fournit une méthode facile pour l’intubation, qui est l’une des étapes les plus critiques de l’ensemble de la procédure. Contrairement à plusieurs autres publications12, la trachéotomie n’est pas effectuée dans notre procédure. Cela améliore l’éveil et la réhabilitation des animaux postopératoirement, conduisant au développement des changements pathophysiologiques qui sont prévus par cette procédure chirurgicale avant que les animaux subissent des mesures postopératoires. Évidemment, s’il s’agit d’un protocole de non-survie, la trachéotomie est effectuée sous la vision et est donc plus facile à exécuter. En outre, la fermeture de la trachéotomie dans un protocole de survie n’est pas applicable. Si le thorax est ouvert, il est obligatoire de ventiler le poumon pour éviter l’effondrement. Par conséquent, les rats sont intubés avant la procédure chirurgicale. L’approche minimalement invasive ne coupe pas les côtes ou le sternum, maintenant ainsi la compacité et la stabilité du thorax. Par conséquent, le rétablissement des animaux est amélioré, et le risque de pneumothorax spontané ou de saignement est relativement faible.
Comme mentionné ci-dessus, bien que l’intubation soit d’un avantage évident, elle est difficile à effectuer et peut entraîner un taux d’abandon plus élevé au début des expériences. Ce problème peut être atténué par la formation et certaines connaissances anatomiques. Il est important d’insérer le tube à l’angle droit et d’étirer le corps de l’animal jusqu’à ce que la lumière brille à travers les lèvres vocales après quoi le tube peut être doucement poussé vers l’avant. Prenez soin de ne pas nuire aux lèvres vocales car cela peut causer un gonflement, l’occlusion ultérieure de la glotte et l’étouffement.
Il est également important que le LAD soit ligaté correctement. La petite fenêtre chirurgicale, le cœur qui bat rapidement et le poumon ventilé (évitez de le toucher autant que possible que chaque contact peut entraîner des saignements dans le poumon) rendent le vaisseau pas clairement visible. Par conséquent, la connaissance anatomique est indispensable. L’auricule gauche est indispensable pour aider à normaliser à la fois la zone à risque et à positionner la ligature autour du LAD. Le point doit être effectué intramurally, pas transmurally dans le LV car cela peut causer une réduction du diamètre et du volume de chambre de LV qui n’est pas due aux processus pathologiques. L’occlusion réussie est associée à la cyanose de la zone myocardique à risque et à l’élévation du segment de ST sur ECG. La principale limitation de cette procédure est le positionnement correct de la suture. Pour obtenir des résultats comparables, les points doivent être au même niveau et doivent utiliser des quantités similaires de tissu. Cela nécessite un niveau élevé de formation et les différents poids des animaux doivent être pris en considération. Un autre point à considérer est l’enlèvement adéquat du pneumothorax avant la fermeture de l’espace intercostal. Si cela n’est pas effectué avec précision, les animaux présenteront des difficultés à respirer car l’inflation du poumon gauche sera entravée par un pneumothorax. Comme mentionné ci-dessus, cela peut être atténué en utilisant une seringue pour enlever tout air résiduel du thorax.
Actuellement, cette procédure MI est une méthode couramment utilisée qui garantit des résultats comparables et un taux de survie élevé si les étapes critiques sont effectuées avec une grande précision. Les futurs projets sur divers traitements, dispositifs ou médicaments en MI, HF ou remodelage cardiaque peuvent être évalués en effectuant cette technique mini-invasive.
Les mesures de WH ne sont pas couramment utilisées car son entretien et sa manutention nécessitent un équipement et des connaissances spécifiques. Pour obtenir des données représentatives et comparables, il faut éviter les pièges. Les étapes les plus critiques sont le montage du cœur et le passage du modèle D au mode WH. Si le cœur n’est pas excisé adéquatement, le montage peut être difficile car la longueur suffisante de tissu aortique est nécessaire pour fixer le coeur à l’appareil. Peu de temps après la connexion au mode LD, la fréquence cardiaque peut diminuer en raison du lavage dans le tampon froid, la déconnexion de ses stimuli physiologiques dans le corps ou la reperfusion avec le sang d’une autre espèce par l’appareil. Dans de tels cas, un stimulateur cardiaque doit être appliqué à la fois pour restaurer et préserver la fréquence physiologique. Cela garantit des résultats comparables chez tous les animaux. Comme le volume sanguin dans l’appareil est un multiple du volume physiologique chez les rats, les globules rouges bovins dans une suspension tampon Krebs-Henseleit sont utilisés.
Le passage du mode LD au mode WH est synonyme d’un passage du travail cardiaque passif au travail cardiaque actif. Le mode LD est utilisé pour habituer le cœur à son nouvel environnement. En mode WH, le cœur doit effectuer ses fonctions physiologiques d’éjection. Par conséquent, une courte phase d’adaptation aux nouvelles circonstances est nécessaire avant l’évaluation en augmentant la charge après.
Une autre étape critique qui est généralement oubliée est la préparation et l’entretien adéquats de l’appareil et du perfusate. Le volume précis de chaque composé doit être mélangé et la température à l’intérieur du système doit être contrôlée et ajustée. Néanmoins, le WH est une méthode élégante pour évaluer la sortie cardiaque, le volume de course, la pression systolique ventriculaire gauche et le flux coronaire simultanément.
Cette procédure hautement reproductible pour induire l’IM et les données de représentation acquises par l’appareil WH prouvent leur capacité elles-mêmes. L’approche semi-mini-invasive, le niveau d’occlusion lad et la méthode d’intubation facilitent le rétablissement rapide et la faible variabilité de la taille infarctus. En outre, l’analyse de la fonction cardiaque dans les cœurs de travail isolés fournissent des résultats hémodynamiques précieux.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient l’équipe de théâtre opérationnel et les techniciens du Centre de recherche biomédicale pour leur contribution, leur assistance technique, leur apport précieux et leurs conseils. Les projets sont financés par l’Institut Ludwig Boltzmann, Cluster for Cardiovascular Research (projet REM).
matériels
| Name | Company | Catalog Number | Comments |
| ANAESTHESIA & ANALGESIA | |||
| Isoflurane | Zoetis | TU061219 / 8-00487 | |
| Ketamine | Dr. E. Gräub AG | 100 mg/kg of bodyweight | |
| Piritramide | Hameln-Pharma Plus GmbH | 2 ampulles with 30 ml of Glucose 5% in 250ml water | |
| Xylazine | Bayer | 4 mg/kg of bodyweight | |
| INTUBATION | |||
| Air | |||
| Oxygen (pure) | |||
| Ventilation machine | Hugo Sachs Electronics | UGO Basile S.R.L. | Respirator |
| 14-gauge tube | Dickinson and Company | BD Venflon | |
| PREPARATION | |||
| Anti-septic povidine iodine solution | Mundipharma | Betaisodona solution | |
| Eye ointment | Fresenius Kabi Austria | Oleovital with Vitamin A + Dexpanthenol | |
| Shaver | |||
| SURGICAL INSTRUMENTS | |||
| Anatomical forceps | Martin | 12-272-15 | |
| Anatomical forceps small | Martin | 24-386-16 | |
| Anatomical forceps thin | Odelga | RU4042-15 | |
| Cautery Fine Tip | High Temp | bvi-Accu-Temp | |
| Cup (small, for liquids) | Martin | 56-231/11 | |
| Mensur | MTI | 29-260/25 | |
| Mosquito clamps | MTI | 05-055/12 | |
| Needleholder short | Martin | 20-658-14 | |
| Needleholder thin | Martin | ||
| Round hook | BT-190 | ||
| Scalpell size 3 | Swann Morton | No.10, 0301 | |
| Scissors for tissue preparation | Aesculap | BC259R | |
| Sharp scissors | MTI | 01-010/10 | |
| Small retractor | Alm | AM.416.10 | |
| Surcigal forceps | Martin | 12-321-13 | |
| Surgical scissors | |||
| SUTURES | |||
| PermaHand Silk 4-0 | Johnson & Johnson Medical Products GmbH | K891H | |
| Vicryl 4-0 | Johnson & Johnson Medical Products GmbH | JV2024 | single monofil suture |
| Vicryl 6-0 | Johnson & Johnson Medical Products GmbH | V301G | polyethylene suture |
| COMPUTER PROGRAMS & APPARATUS | |||
| Labchart 7 Pro | ADInstruments | v7.3.2 | Labchart Software |
| PowerLab System | ADInstruments | Powerlab 8/30 | |
| EX VIVO HEMODYNAMICS | |||
| Flowmeter Narcomatic RT-500 | Narco Bio-Systems | flow probe | |
| Isolated heart apparatus | Hugo Sachs Electronics | ||
| Labchart 7 Pro | ADInstruments GmbH | v7.3.2 | Labchart Software |
| Millar SPR-407 | Millar Instruments Inc. | 840-4079 | high-fidelity MicroTip catheter |
| Needle electrodes via Animal bio Amp | ADInstruments GmbH | MLA1203 | |
| Physiological Pressure Transducer (MLT844) with Clip-on BP Domes | ADInstruments GmbH | MLT844 | |
| PowerLab System | ADInstruments GmbH | Powerlab 8/30 |
Références
- WHO. Global Health Estimates 2015: Deaths by Cause, Age, Sex, by Country and by Region, 2000-2015. World Health Organization. , (2016).
- Jaquet, K., et al. Reduction of myocardial scar size after implantation of mesenchymal stem cells in rats: what is the mechanism. Stem Cells and Development. 14 (3), 299-309 (2005).
- Liu, P., Xu, B., Cavalieri, T. A., Hock, C. E. Age-related difference in myocardial function and inflammation in a rat model of myocardial ischemia-reperfusion. Cardiovascular Research. 56 (3), 443-453 (2002).
- Kolk, M. V. V., et al. LAD-Ligation: A Murine Model of Myocardial Infarction. Journal of Visualized Experiments. (32), e1438 (2009).
- Lugrin, J., Parapanov, R., Krueger, T., Liaudet, L. Murine Myocardial Infarction Model using Permanent Ligation of Left Anterior Descending Coronary Artery. Journal of Visualized Experiments. (150), e59591 (2019).
- Pilz, P. M., et al. Remote ischemic perconditioning attenuates adverse cardiac remodeling and preserves left ventricular function in a rat model of reperfused myocardial infarction. International Journal of Cardiology. 285, 72-79 (2019).
- Santer, D., et al. In vivo and ex vivo functional characterization of left ventricular remodelling after myocardial infarction in mice. ESC Heart Failure. 2 (3), 171-177 (2015).
- Langendorff, O. Untersuchungen am überlebenden Säugetierherzen II. Über den Einfluss von Wärme und Kälte auf das Herz der warmblütigen Tiere. Pflügers Archiv für die gesamte Physiologie des Menschen und der Tiere. 66 (67-68), 355-400 (1897).
- Liao, R., Podesser, B. K., Lim, C. C. The continuing evolution of the Langendorff and ejecting murine heart: new advances in cardiac phenotyping. American Journal of Physiology-Heart and Circulatory Physiology. 303 (2), 156-167 (2012).
- Podesser, B. K., et al. The erythrocyte-perfused "working heart" model: hemodynamic and metabolic performance in comparison to crystalloid perfused hearts. Journal of Pharmacological and Toxicological Methods. 41 (1), 9-15 (1999).
- Kiss, A., et al. Argon preconditioning enhances postischaemic cardiac functional recovery following cardioplegic arrest and global cold ischaemia. European Journal of Cardio-Thoracic Surgery. 54 (3), 539-546 (2018).
- Kiss, A., et al. Vagal nerve stimulation reduces infarct size via a mechanism involving the alpha-7 nicotinic acetylcholine receptor and downregulation of cardiac and vascular arginase. Acta Physiologica. 221 (3), 174-181 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon