Method Article
Visualización de la degeneración sináptica en Drosophila adulta en asociación con neurodegeneración
En este artículo
Resumen
El objetivo de este procedimiento es diseccionar el tejido del músculo longitudinal dorsal (DLM) para evaluar la integridad estructural de las uniones neuromusculares DLM (NMJ) en modelos de enfermedad neurodegenerativa utilizando Drosophila melanogaster.
Resumen
Drosophila sirve como un modelo útil para evaluar la estructura sináptica y la función asociada con enfermedades neurodegenerativas. Mientras que mucho trabajo se ha centrado en las uniones neuromusculares (NMJ) en las larvas de Drosophila, la evaluación de la integridad sináptica en Drosophila adulta ha recibido mucha menos atención. Aquí proporcionamos un método sencillo para la disección de los músculos longitudinales dorsales (DLMs), que son necesarios para la capacidad de vuelo. Además del vuelo como lectura conductual, esta disección permite que tanto las sinapsis DLM como el tejido muscular sean susceptibles de análisis estructural utilizando anticuerpos etiquetados fluorescentemente para marcadores sinápticos o proteínas de interés. Este protocolo permite la evaluación de la integridad estructural de las sinapsis en Drosophila adulta durante el envejecimiento para modelar la naturaleza progresiva y dependiente de la edad de la mayoría de las enfermedades neurodegenerativas.
Introducción
La disfunción sináptica es una de las primeras señas de identidad conocidas de la mayoría de las principales enfermedades neurodegenerativas1,2,3,4,5,6. Sin embargo, se sabe muy poco con respecto a cómo estas deficiencias estructurales y funcionales se relacionan con etapas posteriores de progresión de la enfermedad. Drosophila ha demostrado ser un sistema modelo útil para entender el crecimiento y desarrollo de la sinapsis utilizando NMJs larvales7,8,9. Sin embargo, la tercera etapa de la estrella larval sólo dura unos días, limitando su utilidad en el estudio de la neurodegeneración progresiva y dependiente de la edad. Una alternativa a la evaluación de los NMJ larvales es examinar las estructuras sinápticas en Drosophilaadulta, como las sinapsis formadas en los Músculos Longitudinales Dorsales (MMM) que se requieren para el vuelo10,11,12,13,14,15,16. Estas sinapsis tripartitas están organizadas estructuralmente de manera similar a las sinapsis de mamíferos17,proporcionando una ventaja única para evaluar modelos de enfermedades neurodegenerativas.
Aquí describimos un método sencillo para analizar la integridad estructural de los NMJ adultos en un modelo De Drosophila de neurodegeneración. Los métodos y estudios previos de disección de DLM han hecho hincapié en la importancia de preservar el tejido muscular para una variedad de aplicaciones18,19,20,21,22,23. Nuestro protocolo proporciona un método integral para preservar el tejido neuronal y muscular para investigar enfermedades neurodegenerativas. Otro componente importante del estudio de estas enfermedades es la capacidad de entender la pérdida neuronal de una manera dependiente de la edad. El trabajo previo proporciona una comprensión crítica y profunda de cómo se forman los NMJ de DLM durante la metamorfosis en la edad adulta temprana11,12,14,15,16,24. Nuestro protocolo establece un método para construir sobre este trabajo para investigar DLM NMJs de una manera dependiente de la edad en el envejecimiento y enfermedades neurodegenerativas.
Protocolo
1. Generación de moscas transgénicas
- Para generar moscas transgénicas para este experimento, recoja OK371-Gal425 moscas hembra vírgenes y machos de UAS-TDP-43M337V 26 (Figura 1A)anestesiando moscas con CO2 en una almohadilla para ordenar.
- Ordenar moscas anestesiadas en viales con medios Drosophila estándar para la cruz. Colocar los viales etiquetados a 25oC para que surja la próxima generación.
NOTA: Limpie a los adultos de los viales antes de que surja la progenie para asegurar el genotipo adecuado. - Una vez que la progenie emerge, recoger las moscas transgénicas en viales y ordenar por sexo para comenzar el envejecimiento para condiciones experimentales.
- Una vez recogidas las moscas, transfiera las moscas a alimentos frescos cada 2 días hasta que las moscas tienen 21 días de edad.
2. Preparación de la disección
- Para prepararse para las disecciones, obtenga solución salina tamponada de fosfato a temperatura ambiente (1x PBS), un plato de disección de 10 cm recubierto con un elastómero de silicona, tijeras de disección de borde recto, un conjunto de fórceps de disección contundentes, una pipeta P200 y puntas de pipeta, tubos de microcentrífuga de 2,0 ml, tijeras de oficina estándar, 70% etanol, una placa Petri de 6 cm y 32% de formaldehído diluido al 4% con 1x PBS.
- Etiquete los tubos para cada genotipo o condición y añada 900 l de 1x PBS (temperatura de la habitación) y 150 l de formaldehído al 32% a cada tubo. Use guantes y gafas de seguridad al preparar el fijador de formaldehído al 4%.
- Anesthetize 6-u201210 moscas por grupo directamente desde el vial con CO2 y sumergir moscas en un plato Petri de 6 cm con 70% de etanol. Presione vuela hacia abajo en el etanol usando un pincel de pintura para asegurarse de que los especímenes estén completamente sumergidos. Esto eliminará la capa de aceite en la cutícula exterior.
3. Aislamiento y fijación del tórax
- Antes de diseccionar cada espécimen, agregue aproximadamente 7-u201210 mL de 1x PBS al plato de disección recubierto con elastómero de silicona. Este volumen debe garantizar que las muestras de tejido estén completamente sumergidas.
- Transfiera una mosca al plato de disección del 70% de etanol usando fórceps contundentes y agarrando las alas o las piernas.
- Enfoque la muestra en el plato de disección bajo un microscopio de disección. A continuación, sumerja la muestra en 1x PBS, y retire cuidadosamente las alas usando Dumont #5 fórceps finos.
- Usando las tijeras de disección de resorte de borde recto Vannas, retire las piernas creando una pequeña incisión en el lado ventral de la cutícula. En el paso 3.8, esta incisión permitirá que el formaldehído penetre en el tejido.
- Tome las tijeras en una mano y sostenga los fórceps en la otra para colocar el lado ventral de la mosca hacia arriba. Mientras sostiene el espécimen en su lugar con los fórceps contundentes, retire la cabeza y el abdomen con las tijeras de disección.
- Transfiera el tórax aislado utilizando la punta de pipeta modificada en el tubo etiquetado, desde el paso 3.2.
NOTA: Ajuste la pipeta a 40 oL para evitar añadir 1 PBS adicional al fijador. - Repita los pasos 3.2-u20123.6 anteriores para cada espécimen.
- Fijar muestras durante 30 minutos a temperatura ambiente.
- Retire el arreglo con una pipeta Pasteur y deséchela en el recipiente de residuos adecuado bajo la campana de humo. Enjuague las muestras tres veces con 1,5 ml de 1x PBS cada una con una pipeta Pasteur. Completar un cuarto enjuague con solo 750 oL y dejar los tejidos en 1x PBS.
NOTA: En este punto, las muestras de tejido pueden permanecer a 4 oC durante un máximo de 3 días antes de continuar con los siguientes pasos.
4. Congelación repentina y bisección del tórax
- Antes de comenzar las bisecciónes, llene un matraz Dewar con nitrógeno líquido con guantes crioprotectores y gafas de seguridad adecuados. Obtenga un rompe cuchillas, cuchillas de plumas, un par de fórceps finos, hielo, PBS 1x pbS helado y pinzas criogénicas.
- Prepare un cubo de hielo para mantener 1x PBS helado.
- Utilice el rompe cuchillas para agarrar la hoja de plumas en un ángulo, y doblar la hoja con el fin de romper una pieza pequeña. El rompe cuchillas puede bloquear la cuchilla en posición para su uso como un pequeño bisturí.
NOTA: Una hoja debe durar para todos los grupos. Cambie si la cuchilla se rompe o se vuelve opaca. - Agregue una punta de pipeta limpia al P200th y retire 1/5 de la punta para transportar las muestras.
- Preparar un nuevo tubo de microcentrífuga para cada grupo y añadir 200 l de 1x PBS a cada tubo. Este segundo tubo se utilizará para recoger los preparativos finales de DLM.
- Retire los 1x PBS de los tubos con una pipeta Pasteur.
- Usando el equipo de protección adecuado, sumerja el tubo en el matraz de nitrógeno líquido durante 10 s con las pinzas criogénicas.
NOTA: Los tubos deben cerrarse firmemente para evitar que el tubo explote. - Retire el tubo del nitrógeno líquido y añada aproximadamente 300 l de PBS 1x PBS helado a las muestras con una pipeta Pasteur. Mantenga las muestras en hielo.
- Agregue el comprimido de disección de 10 cm recubierto con elastómero de silicona y prescinda el primer tórax con la pipeta modificada de 200 l.
- Coloque el lado ventral del tórax hacia arriba. En una mano utilice un par aburrido de fórceps para colocar el tórax y en la otra utilizar un buen par de fórceps para eliminar parte del ganglio torácico para exponer la línea media del tórax.
- Utilice la línea media del tórax como guía para hacer un corte superficial a través de 1/3 de laparte del tórax con la hoja.
- Retire la cuchilla del tórax y coloque el tórax en un ángulo de 45o con los fórceps romos. Vuelva a insertar la hoja y corte directamente la línea media del tórax. Esto resultará en dos hemithoraces.
- Tome un hemitórax a la vez y retire el exceso de tejido bajo la fibra muscular DLM F (Figura 1B), la mayor cantidad de fibra ventral. Utilice la cuchilla para realizar cuidadosamente uno o dos cortes para eliminar el exceso de tejido sin dañar los DMM.
- Una vez aislado, transfiera el hemitórax al tubo correcto con 1x PBS.
- Repita los pasos 4.6-u20124.14 hasta que se realicen 10 hemithoraces diseccionadas por grupo.
5. Tinción estructural
- Después de bisectar las muestras del tórax, coloque el tejido en tampón de bloqueo (1x PBS con 0.1% de suero de cabra normal, y 0.2% Tritón X-100 a pH 7.4) para permeabilizar el tejido y prevenir la tinción no específica. Utilice una pipeta Pasteur para eliminar el exceso de 1x PBS y añadir 1,5 ml de tampón de bloqueo a cada tubo. Bloquear los tejidos durante al menos 1 h a 4 oC.
- Preparar las muestras para la tinción estructural utilizando un anticuerpo conjugado fluorescente, peroxidasa de rábano picante 488 (anti-HRP-488) en una dilución de 1:200 y Phalloidin-647 a una dilución de 1:1000 en el bloqueo de las neuronas del motor tampón para manchar las neuronas motoras y el tejido muscular, respectivamente. Haga suficiente mancha para tener 150 ml por tubo. Almacene la mancha a 4 oC cubierta de papel de aluminio o en una caja oscura hasta que esté lista para la tinción.
- Después del bloqueo, retire el exceso de tampón de bloqueo con una pipeta Pasteur de vidrio.
- Antes de dispensar la mancha estructural, vórtice la mancha. Añadir 150 l de la mancha a cada tubo. Coloque las muestras en una caja oscura sobre el rotador a temperatura ambiente durante 2 horas.
- Retire la mancha y lave los tejidos cuatro veces en 1,5 ml de temperatura de la habitación 1x PBS con 0,3% Tritón X-100 durante 5 minutos en el rotador en una caja oscura. Las muestras ya están listas para montarse en una diapositiva.
6. Tejido de montaje
- Después de lavar las muestras en PBST, prepare un portaobjetos del microscopio para montar el tejido para la tinción. Prepare suministros adicionales, como resbalones de cubierta de vidrio, una pipeta P200, puntas de pipeta de 200 l, tijeras, refuerzos transparentes, fórceps de borde recto, medios de montaje fluorescentes anti-fade, esmalte de uñas y una caja oscura para cubrir los portaobjetos.
- Etiquete la diapositiva para identificar las muestras y limpie la diapositiva con kimwipes para asegurarse de que no haya manchas.
- Para asegurarse de que las muestras de hemitórax no se dañen por el resbalón de cubierta, construya un "puente" utilizando etiquetas de refuerzo. Tome una etiqueta de refuerzo, córtela por la mitad y coloque cada media parte de aproximadamente 15 mm. Esta distancia debe ser menor que la anchura del resbalón de la cubierta. Repita este paso cuatro veces para completar un "puente" que tenga 5 etiquetas de alto.
- Tome la pipeta P200 y modifique una puntath cortando 1/5 de la punta para transferir las muestras a la diapositiva. Las muestras deben transferirse a la diapositiva en el centro del puente.
- Tome el borde de una toallita de laboratorio y retire cualquier exceso de PBST. Usando fórceps, organizar los DLMs de tal manera que todas las muestras están mirando hacia arriba y cutícula lado hacia abajo.
- Usando una punta de pipeta P200 estándar, aplique 70 l de soporte de montaje a la corredera, evitando las burbujas de aire. Dispensar el medio en un patrón circular dentro de los refuerzos comenzando desde el exterior hacia el centro.
- Coloque un resguardo de la cubierta sobre los refuerzos.
- Utilice esmalte de uñas para recubrir los bordes exteriores alrededor del perímetro del cubreobjetos. Aplicar generosamente para formar un sello completo del tejido.
- Coloque el portaobjetos sobre una superficie plana en la oscuridad, permitiendo al menos 10 minutos para secar y evitar el foto-blanqueo o la pérdida de fluorescencia. Las diapositivas ahora se pueden utilizar para la creación de imágenes inmediatamente, o de otro modo almacenarse en una carpeta de diapositivas a -20 oC para su posterior visualización.
7. Alternativa: Tinción con anticuerpos primarios
NOTA: Esta sección es opcional y debe utilizarse directamente entre las secciones 4 y 5 si se desea.
- Para manchar el tejido con anticuerpos primarios, sumerja el tejido en el tampón de bloqueo durante al menos 1 h.
- Preparar el anticuerpo primario con la dilución adecuada en el tampón de bloqueo. Como mínimo, prepare suficiente mezcla de anticuerpos para tener 150 ml por grupo. Tenga en cuenta que las muestras se mantienen insopcionados. Conservar a 4oC hasta que esté listo para su uso.
- Elimine el exceso de búfer de bloqueo con una pipeta Pasteur. Vórtice brevemente el anticuerpo primario y añada 150 ml de mezcla de anticuerpos a cada grupo y coloque las muestras a 4 oC durante la noche.
- Al día siguiente, retire el anticuerpo primario y lave el tejido 4 veces con PBST durante 5 minutos cada uno en un rotador.
- Preparar la mancha secundaria en el tampón de bloqueo. Agregue la mancha secundaria a la muestra y luego manténgala a temperatura ambiente durante 2 horas en una caja oscura en el rotador.
NOTA: La tinción secundaria también puede incluir HRP y faloideína. - Después de la incubación de 2 h, para eliminar el tejido de lavado de manchas secundaria 4 veces durante 5 minutos con PBST y proceder al montaje.
Resultados
La generación de moscas transgénicas que expresan la proteína humana de unión al alquitrán de 43 kDa mutante (TDP-43M337V) está representada por el esquema (Figura 1A). Esto demuestra la aplicación del sistema binario Gal4/UAS en Drosophila27. La ilustración representa un hemitórax con seis fibras musculares, A-u2012F que va desde la fibra más dorsal A a la F más ventral (Figura 1B)11,12. Para evaluar la integridad sináptica, los NMJ se tiñeron con HRP y Phalloidin (Figura 1C-u2012E). Las neuronas motoras en los mutantes TDP-43M337V (Figura 1F) tienen poca o ninguna tinción de HRP para el día 21, mientras que WT (Oregon-R) permanece intacto (Figura 1C). No hay diferencias visibles en la tinción muscular(Figura 1D,G). Los cambios en la morfología bruta observados en los mutantes TDP-43M337V demuestran cómo la integridad sináptica puede estar implicada en un modelo de enfermedad neurodegenerativa de esclerosis lateral amiotrófica (ELA) utilizando el modelo DLM adulto. Además de la tinción estructural, la tinción de los NMJ de DLM también puede proporcionar una evaluación de la integridad sináptica con marcadores presinápticos (Figura 2A-u2012R) y post sináptica (Figura 2S-u2012X). Juntos, estos resultados ilustran cómo este protocolo de disección podría aplicarse al estudio del tejido DLM en enfermedades neurodegenerativas.
Un aspecto clave de esta disección es la aplicación de nitrógeno líquido para congelar el tejido para facilitar la bisección. La utilidad del nitrógeno líquido se demuestra en moscas WT con nitrógeno líquido donde el tejido muscular no tiene daño o fibras en picadas(Figura 3A-u2012C). Sin nitrógeno líquido, el tejido puede ser más difícil de diseccionar. Por ejemplo, seguir este protocolo y omitir el paso de congelación del flash de nitrógeno líquido permite que el tejido sea más susceptible al daño de las herramientas de disección como las neuronas dañadas (Figura 3D) o las fibras musculares dañadas (Figura 3E). La aplicación de nitrógeno líquido ayuda a prevenir el daño tisular que podría producirse al trabajar con tejido DLM independientemente del genotipo de la muestra(Figura 3C y 3F).
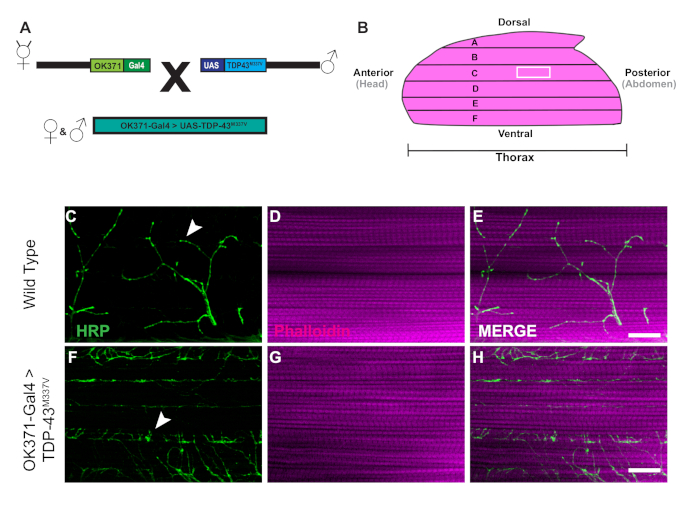
Figura 1: Denervación progresiva de las sinapsis de DLM en un modelo de Drosophila de ELA. (A) La generación de moscas transgénicas de ELA que expresan una forma mutante humana de proteína de unión al tar de 43 kDa (TDP-43) se muestran en el esquema. (B) La ilustración representa la forma y la orientación de un hemitórax en un Drosophilaadulto. Usando el protocolo, podemos observar la pérdida progresiva de la integridad sináptica de las sinapsis DLM NMJ a través de la tinción estructural de las neuronas motoras con HRP (verde) y tejido muscular con Phalloidin (magenta). Nuestro modelo representa la pérdida de integridad sináptica en un modelo adulto de ELA a través de la generación de moscas adultas que expresan un mutante de TDP-43M337V humano en neuronas motoras (Figura 1F-u2012H) en comparación con WT (Figura 1C-u2012E) vuela en fibra muscular C. Las flechas resaltan ejemplos de una sinapsis WT (Figura 1C) y un ejemplo de pérdida de integridad sináptica. Barra de escala de 20 m a un aumento de 63x. Haga clic aquí para ver una versión más grande de esta figura.
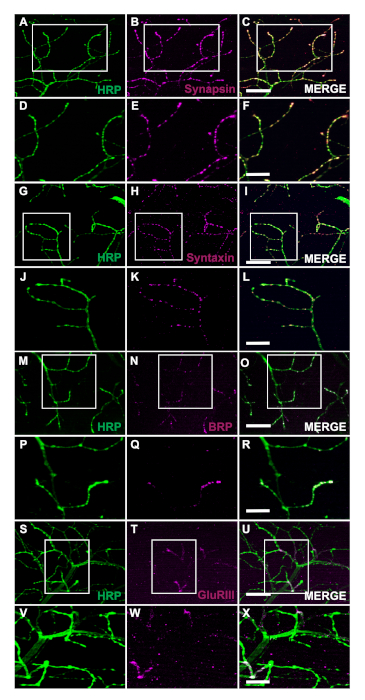
Figura 2: Evaluación de la integridad sináptica mediante marcadores presinápticos en NMJ adultos. La integridad sináptica también se puede evaluar utilizando marcadores presinápticos y postsinápticos en moscas WT que tienen 14 días de edad en la fibra muscular C. Los marcadores presinápticos Synapsin (B), Syntaxin (H), y Bruchpilot (BRP) (N) se colocan con HRP (A, G, M). La tinción representa la localización de estos marcadores en los terminales presinápticos (C, I, O). En un aumento superior, las imágenes ilustran la localización de Synapsin (E), Syntaxin (K) y BRP (Q) con HRP (D, Jy P) con más detalle (Figura F, L, y R). También mostramos un marcador postsináptico Glutamato Receptor III (GluRIII) (T) co-stuido con HRP (S). La co-tinción demuestra la utilidad de estos marcadores (U). En mayor aumento, las imágenes representativas ejemplifican la localización (X) de GluRIII (W) y HRP (V) al tejido muscular postsináptico y a los terminales presinápticos, respectivamente. La barra de escala para los paneles A-u2012C, G-I, M-u2012O, S-u2012U representa 20 m con un aumento de 63x. La barra de escala para los paneles D-u2012F, 2J-2L, 2P-2R y 2V-2X representa 10 m con un aumento de 63x. Haga clic aquí para ver una versión más grande de esta figura.
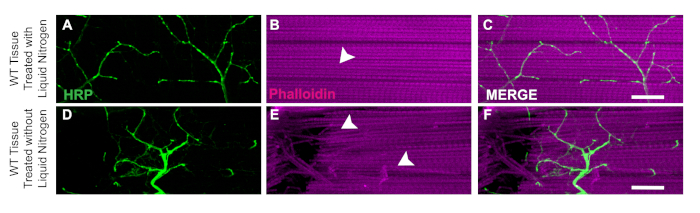
Figura 3: Utilidad de nitrógeno líquido para disecciones DLM. Para demostrar la utilidad del nitrógeno líquido para las disecciones DLM, mostramos una comparación de las moscas del día 21 WT con y sin nitrógeno líquido de la fibra muscular C. Con nitrógeno líquido, Phalloidin (B) permanece intacta y no compromete la tinción HRP (A, C). Sin nitrógeno líquido, el tejido muscular se vuelve tenso y difícil de bisetear (E) y la tinción HRP (D, F) se ve comprometida debido a un error técnico. Las flechas blancas muestran un área sin daño muscular con nitrógeno líquido (B) y tejido muscular dañado (E). Barra de escala de 20 m a un aumento de 63x. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Utilizando los métodos descritos en este protocolo, proporcionamos un enfoque sencillo para la disección del tejido DLM y demostramos cómo se puede aplicar esto para evaluar la integridad sináptica a través de la tinción estructural y marcadores sinápticos en Drosophila adulta. Un paso crítico en el protocolo que hace que el tejido DLM sea más fácil de diseccionar es la congelación del flash con nitrógeno líquido. Sin este paso, el tejido es menos firme y más difícil de cortar precisamente como se observa en la Figura 3. Este protocolo se basa en métodos de disección anteriores para permitir la preservación tanto de las neuronas motoras como del tejido muscular18,19,20,21,22,23. Una limitación de este protocolo es que al hacer el corte de la línea media para la bisección, puede ser difícil obtener dos preparaciones limpias por tórax. Una manera de asegurar al menos un hemitórax por mosca, se puede cortar intencionalmente a un lado del tórax para obtener una preparación limpia. Con esta modificación, también es posible que deba eliminar el exceso de tejido adicional del corte para limpiar la muestra con el disyuntor de la cuchilla. Para los nuevos en esta técnica, con la práctica continua, la precisión de la bisección aumentará.
El método descrito aquí permite a los investigadores evaluar fácilmente la integridad estructural de los NMJ DLM adultos en cualquier momento a lo largo de su vida útil. Una de las principales ventajas de este protocolo es la capacidad de acceder a la integridad sináptica en modelos de enfermedades neurodegenerativas mediante el uso de marcadores sinápticos. Demostramos que esta aplicación puede ayudar a visualizar los cambios en la morfología bruta con la tinción estructural(Figura 1C-u2012H). Además, la integridad sináptica se puede evaluar con la tinción de marcadores presinápticos, incluyendo pero no limitado a Synapsin28 (Figura 2A-u2012F), Syntaxin29 (Figura 2G-u2012L) y BRP30 (Figura 2M-u2012R). El tejido muscular postsináptico también se puede evaluar utilizando el anticuerpo de subunidad31 del Receptor de Glutamato III (Figura 2S-u2012X), demostrando la utilidad de este protocolo.
Los investigadores también pueden utilizar este método de disección para complementar los datos funcionales para examinar exhaustivamente la integridad estructural de las sinapsis asociadas con una amplia variedad de enfermedades. Estas sinapsis también permiten el análisis funcional a través de grabaciones electrofisiológicas32,33,34 y el ensayo de vuelo10. Este protocolo también puede proporcionar facilidad de acceso al tejido para muchas aplicaciones y ensayos. Estudios futuros, por ejemplo, podrían utilizar este protocolo para cuantificar los cambios sinápticos mediante la cuantificación de la densidad y el número de sinapsis15,16. Mientras que el protocolo descrito aquí examina específicamente la integridad sináptica de las neuronas motoras, protocolos complementarios para evaluar la pérdida de células musculares también se pueden realizar con esta disección utilizando la tinción TUNEL35. Para examinar la pérdida neuronal, la disección del ganglio torácico36 también podría utilizarse con tinción TUNEL. Esperamos que la disección descrita aquí tenga más aplicaciones para futuros estudios que evalúen patologías relacionadas con la edad, así como enfermedades neurodegenerativas.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo fue apoyado por los Institutos Nacionales de Salud (R01 NS110727) a D.T.B.
Materiales
| Name | Company | Catalog Number | Comments |
| 32% Formaldehyde | Electron Microscopy Sciences | 15714 | Tissue preservation |
| Alexa Fluor 568 goat anti mouse | Fisher Scientific | A11031 | Labels primary antibodies. Used at 1:200 concentration. |
| Alexa Fluor 568 goat anti rabbit | Fisher Scientific | A11036 | Labels primary antibodies. Used at 1:200 concentration. |
| anti- Bruchpilot (BRP) antibody | Developmental Studies Hybridoma Bank | NC82 | Stains the active zones in presynaptic neurons. Used at 1:25 concentration. |
| anti-GluRIII antibody | Gift from Aaron DiAntonio | N/A | Labels glutamate receptor subunits. Used at 1:1000 concentration. |
| anti-Synapsin antibody | Developmental Studies Hybridoma Bank | 3C11 | Labels the synaptic protein synapsin. Used at 1:50 concentration. |
| anti-Syntaxin antibody | Developmental Studies Hybridoma Bank | 8C3 | labels the synaptic protein syntaxin. Used at 1:10 concentration. |
| BenchRocker | Genesee Scientific | 31-302 | Rotating samples during staining |
| Blade Breaker | Fine Science Tools | 10053-09 | Used for holding feather blade |
| cover slips | Fisher Scientific | 12548A | For mounting tissue |
| cryogenic gloves | VWR | 97008-198 | protect hands from liquid nitrogen |
| cryogenic tweezers | VWR | 82027-432 | Hold 2.0 mL tube in liquid nitrogen |
| dewar flask-1900 mL | Thomas Scientific | 5028M54 | Hold liquid nitrogen |
| Feather Blades | Electron Microscopy Sciences | 72002-01 | Scalpel Blades |
| Fine Forecps x 2 | Fine Science Tools | 11252-20 | One fine pair for Clearing midline of thorax. The other pair can be dulled using a sharpening stone. |
| FITC-conjugated anti HRP | Jackson Laboratories | 123-545-021 | Stains Motor Neurons. Used at 1:100 concentration |
| freezer box (Black) | Fisher Scientific | 14100F | Protects samples from light |
| glass pasteur pipettes | VWR | 14637-010 | Used to transfer samples |
| glass slides | Fisher Scientific | 12550143 | For mounting tissue |
| mounting media (vectashield) anti-fade | VWR | 101098-042 | Mounting media retains fluorescent signaling |
| nail polish | Electron Microscopy Sciences | 72180 | Seals microscope slides |
| normal goat serum | Fisher Scientific | PCN5000 | Prevents non-specific binding of antibodies |
| paint brush | Genesee Scientific | 59-204 | Transferring flies |
| PBS | Fisher Scientific | 10-010-023 | Saline solution for dissecting and staining |
| Phalloidin 647 | Abcam | AB176759 | Stains F-Actin in muscle Tissue. Used at 1:1000 concentration |
| plastic petri dish (100 mm) | VWR | 25373-100 | Dissection dish |
| reinforcement labels | W.B. Mason | AVE05722 | Provides support for glass coverslip over the mounted tissue |
| sharpening block | Grainger | 1RDF5 | Keeping fine forceps sharp and also dulling separate pair |
| slide folder | VWR | 10126-326 | Sample storage |
| standard office scissors | W.B. Mason | ACM40618 | Cutting reinforcement labels |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | Coating for dissection dish |
| Triton-X-100 | Electron Microscopy Sciences | 22140 | Helps to permeabilize tissue |
| Vannas Disssection Sissors | Fine Science Tools | 1500-00 | Ued for removing fly legs and making an incision on thorax |
Referencias
- Casas, C., Manzano, R., Vaz, R., Osta, R., Brites, D. Synaptic failure: focus in an integrative view of ALS. Brain Plasticity. 1, 159-175 (2016).
- Lodato, M. A., et al. Aging and neurodegeneration are associated with increased mutations in single human neurons. Science. 359, 555-559 (2018).
- López-Erauskin, J., et al. ALS/FTD-linked mutation in FUS suppresses intra-axonal protein synthesis and drives disease without nuclear loss-of-function of FUS. Neuron. 100, 816-830 (2018).
- Munsie, L., et al. Retromer-dependent neurotransmitter receptor trafficking to synapses is altered by the Parkinson's disease VPS35 mutation p. D620N. Human Molecular Genetics. 24, 1691-1703 (2015).
- Oddo, S., et al. Triple-transgenic model of Alzheimer's disease with plaques and tangles: intracellular Aβ and synaptic dysfunction. Neuron. 39, 409-421 (2003).
- Selkoe, D. J. Alzheimer's disease is a synaptic failure. Science. 298, 789-791 (2002).
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Current Opinion in Neurobiology. 17, 35-42 (2007).
- Jan, L., Jan, Y. Properties of the larval neuromuscular junction in Drosophila melanogaster. The Journal of Physiology. 262, 189-214 (1976).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Babcock, D. T., Ganetzky, B. An improved method for accurate and rapid measurement of flight performance in Drosophila. Journal of Visualized Experiments. , e51223 (2014).
- Fernandes, J., Bate, M., Vijayraghavan, K. Development of the indirect flight muscles of Drosophila. Development. 113, 67-77 (1991).
- Fernandes, J., VijayRaghavan, K. The development of indirect flight muscle innervation in Drosophila melanogaster. Development. 118, 215-227 (1993).
- Fernandes, J. J., Keshishian, H. Patterning the dorsal longitudinal flight muscles (DLM) of Drosophila: insights from the ablation of larval scaffolds. Development. 122, 3755-3763 (1996).
- Fernandes, J. J., Keshishian, H. Nerve-muscle interactions during flight muscle development in Drosophila. Development. 125, 1769-1779 (1998).
- Hebbar, S., Fernandes, J. J. Pruning of motor neuron branches establishes the DLM innervation pattern in Drosophila. Journal of Neurobiology. 60, 499-516 (2004).
- Hebbar, S., Fernandes, J. J. A role for Fas II in the stabilization of motor neuron branches during pruning in Drosophila. Developmental Biolology. 285, 185-199 (2005).
- Danjo, R., Kawasaki, F., Ordway, R. W. A tripartite synapse model in Drosophila. PloS One. 6, (2011).
- Hunt, L. C., Demontis, F. Whole-mount immunostaining of Drosophila skeletal muscle. Nature Protocols. 8, 2496-2501 (2013).
- Kucherenko, M. M., et al. Paraffin-embedded and frozen sections of Drosophila adult muscles. Journal of Visualized Experiments. , e2438 (2010).
- Llamusi, B., et al. BSF and TBPH are mislocalized in the muscle sarcomere of a Drosophila myotonic dystrophy model. Disease Models & Mechanisms. 6, 184-196 (2013).
- Pantoja, M., Fischer, K. A., Ieronimakis, N., Reyes, M., Ruohola-Baker, H. Genetic elevation of sphingosine 1-phosphate suppresses dystrophic muscle phenotypes in Drosophila. Development. 140, 136-146 (2013).
- Schnorrer, F., et al. Systematic genetic analysis of muscle morphogenesis and function in Drosophila. Nature. 464, 287-291 (2010).
- Viswanathan, M. C., Blice-Baum, A. C., Schmidt, W., Foster, D. B., Cammarato, A. Pseudo-acetylation of K326 and K328 of actin disrupts Drosophila melanogaster indirect flight muscle structure and performance. Frontiers in Physiology. 6, 116 (2015).
- Hebbar, S., Fernandes, J. J. Glial remodeling during metamorphosis influences the stabilization of motor neuron branches in Drosophila. Developmental Biology. 340, 344-354 (2010).
- Mahr, A., Aberle, H. The expression pattern of the Drosophila vesicular glutamate transporter: a marker protein for motoneurons and glutamatergic centers in the brain. Gene Expression Patterns. 6, 299-309 (2006).
- Ritson, G. P., et al. TDP-43 mediates degeneration in a novel Drosophila model of disease caused by mutations in VCP/p97. Journal of Neuroscience. 30, 7729-7739 (2010).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Klagges, B. R., et al. Invertebrate synapsins: a single gene codes for several isoforms in Drosophila. Journal of Neuroscience. 16, 3154-3165 (1996).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proceedings of the National Academy of Sciences of the United States of America. 79, 7929-7933 (1982).
- Wagh, D. A., et al. a protein with homology to ELKS/CAST, is required for structural integrity and function of synaptic active zones in Drosophila. Neuron. 49, 833-844 (2006).
- Marrus, S. B., DiAntonio, A. Preferential localization of glutamate receptors opposite sites of high presynaptic release. Current Biology. 14, 924-931 (2004).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological recordings from the giant fiber pathway of D. melanogaster. Journal of Visualized Experiments. , e2412 (2011).
- Maccioni, R., et al. Standardized phytotherapic extracts rescue anomalous locomotion and electrophysiological responses of TDP-43 Drosophila melanogaster model of ALS. Scientific Reports. 8, 16002 (2018).
- Siddiqi, O., Benzer, S. Neurophysiological defects in temperature-sensitive paralytic mutants of Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. 73, 3253-3257 (1976).
- Wang, Z. H., Clark, C., Geisbrecht, E. R. Drosophila clueless is involved in Parkin-dependent mitophagy by promoting VCP-mediated Marf degradation. Human Molecular Genetics. 25, 1946-1964 (2016).
- O'Sullivan, A., et al. Multifunctional Wing Motor Control of Song and Flight. Current Biology. 28, 2705-2717 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados