Method Article
Nörodejenerasyon ile Birlikte Erişkin Drosophila'da Sinaptik Dejenerasyonun Görselleştirilmesi
Bu Makalede
Özet
Bu işlemin amacı Drosophila melanogasterkullanarak nörodejeneratif hastalık modellerinde DLM nöromüsküler kavşaklar (NMJs) yapısal bütünlüğünü değerlendirmek için dorsal uzunlatanal kas (DLM) doku incelemektir.
Özet
Drosophila nörodejeneratif hastalıklar ile ilişkili sinaptik yapısı ve fonksiyonu değerlendirmek için yararlı bir model olarak hizmet vermektedir. Çok iş nöromüsküler kavşaklar odaklanmış iken (NMJs) Drosophila larvaları, yetişkin Drosophila sinaptik bütünlüğünü niçin değerlendirilmesi çok daha az dikkat aldı. Burada uçuş yeteneği için gerekli olan dorsal uzunlamasına kasların (DLM) diseksiyonu için basit bir yöntem salıyoruz. Davranışsal bir okuma olarak uçuşa ek olarak, bu diseksiyon hem DLM sinapslarının hem de kas dokusunun sinaptik belirteçler veya ilgi proteinleri için floresan olarak etiketlenmiş antikorlar kullanılarak yapısal analize uygun olmasını sağlar. Bu protokol, çoğu nörodejeneratif hastalığın ilerleyici, yaşa bağlı doğasını modellemek için yaşlanma sırasında erişkin Drosophila'daki sinapsların yapısal bütünlüğünün değerlendirilmesine olanak sağlar.
Giriş
Sinaptik disfonksiyon en büyük nörodejeneratif hastalıkların bilinen en erken özellikleri arasında yer alıyor1,2,3,4,5,6. Ancak, bu yapısal ve fonksiyonel bozuklukların hastalığın ilerlemesinin sonraki aşamalarıile nasıl ilişkili olduğu konusunda çok az şey bilinmektedir. Drosophila larva NMJs7,8,,9kullanarak sinaps büyüme ve gelişme anlamak için yararlı bir model sistemi olduğu kanıtlanmıştır. Ancak, üçüncü larva instar aşamasında sadece birkaç gün sürer, ilerleyici çalışmada kendi yarar sınırlayan, yaşa bağlı nörodejenerasyon. Larva NMJs değerlendirmek için bir alternatif yetişkin Drosophilasinaptik yapıları incelemektir , Dorsal Longitudinal Kaslar oluşan sinaps gibi (DLMs) uçuş için gerekli olan10,11,12,13,14,15,16. Bu üçlü sinapslar yapısal memeli sinaps benzer bir şekilde organizeedilir 17, nörodejeneratif hastalıkların modellerini değerlendirmek için benzersiz bir avantaj sağlayan.
Burada nörodejenerasyon bir Drosophila modelinde yetişkin NMJs yapısal bütünlüğünü analiz etmek için basit bir yöntem açıklar. Önceki DLM diseksiyon yöntemleri ve çalışmaları çeşitli uygulamalar için kas dokusunun korunmasının önemini vurgulamıştır18,19,20,21,2222,23. Protokolümüz nörodejeneratif hastalıkları araştırmak için hem nöronal hem de kas dokusunu korumak için kapsamlı bir yöntem sağlar. Bu hastalıkların incelenmesinin bir diğer önemli bileşeni de yaşa bağlı bir şekilde nöronal kaybı anlama yeteneğidir. Önceki çalışma dlm NMJs erken yetişkinlik içine metamorfoz sırasında nasıl oluştuğunu eleştirel ve derinlemesine bir anlayış sağlar11,12,14,15,1616,24. Protokolümüz, dlm NMJ'lerini yaşlanma ve nörodejeneratif hastalıklarda yaşa bağlı bir şekilde araştırmak için bu çalışma üzerine inşa etmek için bir yöntem belirlememektedir.
Protokol
1. Transgenik sinek üretimi
- Bu deney için transgenik sinekler oluşturmak için, OK371-Gal425 bakire dişi sinekler ve UAS-TDP-43M337V 26 (Şekil 1A)erkek toplamak bir yastık üzerinde CO2 ile sinekler anestezi tarafından sıralamak için.
- Çapraz için standart Drosophila medya ile şişeler halinde anestezi sinekler sıralamak. Yeni neslin ortaya çıkması için etiketli şişeleri 25 °C'ye yerleştirin.
NOT: Uygun genotipsağlamak için döl ortaya çıkmadan önce yetişkinleri şişelerden temizleyin. - Bir kez döl ortaya, şişeler halinde transgenik sinekler toplamak ve deneysel koşullar için yaşlanmaya başlamak için cinsiyete göre sıralamak.
- Sinekler toplandıktan sonra sinekler 21 günlük olana kadar her 2 günde bir taze yiyeceklere aktarın.
2. Diseksiyon hazırlığı
- Diseksiyonlar için hazırlanmak için, oda sıcaklığında fosfat tamponlu salin (1x PBS), silikon elastomer ile kaplanmış 10 cm'lik bir diseksiyon kabı, düz kenar kesme makası, künt diseksiyon forsepsbir set, P200 pipet ve pipet uçları, 2.0 mL mikrosantrifüj tüpler, standart ofis makas, 70% etanol, 6 cm Petri çanak, ve 32% formaldehit 1x PBS ile% 4 seyreltilmiş.
- Her genotip veya durum için etiket tüpleri ve her tüpe 900 μL 1x PBS (oda sıcaklığı) ve 150 μL %32 formaldehit ekleyin. %4 formaldehit fiksatifhazırlarken eldiven ve güvenlik gözlüğü takın.
- Anestezi 6\u201210 co2 ile şişe doğrudan grup başına uçar ve% 70 etanol ile 6 cm Petri çanak içine sular. Numunelerin tamamen batırılmış olduğundan emin olmak için bir boya fırçası kullanarak etanolün içine bastırın. Bu dış manikül üzerinde yağ tabakası kaldıracaktır.
3. Toraks izolasyonu ve fiksasyonu
- Her numuneyi incelemeden önce, silikon elastomerle kaplanmış diseksiyonu kabına yaklaşık 7\u201210 mL 1x PBS ekleyin. Bu hacim doku örneklerinin tamamen batırılmış olduğundan emin olmalıdır.
- Künt forceps kullanarak ve kanatveya bacaklar kavramak kullanarak% 70 etanol diseksiyon çanak bir sinek aktarın.
- Örneği bir diseksiyon mikroskobu altında diseksiyon kabına odaklayın. Sonraki 1x PBS örnek batırın ve dikkatle künt Dumont #5 ince forceps kullanarak kanatları çıkarın.
- Vannas düz kenar yay diseksiyonu makası kullanarak, mite ventral tarafında küçük bir kesi oluşturarak bacaklar çıkarın. Adım 3.8' de, bu kesi formaldehitin dokuya nüfuz etmesini sağlayacak.
- Bir elinde makas alın ve sinek ventral tarafı konumlandırmak için diğer forseps tutun. Künt forceps ile yerde örnek tutarken, diseksiyon makas ile baş ve karın çıkarın.
- Modifiye pipet ucunu kullanarak izole toraksı 3.2 adımdan etiketlenmiş tüpe aktarın.
NOT: Fiksatife ekstra 1x PBS eklememek için pipeti 40 μL'ye ayarlayın. - Her numune için yukarıdaki 3.2\u20123.6 adımlarını tekrarlayın.
- Oda sıcaklığında 30 dakika boyunca örnekleri düzeltin.
- Pasteur pipetini kullanarak düzeltmeyi çıkarın ve duman kaputunun altındaki uygun atık kabına atın. Pasteur pipeti kullanarak her biri 1,5 mL 1x PBS ile üç kez durulayın. Sadece 750 μL kullanarak dördüncü bir durulama tamamlayın ve 1x PBS dokuları bırakın.
NOT: Bu noktada doku örnekleri sonraki adımlara geçmeden önce 3 gün ekadar 4 °C'de kalabilir.
4. Flaş donma ve toraks bisection
- Bisections başlamadan önce, uygun kriyo-koruyucu eldiven ve güvenlik gözlükleri giyen sıvı nitrojen ile bir Dewar şişesi doldurun. Bir bıçak kırıcı, tüy bıçaklar, bir çift ince çöke, buz, buz gibi 1x PBS ve kriyojenik cımbız elde edin.
- 1x PBS buz gibi tutmak için bir buz kovası hazırlayın.
- Bir açıda tüy bıçak kapmak için bıçak kırıcı kullanın ve küçük bir parça kırmak için bıçak viraj. Bıçak kırıcı daha sonra küçük bir neşter olarak kullanılmak üzere pozisyonda bıçak kilitleyebilirsiniz.
NOT: Bir bıçak tüm gruplar için sürmelidir. Bıçak kırılırsa veya donuklaşırsa değiştirin. - P200'e temiz bir pipet ucu ekleyin ve numuneleri taşımak için ucun1/5'ini çıkarın.
- Her grup için yeni bir mikrosantrifüj tüp hazırlayın ve her tüpe 200 μL 1x PBS ekleyin. Bu ikinci tüp son DLM hazırlıktoplamak için kullanılacaktır.
- Pasteur pipeti kullanarak tüm 1x PBS'yi tüplerden çıkarın.
- Uygun koruyucu ekipman giyen, kriyojenik cımbız ile 10 s için sıvı azot şişesi içine tüp batırın.
NOT: Tüplerin patlamasını engellemek için tüpler sıkıca kapatılmalıdır. - Tüpü sıvı nitrojenden çıkarın ve pasteur pipetli numunelere yaklaşık 300 μL buz gibi 1x PBS ekleyin. Örnekleri buzda tut.
- Silikon elastomer le kaplanmış 10 cm'lik diseksiyon kabına buz gibi 1x PBS ekleyin ve modifiye edilmiş 200 μL pipetle ilk toraksı dağıtın.
- Toraks ventral tarafını yukarı yerleştirin. Bir yandan toraks konumlandırmak için forseps donuk bir çift kullanın ve diğer toraks orta hattı ortaya çıkarmak için torasik ganglion bazı kaldırmak için forseps ince bir çift kullanın.
- Bıçak ile toraksın1/3'ünde sığ bir kesim yapmak için toraksın orta çizgisini kılavuz olarak kullanın.
- Bıçağı torakstan çıkarın ve toraksı künt forceplarla 45° açıyla konumlandırın. Bıçağı tekrar takın ve toraksın orta çizgisini kesin. Bu iki hemithoraces neden olacaktır.
- Bir seferde bir hemithorax alın ve DLM kas lifi F altında aşırı doku kaldırmak (Şekil 1B), en ventral lif. DLM'lere zarar vermeden fazla dokuyu çıkarmak için bir veya iki kesim yapmak için bıçağı dikkatlice kullanın.
- İzole olduktan sonra hemithorax'ı 1x PBS ile doğru tüpe aktarın.
- Tekrar adımları 4.6\u20124.14 kadar 10 grup başına diseksiyon hemithoraces yapılır.
5. Yapısal boyama
- Toraks örneklerini ikiye kaldıktan sonra, dokuyu bloke edici tampona yerleştirin (%0.1 normal keçi serumu ile 1x PBS ve pH 7.4'te %0.2 Triton X-100) dokuyu permeabilize edin ve spesifik olmayan lekelenmeyi önleyin. Fazla 1x PBS'yi kaldırmak ve her tüpe 1,5 mL engelleme tamponu eklemek için pasteur pipeti kullanın. 4 °C'de en az 1 saat boyunca dokuları bloke edin.
- Bir floresan konjuge antikor kullanarak yapısal boyama için örnekleri hazırlamak, horseradish peroksidaz 488 (anti-HRP-488) bir seyreltme 1:200 ve Phalloidin-647 bir seyreltme 1:1000 bir seyreltme motor nöronlar ve kas dokusu leke tampon, sırasıyla. Tüp başına 150 μL olacak kadar leke yapın. Lekeyi folyoyla kaplı 4 °C'de veya lekelenmeye hazır olana kadar koyu bir kutuda saklayın.
- Bloke ettikten sonra, aşırı engelleme tamponunu cam pasteur pipetiyle çıkarın.
- Yapısal lekedağıtmadan önce, lekegirdirin. Her tüpe 150 μL leke ekleyin. Örnekleri oda sıcaklığında 2 saat boyunca dönerin üzerinde koyu bir kutuya yerleştirin.
- Lekeyi çıkarın ve koyu bir kutuda rotator üzerinde 5 dakika için% 0,3 Triton X-100% ile oda temp 1x PBS 1,5 mL dokuları dört kez yıkayın. Örnekler artık bir slayta monte etmeye hazır.
6. Montaj dokusu
- PBST'deki örnekleri yıkadıktan sonra, dokuların boyanması için bir mikroskop slaytı hazırlayın. Cam kapak fişleri, P200 pipet, 200 μL pipet uçları, makas, net takviyeler, düz kenar forceps, anti-fade floresan montaj ortamı, oje ve slaytları kapsayacak şekilde koyu bir kutu dahil olmak üzere ek sarf malzemeleri hazırlayın.
- Örnekleri tanımlamak için slaydı etiketleyin ve leke olmadığından emin olmak için slaydın kimwipes ile temizleyin.
- Hemithorax örneklerinin kapak kaymasından zarar görmemesini sağlamak için takviye etiketleri kullanarak bir "köprü" oluşturun. Bir takviye etiketi alın, ikiye bölün ve her yarısını yaklaşık 15 mm arayla yerleştirin. Bu mesafe kapak fişinin genişliğinden daha küçük olmalıdır. 5 etiket yüksekliğinde bir "köprü" tamamlamak için bu adımı dört kez tekrarlayın.
- P200 pipetini alın ve numuneleri slayta aktarmak için ucun1/5'ini keserek bir ucu değiştirin. Örnekler köprünün ortasındaki slayta aktarılmalıdır.
- Bir laboratuar silme kenarına alın ve herhangi bir fazla PBST kaldırın. Forceps kullanarak, tüm örnekler kas tarafı yukarı ve cuticle tarafı aşağı karşı karşıya olduğu gibi DLMs düzenleyin.
- Standart bir P200 pipet ucu kullanarak, hava kabarcıklarından kaçınarak slayta 70 μL montaj ortamı uygulayın. Dışarıdan merkeze başlayan takviyeler içinde dairesel bir desen medya dağıtın.
- Takviye lerin üzerine bir kapak fişi yerleştirin.
- Kapak kapağının çevresindeki dış kenarları kaplamak için oje kullanın. Doku tam bir mühür oluşturmak için cömertçe uygulayın.
- En az 10 dakika kurumasını ve fotoğraf beyazlatma veya floresan kaybını önlemesini sağlayarak skalıcı karanlıkta düz bir yüzeye yerleştirin. Slaytlar artık hemen görüntüleme için kullanılabilir veya daha sonra görüntülemek için -20 °C'deki bir slayt klasöründe depolanabilir.
7. Alternatif: Primer antikorlarla boyama
NOT: Bu bölüm isteğe bağlıdır ve istenirse doğrudan 4 ve 5 numaralı bölümler arasında kullanılmalıdır.
- Primer antikorlar ile doku leke için, en az 1 saat için tampon engelleme doku batırın.
- Tampon engelleme uygun seyreltme ile birincil antikor hazırlayın. En azından, grup başına 150 μL olacak kadar antikor karışımı hazırlayın. Örneklerin hareketsiz tutulduğunu unutmayın. Kullanıma hazır olana kadar 4 °C'de saklayın.
- Pasteur pipetiyle fazla engelleme tamponunu kaldırın. Kısaca birincil antikor girdap ve her gruba 150 μL antikor karışımı ekleyin ve 4 ° C gecede örnekleri yerleştirin.
- Ertesi gün, primer antikor çıkarın ve bir rotator her 5 dakika için PBST ile 4 kez doku yıkayın.
- Engelleme tamponunda ikincil leke hazırlayın. İkincil lekeyi numuneye ekleyin ve rotator üzerindeki koyu bir kutuda 2 saat oda sıcaklığında tutun.
NOT: İkincil boyama da HRP ve phalloidin içerebilir. - 2 saat kuluçka sonra, ikincil leke yıkama doku kaldırmak için 4 kez PBST ile 5 dakika ve montaj devam edin.
Sonuçlar
43 kDa mutant (TDP-43M337V)insan Katran Bağlayıcı Protein ifade transgenik sineklerin nesil şematik tarafından temsil edilmektedir (Şekil 1A). Bu Drosophila27ikili Gal4/UAS sisteminin uygulama göstermektedir. Resimde altı kas lifleri ile bir hemithorax tasvir, A\u2012F en dorsal fiber A en ventral F gidiyor (Şekil 1B)11,12. Sinaptik bütünlüğü değerlendirmek için NMJ'ler HRP ve Phalloidin ile boyandı (Şekil 1C\u2012E). TDP-43M337V mutantlarında motor nöronlar(Şekil 1F)21.Figure 1C Kas boyamada gözle görülür bir fark yoktur (Şekil 1D,G). TDP-43M337V mutantlarında gözlenen brüt morfolojideki değişiklikler, yetişkin DLM modeli kullanılarak amiyotrofik lateral sklerozun nörodejeneratif hastalık modelinde sinaptik bütünlüğün nasıl karıştığını göstermektedir. Yapısal boyamanın yanı sıra, DLM NMJ'lerin boyanması da presinaptik(Şekil 2A\u2012R)ve post sinaptik (Şekil 2S\u2012X) belirteçleri ile sinaptik bütünlüğün değerlendirilmesi sağlayabilir. Birlikte, bu sonuçlar nörodejeneratif hastalıklarda DLM doku eğitimi için bu diseksiyon protokolü nasıl uygulanabileceğini göstermektedir.
Bu diseksiyonun önemli bir yönü, bisection daha kolay hale getirmek için doku dondurma flaş sıvı nitrojen uygulamasıdır. Sıvı azotun faydası WT'de, kas dokusunun hasar veya çentikli liflerin olmadığı sıvı nitrojenle uçar(Şekil 3A\u2012C)gösterilmiştir. Sıvı nitrojen olmadan, doku incelemek daha zor olabilir. Örneğin, bu protokolü izleyerek ve sıvı nitrojen flaş dondurma adım atlama doku hasarlı nöronlar gibi diseksiyon araçları zarar alabından daha duyarlı olmasını sağlar (Şekil 3D) veya hasarlı kas lifleri(Şekil 3E). Sıvı nitrojen uygulaması, numunenin genotipine bakılmaksızın DLM dokusu ile çalışırken oluşabilecek doku hasarını önlemeye yardımcı olur(Şekil 3C ve 3F).
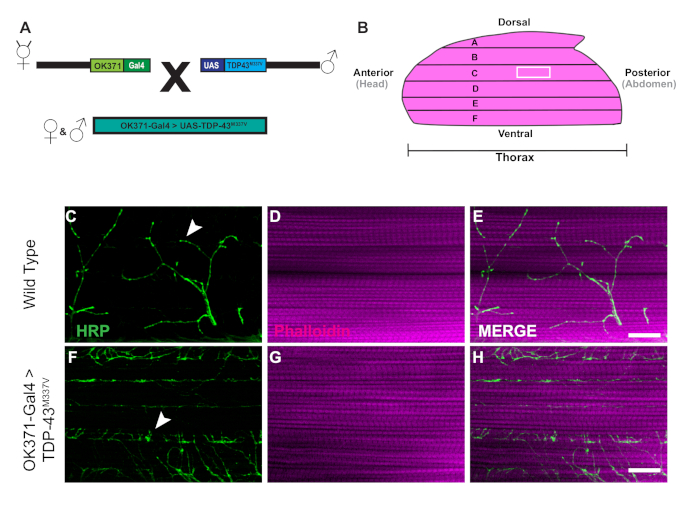
Şekil 1: ALS'nin Drosophila modelinde DLM sinapslarının progresif denervasyonu. (A) 43 kDa 'lık Tar-Bağlayıcı Proteinin insan mutant formunu ifade eden ALS transgenik sineklerin nesli şematik olarak gösterilmiştir. (B) Resimde yetişkin bir Drosophila'dahemithorax'ın şekli ve yönü gösterilmiştir. Protokolü kullanarak, DLM NMJ sinapslarının sinaptik bütünlüğünün progresif kaybını, motor nöronların HRP (yeşil) ve Kas dokusunun Phalloidin (macenta) ile yapısal boyama yoluyla gözlemleyebiliyoruz. Modelimiz, motor nöronlarda insan TDP-43M337V 'den bir mutantı ifade eden yetişkin sineklerin nesli ile ALS'nin yetişkin modelinde sinaptik bütünlük kaybını tasvir eder (Şekil 1F\u2012H) WT'ye göre (Şekil 1C\u2012E) kas lifi C'de uçar. Oklar WT sinaps(Şekil 1C)ve sinaptik bütünlük kaybı örneklerini vurgular. Ölçek çubuğu =20 μm 63x büyütme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
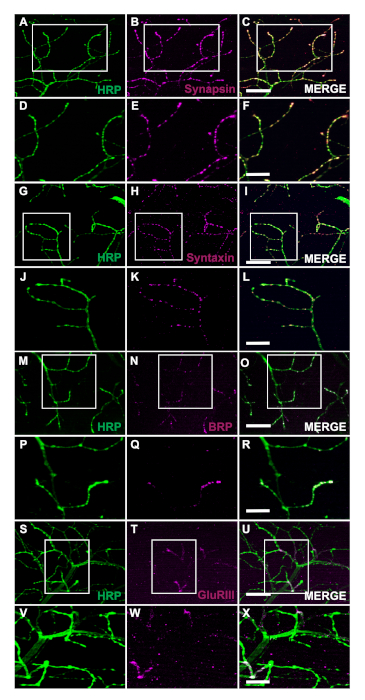
Şekil 2: Erişkin NMJ'lerde presinaptik belirteçler kullanılarak sinaptik bütünlüğün değerlendirilmesi. Sinaptik bütünlük de kas lifi C 14 gün eski WT sinekler presinaptik ve postsinaptik belirteçleri kullanılarak değerlendirilebilir. Presinaptik belirteçler Synapsin (B), Syntaxin (H), ve Bruchpilot (BRP) (N) HRP ile eş-lekeli (A, G, M). Boyama presinaptik terminalleri(C, I, O)bu belirteçlerin lokalizasyonu tasvir eder. Daha yüksek büyütme de, görüntüler Synapsin yerelleştirilmesi göstermek (E), Syntaxin (K), ve BRP(Q) HRP ile (D, J, ve P) daha ayrıntılı olarak(Şekil F, L, ve R). Biz de bir postsinaptik marker Glutamat Reseptör III göstermek (GluRIII) (T) co-HRP ile boyanmış(S). Co-boyama bu belirteçlerin yarar gösterir (U). Daha yüksek büyütmede temsili görüntüler gluriii(W) veWHRP(V)lokalizasyonuna ( X ) sırasıyla postinaptik kas dokusuna ve presinaptik terminallere örneklenir. A\u2012C, G-I, M\u2012O, S\u2012U panelleri için ölçek çubuğu 63x büyütmede 20 μm'yi temsil eder. D\u2012F, 2J-2L, 2P-2R ve 2V-2X panelleri için ölçek çubuğu 63x büyütmede 10 μm'yi temsil ediyor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
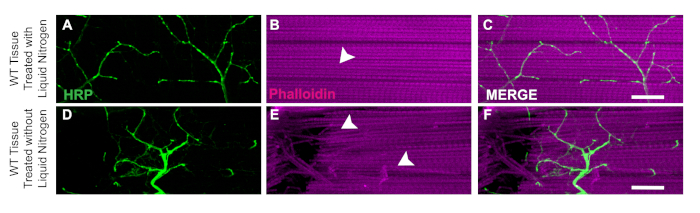
Şekil 3: DLM diseksiyonları için sıvı nitrojen inkişa sıyrık. DLM diseksiyonları için sıvı nitrojenin faydasını göstermek için, kas lifi C'den sıvı nitrojen içeren ve olmayan 21 WT'lik gün uçarken bir karşılaştırma gösteriyoruz. Sıvı nitrojen ile, Phalloidin (B) bozulmadan kalır ve HRP boyama ödün vermez (A, C). Sıvı nitrojen olmadan, kas dokusu stringy olur ve bisect zor (E) ve HRP boyama (D, F) teknik hata nedeniyle tehlikeye olur. Beyaz oklar sıvı nitrojen (B) ve hasarlı kas dokusu(E)ile hiçbir kas hasarı bir alan göstermektedir. Ölçek çubuğu = 63x büyütmede 20 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde açıklanan yöntemleri kullanarak, DLM dokusunun diseksiyonu için basit bir yaklaşım sağlar ve yetişkin Drosophila'da yapısal boyama ve sinaptik belirteçler yoluyla sinaptik bütünlüğü değerlendirmek için bunun nasıl uygulanabileceğini gösteririz. Protokolde DLM dokusunun incelenmesini kolaylaştıran kritik bir adım, sıvı nitrojenle donan flaştır. Bu adım olmadan, doku daha az sert ve şekil 3'tegözlenen tam olarak kesmek daha zordur. Bu protokol hem motor nöronların hem de kas dokusunun korunmasına olanak sağlamak için önceki diseksiyon yöntemleri üzerine inşa18,19,20,21,22,23. Bu protokolün bir sınırlama sıyrık için orta hat aşağı kesim yaparken, toraks başına iki temiz hazırlık almak zor olabilir. Sinek başına en az bir hemithorax sağlamak için bir yolu, bilerek bir temiz hazırlık almak için toraks bir tarafına kesebilir. Bu modifikasyon ile, bir de bıçak kesici ile örnek temizlemek için kesim ek fazla doku kaldırmak gerekebilir. Bu teknikte yeni olanlar için, sürekli uygulama ile, bisection doğruluğu artacaktır.
Burada açıklanan yöntem, araştırmacıların yaşam süreleri boyunca yetişkin DLM NMJ'lerinin yapısal bütünlüğünü herhangi bir zamanda kolayca değerlendirmelerine olanak tanır. Bu protokolün en önemli avantajı, nörodejeneratif hastalık modellerinde sinaptik belirteçler kullanılarak sinaptik bütünlüğe erişebilme yeteneğidir. Bu uygulamanın brüt morfolojideki değişiklikleri yapısal boyama ile görselleştirmeye yardımcı olabileceğini gösteriyoruz (Şekil 1C\u2012H). Ayrıca, sinaptik bütünlük dahil ancak Synapsin28 (Şekil 2A\u2012F), Sözdizim2 ( Şekil229 G\u2012L) ve BRP30 (Şekil 2M\u2012R)dahil ancak bunlarla sınırlı olmamak üzere presinaptik belirteçlerin boyanması ile değerlendirilebilir. Postsinaptik kas dokusu da Glutamat Reseptör III alt ünite antikor kullanılarak değerlendirilebilir31 (Şekil 2S\u2012X), Bu protokolün yarar gösteren.
Araştırmacılar ayrıca kapsamlı hastalıkların geniş bir yelpazede ile ilişkili sinapsların yapısal bütünlüğünü incelemek için fonksiyonel verileri tamamlamak için bu diseksiyon yöntemini kullanabilirsiniz. Bu sinapslar aynı zamanda elektrofizyolojik kayıtlar32,33,34 ve uçuş tahlil10ile fonksiyonel analiz için izin verir. Bu protokol aynı zamanda birçok uygulama ve tahliller için doku erişim kolaylığı sağlayabilir. Gelecekteki çalışmalar, örneğin, yoğunluk ve sinaps sayısı 15 ,,16niceliksel yoluyla sinaptik değişiklikleri ölçmek için bu protokolü kullanabilirsiniz.15 Burada açıklanan protokol özellikle motor nöronların sinaptik bütünlüğünü incelerken, kas hücre kaybını değerlendirmek için tamamlayıcı protokoller de TUNEL boyama kullanılarak bu diseksiyon ile yapılabilir35. Nöronal kaybı incelemek için, torasik ganglion diseksiyon36 da TUNEL boyama ile kullanılabilir. Burada açıklanan diseksiyonun yaşa bağlı patolojilerin yanı sıra nörodejeneratif hastalıkları değerlendiren gelecekteki çalışmalara daha fazla uygulama yapmasını bekliyoruz.
Açıklamalar
Yazarların ifşa etmesi gereken çıkar çatışmaları yok.
Teşekkürler
Bu çalışma D.T.B.'ye Ulusal Sağlık Enstitüleri (R01 NS110727) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 32% Formaldehyde | Electron Microscopy Sciences | 15714 | Tissue preservation |
| Alexa Fluor 568 goat anti mouse | Fisher Scientific | A11031 | Labels primary antibodies. Used at 1:200 concentration. |
| Alexa Fluor 568 goat anti rabbit | Fisher Scientific | A11036 | Labels primary antibodies. Used at 1:200 concentration. |
| anti- Bruchpilot (BRP) antibody | Developmental Studies Hybridoma Bank | NC82 | Stains the active zones in presynaptic neurons. Used at 1:25 concentration. |
| anti-GluRIII antibody | Gift from Aaron DiAntonio | N/A | Labels glutamate receptor subunits. Used at 1:1000 concentration. |
| anti-Synapsin antibody | Developmental Studies Hybridoma Bank | 3C11 | Labels the synaptic protein synapsin. Used at 1:50 concentration. |
| anti-Syntaxin antibody | Developmental Studies Hybridoma Bank | 8C3 | labels the synaptic protein syntaxin. Used at 1:10 concentration. |
| BenchRocker | Genesee Scientific | 31-302 | Rotating samples during staining |
| Blade Breaker | Fine Science Tools | 10053-09 | Used for holding feather blade |
| cover slips | Fisher Scientific | 12548A | For mounting tissue |
| cryogenic gloves | VWR | 97008-198 | protect hands from liquid nitrogen |
| cryogenic tweezers | VWR | 82027-432 | Hold 2.0 mL tube in liquid nitrogen |
| dewar flask-1900 mL | Thomas Scientific | 5028M54 | Hold liquid nitrogen |
| Feather Blades | Electron Microscopy Sciences | 72002-01 | Scalpel Blades |
| Fine Forecps x 2 | Fine Science Tools | 11252-20 | One fine pair for Clearing midline of thorax. The other pair can be dulled using a sharpening stone. |
| FITC-conjugated anti HRP | Jackson Laboratories | 123-545-021 | Stains Motor Neurons. Used at 1:100 concentration |
| freezer box (Black) | Fisher Scientific | 14100F | Protects samples from light |
| glass pasteur pipettes | VWR | 14637-010 | Used to transfer samples |
| glass slides | Fisher Scientific | 12550143 | For mounting tissue |
| mounting media (vectashield) anti-fade | VWR | 101098-042 | Mounting media retains fluorescent signaling |
| nail polish | Electron Microscopy Sciences | 72180 | Seals microscope slides |
| normal goat serum | Fisher Scientific | PCN5000 | Prevents non-specific binding of antibodies |
| paint brush | Genesee Scientific | 59-204 | Transferring flies |
| PBS | Fisher Scientific | 10-010-023 | Saline solution for dissecting and staining |
| Phalloidin 647 | Abcam | AB176759 | Stains F-Actin in muscle Tissue. Used at 1:1000 concentration |
| plastic petri dish (100 mm) | VWR | 25373-100 | Dissection dish |
| reinforcement labels | W.B. Mason | AVE05722 | Provides support for glass coverslip over the mounted tissue |
| sharpening block | Grainger | 1RDF5 | Keeping fine forceps sharp and also dulling separate pair |
| slide folder | VWR | 10126-326 | Sample storage |
| standard office scissors | W.B. Mason | ACM40618 | Cutting reinforcement labels |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | Coating for dissection dish |
| Triton-X-100 | Electron Microscopy Sciences | 22140 | Helps to permeabilize tissue |
| Vannas Disssection Sissors | Fine Science Tools | 1500-00 | Ued for removing fly legs and making an incision on thorax |
Referanslar
- Casas, C., Manzano, R., Vaz, R., Osta, R., Brites, D. Synaptic failure: focus in an integrative view of ALS. Brain Plasticity. 1, 159-175 (2016).
- Lodato, M. A., et al. Aging and neurodegeneration are associated with increased mutations in single human neurons. Science. 359, 555-559 (2018).
- López-Erauskin, J., et al. ALS/FTD-linked mutation in FUS suppresses intra-axonal protein synthesis and drives disease without nuclear loss-of-function of FUS. Neuron. 100, 816-830 (2018).
- Munsie, L., et al. Retromer-dependent neurotransmitter receptor trafficking to synapses is altered by the Parkinson's disease VPS35 mutation p. D620N. Human Molecular Genetics. 24, 1691-1703 (2015).
- Oddo, S., et al. Triple-transgenic model of Alzheimer's disease with plaques and tangles: intracellular Aβ and synaptic dysfunction. Neuron. 39, 409-421 (2003).
- Selkoe, D. J. Alzheimer's disease is a synaptic failure. Science. 298, 789-791 (2002).
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Current Opinion in Neurobiology. 17, 35-42 (2007).
- Jan, L., Jan, Y. Properties of the larval neuromuscular junction in Drosophila melanogaster. The Journal of Physiology. 262, 189-214 (1976).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Babcock, D. T., Ganetzky, B. An improved method for accurate and rapid measurement of flight performance in Drosophila. Journal of Visualized Experiments. , e51223 (2014).
- Fernandes, J., Bate, M., Vijayraghavan, K. Development of the indirect flight muscles of Drosophila. Development. 113, 67-77 (1991).
- Fernandes, J., VijayRaghavan, K. The development of indirect flight muscle innervation in Drosophila melanogaster. Development. 118, 215-227 (1993).
- Fernandes, J. J., Keshishian, H. Patterning the dorsal longitudinal flight muscles (DLM) of Drosophila: insights from the ablation of larval scaffolds. Development. 122, 3755-3763 (1996).
- Fernandes, J. J., Keshishian, H. Nerve-muscle interactions during flight muscle development in Drosophila. Development. 125, 1769-1779 (1998).
- Hebbar, S., Fernandes, J. J. Pruning of motor neuron branches establishes the DLM innervation pattern in Drosophila. Journal of Neurobiology. 60, 499-516 (2004).
- Hebbar, S., Fernandes, J. J. A role for Fas II in the stabilization of motor neuron branches during pruning in Drosophila. Developmental Biolology. 285, 185-199 (2005).
- Danjo, R., Kawasaki, F., Ordway, R. W. A tripartite synapse model in Drosophila. PloS One. 6, (2011).
- Hunt, L. C., Demontis, F. Whole-mount immunostaining of Drosophila skeletal muscle. Nature Protocols. 8, 2496-2501 (2013).
- Kucherenko, M. M., et al. Paraffin-embedded and frozen sections of Drosophila adult muscles. Journal of Visualized Experiments. , e2438 (2010).
- Llamusi, B., et al. BSF and TBPH are mislocalized in the muscle sarcomere of a Drosophila myotonic dystrophy model. Disease Models & Mechanisms. 6, 184-196 (2013).
- Pantoja, M., Fischer, K. A., Ieronimakis, N., Reyes, M., Ruohola-Baker, H. Genetic elevation of sphingosine 1-phosphate suppresses dystrophic muscle phenotypes in Drosophila. Development. 140, 136-146 (2013).
- Schnorrer, F., et al. Systematic genetic analysis of muscle morphogenesis and function in Drosophila. Nature. 464, 287-291 (2010).
- Viswanathan, M. C., Blice-Baum, A. C., Schmidt, W., Foster, D. B., Cammarato, A. Pseudo-acetylation of K326 and K328 of actin disrupts Drosophila melanogaster indirect flight muscle structure and performance. Frontiers in Physiology. 6, 116 (2015).
- Hebbar, S., Fernandes, J. J. Glial remodeling during metamorphosis influences the stabilization of motor neuron branches in Drosophila. Developmental Biology. 340, 344-354 (2010).
- Mahr, A., Aberle, H. The expression pattern of the Drosophila vesicular glutamate transporter: a marker protein for motoneurons and glutamatergic centers in the brain. Gene Expression Patterns. 6, 299-309 (2006).
- Ritson, G. P., et al. TDP-43 mediates degeneration in a novel Drosophila model of disease caused by mutations in VCP/p97. Journal of Neuroscience. 30, 7729-7739 (2010).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Klagges, B. R., et al. Invertebrate synapsins: a single gene codes for several isoforms in Drosophila. Journal of Neuroscience. 16, 3154-3165 (1996).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proceedings of the National Academy of Sciences of the United States of America. 79, 7929-7933 (1982).
- Wagh, D. A., et al. a protein with homology to ELKS/CAST, is required for structural integrity and function of synaptic active zones in Drosophila. Neuron. 49, 833-844 (2006).
- Marrus, S. B., DiAntonio, A. Preferential localization of glutamate receptors opposite sites of high presynaptic release. Current Biology. 14, 924-931 (2004).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological recordings from the giant fiber pathway of D. melanogaster. Journal of Visualized Experiments. , e2412 (2011).
- Maccioni, R., et al. Standardized phytotherapic extracts rescue anomalous locomotion and electrophysiological responses of TDP-43 Drosophila melanogaster model of ALS. Scientific Reports. 8, 16002 (2018).
- Siddiqi, O., Benzer, S. Neurophysiological defects in temperature-sensitive paralytic mutants of Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. 73, 3253-3257 (1976).
- Wang, Z. H., Clark, C., Geisbrecht, E. R. Drosophila clueless is involved in Parkin-dependent mitophagy by promoting VCP-mediated Marf degradation. Human Molecular Genetics. 25, 1946-1964 (2016).
- O'Sullivan, A., et al. Multifunctional Wing Motor Control of Song and Flight. Current Biology. 28, 2705-2717 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır