Method Article
Preparación de nanopartículas para análisis ToF-SIMS y XPS
En este artículo
Resumen
Se presentan varios procedimientos diferentes para preparar nanopartículas para el análisis de superficies (fundición por gota, recubrimiento por espín, deposición de polvos y criofijación). Discutimos los desafíos, oportunidades y posibles aplicaciones de cada método, particularmente con respecto a los cambios en las propiedades de la superficie causados por los diferentes métodos de preparación.
Resumen
Las nanopartículas han ganado cada vez más atención en los últimos años debido a su potencial y aplicación en diferentes campos, incluidos la medicina, la cosmética, la química y su potencial para permitir materiales avanzados. Para comprender y regular eficazmente las propiedades físico-químicas y los posibles efectos adversos de las nanopartículas, es necesario desarrollar procedimientos de medición validados para las diversas propiedades de las nanopartículas. Si bien los procedimientos para medir el tamaño y la distribución del tamaño de las nanopartículas ya están establecidos, aún no se han establecido métodos estandarizados para el análisis de su química superficial, aunque la influencia de la química de la superficie en las propiedades de las nanopartículas es indiscutible. En particular, el almacenamiento y la preparación de nanopartículas para el análisis de superficies influyen fuertemente en los resultados analíticos de varios métodos, y para obtener resultados consistentes, la preparación de la muestra debe optimizarse y estandarizarse. En esta contribución, presentamos, en detalle, algunos procedimientos estándar para preparar nanopartículas para análisis de superficies. En principio, las nanopartículas se pueden depositar sobre un sustrato adecuado desde la suspensión o como polvo. Las obleas de silicio (Si) se usan comúnmente como sustrato, sin embargo, su limpieza es crítica para el proceso. Para la preparación de muestras a partir de la suspensión, discutiremos la fundición por gota y el recubrimiento por centrifugado, donde no solo la limpieza del sustrato y la pureza de la suspensión, sino también su concentración juegan un papel importante para el éxito de la metodología de preparación. Para nanopartículas con capas o recubrimientos de ligandos sensibles, la deposición como polvos es más adecuada, aunque este método requiere un cuidado particular en la fijación de la muestra.
Introducción
Los nanomateriales se definen como materiales que tienen cualquier dimensión externa entre 1 nm y 100 nm o que tienen una estructura interna o superficial a esta escala1. Debido a las propiedades únicas que surgen de su pequeña escala y, en consecuencia, su gran superficie (entre otros factores), encuentran un uso cada vez mayor en una amplia variedad de campos, incluidos la agricultura, la química, la construcción automotriz, los cosméticos, el medio ambiente, la medicina, la impresión, la energía y los textiles. Este mayor uso significa que tanto el ser humano como el medio ambiente estarán expuestos, a una escala hasta ahora desconocida, a estos materiales cuyas propiedades toxicológicas aún no se conocen completamente, y cuyo tamaño permite su fácil integración en sistemas biológicos o ambientales2.
Después de las propiedades fundamentales del área de superficie y la distribución del tamaño de partícula / tamaño, la química de la superficie y los recubrimientos se identificaron como la propiedad más crucial de los nanomateriales3; Las partículas más pequeñas tienen un área de superficie más alta por unidad de masa y, por lo tanto, una mayor proporción de átomos superficiales a granel. De hecho, para nanopartículas de tamaño de 1 nm, más del 70% de los átomos se pueden encontrar en esquinas o bordes; esto influye fuertemente en las propiedades de la superficie, como la quimisorción, que depende en gran medida de la morfología de la superficie a escala atómica4. Las regulaciones que se ocupan de los nanomateriales requieren datos precisos sobre las propiedades fisicoquímicas y estimaciones confiables de las propiedades toxicológicas de estos materiales. Para estimar eficientemente las propiedades toxicológicas a partir de las propiedades físicas y químicas de los nanomateriales, la comunidad de nanomateriales requiere procedimientos analíticos confiables, estandarizados y verificados. Proyectos como ACEnano5 tienen como objetivo recopilar y correlacionar datos físicos precisos y verificables de nanopartículas en un marco que permita una mejor regulación y caracterización de los nanomateriales. Este impulso hacia procedimientos analíticos estandarizados también ha sido apoyado por los editores de ACS Nano, que desean "consolidar y acordar métodos de caracterización y niveles mínimos de análisis de materiales6". Además, XPS y ToF-SIMS ofrecen nuevas posibilidades para dilucidar la arquitectura de partículas de las nanopartículas core-shell7,8.
La espectroscopia de fotoelectrones de rayos X (XPS) y la espectrometría de masas de iones secundarios de tiempo de vuelo (ToF-SIMS), comparadas en la Tabla 1, son métodos bien establecidos para la investigación de átomos de superficie. En XPS, la muestra se irradia con rayos X que tienen una energía entre 1 y 2 keV, causando emisión de electrones debido al efecto fotoeléctrico. Estos electrones emitidos, que tienen una energía cinética en el mismo rango, se correlacionan con la energía de unión de los electrones en el sólido; por lo tanto, la aparición de fotoelectrones en estas energías de unión definidas e intensidades medibles permite el análisis cuantitativo de la composición. Dado que la vía libre media de estos fotoelectrones es inferior a 10 nm, XPS es una técnica altamente sensible a la superficie para el análisis cuantitativo. Además, el análisis detallado de las energías de unión en espectros altamente resueltos permite la determinación cuantitativa de los estados de valencia de estos electrones.
En ToF-SIMS, la superficie se pulveriza con un haz de iones enfocado (iones primarios), con los iones expulsados del material (iones secundarios) recogidos y analizados en un espectrómetro de masas de tiempo de vuelo. El patrón de masa/carga obtenido permite la determinación de la composición elemental, isotópica o molecular. Debido a la vía libre media de los iones secundarios, esta técnica también es altamente sensible a la superficie y tiene una profundidad de información de 1-2 nm, pero es en el mejor de los casos semicuantitativa, debido al efecto de matriz por el cual la probabilidad de ionización (y por lo tanto el rendimiento) de los iones secundarios está fuertemente influenciada por su matriz circundante. ToF-SIMS se puede operar en modo estático o dinámico; la diferencia entre los dos es el flujo iónico primario que afecta a la superficie. El SIMS estático mantiene el flujo de iones primario a un nivel que impacta (es decir, fragmentos) en un máximo del 1% al 10% de la superficie; la superficie permanece relativamente intacta, lo que permite el análisis de las capas atómicas superiores de material. Dado que incluso el SIMS estático causa cierta destrucción en la superficie, se considera que es menos "no destructivo" de los dos métodos.
Estas técnicas sensibles a la superficie permiten el análisis de los primeros nanómetros del material, incluidos los recubrimientos intencionales o no intencionales, que, para los nanomateriales, pueden influir significativamente en las propiedades del material. Ejemplos de recubrimientos intencionales son capas de recubrimiento en puntos cuánticos para mejorar los rendimientos cuánticos de fotoluminiscencia y reducir la reactividad ambiental9, recubrimientos de alúmina o sílice para la prevención de la actividad fotocatalítica de nanopartículas de titania en bloqueadores solares10, funcionalización de superficies para permitir la bioconjugación y la actividad biológica posterior11, recubrimientos para aplicaciones de diagnóstico y administración de fármacos12 , y recubrimientos de fluorocarbono sobre partículas magnéticas para ferrofluidos y sistemas metálicos core-shell para mejorar las propiedades del catalizador13. Los recubrimientos no intencionales, como la oxidación, la contaminación superficial o las coronas de proteínas en los sistemas biológicos tienen una influencia igualmente fuerte en las propiedades de las nanopartículas y es crucial que los procedimientos de preparación experimental garanticen que el recubrimiento y, en general, la química superficial del nanomaterial no se destruyan ni transformen. También es crucial evaluar las propiedades de las nanopartículas tal como están in situ, ya que sus propiedades pueden verse drásticamente alteradas por el cambio2,14,15. Además, la concentración de estabilizadores en la suspensión de nanopartículas puede influir dramáticamente en el análisis y la integridad estructural de las nanopartículas; la presencia de un estabilizador puede dar lugar a grandes señales no deseadas (por ejemplo, C, H, O y Na) en el análisis, mientras que su eliminación puede provocar daños o aglomeración de las nanopartículas.
Debido a su tamaño y superficie, las condiciones de almacenamiento de las nanopartículas también afectan su comportamiento, tanto como polvos/suspensiones almacenados como muestras preparadas. En diversos estudios se ha demostrado que el efecto de las condiciones de almacenamiento subóptimas, en particular el almacenamiento a temperatura ambiente y la exposición a la luz, causan la degradación de las nanopartículas, lo que ha demostrado alterar las propiedades físicas, químicas y/o toxicológicas de las partículas14,15,16,17,18 . Se ha demostrado que las nanopartículas más pequeñas se oxidan más rápidamente que las más grandes con tasas de oxidación/degradación dependientes de las condiciones de almacenamiento15 y de la química de la superficie14. Se ha demostrado que los efectos de la degradación de las nanopartículas durante el almacenamiento afectan significativamente las propiedades fisicoquímicas, incluida la toxicidad14, mientras que el crecimiento oxidativo puede avanzar hacia el interior a expensas del núcleo15.
Por lo tanto, el almacenamiento y la preparación cuidadosos de los nanomateriales son esenciales para un análisis preciso de la superficie, y cualquier factor que pueda influir en la superficie de la muestra y / o la calidad de las mediciones debe considerarse cuidadosamente. Cabe señalar que debido a la resolución espacial relativamente baja de XPS (en el rango de μm) y ToF-SIMS (unos pocos cientos de nm), solo se puede investigar un pequeño subconjunto de las nanopartículas; estos métodos promedian sobre un área y no tienen la capacidad de obtener imágenes de partículas individuales como es posible con técnicas como la microscopía electrónica. Por esta razón, cualquier análisis requiere la deposición de las nanopartículas en una capa continua para garantizar que no haya interferencias del sustrato. Por lo tanto, la microscopía electrónica y XPS / ToF-SIMS se utilizan a menudo juntos como métodos complementarios para el análisis de nanomateriales.
Aparte de los cambios en la química de la superficie, los principales desafíos para la preparación de muestras de nanopartículas para el análisis XPS y ToF-SIMS son preparar una capa que sea: homogénea, para aumentar la reproducibilidad; gapless, para minimizar la contribución del sustrato a los espectros; lo suficientemente delgado como para evitar efectos de carga (para muestras no conductoras); y fijado de forma segura al sustrato, para evitar que las nanopartículas libres entren y dañen los instrumentos de ultra alto vacío
Las nanopartículas se pueden depositar sobre el sustrato desde la suspensión o como polvo. En primer lugar, discutiremos los diferentes métodos para depositar nanopartículas a partir de la suspensión. Las obleas de silicio son un sustrato comúnmente utilizado para la deposición en suspensión, porque son relativamente baratas, fácilmente disponibles como un producto altamente puro que consiste en silicio puro o dopado (el dopaje evita los efectos de carga), y para la mayoría de las nanopartículas los picos espectrales no se superponen con los picos típicos de las nanopartículas. Este último punto es importante; antes del análisis, debe asegurarse de que los picos del sustrato estén bien separados de los picos esperados de las nanopartículas, de lo contrario la interpretación de los espectros es complicada o imposible y no se puede verificar la cobertura continua del sustrato por parte de las nanopartículas. Antes de usar obleas de silicio, es necesario un procedimiento de limpieza extenso (descrito en esta publicación) para eliminar los contaminantes (orgánicos) y aumentar la humectabilidad de la superficie. Otros sustratos adecuados como películas de oro, grafito pirolítico altamente ordenado (HOPG) o láminas de indio se han utilizado con éxito, pero una discusión sobre su preparación está más allá del alcance de este trabajo19,20,21,22.
En segundo lugar, presentamos métodos para depositar polvos de nanopartículas en un sustrato para el análisis XPS y ToF-SIMS y presentamos las ventajas y desventajas de cada método, lo que permite a los investigadores nuevos en las técnicas encontrar el método de preparación óptimo para sus propósitos. En tercer lugar, discutimos la criofijación, que es un método de preparación adecuado para conservar características como el comportamiento de aglomeración, la corona orgánica, la interfaz sólido/acuosa23,24 o la distribución en medios biológicos25 de NP. La criofijación, típicamente congelación rápida de material en un criógeno líquido refrigerado por nitrógeno y análisis en estado congelado-hidratado, permite el análisis y visualización de nanopartículas directamente en matrices complejas. Este procedimiento no causa la formación de cristales de hielo, sino que forma hielo amorfo que mantiene las membranas y las estructuras celulares y tisulares en su estado biológico nativo, evitando el daño causado por los procesos de cristalización del agua y permitiendo mantener la distribución química exacta de todos los metabolitos celulares y compuestos de la membrana celular26,27,28 . Este método de preparación puede ser de particular interés para presentar un mapa químico exacto del aglomerado o heteroaglomerado NP real, visualizar el espacio químico exacto en las proximidades de la nanopartícula directamente en suspensión, o correlacionar características específicas del tejido celular o compartimentos intracelulares dentro de aglomerados o heteroaglorados NP.
Como se muestra a través de los resultados presentados en este trabajo, el procedimiento más adecuado en un caso particular depende de una variedad de parámetros como la hidrofilicidad, estabilidad, conductividad, estado (por ejemplo, polvo o suspensión) de las nanopartículas y la cuestión analítica en cuestión (por ejemplo, tamaño, propiedades a granel o recubrimientos superficiales). Aquí se presenta una variedad de métodos que se pueden utilizar para la preparación de NP para el análisis de superficie, así como una comparación de sus ventajas y desventajas.
Protocolo
PRECAUCIÓN: Las propiedades toxicológicas de las nanopartículas aún están bajo investigación; debido a su tamaño, pueden presentar peligros únicos en los seres humanos, así como en el medio ambiente, incluso cuando consisten en materiales intrínsecamente no peligrosos. Antes de realizar cualquier trabajo con nanopartículas, se debe completar una evaluación de riesgos adecuada y establecer controles de ingeniería, procedimientos de laboratorio y EPI (equipos de protección individual) adecuados, dependiendo del nivel de peligro de los materiales a estudiar29,30,31,32.
1. Preparación de obleas de Si
NOTA: Estos pasos son necesarios para eliminar la contaminación no deseada (orgánica) y aumentar la humectabilidad de la superficie. Todos los disolventes utilizados deben ser al menos de grado ACS. Un baño de sonicación estándar (35 kH y 120 vatios) es adecuado.
- Limpieza química húmeda de obleas de Si
- Coloque la oblea Si en un vaso de precipitados con isopropanol y ultrasonido durante 5 min.
- Transfiera la oblea Si a un vaso de precipitados con una solución de limpieza de vidrio alcalino y ultrasonido durante 10 minutos.
- Coloque la oblea en un vaso de precipitados con agua ultrapura. Cambie el agua 10 veces vertiendo el agua y rellenando el vaso de precipitados; las obleas de Si permanecerán en la parte inferior debido al efecto capilar.
- Seque la oblea con gas N2 limpio.
NOTA: El secado con N2 evita la formación de "anillos de café" y otros artefactos del secado con agua. - Coloque la oblea en un segundo vaso de precipitados con isopropanol y ultrasonido durante 10 minutos.
- Seque la oblea con gas N2 limpio.
- Coloque la oblea en un vaso de precipitados con etanol y ultrasonido durante 10 minutos.
- Seque la oblea con gas N2 limpio. El protocolo se puede pausar aquí.
- Limpieza por plasma o UV/ozono de obleas de silicio
- Introduzca la oblea Si en el plasma o el limpiador UV/ozono y enciéndala durante 30 min.
NOTA: Las obleas deben limpiarse con plasma o UV/ozono inmediatamente antes de su uso.
- Introduzca la oblea Si en el plasma o el limpiador UV/ozono y enciéndala durante 30 min.
2. Deposición de nanopartículas de la suspensión
NOTA: La vía de exposición más común para las nanopartículas es por inhalación. Trabajar con suspensiones puede minimizar los riesgos de exposición.
- Preparación de la suspensión de nanopartículas a partir de polvo
NOTA: Todas las cantidades descritas aquí son ejemplos. El método debe optimizarse para las nanopartículas particulares utilizadas en cada caso.- Pesar con precisión 15 mg de polvo de nanopartículas (± 10%) en un tubo de 10 ml.
- Pesa con precisión aproximadamente 8 ml de agua ultrapura.
- Cierre el tubo, embale un tubo centrífugo de 50 ml con toalla de papel y colóquelo en el vórtice a 3.000 rpm durante 15 min.
- Fundición a gota de nanopartículas eléctricamente conductoras a partir de suspensión acuosa
- Coloque la oblea en el limpiador UV/ozono durante 30 min.
- Coloque la oblea en la mitad del soporte de la oblea y coloque una gota de 3 μL de suspensión de nanopartículas en el centro del anillo.
- Monte una junta tórica Viton de 6,07 mm de diámetro en la oblea alrededor de la gota. Tenga cuidado de que el anillo no toque la gota.
- Coloque la oblea en un desecador al vacío bajo un vacío de 4 mbar durante 15 minutos para secar la oblea.
- Retire la oblea del desecador y examine utilizando microscopía de luz y XPS para determinar que la capa de partículas es homogénea y cerrada. Repita los pasos 2.2.1 y 2.2.2 hasta que el análisis muestre una capa cerrada y homogénea. El protocolo se puede pausar aquí.
- Recubrimiento por espín de nanopartículas eléctricamente no conductoras de suspensión acuosa
- Coloque la oblea en el limpiador UV/ozono durante 30 min.
NOTA: Mediante suspensiones de recubrimiento por espín de diferentes concentraciones utilizando el mismo protocolo, se pueden lograr diferentes niveles de cobertura superficial. - Programe el spin-coater. Un programa de muestra adecuado es: paso 1: rampa de 500 rpm/s a 1.000 rpm (5 s); paso 2: rampa de 1.000 rpm/s a 2.000 rpm (3 min); paso 3: desaceleración a 2.000 rpm/s a 0 rpm.
- Inserte la oblea en el recubrimiento de centrifugado y encienda el vacío para la fijación.
- Deposite 80 μL de la suspensión en la oblea e inicie el programa.
- Retire la oblea del recubrimiento giratorio.
- Guarde la muestra en un nuevo wafertray limpio. El protocolo se puede pausar aquí.
- Analice la muestra utilizando SEM para confirmar la cobertura sin huecos del sustrato.
- Coloque la oblea en el limpiador UV/ozono durante 30 min.
3. Deposición de nanopartículas a partir de polvo
- Deposición de nanopartículas en cintas adhesivas de doble cara ("stick and go")
- Fije el adhesivo de doble cara al soporte de la muestra y retire el revestimiento.
- Tome una punta de espátula del polvo de nanopartículas y sumérjala sobre el adhesivo.
- Extienda la muestra sobre el adhesivo y presione en el adhesivo con la espátula, hasta que se adhiera la mayor cantidad posible del polvo.
- Compruebe que el polvo está fijado en el grifo invirtiendo y golpeando el soporte de la muestra, y soplando una corriente de gas (por ejemplo, nitrógeno) a través de él. El protocolo se puede pausar aquí.
NOTA: Alternativamente, se puede colocar una pequeña cantidad de polvo sobre una superficie limpia (lámina de aluminio o portaobjetos de vidrio) y presionarse desde arriba con el adhesivo y el soporte de muestra de doble cara. - Coloque una punta de espátula del polvo sobre la superficie limpia. Presione el soporte de la muestra con el adhesivo sobre el polvo desde arriba.
- Compruebe que el polvo está fijado en el grifo invirtiendo y golpeando el soporte de la muestra, y soplando una corriente de gas (por ejemplo, nitrógeno) a través de él. El protocolo se puede pausar aquí.
-
Preparación de pellets de polvo prensado
- Limpie a fondo todas las partes de la matriz de pellets, teniendo cuidado de no rayar la superficie pulida.
- Invierta el troquel de pellets y descanse en un pequeño espaciador.
- Inserte el émbolo y un gránulo de acero inoxidable, con el lado pulido hacia arriba, y tire del émbolo hasta que haya suficiente espacio para llenar con la muestra en polvo.
- Llene el troquel con una pequeña cantidad de muestra (1 punta de espátula grande) y luego inserte el segundo pellet de acero inoxidable con el lado pulido frente a la muestra.
- Coloque la base sobre el cuerpo y invierta cuidadosamente. Si se desea un vacío y está disponible, conecte la bomba de vacío a la base de la matriz de pellets.
- Coloque el troquel en una prensa, asegurándose de que esté centrado.
- Aplicar una carga ligera (2 kN) durante aproximadamente 20 s y soltar.
- Aplicar una carga más pesada (6 kN) durante 2 min y soltar.
- Después de liberar la carga, suelte la bomba de vacío.
NOTA: Debido a las diferentes propiedades del material de varias nanopartículas, puede ser ventajoso preparar una serie de pellets con diferentes cargas y tiempos de carga para determinar las condiciones óptimas de prensado de pellets. - Invierta la matriz, coloque el anillo extractor en su posición y coloque una carga ligera (hasta 1 kN) entre el émbolo y el anillo extractor.
- Retire las piezas de la matriz de la prensa y extraiga cuidadosamente el pellet de muestra con pinzas.
- Monte suavemente la muestra en una oblea de Si limpia con adhesivo de doble cara. El protocolo se puede pausar aquí.
4. Criofijación de suspensiones de nanopartículas
- Llene la cámara principal del dispositivo de congelación rápida con nitrógeno líquido.
- Llene la cámara de congelación rápida enfriada con el criógeno (propano).
- Permita que el dispositivo de congelación rápida se enfríe a su temperatura de funcionamiento.
NOTA: El dispositivo de congelación rápida requiere algún tiempo para alcanzar la temperatura de funcionamiento antes de la preparación de la muestra, por lo tanto, se requiere un plazo razonable (unas pocas horas) para la criofija de las muestras. - Fundición a gota de 10–20 μL de suspensión NP sobre una oblea de Si limpia con una pipeta.
- Sosteniendo la oblea Si con pinzas de fijación, colóquela dentro del dispositivo de congelación de inmersión.
- Mueva las pinzas de fijación a la posición de hundimiento.
- Presione el botón para dejar caer la muestra dentro del criógeno.
- Espere varios segundos hasta que la muestra esté completamente congelada.
- Transfiera las muestras congeladas lo más rápido posible a un ambiente enfriado.
- Coloque la muestra criofijada (oblea de Si) en el soporte de la muestra y transfiérala dentro del instrumento.
NOTA: Para el transporte, se recomienda el hielo seco y es posible el almacenamiento de muestras a corto plazo. Las muestras se pueden medir en estado congelado con un instrumento refrigerado o con ajustes ToF-SIMS convencionales después de la estabilización mediante la liofilización de la muestra.
Resultados
Este artículo presenta una variedad de métodos de preparación de muestras para el análisis de superficies de nanopartículas. Dado que las propiedades fisicoquímicas de un NP específico definirán tanto el método óptimo para la preparación de la muestra (por ejemplo, fundición por gota frente al recubrimiento por espín) como el mejor procedimiento para ese método (por ejemplo, que requiera diferentes sustratos o disolventes), la idoneidad del método utilizado debe validarse a través de métodos analíticos alternativos y optimizarse si es necesario. Los resultados observados en esta publicación son consistentes con la literatura publicada anteriormente al mostrar la necesidad de protocolos y procedimientos consistentes para la preparación de muestras, así como la necesidad de controles de calidad para garantizar que los métodos de preparación y purificación de muestras sean apropiados, exitosos y no dañen las nanopartículas22,33,34,35,36.
Los métodos de muestreo y almacenamiento para los NP no se han abordado aquí, ya que se describen en detalle en varias otras referencias14,15,16,17,18,34,37,38,39. Naturalmente, se debe tener mucho cuidado de que las muestras analizadas sean representativas de la distribución general de nanopartículas y se desarrollen y validen métodos de muestreo adecuados. También se ha demostrado que las condiciones de almacenamiento afectan fuertemente las propiedades de las nanopartículas durante un período de meses y, por lo tanto, deben considerarse cuidadosamente. Como ejemplo, recomendamos que las nanopartículas se almacenen en pequeñas cantidades en recipientes sellados lejos de la luz, idealmente por debajo de 4 ° C. También es crucial que el almacenamiento, el muestreo y la preparación de muestras se realicen de manera consistente de acuerdo con procedimientos validados, así como que se documenten en detalle. Esta documentación debe incluir los metadatos de los propios NP, como la información de procedencia y las condiciones de almacenamiento40. Herramientas como los cuadernos de laboratorio electrónicos (ELN) pueden ser útiles para la documentación coherente de procedimientos y metadatos NP, así como para permitir la producción de datos de acuerdo con el principio FAIR (Findable, Accessible, Interoperable y Reusable).
El análisis preciso y correcto de la superficie de los NP requiere, en primer lugar, una elección adecuada del sustrato. Hemos utilizado obleas de Si limpias como sustratos porque están fácilmente disponibles, son duraderas, fáciles de limpiar, conductoras y suficientemente planas, sin embargo, dependiendo de los objetivos del análisis, la capa superficial de óxido puede ser un inconveniente, ya que los hidrocarburos adventicios en el sustrato no se pueden diferenciar de los de las nanopartículas. Cuando sea necesario, se pueden utilizar otros materiales como recubrimientos de oro o poliméricos en obleas de Si, obleas de Si3N4 o HOPG (grafito pirolítico altamente orientado)19,20,21,22. El primer paso en la preparación de la muestra descrito en este documento es la limpieza de la oblea de Si, que se muestra como un esquema en la Figura 1. La eficacia del proceso de limpieza se puede verificar mediante una variedad de métodos, incluido XPS, como se muestra en la Figura 2. El principal contaminante (carbono adventicio) es típico de las muestras almacenadas en el aire y se reduce significativamente después del proceso de limpieza. Además, la hidroxilación de la superficie de la oblea a través del tratamiento UV u ozono evita el efecto de anillo de café de la deposición de la suspensión acuosa al mejorar la humectabilidad y conducir, por lo tanto, a una distribución más homogénea de las nanopartículas como se muestra en la Figura 3. Se pueden utilizar métodos alternativos de limpieza química húmeda para las obleas de Si según sea necesario; aquí solo se requiere una superficie reproduciblemente limpia en lugar de la eliminación completa de todos los contaminantes orgánicos o la capa de óxido. Si el protocolo se detiene entre los pasos de limpieza y deposición de suspensión, la oblea debe tratarse nuevamente bajo plasma o UV / ozono y la suspensión debe depositarse idealmente dentro de los 15 minutos posteriores al tratamiento.
La suspensión de nanopartículas de núcleo Au-Ag de 60 nm que se muestra en la sección 2.2 contenía una cantidad significativa de citrato de sodio como estabilizador, que es una ocurrencia común en las suspensiones de nanopartículas. Para un análisis preciso de estas partículas y sus propiedades superficiales, particularmente a través de XPS, se debe eliminar la mayor cantidad posible de estabilizador, ya que atenúa la señal de las nanopartículas y causa efectos de carga. Con el fin de establecer el método de purificación óptimo para estas nanopartículas, mostradas como micrografías SEM en la Figura 4, se dializaron en agua ultrapura o se purificaron mediante centrifugación y reexpersión por triplicado. Aunque la diálisis parecería un método más suave y la centrifugación y la reexspersión tienen más probabilidades de causar aglomeración y agregación de las partículas, las imágenes SEM muestran una deformación y daño significativos de las nanopartículas de Au-Ag después de la diálisis (Figura 4B), mientras que las partículas centrifugadas / redespersadas aún están intactas (Figura 4C ). Esto es particularmente notable con nanopartículas metálicas; nuestra hipótesis es que hay una cantidad óptima de citrato de sodio que permite cierta estabilización de la solución sin interferir con la señal de las nanopartículas, y la eliminación de demasiado estabilizador causa daño a las nanopartículas. Un informe anterior muestra que existe un número óptimo de ciclos de centrifugación para la eliminación de la mayor parte del citrato de sodio; exceder este número causa cierta agregación de NP33. En este estudio, se requirieron nueve ciclos de diálisis (un total de 36 h) para obtener una concentración de citrato similar; sin embargo, este método resultó en una mayor cantidad de agregación que la centrifugación, además de causar una disminución en la funcionalización de la superficie. Estos resultados demuestran la importancia de verificar cada paso en el procedimiento de preparación para cada tipo diferente de nanopartícula, particularmente con muestras desconocidas.
Las nanopartículas de núcleo-cáscara Au-Ag de 60 nm utilizadas en este ejemplo son adecuadas para la fundición en gota debido a su conductividad eléctrica, porque los efectos de carga no son un problema y se puede generar un punto grueso mediante la deposición repetida utilizando relativamente poco equipo. Esta capa más gruesa tiene la ventaja de dar mediciones más reproducibles, y la fundición a partir de una suspensión más concentrada puede ahorrar tiempo al reducir el número de pasos de deposición. La deposición puede estar influenciada por la humectabilidad del sustrato; una mala humectación puede producir una mancha de nanopartículas gruesas que es ventajosa para muestras conductoras, mientras que una buena humectación puede producir una capa de nanopartículas más homogénea, que puede ser útil tanto para muestras conductoras como aislantes. Como se describe en el protocolo, la fundición por gota de suspensiones de nanopartículas generalmente requiere aplicaciones repetidas para obtener una capa gruesa con cobertura completa; esto debe verificarse utilizando XPS, pero también puede verificarse rápida y fácilmente mediante microscopía óptica. La Figura 5 muestra la evolución de la cobertura de gotas en una fundición de gotas de nanopartículas de núcleo-cáscara de Au-Ag a partir de solución acuosa; en este caso, se requieren 13 pasos de drop-casting para lograr una cobertura completa. La fundición por gota es particularmente adecuada para partículas conductoras, o aquellas en las que los efectos de carga pueden compensarse adecuadamente. Al igual que con los otros métodos descritos en esta publicación, la fundición por gota debe optimizarse para cada muestra, ya que los diferentes materiales NP tendrán diferentes propiedades con respecto a la profundidad de la información y la concentración y los límites de espesor de la película. Es importante evitar películas demasiado gruesas que pueden causar el apilamiento de compuestos orgánicos que a su vez inhiben la señal NP.
Un recubrimiento homogéneo y de buena calidad ayuda a garantizar resultados consistentes y reproducibles. Además de los parámetros de concentración de suspensión, disolvente y recubrimiento de espín, la calidad de las suspensiones recubiertas de espín también puede verse influenciada negativamente por la presencia de polvo u otras partículas macro o microscópicas grandes. La Figura 6 muestra la mejora en la calidad del recubrimiento por espín de una suspensión de nanopartículas después de la filtración con un filtro de jeringa de 0,45 μm. El filtro debe seleccionarse para asegurarse de que no elimina las nanopartículas de la suspensión. Las tres concentraciones de suspensión diferentes descritas en el protocolo (90, 9,0 y 0,9 mg/ml de nanopartículas de núcleo-cáscara PS-PTFE de 135 nm) se fundieron en las mismas condiciones y se analizaron utilizando SEM y XPS. La imagen superior y el espectro en la Figura 7 muestran la película fundida de la suspensión de 90 mg / ml, que muestra una cobertura multicapa gruesa y sin brechas en la imagen SEM, así como una notable ausencia de picos de Si en los espectros CPS, lo que indica que no hay contribución del sustrato al espectro. Esta muestra es ideal para el análisis XPS o ToF-SIMS; además, los picos F1 más pequeños de la cáscara de las partículas se pueden ver claramente en ausencia de una gran señal del sustrato. La segunda muestra fundida de la suspensión de 9,0 mg/ml muestra las partículas en pequeños aglomerados de una sola capa, que no cubren completamente la superficie. Esta muestra es demasiado delgada y poco homogénea para el análisis XPS o ToF-SIMS. Además, el análisis cuantitativo puede verse afectado debido a la contribución de carbono adventicio en el sustrato, incluso después de una limpieza cuidadosa; como mínimo, tal efecto debe considerarse en el presupuesto de incertidumbre de la medición. Sin embargo, esta muestra sería ideal para el análisis SEM o TEM de la distribución del tamaño de partícula utilizando un software de análisis de imágenes, ya que las partículas existen en una sola capa y en un número suficiente (dentro de la imagen) para proporcionar una evaluación estadísticamente significativa. La muestra fundida a partir de la concentración más baja (0,9 mg/ml) no proporciona una cobertura continua ni una densidad de partículas suficiente para que sea adecuada para el análisis de la química de la superficie o la distribución del tamaño de las partículas. Un análisis cuantitativo fiable no es en absoluto posible debido a la influencia dominante del sustrato.
Los NP de núcleo Al2O3-TiO2 con una capa externa de PDMS o glicerol se prepararon mediante fundición a gota de suspensión y de polvo utilizando el método "stick-and-go" para comparar los efectos de los diferentes métodos de preparación en la capa externa sensible. Las muestras fueron analizadas con ToF-SIMS, donde en los espectros se analizó mediante Análisis de Componentes Principales (PCA). PcA es una técnica estadística para reducir la dimensionalidad de grandes conjuntos de datos mediante la creación de nuevas variables no correlacionadas (los componentes principales), que maximizan la varianza en los datos41,42,43,44,45. La separación de diferentes conjuntos de muestras en el gráfico de componentes principales permite que los resultados se analicen y agrupen más fácilmente. En el gráfico de puntuaciones de PCA en la Figura 8B, que muestra el poder de discriminación de cada conjunto de datos en comparación con todos los demás conjuntos de datos (es decir, entre diferentes conjuntos de muestras), las dos muestras preparadas a partir de polvo muestran puntuaciones muy diferentes, mientras que las muestras preparadas a partir de dispersión muestran puntuaciones muy similares. Los gráficos de carga que se muestran en la Figura 8C indican la relación entre las variables, es decir, qué picos contribuyen más a los respectivos componentes principales. Todos los componentes principales se ordenan de acuerdo con su contribución a la diferencia observada entre los conjuntos de datos, es decir, PCA1 es el que más contribuye a la separación observada de los diferentes conjuntos de datos. Pc1 está dominado por la presencia (NP recubiertos de PDMS preparados a partir de polvo) o ausencia (todas las demás muestras) de picos de PDMS, mientras que PC2, el factor que representa la segunda mayor variación dentro de los conjuntos de datos, permite la diferenciación del Al2O3 y el taponamiento orgánico en los NP. Esto indica que los espectros medidos de los NP preparados a partir de la suspensión son muy similares y sugiere que las capas de PDMS y glicerol pueden haber sido eliminadas o dañadas por la preparación de la suspensión, ya sea de la propia suspensión o del proceso de secado, con señales dominantes del Al2O3 o TiO2.
Si bien los gránulos prensados pueden proporcionar ventajas para la preparación de muestras en polvo, como la facilidad de manejo y la estabilidad en instrumentos de ultra alto vacío (incluida la capacidad de pulverizar sin desalojar np en la cámara de alto vacío), las altas fuerzas involucradas también pueden dañar nanopartículas sensibles, como ya se ha visto con otros métodos de preparación. Se debe preparar y validar un protocolo adecuado.
En el caso de las dispersiones de NP, la criofijación de las suspensiones de muestra fundidas en gota evita los efectos del anillo de café (debido a la fijación instantánea de la suspensión de NP y, por lo tanto, la eliminación de los efectos de secado), así como la preservación de estructuras más grandes presentes en la suspensión. Además, se evita la aplicación de cinta adhesiva. Esto a su vez se refleja en señales reducidas, que pueden atribuirse a sales, contaminantes u otros artefactos del procedimiento de preparación de muestras en los respectivos espectros de masas como se muestra en la Figura 9. La principal ventaja de la criofijación es la capacidad de conservar "tal cual" el espacio químico alrededor de las nanopartículas y / o la entidad química de los aglomerados o heteroaglerados de partículas, así como su correlación con las características biológicas dentro de los tejidos o células individuales o incluso la colocalización a los compartimentos intracelulares, sin interrupción de los pasos de manejo de muestras como el secado, drop-casting, etc46'47. Hemos demostrado la aplicabilidad de la técnica de criofijación dentro del artículo actual y hemos destacado las ventajas de la criofijación para nanopartículas de TiO2. Destacamos que la criofijación es particularmente adecuada para el análisis de muestras biológicas debidas a su estado natural sin la dislocación de productos químicos debido a artefactos de preparación de muestras. Para obtener información más detallada sobre las técnicas de fijación de muestras biológicas, se remite al lector a la literatura19,25,27,48,49.
| XPS | ToF-SIMS | |
| Haz de sonda | Fotones | Iones |
| Haz de análisis | Electrones | Iones |
| Resolución espacial* | > 1 μm | 0,1 μm |
| Profundidad de muestreo | 0,5 – 7,5 nm | <2 nm |
| Límite de detección | 0,01 -0,1 átomo % | Ppb |
| Cuantificación | Excelente (semi cuantitativo) | Desafiante (efectos de matriz) |
| Contenido de la información | Elemental Enlace químico | Elemental Molecular |
| Análisis Orgánico | Excelente | Excelente en modo estático |
| * especificado por el fabricante | ||
Tabla 1: Comparación de varios métodos para el análisis de superficies.
| Método | Adecuado para | Da | Ventajas | Desventajas | Cautela | Mandos | Comprobar |
| Diálisis | Purificación | Eliminación de estabilizadores/impurezas | Equipo simple, de bajo esfuerzo, sin complicaciones | Falta de control sobre el proceso | Puede causar daño a las nanopartículas | Hora | Daño a las nanopartículas (SEM) |
| Centrifugación/reexspersión | Purificación | Eliminación de estabilizadores/impurezas | Más control sobre el proceso, concentración simultánea | Intensivo en mano de obra, requiere centrifugación | Puede causar agregación o aglomeración | Velocidad de rotación de la centrífuga, cantidad de disolvente | Aglomeración/ agregación/ daño a nanopartículas (SEM) |
| Drop casting (suspensión) | NP conductoras sin capa externa sensible | Mancha recubierta relativamente gruesa | Equipo simple, sin complicaciones | Puede dar espesor no homogéneo, tiempo intensivo | La preparación de la suspensión puede dañar las carcasas NP sensibles | Concentración de suspensión, disolvente (humectabilidad del sustrato) | Cobertura (microscopía de luz/XPS) |
| recubrimiento de centrifugado (suspensión) | NP conductores o no conductores sin capa externa sensible | Capa homogénea delgada o partículas individuales | Configuración coherente | Requiere determinación experimental de parámetros óptimos | Filtre el polvo / impurezas, la cobertura puede ser inconsistente | Concentración, parámetros de recubrimiento de espín, disolvente | Prefiltración, cobertura, espesor de capa (SEM/XPS) |
| "stick and go" (polvo) | NPS conductores y no conductores inorgánicos con capa externa sensible | Mancha de polvo en el adhesivo | Equipo simple, de bajo esfuerzo, sin complicaciones | No apto para NP orgánicos o que contienen C, espesor de película inconsistente | Peligro de liberación de NP en instrumentos | Fijación de NP en adhesivo | Estabilidad en condiciones de alto vacío |
| deposición en el orificio de un talón (polvo) | Análisis XPS; partículas orgánicas o inorgánicas conductoras/no conductoras | Muestra de nanopartículas ligeramente prensada | Sin contacto con otros materiales | No hay fijación segura de NP; inadecuado para ToF-SIMS | Dager de la liberación de NP en instrumentos | Ninguno | Incline ligeramente hacia un lado, para garantizar que el polvo se compacte |
| Pellets prensados (polvo) | NPS conductores y no conductores, NP poliméricos | Pellet sólido | Permite el análisis de NP poliméricos en polvo | Puede dañar o contaminar la superficie del NP | Los materiales deben limpiarse a fondo para evitar la contaminación de la superficie; puede dañar la superficie | Tamaño, presión, tiempo | Estabilidad en condiciones de alto vacío |
| Criofijación (suspensión) | Suspensiones NP con capa de ligando sensible; muestras biológicas | Muestra sólida | Conserva la morfología, el estado biológico nativo y la corona, reduce el efecto del anillo de café | La preparación sofisticada y costosa y el manejo de muestras, requieren un usuario experto | alto grado de habilidades requeridas para el manejo y almacenamiento de muestras | Concentración, tamaño de las gotas, temperatura | Conservación de la vitrificación |
Tabla 2: Comparación de diferentes métodos de preparación de muestras.
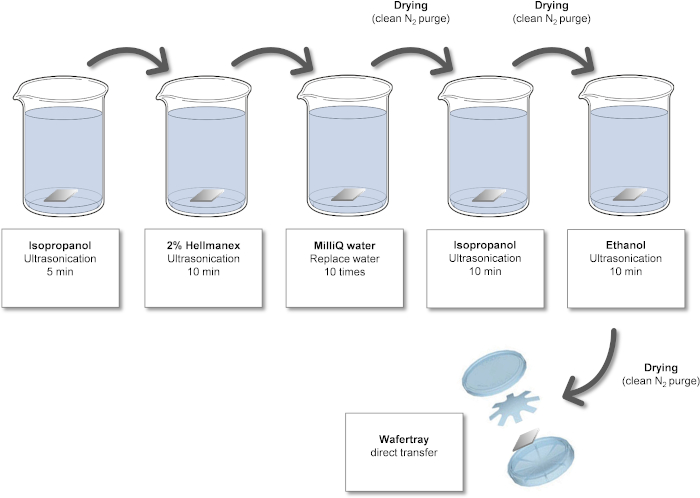
Figura 1: Proceso de limpieza de obleas de Si. Haga clic aquí para ver una versión más grande de esta figura.
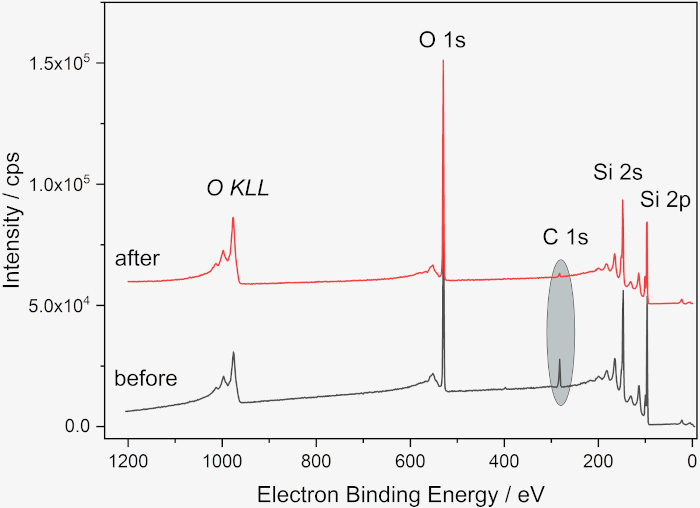
Figura 2: Espectros XP de la oblea de Si antes y después de la limpieza. Encuesta antes (gris) y después de la limpieza (rojo), mostrando la disminución de la cantidad de carbono del 13 al% al 2 al%. Los espectros se obtuvieron con un Kratos Supra DLD (Manchester, Reino Unido) con una radiación Monocromática Al Kα. Las muestras se fijaron con cinta adhesiva doble en el soporte de la muestra, la energía de paso fue de 80 eV, el ancho de paso 1 eV, el tiempo de permanencia 500 ms. Se utilizó el "modo de lente híbrida". El tamaño del punto de rayos X fue de 300 x 700 μm². Se utilizó una pistola de inundación para la compensación de cargos. Para el análisis cuantitativo, se utilizó el paquete de software UNIFit 202050 , utilizando las áreas pico de los picos fotoelectrones correspondientes corregidos con un fondo de Tougaard y normalizados con factores de Scofield, vías libres medias inelásticas y la función de transmisión. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Efecto de la limpieza UV/Ozono sobre la homogeneidad de la dispersión de partículas en la fundición por gota de nanopartículas de PTFE-PMMA de núcleo-cáscara de suspensión acuosa. Las obleas limpias con UV/ozono muestran una disminución significativa en los anillos de café, así como una mejor adhesión de las partículas a la superficie. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Opciones de tratamiento para eliminar las impurezas (por ejemplo, estabilizadores) de las suspensiones de nanopartículas Imágenes SEM que muestran el efecto de la diálisis (arriba a la derecha) y la centrifugación y reexspersión por triplicado (abajo a la derecha) en nanopartículas de núcleo-cáscara Au-Ag de 60 nm. Las nanopartículas están claramente dañadas por la diálisis, mientras que la centrifugación no tiene ningún efecto visible. Todas las barras de escala son de 100 nm. Haga clic aquí para ver una versión más grande de esta figura.
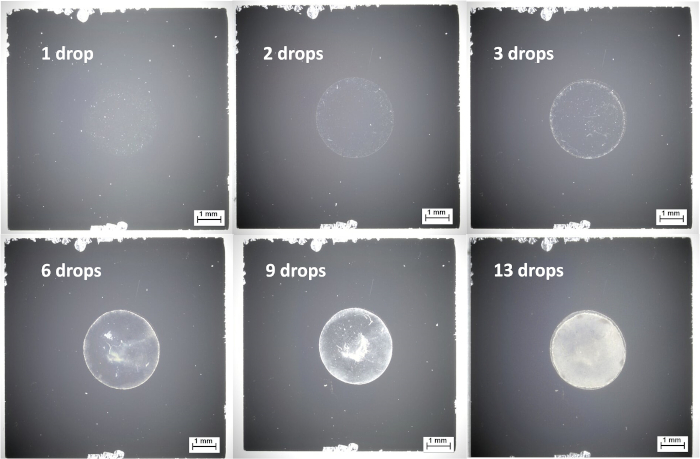
Figura 5: Imágenes de microscopio óptico de nanopartículas de núcleo-cáscara Au-Ag de 60 nm de diámetro desde suspensión acuosa sobre obleas de silicio, mostrando una cobertura suficiente después de 13 gotas. Haga clic aquí para ver una versión más grande de esta figura.
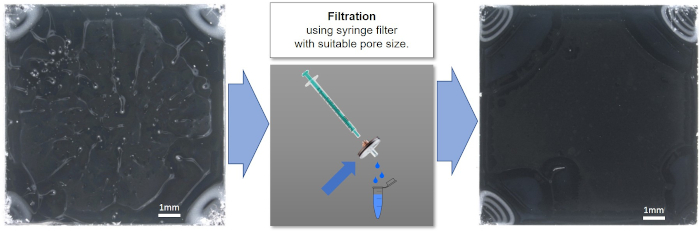
Figura 6: Suspensión de nanopartículas recubiertas de espín, antes (izquierda) y después (derecha) de filtración con un filtro de jeringa de 0,45 μm. La mejora en la calidad después de la filtración se puede ver claramente. Haga clic aquí para ver una versión más grande de esta figura.
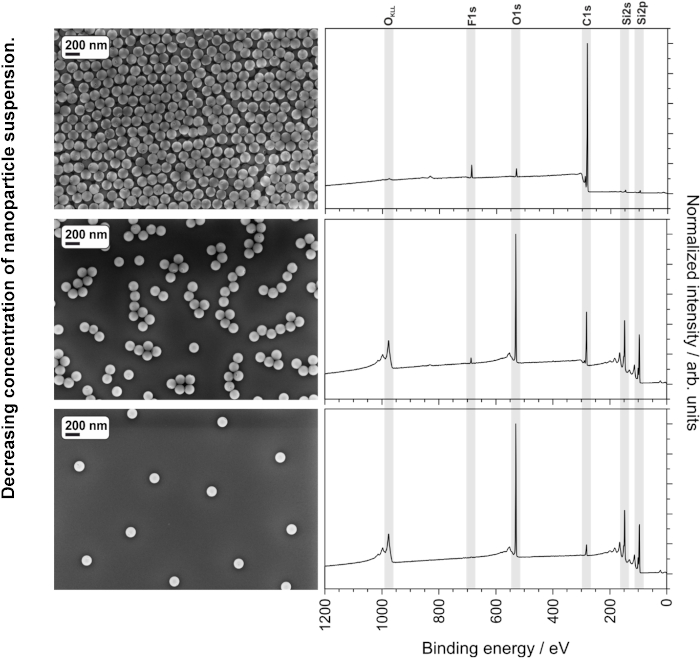
Figura 7: Imágenes SEM y espectros XPS de nanopartículas núcleo-capa de PMMA-PTFE fundidas a varias concentraciones, mostrando el efecto de los picos de sustrato (por cobertura insuficiente) en los espectros XPS. Haga clic aquí para ver una versión más grande de esta figura.
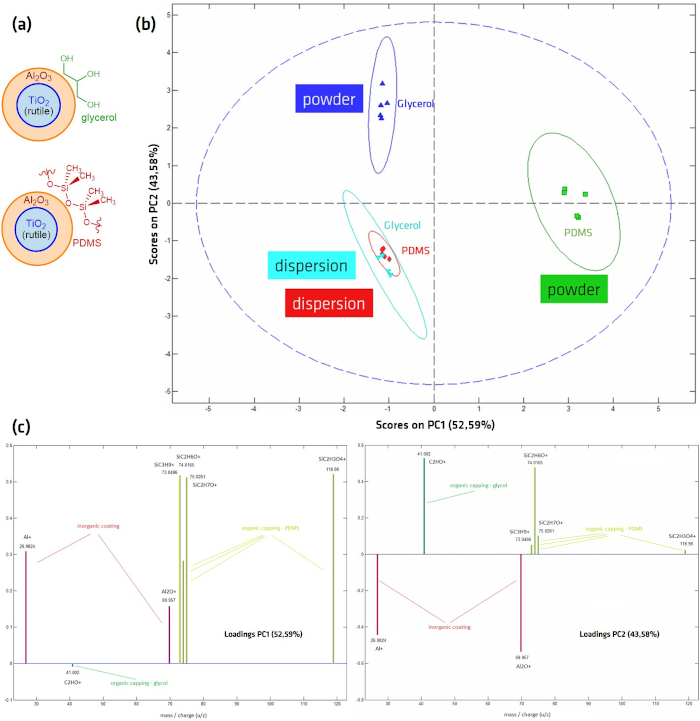
Figura 8: Gráfico de puntuación del análisis de componentes principales (PCA), derivado de los espectros ToF-SIMS de los NP de núcleo-shell Al2O3-TiO2 recubiertos de glicerol y PDMS. (A) Esquema de la estructura NP; (B) Puntuaciones y (C) Gráficos de carga después del análisis ToF-SIMS de los métodos de preparación drop-cast (dispersión) y "stick-and go" (polvo). PC1 representa picos que se correlacionan con fragmentos de PDMS; PC2 separa las muestras con un recubrimiento orgánico (muestras preparadas a partir de polvo) de picos de Al2O3 aparentemente sin recubrimiento superficial. Los espectros se midieron en modo positivo en un instrumento IONTOF ToF-SIMS IV (ION-TOF GmbH, Münster, Alemania) en el modo de espectrometría (HCBU) con un haz de iones Bi3+ de 25 kV con una densidad de dosis máxima de 1012 iones/cm2. Se escaneó un campo de visión de 150 x 150 μm en modo diente de sierra con 125 x 125 píxeles. Haga clic aquí para ver una versión más grande de esta figura.
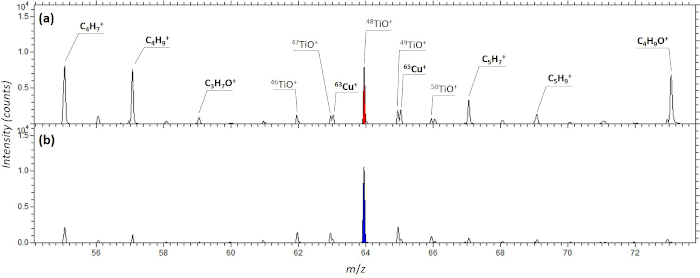
Figura 9: Sección de espectros de masas ToF-SIMS de NP de TiO2 . (A) preparado a partir de polvo con el método "stick and go" y (B) después de la criofijación de la dispersión NP. Un instrumento ToF-SIMS (ION-TOF V; Ion-TOF GmbH, Münster, Alemania) se utilizó para análisis de espectrometría de masas con una pistola de iones de metal líquido pulsada de 30 keV Bi3+ (LMIG, corriente continua (dc), 16 nA). Cada espectro se adquirió escaneando el haz de iones sobre un área de muestra de 500 × 500 μm. Se adquirieron iones secundarios positivos en el rango de masa 0-1,200 Da utilizando 106 pulsos Bi3+ . Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Se han presentado varios métodos para la preparación de nanopartículas para el análisis de superficies utilizando XPS y ToF-SIMS. Hemos resumido las ventajas y desventajas de estos métodos, así como las posibles fuentes de error e idoneidad para diferentes materiales, en la Tabla 2. Como se muestra en los resultados representativos, la preparación de nanopartículas puede influir fuertemente en el éxito del análisis de superficie resultante. Además, no todos los métodos son adecuados para todos los tipos de partículas debido a factores como la interferencia de la señal con el sustrato o los materiales de montaje, los efectos de carga en películas gruesas no conductoras, el estado de las nanopartículas como polvo o suspensión, el daño potencial a las capas externas sensibles, la destrucción de estructuras biológicas e información sobre agregación e interfaces, o la vulnerabilidad de los instrumentos sensibles de ultra alto vacío a las nanopartículas libres.
Debido a que las mediciones de XPS y ToF-SIMS promedian sobre un área en lugar de medir partículas individuales, solo es posible obtener resultados reproducibles a partir de capas homogéneas; por lo tanto, debe evitarse la agregación o aglomeración de las partículas en el sustrato. Además, las capas demasiado gruesas de materiales no conductores causan efectos de carga durante el análisis, lo que puede conducir a artefactos no deseados en los espectros, especialmente la carga parcial que no se puede compensar con una pistola de inundación. Por otro lado, las películas incompletas muestran señales fuertes del sustrato o materiales de montaje (por ejemplo, adhesivos), que pueden interferir con picos sensibles de la superficie de partículas. El espesor ideal de la película depende del material y debe determinarse experimentalmente mediante el análisis de películas de diferentes espesores. En particular, las muestras preparadas con recubrimiento de espín deben analizarse con SEM para garantizar la integridad del recubrimiento.
Trabajar con suspensiones NP presenta menos riesgos de exposición y requisitos de seguridad en comparación con trabajar con polvos NP. La fundición por gota es un método relativamente simple con bajos requisitos de equipo y es particularmente adecuado para nanopartículas conductoras en suspensión donde el grosor de la película no es una preocupación. Si bien las muestras se pueden secar fácilmente en condiciones atmosféricas, el desecador al vacío sirve para reducir el tiempo de secado de las gotas, así como para proteger las obleas de la contaminación. El anillo Viton se utiliza para modificar los patrones de evaporación de la gota y, por lo tanto, minimizar la formación de anillos de café. Los patrones de evaporación también pueden verse influenciados por la variación de la hidrofilia del sustrato mediante protocolos de limpieza o por la aplicación de recubrimientos alternativos51,52, por la evaporación en atmósferas solventes53, o incluso por el calentamiento del sustrato54. El recubrimiento por espín se recomienda para suspensiones de nanopartículas no conductoras en suspensión porque es capaz de generar una capa de partículas homogénea que es lo suficientemente delgada como para evitar efectos de carga, pero lo suficientemente gruesa como para evitar que el sustrato de Si contribuya a los espectros XPS y ToF-SIMS. Para cada sistema NP individual y concentración, tanto la centrífuga como los parámetros de recubrimiento de espín deben optimizarse, pero luego se pueden reproducir de manera muy confiable incluso en diferentes instrumentos. Debido a que la gota recubierta de espín siempre está en el medio de la oblea, el radio de rotación es irrelevante y se puede usar la unidad "revoluciones por minuto" (rpm). Alternativamente, la suspensión podría depositarse en la oblea después de iniciar el programa; sin embargo, esto requeriría diferentes parámetros de recubrimiento de espín y una mayor cantidad de suspensión para obtener un recubrimiento más grueso.
Debido a su tamaño extremadamente pequeño, las nanopartículas pueden desprenderse del sustrato y moverse libremente dentro de la cámara de ultra alto vacío cuando se impactan con un haz de iones o rayos X. Este es un problema particular para las muestras preparadas con polvo. En algunos casos, las nanopartículas pueden penetrar en los componentes sensibles del instrumento, lo que requiere un mantenimiento costoso y lento. Debido al voltaje de aceleración aplicado, el peligro de dañar piezas sensibles es mayor con ToF-SIMS que con XPS. Las muestras en polvo, en particular las preparadas con el método "stick and go", deben revisarse cuidadosamente para garantizar que los polvos se fijen de manera lo suficientemente segura, especialmente para el análisis ToF-SIMS. Esto se puede confirmar, por ejemplo, sosteniendo la muestra boca abajo y soplando una corriente de gas (por ejemplo, N2) a través de ella. Antes del análisis, las muestras también se pueden dejar durante la noche en la esclusa de aire u otra cámara de entrada de muestra inicial del instrumento, donde un vacío estable puede indicar que no hay partículas sueltas de la muestra. Las nanopartículas preparadas como gránulos, sin embargo, pueden incluso ser pulverizadas (a bajas tensiones de aceleración) sin dañar el instrumento; este método puede eliminar contaminantes, particularmente hidrocarburos, introducidos desde la prensa y también puede permitir el análisis a granel de las partículas.
La preparación de polvos NP en el talón del portamuestras permite la preparación de muestras con geometría definida y una superficie macroscópicamente plana. Los puntos críticos son la limpieza de la herramienta para presionar la muestra y el uso de una presión baja para evitar cambios en la superficie de las nanopartículas debido a este procedimiento. Tiene las desventajas de necesitar una cantidad relativamente alta de material y problemas potenciales con la pérdida de material en instrumentos de alto vacío. No recomendamos este método para el análisis ToF-SIMS, ya que las partículas no están comprimidas ni aseguradas de ninguna manera.
Con respecto al material NP, la primera consideración para la preparación de muestras es la eliminación o minimización de la interferencia entre NP y sustratos de material similar; por ejemplo, las obleas de Si son un sustrato inadecuado para el análisis de NP de SiO2 utilizando XPS y ToF-SIMS, incluso con suficiente cobertura de muestra. Las nanopartículas metálicas o inorgánicas pueden analizarse fácilmente como polvo en un adhesivo (suponiendo que no contengan capas o recubrimientos orgánicos) debido a la falta de interferencia de señal entre las nanopartículas y el adhesivo de doble cara, un método de preparación que no sería adecuado para NP poliméricos. Las nanopartículas metálicas tienen más flexibilidad en términos de posible espesor de película utilizado debido a la ausencia de efectos de carga, y pueden ser lanzados con relativamente poco equipo; sin embargo, es probable que contengan grandes cantidades de impurezas y estabilizadores de su síntesis, que deben eliminarse cuidadosamente sin dañar las partículas. Las nanopartículas poliméricas pueden dañarse más fácilmente por el prensado de troqueles, pero también pueden mantenerse unidas más fácilmente en el pellet, dependiendo de las presiones utilizadas. Los gránulos o recubrimientos orgánicos blandos en la superficie de NP también pueden ser sensibles al daño. La deposición directa de la solución tiene el potencial de dañar los recubrimientos sensibles, ya sea a través de la suspensión o el proceso de secado, pero es ventajosa para analizar los NP ya presentes en la suspensión. La criofijación es un método adecuado para el análisis de estructuras químicas, superficies o interfaces en suspensión que podrían dañarse o destruirse por otras técnicas de preparación de muestras, pero requiere un crioequipo especializado tanto para XPS como para ToF-SIMS46'47.
Si bien este documento describe varios métodos ejemplares que se pueden utilizar para la preparación de muestras, en todos los casos el método debe optimizarse y validarse utilizando métodos analíticos alternativos. Recientemente se publicó una descripción detallada de la influencia de diferentes factores22. Además del desarrollo y la validación de métodos de preparación adecuados, la documentación de estos pasos también es de suma importancia40. Esta publicación presenta algunos métodos fáciles de manejar y es una guía para modificar o desarrollar nuevos métodos de acuerdo con los requisitos de la tarea específica.
Divulgaciones
Los autores no tienen intereses contrapuestos que revelar.
Agradecimientos
Este proyecto ha recibido financiación del Programa Horizonte 2020 de la Unión Europea (H2020) en virtud del acuerdo de subvención n.º 720952 (ACEnano). A los autores les gustaría agradecer a Sigrid Benemann por las mediciones SEM, Markus Schneider por las mediciones ToF-SIMS y PCA, y Philipp Reichardt por la ayuda con la filmación.
Materiales
| Name | Company | Catalog Number | Comments |
| 4-figure Laboratory balance | Kern & Sohn GmbH | ADB200-4A | |
| 5 mm Pellet die | Specac | GS03060 | |
| Alkali glass cleaning solution | Sigma-Aldrich | Hellmanex™ III Z805939 | Special cleaning solution for cuvettes |
| Carbon adhesive tabs | Plano | "Leit-Tabs" G3347 | |
| Clean laboratory beakers | any | e.g. 300 mL | |
| Cryo-freezer | Electron Microscopy Sciences | EMS-002 Cryo Workstation | |
| Dialysis tube with fasteners | Medicell Membranees Ltd | DTV12000.06.30 | Molecular weight cut-off (MWCO) 12-14 kDa |
| Die press | any | Capable of 2 kN force | |
| Disposable syringe, 1 mL, Luer-slip | TH Geyer | Labsolute 7657545 | Any appropriate volume can be used |
| Double-sided adhesive | 3M | Removable Repositionable Tape 665 | |
| Dry ice | Linde AG | ICEBITZZZ® | For short term storage/cooling |
| Eppendorf transfer pipette and tips | Eppendorf | various | Check correct size for planned pipetting volume |
| Ethanol, ACS grade | Merck KGaA | 1009832500 | |
| FFP2 or FFP3 mask | various | For working with nanoparticles from non-hazardous materials, when not in a fume hood or glove box | |
| Isopropanol, ACS grade | Merck KGaA | 1096342500 | |
| Lab coat, gloves and goggles | any | ||
| Laboratory centrifuge | Eppendorf | Centrifuge 5430 | |
| Laboratory fume hood | any | necessary for working with nanoparticles | |
| Laboratory stirrer & stirrer bar | NeoLab | D-6010 | |
| Lint-free wipes | Kimberley Clark Professional | Kimtech Science Precision wipes | Recommended for working with Si wafers |
| Liquid Nitrogen | Linde AG | Stickstoff flüssig 5.0 | Only for cooling of the cryogen. |
| Microtube/centrifuge tube 1,5 mL | T.H. Geyer GmbH & Co. KG | Labsolute 7696751 | |
| Nitrogen 5.0 | any | 99.999% purity | |
| Pasteur pipette, PE, plastic 3 mL | TH Geyer | Labsolute 7 691 203 | |
| Pasteur pipette, PE, plastic 3 mL | TH Geyer | Labsolute 7 691 203 | |
| Powder sample holder | BAM workshop | "Home-made" sample holder | |
| Propane | Sigma-Aldrich | 769037 | The cryogen should be of highest possible purity. |
| Sample vial or centrifuge tube 1 mL | Greiner Bio-One GmbH | Cellstar 188 261 | Should be capable of being fixed in the Vortexer |
| Silicon wafers | any | ideally 1cm2 pre-cut | |
| Spin-coater | SPS Europe | SPIN150i-NPP | |
| Syringe filter 0,45 µm | Th Geyer | Labsolute 7699803 | For smaller samples; larger versions exist for larger sample volumes |
| ToF-SIMS | IONTOF GmbH | ToF-SIMS IV or V, equipped with Bi LMIG and flood gun | |
| Tweezers for handling Si wafers | any | ||
| ultrapure water | TKA | MicroPure 08.1202 | |
| Ultrasonicator | Bandelin | Sonorex Super | |
| UV/Ozone cleaner | NanoBioAnalytics | UVC-1014 | |
| Vacuum dessicator | any | ||
| Vacuum pump (membrane/diaphragm) | Vacuubrand GmbH | Type MD-4T | |
| Viton O-ring 6.07 x 1.78 mm | Betech GmbH | 2-010, FKM 80 | |
| Vortexer | Heathrow Scientific | Vortexer HS120212 | |
| Wafer Holder 25mm coin style | Semiconductor Production Systems Europe | eWB0091-ASSY-1 | |
| XPS | Kratos | Kratos Axis Ultra DLD |
Referencias
- ISO/TS 18110:2015 in Nanotechnologies - Vocabularies for science, technology and innovation indicators. International Organization for Standardization Available from: https://www.iso.org/obp/ui/iso:std:61482:en (2015)
- Valsami-Jones, E., Lynch, I. How safe are nanomaterials. Science. 350, 388-389 (2015).
- EU Regulation Commission. Commission Regulation (EU) 2018/1881. Official Journal of the European. , (2018).
- Rotello, V. . Nanoparticles: Building Blocks for Nanotechnology. , 9042-9046 (2004).
- Mulvaney, P., Parak, W. J., Caruso, F., Weiss, P. S. Standardizing nanomaterials. ACS Nano. 10 (11), 9763-9764 (2016).
- Müller, A., et al. Determining the thickness and completeness of the shell of polymer core-shell nanoparticles by X-ray photoelectron spectroscopy, secondary ion mass spectrometry, and transmission scanning electron microscopy. The Journal of Physical Chemistry C. 123 (49), 29765-29775 (2019).
- Powell, C. J., Werner, W. S. M., Shard, A. G., Castner, D. G. Evaluation of Two Methods for Determining Shell Thicknesses of Core-Shell Nanoparticles by X-ray Photoelectron Spectroscopy. The Journal of Physical Chemistry C. 120 (39), 22730-22738 (2016).
- Shirasaki, Y., Supran, G. J., Bawendi, M. G., Bulović, V. Emergence of colloidal quantum-dot light-emitting technologies. Nature Photonics. 7 (1), 13-23 (2013).
- Smijs, T. G., Pavel, S. Titanium dioxide and zinc oxide nanoparticles in sunscreens: focus on their safety and effectiveness. Nanotechnology, Science and Applications. 4, 95-112 (2011).
- Medintz, I. L., Uyeda, H. T., Goldman, E. R., Mattoussi, H. Quantum dot bioconjugates for imaging, labelling and sensing. Nature Materials. 4 (6), 435-446 (2005).
- Byrne, J. D., Betancourt, T., Brannon-Peppas, L. Active targeting schemes for nanoparticle systems in cancer therapeutics. Advanced Drug Delivery Reviews. 60 (15), 1615-1626 (2008).
- Serpell, C. J., Cookson, J., Ozkaya, D., Beer, P. D. Core@shell bimetallic nanoparticle synthesis via anion coordination. Nature Chemistry. 3 (6), 478-483 (2011).
- Izak-Nau, E., et al. Impact of storage conditions and storage time on silver nanoparticles' physicochemical properties and implications for their biological effects. RSC Advances. 5 (102), 84172-84185 (2015).
- Widdrat, M., et al. Keeping Nanoparticles Fully Functional: Long-Term Storage and Alteration of Magnetite. ChemPlusChem. 79 (8), 1225-1233 (2014).
- Gorham, J. M., et al. Storage wars: how citrate-capped silver nanoparticle suspensions are affected by not-so-trivial decisions. Journal of Nanoparticle Research. 16 (4), 2339 (2014).
- Velgosová, O., Elena, &. #. 2. 6. 8. ;., Malek, J., Kavuličová, J. Effect of storage conditions on long-term stability of Ag nanoparticles formed via green synthesis. International Journal of Minerals, Metallurgy, and Materials. 24, (2017).
- Zaloga, J., et al. Different storage conditions influence biocompatibility and physicochemical properties of iron oxide nanoparticles. International Journal of Molecular Sciences. 16 (5), (2015).
- Benettoni, P., et al. Identification of nanoparticles and their localization in algal biofilm by 3D-imaging secondary ion mass spectrometry. Journal of Analytical Atomic Spectrometry. 34 (6), 1098-1108 (2019).
- Ndlovu, G. F., et al. Epitaxial deposition of silver ultra-fine nano-clusters on defect-free surfaces of HOPG-derived few-layer graphene in a UHV multi-chamber by in situ STM, ex situ XPS, and ab initio calculations. Nanoscale Research Letters. 7 (1), 173 (2012).
- Caprile, L., et al. Interaction of l-cysteine with naked gold nanoparticles supported on HOPG: a high resolution XPS investigation. Nanoscale. 4 (24), 7727-7734 (2012).
- Baer, D. R., et al. Chapter 4.2 - Preparation of nanoparticles for surface analysis. Characterization of Nanoparticles. , 295-347 (2020).
- Škvarla, J., Kaňuchová, M., Shchukarev, A., Girová, A., Brezáni, I. Cryo-XPS - A new technique for the quantitative analysis of the structure of electric double layer at colloidal particles. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 586, 124234 (2020).
- Shchukarev, A., Ramstedt, M. Cryo-XPS: probing intact interfaces in nature and life. Surface and Interface Analysis. 49 (4), 349-356 (2017).
- Suhard, D., et al. Intracellular uranium distribution: Comparison of cryogenic fixation versus chemical fixation methods for SIMS analysis. Microscopy Research and Technique. 81 (8), 855-864 (2018).
- Piwowar, A. M., et al. Effects of cryogenic sample analysis on molecular depth profiles with TOF-secondary ion mass spectrometry. Analytical Chemistry. 82 (19), 8291-8299 (2010).
- Winograd, N., Bloom, A. Sample preparation for 3D SIMS chemical imaging of cells. Methods in Molecular Biology. 1203, 9-19 (2015).
- Schaepe, K., et al. . Characterization of Nanoparticles. , 481-509 (2020).
- Managing nanomaterials in the workplace. European Agency for Safety and Health at Work Available from: https://osha.europa.eu/en/emerging-risks/nanomaterials (2020)
- European Union Programme for Employment and Social Solidarity. Working safely with manufactured nanomaterials: guidance for workers. European Union Programme for Employment and Social Solidarity. , (2014).
- . Recommendation of the council on the safety testing and assessment of manufactured nanomaterials in C(2019)55/REV1 Available from: https://legalinstruments.oecd.org/en/instruments/298 (2013)
- Working safely with nanomaterials in research and development. NanoSafety Partnership Group Available from: https://www.safenano.org/media/64896/Working_Safely_with_Nanomaterials_-_Release_200_-_Aug2012.pdf (2012)
- La Spina, R., Spampinato, V., Gilliland, D., Ojea-Jimenez, I., Ceccone, G. Influence of different cleaning processes on the surface chemistry of gold nanoparticles. Biointerphases. 12 (3), 031003 (2017).
- Belsey, N. A., et al. Versailles Project on Advanced Materials and Standards Interlaboratory Study on Measuring the Thickness and Chemistry of Nanoparticle Coatings Using XPS and LEIS. The Journal of Physical Chemistry C. 120 (42), 24070-24079 (2016).
- Ghomrasni, N. B., Chivas-Joly, C., Devoille, L., Hochepied, J. F., Feltin, N. Challenges in sample preparation for measuring nanoparticles size by scanning electron microscopy from suspensions, powder form and complex media. Powder Technology. 359, 226-237 (2020).
- Lu, P. J., et al. Methodology for sample preparation and size measurement of commercial ZnO nanoparticles. Journal of Food and Drug Analysis. 26 (2), 628-636 (2018).
- Allen, T. . Powder Sampling and Particle Size Determination. , 1-55 (2003).
- Allen, T. . Particle Size Measurement. Powder Technology Series. , (1981).
- Brittain, H. G. . Pharmaceutical Technology. 67-73, (2002).
- ISO. Part 4: Reporting information related to the history, preparation, handling and mounting of nano-objects prior to surface analysis. ISO. , (2018).
- Bro, R., Smilde, A. K. Principal component analysis. Analytical Methods. 6 (9), 2812-2831 (2014).
- Graham, D. J., Castner, D. G. Multivariate Analysis of ToF-SIMS Data from Multicomponent Systems: The Why, When, and How. Biointerphases. 7 (1), 49 (2012).
- Jolliffe, I. T., Cadima, J. Principal component analysis: a review and recent developments. Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences. 374 (2065), 20150202 (2016).
- Lever, J., Krzywinski, M., Altman, N. Principal component analysis. Nature Methods. 14 (7), 641-642 (2017).
- Shiens, J. . A tutorial on principal component analysis. , (2014).
- Fletcher, J. S., Lockyer, N. P., Vaidyanathan, S., Vickerman, J. C. TOF-SIMS 3D biomolecular imaging of xenopus laevis oocytes using buckminsterfullerene (C60) primary ions. Analytical Chemistry. 79 (6), 2199-2206 (2007).
- Fletcher, J. S., Rabbani, S., Henderson, A., Lockyer, N. P., Vickerman, J. C. Three-dimensional mass spectral imaging of HeLa-M cells - preparation, data interpretation and visualisation. Rapid Communications in Mass Spectrometry: RCM. 25 (7), 925-932 (2011).
- Malm, J., Giannaras, D., Riehle, M., Gadegaard, N., Sjövall, P. Fixation and Drying Protocols for the Preparation of Cell Samples for Time-of-Flight Secondary Ion Mass Spectrometry Analysis. Analytical Chemistry. 81, 7197-7205 (2009).
- Chandra, S. Challenges of biological sample preparation for SIMS imaging of elements and molecules at subcellular resolution. Applied Surface Science. 255, 1273-1284 (2008).
- Hesse, R., Bundesmann, C., Denecke, R. Automatic spike correction using UNIFIT 2020. Surface and Interface Analysis. 51 (13), 1342-1350 (2019).
- Lee, H. H., Fu, S. C., Tso, C. Y., Chao, C. Y. H. Study of residue patterns of aqueous nanofluid droplets with different particle sizes and concentrations on different substrates. International Journal of Heat and Mass Transfer. 105, 230-236 (2017).
- Lin, S. Y., Yang, K. C., Chen, L. J. Effect of surface hydrophobicity on critical pinning concentration of nanoparticles to trigger the coffee ring formation during the evaporation process of sessile drops of nanofluids. Journal of Physical Chemistry. C. 119 (6), 3050-3059 (2015).
- Majumder, M., et al. Overcoming the "Coffee-Stain" effect by compositional marangoni-flow-assisted drop-drying. Journal of Physical Chemistry. B. 116 (22), 6536-6542 (2012).
- Zhong, X., Wu, C. L., Duan, F. From enhancement to elimination of dual-ring pattern of nanoparticles from sessile droplets by heating the substrate. Applied Thermal Engineering. 115, 1418-1423 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados