Method Article
Incorporación optimizada de análogos de ácidos grasos alquilinos para la detección de proteínas aciladas grasas utilizando Click Chemistry
En este artículo
Resumen
El estudio de la acilación grasa tiene importantes implicaciones en las interacciones y enfermedades de las proteínas celulares. Aquí se presenta un protocolo modificado para mejorar la detección química de clics de proteínas aciladas grasas, que se puede aplicar en varios tipos de células y combinarse con otros ensayos, incluida la persecución de pulsos y la espectrometría de masas.
Resumen
La acilación grasa, la adición covalente de ácidos grasos saturados a sustratos de proteínas, es importante para regular una miríada de funciones celulares, además de sus implicaciones en el cáncer y las enfermedades neurodegenerativas. Los desarrollos recientes en los métodos de detección de acilación grasa han permitido la detección eficiente y no peligrosa de proteínas aciladas grasas, particularmente mediante el uso de la química de clics con etiquetado bio-ortogonal. Sin embargo, la detección de química de clic puede estar limitada por la escasa solubilidad y los posibles efectos tóxicos de agregar ácidos grasos de cadena larga al cultivo celular. Aquí se describe un enfoque de etiquetado con entrega optimizada utilizando ácidos grasos saponificados en combinación con BSA libre de ácidos grasos, así como medios delipidados, que pueden mejorar la detección de proteínas aciladas grasas difíciles de detectar. Este efecto fue más pronunciado con el análogo alquil-estearato, 17-ODYA, que ha sido el análogo de ácidos grasos más utilizado en la detección química de clics de proteínas aciladas. Esta modificación mejorará la incorporación celular y aumentará la sensibilidad a la detección de proteínas aciladas. Además, este enfoque se puede aplicar en una variedad de tipos de células y combinarse con otros ensayos como el análisis de persecución de pulsos, el etiquetado de isótopos estables con aminoácidos en cultivo celular y la espectrometría de masas para el perfil cuantitativo de proteínas aciladas grasas.
Introducción
La acilación grasa implica la adición covalente de ácidos grasos a las proteínas y es bien conocida por su importancia en la promoción de las interacciones proteína-membrana, pero también se ha demostrado que promueve las interacciones proteína-proteína, los cambios conformacionales y regula los sitios catalíticos de las enzimas1,2,3,4,5,6,7 . La acilación grasa se ha convertido en un objetivo farmacológico potencial en una miríada de enfermedades, incluyendo infecciones, cáncer, inflamación y neurodegeneración, donde se han documentado interrupciones en la palmitoilación8,9,10,11,12,13. Esto ha sido estimulado principalmente por el desarrollo de nuevos métodos de detección química, que permitieron la identificación a gran escala de objetivos de proteínas S-aciladas.
La acilación grasa puede incluir una variedad de modificaciones que involucran la adición covalente de ácidos grasos saturados e insaturados, pero generalmente se refiere a la N-miristoilación y la S-acilación. La N-miristoilación se refiere a la adición de ácido mirístico a las glicinas N-terminales, ya sea co-traduccionalmente en polipéptidos nacientes o post-traduccionalmente en glicinas N-terminales recién expuestas después de la escisión proteolítica2,14. La N-miristoilación ocurre a través de un enlace amida irreversible. Por otro lado, la S-acilación típicamente se refiere a la adición reversible de ácidos grasos de cadena larga a los residuos de cisteína a través de un enlace tioéster. La forma más común de esta modificación incluye la incorporación de palmitato y, por lo tanto, se conoce comúnmente como S-palmitoilación, o simplemente palmitoilación11,15. En muchos sentidos, la palmitoilación S es similar a la fosforilación. Es dinámico, enzimáticamente regulado y demuestra ser altamente manejable.
Hasta la última década, el estudio de la acilación grasa se veía obstaculizado por métodos de detección limitados, que requerían ácidos grasos marcados radiactivamente. Esto tenía varias desventajas, incluyendo el costo, los problemas de seguridad y los tiempos de detección muy largos. Típicamente, se utilizó palmitato tritiado o yodado para la detección de S-acilación16. El palmitato tritiado requirió largos períodos de detección con película de autorradiografía, que pueden tardar semanas o meses. Si bien los análogos de ácidos grasos yodo [125I] acortaron los tiempos de detección, presentaron un riesgo de seguridad mucho mayor y requirieron una estrecha vigilancia de la tiroides de los experimentadores. Además, estos métodos no eran cuantitativos, por lo tanto, limitaban la capacidad de medir la palmitoilación dinámica, y también consumían mucho tiempo para su configuración y limpieza debido al equipo de protección personal adicional y el monitoreo radiactivo. Finalmente, las etiquetas radiactivas no eran adecuadas para los estudios proteómicos y, por lo general, se limitaban a la detección de bajo rendimiento de proteínas específicas de interés. A medida que se detectaron más sustratos e, inevitablemente, se identificaron las enzimas que median cada modificación, quedó claro que se requerían nuevos métodos de detección17,18,19,20,21. Casi simultáneamente, surgieron varios métodos nuevos para la detección de proteínas aciladas grasas. El primero explota la reversibilidad y reactividad del enlace tioéster de S-acilación. El ensayo de intercambio de acil-biotina (ABE) reemplaza químicamente el palmitato con biotina para la posterior extracción de proteínas S-aciladas utilizando perlas de agarosa de avidina y detección directa por western blot22,23,24. A continuación, se desarrolló el etiquetado bio-ortogonal de ácidos grasos y la adición quimioselectiva a etiquetas o asas que incluyeron el uso de la ligadura de Staudinger y la química de clic25,26,27,28,29,30,31,32,33 . Finalmente, al igual que el ABE, la captura asistida por resina de acil (RAC) esencialmente reemplaza los sitios S-acilados con perlas tiol-reactivas para la captura y detección de proteínas S-aciladas34,35. Juntos, los ensayos basados en el intercambio y la química del clic han proporcionado métodos más eficientes y sensibles de detección de acilación y purificación de afinidad para el análisis aguas abajo y posteriormente han llevado al descubrimiento de miles de proteínas S-aciladas8,36.
El término química de clic abarca un grupo de reacciones químicas, pero más comúnmente se refiere al mecanismo de reacción de cicloadición azido-alquino catalizado por Cu(I) [3+2] entre un grupo alquilino y un grupo azido27,28,37. Particularmente, en el caso de la acilación grasa, la química del clic implica la detección de S-palmitoilación o N-miristilación mediante la incorporación de alquil-palmitato bio-ortogonal de 16 carbonos (ácido 15-hexadecinoico; 15-HDYA) o el alquil-miristato de 14 carbonos (ácido 13-tetradecinoico; 13-TDYA), respectivamente, en las células para etiquetar proteínas aciladas endógenamente28 . Después de la lisis celular y la inmunoprecipitación de la proteína de interés, se realiza una reacción química de clic (enlace covalente entre un alquino y una azida) para unirse a una sonda de afinidad, típicamente biotina, para su detección por western blot28,37. Alternativamente, la química de clic se puede realizar en el lisado celular total y las proteínas aciladas grasas se pueden purificar por afinidad para su identificación por espectrometría de masas. La reacción química de clic inicial con azido-biotina aumentó la selectividad y la sensibilidad de la detección más de un millón de veces en comparación con la radiactividad2. Otra ventaja de la química de clics es que se puede combinar con otros métodos clásicos de etiquetado, como el análisis de búsqueda de pulsos del recambio de proteínas utilizando azido-homoalanina para el análisis cuantitativo38. Además, se pueden utilizar sondas fluorescentes en lugar de biotina u otras sondas bioquímicas, como las etiquetas FLAG o Myc, para examinar la localización de proteínas16,28,39.
A pesar de la relativa facilidad de uso de la química de clics, la detección puede verse limitada por la baja solubilidad y la toxicidad potencial del uso de ácidos grasos libres de cadena larga en el cultivo celular40. En particular, a pesar de la preferencia del palmitato durante la S-acilación para la mayoría de las proteínas, muchos estudios han utilizado el estearato de 18 carbonos (ácido 17-octadeciano - 17-ODYA) en lugar de palmitato (15-HDYA) para detectar proteínas S-aciladas debido a su disponibilidad comercial y costo relativamente bajo. Sin embargo, el 17-ODYA es muy insoluble y requiere una atención especial cuando se utiliza. Además, la química del clic puede requerir una preparación y almacenamiento matizados de productos químicos. Aquí, el protocolo describe un enfoque de etiquetado, que optimiza la entrega mediante saponificación de ácidos grasos, entrega con BSA libre de ácidos grasos y suero bovino fetal (FBS) deslipidado para aumentar la solubilidad y evitar los posibles efectos tóxicos de la adición de ácidos grasos libres a las células28. Este método funciona en una variedad de tipos de células e incluso se ha utilizado en animales vivos28.
Protocolo
1. Cultivo celular
- Para complementar DMEM (Dulbecco's Modified Eagle Medium) para cultivo celular, agregue 10% de suero fetal bovino (FBS), 1x penicilina-estreptomicina, 2 mM de L-glutamina y 100 mM de piruvato de sodio (1% vol / vol).
- Placa aproximadamente 5 x 105 células HEK293T/pocillo de una placa de cultivo de tejidos de 6 pocillos y crece durante 18 h en una incubadora humidificada a 37 °C con 5% de CO2 para alcanzar una confluencia del 75%-80%.
- Privación de suero de ácidos grasos
- Para preparar los medios de etiquetado, prepare DMEM como se indica anteriormente (paso 1.1) sin un 10% de FBS. Reemplace FBS con FBS recubierto de dextrano-carbón al 5% (DCC-FBS). Precaliente a 37 °C antes de su uso.
- Lave suavemente las células con 1 solución salina tamponada con fosfato (PBS) a temperatura ambiente y reemplácelas con medios de etiquetado.
NOTA: Las células HEK293T se desprenden fácilmente de las placas de cultivo de tejidos. Tenga cuidado al lavar las células y reemplazar los medios. Minimice la agitación durante la transferencia hacia y desde la incubadora tanto como sea posible. - Devolver las células a la incubadora de 37 °C con un 5% de CO2 e incubar aproximadamente 45 min (mínimo 15 min es efectivo), hasta 60 min, antes de proceder con el etiquetado metabólico con ácidos grasos.
2. Preparación y saponificación de análogos de ácidos grasos
- Preparar las soluciones madre de ácidos grasos alquilinos con antelación mediante solubilización en DMSO para alcanzar las siguientes concentraciones y almacenar a -20 °C. Descongelar a temperatura ambiente según sea necesario. Almacene las preparaciones para su mejor rendimiento bajo N2 o Ar.
Alquil-miristato (ácido 13-tetradecinoico, 13-TDYA): 25 mM
Alquil-palmitato (ácido 15-hexadecinoico; 15-HDYA): 100 mM
Alquil-estearato (ácido 17-octadecianoico; 17-ODYA): 100 mM - Para preparar BSA libre de ácidos grasos al 20% (FAFBSA), pese 2 g de FAFBSA en un tubo desechable de 50 ml.
- Lleve hasta 10 ml con DMEM precalentado (37 °C).
- Mezclar por rotación de extremo a extremo o por vórtice, y colocar en un baño de agua de 37 °C para disolver FAFBSA por completo.
- Utilice un filtro de 0,2 μm para filtrar el medio.
- Alícuota en volúmenes de aproximadamente 1 ml y almacenar a -20 °C. Descongelar según sea necesario y calentar a 37 °C en un baño de agua antes de su uso.
- Para mejorar la solubilidad de los análogos de ácidos grasos y ácidos grasos, saponificar incubando con un exceso molar del 20% de hidróxido de potasio (KOH) en viales de reacción cónica de vidrio de 3 ml.
NOTA: Estos viales permiten que la sal permanezca soluble al tiempo que garantizan que la FAFBSA no se congele por el alto calor. El uso de vidrio también evita que los ácidos grasos se peguen al plástico.- Pipetear al menos 2 μL de análogo de ácido graso alquil directamente en la parte inferior de un vial de reacción cónica de 3 ml. Preparar 2 μL de lípido por pocillo de una placa de 6 pocillos utilizada (ver Tabla 1).
NOTA: Debido a la hidrofobicidad de los ácidos grasos, es mejor recubrir la punta de la pipeta estirando el volumen deseado varias veces antes de dispensarlo en el vial de reacción. - Diluir 1 M KOH a concentraciones iguales al 20% de exceso molar de la etiqueta de ácidos grasos alquilinos (30 mM para 13-TDYA y 120 mM para 15-HDYA y 17-ODYA).
- Pipetear una cantidad igual de KOH diluido (1 μL : 1 μL de ácido graso : KOH) cerca de la parte inferior del vial de reacción en el borde del vaso, de modo que el volumen dispensado del KOH se mezcle con el ácido graso.
- Cierre la tapa del vial y toque suavemente para mezclar las soluciones.
NOTA: La mezcla puede solidificarse rápidamente, especialmente con el aumento de las longitudes de la cadena de hidrocarburos del ácido graso. Tenga cuidado de no pipetear el sólido (es decir, no mezclar por pipeteo). - Calentar el vial de reacción a 65 °C durante aproximadamente 5 min, o tan pronto como se incorpore el ácido graso (la solución se vuelve transparente).
NOTA: Los ácidos grasos con un mayor número de carbonos y una solubilidad disminuida, como el estearato (17-ODYA), pueden requerir tiempos de incubación más largos para incorporarse completamente al KOH a 65 °C. Eleve la temperatura a 70 °C si es necesario. Un baño de agua es lo mejor. Tenga cuidado de que el líquido no se evapore demasiado. - Una vez que los ácidos grasos han entrado en solución y no quedan sólidos visibles, la pipeta precalentada 20% FAFBSA tal que la relación de volumen de ácidos grasos: KOH: FAFBSA es 1: 1: 50 para lograr una concentración final de 20x ácidos grasos alquilinos unidos a BSA.
- Mezclar mediante pipeteo hacia arriba y hacia abajo. La solución generalmente parece clara sin sólidos visibles.
NOTA: Por lo general, cualquier sólido pequeño entrará en solución después de la incubación a 37 ° C. - Incubar el ácido graso y FAFBSA durante 15 min a 37 °C.
NOTA: La etiqueta saponificada en este punto es estable más allá de los 15 min.
- Pipetear al menos 2 μL de análogo de ácido graso alquil directamente en la parte inferior de un vial de reacción cónica de 3 ml. Preparar 2 μL de lípido por pocillo de una placa de 6 pocillos utilizada (ver Tabla 1).
| Volumen total de medios (ml) | Vol. ácido graso o análogo de ácidos grasos (μL) | Vol. KOH (μL) | Vol. 20% FAFBSA (μL) | Volumen total de la etiqueta saponificada conjugada con BSA (μL) |
| 4 | 4 | 4 | 200 | 208 |
| 2 | 2 | 2 | 100 | 104 |
Tabla 1: Proporciones de etiquetado de ácidos grasos saponificados. Volúmenes experimentales de ácido graso, KOH y FAFBSA para la saponificación de ácidos grasos etiquetan de acuerdo con el volumen de medios utilizados.
- Como control, repita el paso 2.3. con ácidos grasos sin etiqueta de alquino.
- Etiquete las células con 1/20 de volumen del ácido graso 20x-BSA conjugado directamente sobre el medio de inanición (típicamente, 100 μL en 2 mL de medios/células) para lograr una concentración final de 1% de BSA y 25 μM para alquinil-miristato, o 100 μM para alquil-palmitato y alquil-estearato.
NOTA: Para minimizar la cantidad de perturbación física en las celdas adjuntas, forme una gota en la punta de la pipeta cerca de la superficie del medio en lugar de pipetear directamente en el medio. Si usa inhibidores de la acilación, agregue al menos 15 minutos antes de los ácidos grasos etiquetados. Los tiempos pueden variar dependiendo de las células o inhibidores utilizados. También se ha recomendado utilizar la saponificación para este paso28.- A modo de comparación, agregue lípidos no saponificados pipeteando 2 μL (o equivalente al volumen saponificado) de ácido graso no etiquetado directamente en el medio de inanición.
- Coloque las células de nuevo en la incubadora e incube durante 3-6 h.
NOTA: Es posible que sea necesario determinar el momento óptimo de etiquetado para cada tipo de célula o condición experimental. Los tiempos de incubación más largos pueden conducir potencialmente a la descomposición de los ácidos grasos por β-oxidación y/o incorporación a otros grupos lipídicos, como los fosfolípidos28.
- Lave suavemente las células con 1x PBS a temperatura ambiente.
- Cosechar y lisar las células con un tampón de 500 μL de ácido etilendiaminotetraacético (EDTA) libre de radioinmunoprecipitación modificada (RIPA) (0,1% SDS, 50 mM de ácido N-2-hidroxietilpiperazina-N-etanosulfónico (HEPES) pH 7,4, 150 mM NaCl, detergente no desnaturalizante al 1%, desoxicolato de sodio al 0,5%, 2 mM MgCl2 con fluoruro de fenilmetilsulfonilo (PMSF) recién añadido y 10 μg/μL de pepstatina A (o cóctel inhibidor completo de proteasa sin EDTA)) meciendo los lisados durante 15 min a 4 °C.
- Centrifugar los lisados a 16.000 x g durante 10 min a 4 °C.
- Recoja el sobrenadante en tubos de microcentrífuga de 1,7 ml y guárdelo a -20 °C hasta que esté listo para proceder con la reacción de clic.
NOTA: El protocolo se puede pausar aquí. Los lisados son estables a -20 °C durante un máximo de 1 mes. Sin embargo, se recomienda proceder con la reacción de clic de manera oportuna.
- Cuantificar las concentraciones de proteínas utilizando un ensayo apropiado según el protocolo del fabricante, como un ensayo compatible con detergente (DC).
3. Haga clic en la reacción en los lisados celulares
- Prepare los reactivos para la química del clic.
- Disolver la amina tris-(benciltriazolilmetil) (TBTA) en DMSO a 2 mM. Conservar en pequeñas alícuotas con desecante a -20 °C durante un máximo de 2-3 meses. Mejor almacenado bajo N2 o Ar.
- Disolver CuSO4 en agua ddH2O para alcanzar los 50 mM. Conservar a temperatura ambiente durante un máximo de 2 meses.
- Disolver tris-carboxietilfosfina (TCEP) en agua ddH2O a 250 mM. Almacene en la oscuridad a 4 °C y haga diluciones frescas de 50 mM justo antes de la reacción de clic.
- Preparar 2 mM de azida en DMSO. Conservar en pequeñas alícuotas con desecante a -20 °C durante un máximo de 6 meses. Mejor almacenado bajo N2 o Ar.
NOTA: Se observó que los productos con tres o más grupos de polietilenglicoles funcionaron mejor con biotina.
- Lleve 50-100 μg de lisados de proteínas en tubos de microcentrífuga de 1,7 ml al mismo volumen utilizando el mismo tampón de lisis que el anterior.
NOTA: Mantenga el volumen de reacción lo más pequeño posible (20-100 μL).- Agregue dodecil sulfato de sodio (SDS) a cada muestra para alcanzar una concentración final del 1%.
- Prepare una mezcla maestra de reactivos de clic para que las concentraciones finales después de la adición a los lisados sean: TBTA de 100 μM (stock de 2 mM), 1 mM de CuSO4, (stock de 50 mM), TCEP de 1 mM (stock de 50 mM) y sonda de azida de 100 μM (stock de 2 mM). Combinar las soluciones de stock en consecuencia (véase el cuadro 2).
NOTA: El pedido es importante. Mezclar completamente después de la adición de cada componente. - Agregue los volúmenes apropiados de la mezcla maestra en los lisados. Mezclar mediante pipeteo hacia arriba y hacia abajo.
- Incubar durante 30 min en la oscuridad en un baño de agua a 37 °C. Agitar/mezclar ocasionalmente.
| Volumen total de reacción (μL) | Vol. proteína (μL) | Vol. TBTA (2 mM) (μL) | Vol. CuSO4 (50 mM) (μL) | Vol. TCEP (50 mM) (μL) | Sonda Vol. azido (2 mM) (μL) |
| 50 | 43 | 2.5 | 1 | 1 | 2.5 |
| 100 | 86 | 5 | 2 | 2 | 5 |
Tabla 2: Haga clic en las proporciones de volumen de reactivos y proteínas. Volúmenes experimentales de los reactivos químicos click y las concentraciones de stock correspondientes, además de los volúmenes de muestras de proteínas.
4. Reacción de clic en proteínas inmunoprecipitadas
- Alternativamente, es posible realizar la reacción de clic en proteínas inmunoprecipitadas (IP) dentro o fuera de las perlas.
NOTA: Por lo general, realizar clics fuera de las cuentas conduce al menor fondo y es mejor cuando se prueban nuevas proteínas de interés.- Células transfectas para la proteína de interés, en este caso, huntingtina C-terminal miristoilada de tipo salvaje (HTT) fusionada a GFP (myr-ctHTT-GFP) y ctHTT-GFP con una sustitución G2A, utilizando coprecipitación de ADN de fosfato de calcio, como se describió anteriormente41.
- Placa 2.5 x 105 células / pozo en placas de cultivo de tejido de 6 pocillos y crecen durante la noche a ~ 70-80% de confluencia.
- Prepare la mezcla de ADN agregando 2,5 μg de ADN en 10 μL con H2O de grado molecular de 99,75 μL a un tubo de microcentrífuga de 1,7 ml. Luego, agregue 15.25 μL CaCl2 gota a gota a la mezcla de ADN.
- Agregue la mezcla de ADN/CaCl2 a un tubo separado que contenga 125 μL 2x solución salina tamponada HEPES (HBS, pH 7.0) de manera aleatoria con la mezcla.
- Agregue lentamente la mezcla de ADN / CaCl2 / HBS a las células. Después de 2-4 h, reemplace el medio e incube durante la noche. Continúe con el etiquetado de los pasos 1.3-2.8.
- Prepare volúmenes iguales de 500 μg de proteína en tampón de lisis.
- Realice IP incubando con conejo anti-GFP para ctHTT-GFP girando durante la noche a 4 ° C.
- Agregue perlas de proteína G de 15-20 μL preequilibradas con tampón de lisis a cada tubo y permita que reaccione de extremo a extremo a 4 ° C durante 3 h.
- Lave las perlas con tampón de lisis y resuspenda en tampón HEPES de 45 μL 1% SDS 50 mM.
- Calentar las perlas a 80 °C durante 15 min e invertir los tubos o agitar aproximadamente cada 5 min. Gire brevemente los tubos y vuelva a 80 °C.
- Recoja el sobrenadante que contiene las proteínas mientras las muestras aún están calientes.
NOTA: El protocolo se puede pausar aquí y las muestras inmunoprecipitadas se pueden almacenar a -20 ° C o -80 ° C, si no se utilizan para la química de clics de inmediato. - Permita que 43 μL del sobrenadante reaccionen con una mezcla maestra de 7 μL de reactivos de clic.
- Continúe con la reacción como se indica en el paso 3.2.3.
- Células transfectas para la proteína de interés, en este caso, huntingtina C-terminal miristoilada de tipo salvaje (HTT) fusionada a GFP (myr-ctHTT-GFP) y ctHTT-GFP con una sustitución G2A, utilizando coprecipitación de ADN de fosfato de calcio, como se describió anteriormente41.
5. SDS-PAGE y western blotting
- Detenga la reacción y desnaturalice agregando 1x tampón de carga de muestra que contenga 25 mM de ditiotreitol (TDT) y caliente a 95 °C durante 5 min.
NOTA: Se pueden utilizar hasta 100 mM de TDT28. No use β-mercaptoetanol con proteínas S-aciladas, ya que puede hidrolizar los enlaces tioéster y eliminar el análogo de ácidos grasos clicados. - Gire brevemente hacia abajo las muestras.
- Separe las proteínas con SDS-PAGE en un gel de poliacrilamida, por duplicado.
NOTA: Se requieren dos geles para el tratamiento alcalino con KOH para confirmar la presencia de enlaces tioéster. Si se utiliza una sonda de azida fluorescente, la acilación se puede detectar en gel o después de la transferencia utilizando el canal de excitación indicado. - Transferencia a membranas de fluoruro de polivinilideno (PVDF) (activadas en metanol y enjuagadas en ddH2O - 5 min cada una) con aparato de transferencia semiseco a 25 V, 1.0 A (constante) durante 30 min.
- Después de enjuagar brevemente las membranas con ddH2O, remoje una membrana replicada en 0.1 M KOH en metanol / agua (9: 1 v / v) y la otra en 0.1 M Tris-HCl pH 7.0 en metanol / agua (9: 1 v / v) como un control no alcalino durante 60 min a temperatura ambiente con balanceo suave.
- Enjuague las membranas brevemente en agua ddH2O, seguido de 6 veces de 5 min lavados en PBS-T (1x PBS, 0.1% Tween 20).
NOTA: Lávese bien. - Bloquee las membranas durante la noche en un tampón de bloqueo de leche descremada al 5% (1x PBS, 0.1% Tween20).
6. Realiza western blot
- Cuando esté indicado, sonda con streptavidin marcada fluorescentemente (1:5000) y control de carga, rodamina anti-GAPDH (1:5000) en tampón de bloqueo BSA al 5% (0.01% SDS, 1x PBS, 0.1% Tween20) a temperatura ambiente durante 45-60 min con balanceo suave, en la oscuridad.
- Sondee la mancha de proteína inmunoprecipitada primero con el anticuerpo primario anti-GFP en un tampón de bloqueo de leche descremada al 5%, luego con anticuerpos secundarios apropiados en BSA al 5% como en el paso 6.1.
- Lave las membranas durante 5 min en PBS-T (1x PBS, 0.1% Tween20) un total de cuatro repeticiones y enjuague con agua ddH2O antes de obtener la imagen.
Resultados
La diferencia en la eficiencia del etiquetado entre los ácidos grasos alquilinos saponificados y no saponificados (no saponificados) para la detección de química de clics se puede visualizar y comparar por la intensidad de la señal de las proteínas aciladas grasas a través de western blot (Figura 1). Se observó un efecto notable con el aumento de la longitud de las cadenas de acilo. En células marcadas con alquil-estearato (alk-stear), la saponificación del ácido graso y la entrega con BSA para el etiquetado metabólico aumentaron drásticamente la detección de la señal de proteína S-acilada a través de la química del clic y la detección por una sonda fluorescente de azido (Figura 1, derecha), lo que sugiere un aumento general en la incorporación celular de la etiqueta de ácido graso alquililo. Por el contrario, no se observaron diferencias notables en las células tratadas con el ácido graso más corto y soluble, el alquil-miristato (alk-myr; ácido 13-tetradecinoico o 13-TDYA). Las células marcadas con alquil-palmitato (Figura 1, medio) mostraron un aumento intermedio en la etiqueta en comparación con el alquil-miristato (13-TDYA), pero menor que el alquil-estearato.
Es importante destacar que el tratamiento de las membranas de PVDF con 0,1 M de KOH eliminó en gran medida las etiquetas de ácidos grasos de las células incubadas con alquil-palmitato y alquil-estearato, confirmando que la mayor parte de la señal fue a través de un enlace éster o tioéster (Figura 1, paneles medio y derecho, inferior). Como era de esperar, la incorporación de alquil-miristato fue en su mayoría resistente a los álcalis (Figura 1, izquierda, paneles inferiores), debido a la unión del miristato a las proteínas a través de un enlace amida.
La Figura 2 demuestra la versatilidad y sensibilidad de la química de clic para detectar la acilación grasa de proteínas inmunoprecipitadas. Las células HEK293T fueron transfectadas con huntingtina C-terminal miristoilada (HTT) fusionada a GFP (myr-ctHTT-GFP) y marcadas con alquil-miristato, como se describió anteriormente18. Después de la inmunoprecipitación, ctHTT-GFP se liberó de las perlas y se sometió a la química de clic junto con los lisados. No solo se detectó miristoilación de wildtype (WT) myr-ctHTT-GFP en los inmunoprecipitados, sino que se detectó fuertemente en los lisados, mientras que la mutación G2A bloqueó completamente la miristoilación del ctHTT-GFP (Figura 2).
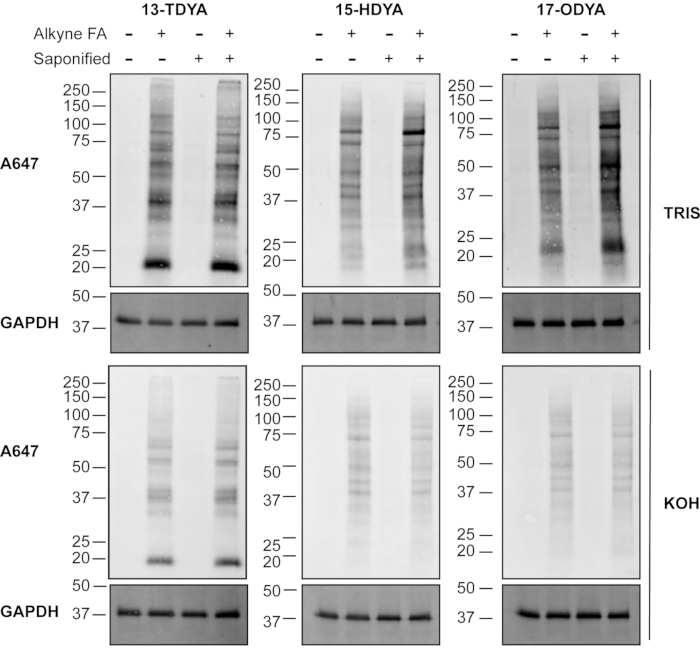
Figura 1: Detección de proteínas aciladas grasas mediante química de clic. Las células HEK293T se incubaron con los ácidos grasos indicados directamente (no savia) o después de la saponificación (savia) y la incubación con la proteína portadora BSA, como se describe en el protocolo 2.1-2.7. Los ácidos grasos alquilinos se vincularon a la azida fluorescente sometiendo 100 μg de lisados de proteínas a la química de clic, separados por SDS-PAGE y transferidos a membranas de PVDF. Después del tratamiento con 0.1 M Tris pH 7.0 o 0.1 M KOH, para revertir los enlaces tioésteres, se detectó acilación grasa utilizando una azida fluorescente. GAPDH se utilizó como control de carga; anti-GAPDH rodamina (1:5.000). Alk-myr = 13-TDYA, alk-pal = 15-HDYA, alk-ste = 17-ODYA. Haga clic aquí para ver una versión más grande de esta figura.
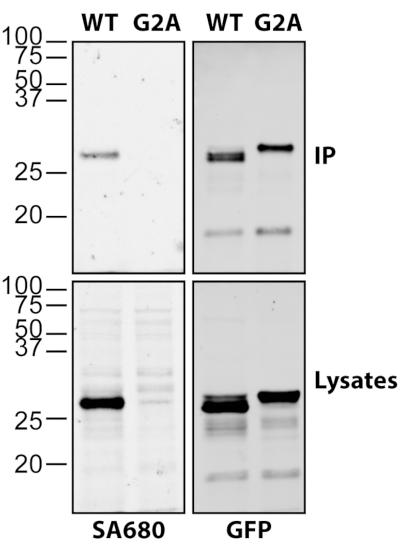
Figura 2: Detección de ctHTT-GFP N-miristoilado utilizando química de clic. Las células HEK293T fueron transfectadas con C-terminal truncada (ct) y miristoilable forma de HTT (myr-ctHTT-GFP) y marcadas con alquilino-miristato. Se incluyó una forma no miristoilable con la glicina esencial reemplazada por una alanina (G2A). Después de la cosecha y la lisis, ctHTT-GFP fue inmunoprecipitado usando anti-GFP de cabra. Los lisados se sometieron a una reacción química de clic (izquierda), así como a inmunoprecipitados después de la liberación de las perlas. La miristoilación se detectó utilizando Streptavidin Alexa 680 (SA680). GFP se detectó utilizando anti-GFP de conejo en combinación con anti-conejo Alexa 488. Haga clic aquí para ver una versión más grande de esta figura.
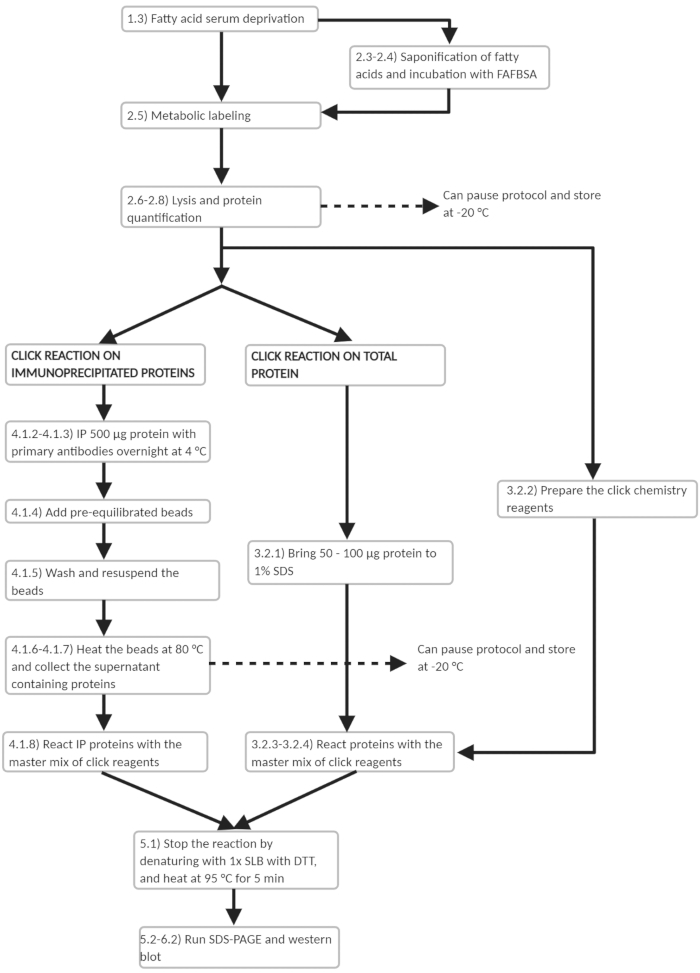
Figura 3: Esquema de flujo de trabajo del protocolo experimental. Esquema de flujo de trabajo de los principales pasos experimentales en el protocolo. Se señalan varios puntos en los que el protocolo puede ser pausado. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La adición directa de ácidos grasos a las células en cultivo puede resultar en insolubilidad, precipitación de lípidos y lipotoxicidad40. En consecuencia, la adición de ácidos grasos directamente a las células no solo puede resultar en una absorción celular deficiente y una baja disponibilidad de la etiqueta de ácidos grasos, sino también en una disminución del número de células viables para el análisis posterior, así como la activación de vías fuera del objetivo. Sin embargo, muchos protocolos de etiquetado metabólico para la detección de química de clic implican la adición directa de ácidos grasos y un gran número de estudios de palmitoil-proteoma que utilizan la detección de química de clic hasta la fecha rara vez saponifican las etiquetas de ácidos grasos o las incuban con BSA8,36. Es importante considerar el hecho de que la eficiencia y la sensibilidad de la detección química de clic de proteínas aciladas en grasa dependen de una absorción celular suficiente de los análogos de ácidos grasos. Por lo tanto, es razonable especular que muchas proteínas S-aciladas pueden haber escapado a la detección en estudios proteómicos debido a una baja disponibilidad de las etiquetas de ácidos grasos por una mala incorporación en las células, especialmente cuando se utilizó el ácido graso de cadena más larga 17-ODYA. El 17-ODYA, o alquil-estearato, ha sido la etiqueta de elección ampliamente utilizada para varios estudios debido a su disponibilidad comercial y su uso temprano8,36. Sin embargo, los resultados de este protocolo demuestran que la saponificación de 17-ODYA resulta en el mayor aumento en la detección de proteínas S-aciladas, en comparación con ácidos grasos de cadena más corta como el palmitato o el miristato. Por lo tanto, repetir estos experimentos con etiquetas saponificadas puede producir sustratos adicionales de S-acilación que pueden haber sido previamente pasados por alto. Además, mientras que la mayoría de las aciltransferasas de palmitoilo prefieren el palmitato para la S-acilación, algunas tienen preferencias por otras longitudes de ácidos grasos como el estearato15,38,44. Además, algunas proteínas o incluso sitios específicos dentro de las proteínas prefieren un ácido graso sobre otro15,45. Por lo tanto, los estudios que utilizan 17-ODYA pueden tener un sesgo hacia las proteínas S-aciladas con estearato, no palmitato, mientras que también subestiman esas proteínas debido a una menor detección.
La eficiencia mejorada del etiquetado metabólico para la química de clics se basa en la saponificación de lípidos y la incubación con pasos FAFBSA, así como el FBS deslipidado. Todos los ácidos grasos deben estar completamente saponificados en KOH sin que queden sólidos visibles antes de proceder a la incubación con FAFBSA. Este puede ser un paso difícil y el momento es crucial. Después de que los ácidos grasos saponificados hayan entrado en solución a 65 ° C, agregue BSA caliente inmediatamente, ya que el calentamiento adicional causará la evaporación del DMSO de los ácidos grasos. Además, la etiqueta saponificada comenzará a volver a solidificarse tan pronto como comience a enfriarse. Por lo tanto, la FAFBSA debe estar caliente y agregarse rápidamente después de que la sal se haya vuelto soluble. Los viales de reacción de vidrio y su forma son importantes para este paso. Permiten que el lípido saponificado sea lo suficientemente cálido como para permanecer soluble, mientras que lo suficientemente frío como para garantizar que la FAFBSA no se congele. La mezcla suficiente a través de pipeteo también es importante en este paso para garantizar una solución homogénea para el etiquetado.
Los reactivos para la química de clics deben almacenarse adecuadamente, generalmente con desecantes o bajo gas N2 o Ar a -20 ° C a -80 ° C. La falta de señal de acilación o la señal débil pueden deberse a reactivos inestables, particularmente a soluciones de stock de TBTA y azida más antiguas. Además, se debe tener cuidado con las soluciones de stock de azida fluorescente, que deben protegerse de la luz tanto como sea posible. Además, es posible que sea necesario probar variables como el método de privación de lípidos y el tiempo de etiquetado para determinar las condiciones óptimas según el tipo de célula utilizada. Por ejemplo, las células neuronales pueden necesitar tiempos de etiquetado más largos porque los cambios en los medios y la privación de lípidos son difíciles (no publicados).
El beneficio de este protocolo es más dramático cuando se usa para ácidos grasos de cadena más larga. Para cadenas más cortas, el aumento en la intensidad de la señal se vuelve menos dramático, pero aún así es probable que proteja a las células. Si bien las modificaciones sugeridas mejorarán la detección de acilación de proteínas en general, la química del clic todavía se considera un método centrado en los lípidos1 que se limita a la detección de proteínas S-aciladas dinámicamente, no de manera estable1. Otras limitaciones a considerar incluyen el requisito de privación de ácidos grasos para promover el etiquetado, y su rango relativamente limitado de tipos de células compatibles en comparación con la detección de intercambio de acil-biotina (ABE) de S-acilación16. A pesar de estas limitaciones, la detección química de clics es más rápida que la mayoría de los ensayos de intercambio de acil y es más adecuada para la detección de proteínas que no toleran los pasos repetidos de precipitación de proteínas requeridos para los ensayos de intercambio de acil. Además, este enfoque se puede combinar con el etiquetado simultáneo mediante otros ensayos de clic, como el análisis de persecución de pulsos38.
El uso de esta modificación para el etiquetado metabólico para la química del clic aumentó la detección general de proteínas aciladas, particularmente S-aciladas, con una variedad de técnicas proteómicas que se utilizan junto con la química del clic. Como se muestra, la detección fluorogénica se puede utilizar como una alternativa a la biotina (Figura 1)28. Esto es particularmente útil porque no hay proteínas endógenamente fluorescentes en los lisados celulares. Además, se pueden utilizar fluoróforos que solo se activan después de la química del clic46. El ácido graso saponificado y unido a FAFBSA para el etiquetado químico de clic puede ayudar con las dificultades para detectar proteínas de interés debido a un aumento general en la cantidad de etiqueta disponible en la célula y al limitar los efectos tóxicos de agregar ácidos grasos directamente al medio. También se puede utilizar junto con la espectrometría de masas27 para aumentar la detección de proteínas de baja abundancia, especialmente cuando se toma junto con el reciente avance utilizando algoritmos de aprendizaje automático que evitan mediciones redundantes para aumentar la sensibilidad a las proteínas de baja abundancia, a diferencia de la adquisición dependiente de datos existente que favorece la detección de las proteínas más abundantes47 . Además, la química del clic se puede combinar con el etiquetado de isótopos estables con aminoácidos en cultivo celular (SILAC) y métodos de persecución de pulsos para producir datos cuantificables sobre la proteína dinámica S-acilación27. Finalmente, el grupo Hannoush ha combinado la química del clic con el ensayo de ligadura de proximidad (PLA) para permitir la visualización unicelular y los exámenes de la distribución subcelular de las proteínas palmitoiladas43,48.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por el Consejo Nacional de Investigación de Ciencia e Ingeniería (NSERC; RGPIN-2019-04617). Lucia Liao fue financiada por The Ram and Lekha Tumkur Memorial Scholarship a través del Departamento de Biología de la Universidad de Waterloo, y la Lucy Morrison Memorial Bursary a través de IODE Ontario, además de los fondos de investigación de posgrado de la Universidad de Waterloo que comprenden la Beca de Investigación de Posgrado (50503-11072), el Premio de Posgrado en Ciencias y la Ayudantía de Enseñanza de Posgrado. Los autores desean agradecer a todos los miembros del laboratorio Martin por su apoyo en la preparación de este manuscrito, particularmente a Stephanie Ryall, Harleen Gill y Sadia Khan, quienes ayudaron inicialmente a establecer el Laboratorio Martin en preparación para estos estudios. Los autores también desean agradecer al Dr. Luc Berthiaume por el amable regalo de las construcciones ctHTT-GFP y al Dr. Shaun Sanders por su contribución crítica en la preparación del manuscrito. La figura 3 se creó con BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 13-tetradecynoic acid (alkynyl myristic acid) (25mM) | Click Chemistry Tools | 1164 | |
| 15-hexadecynoic acid (alkynyl palmitic acid) (100mM) | Click Chemistry Tools | 1165 | |
| 17-octadecynoic acid (alkynyl stearic acid) (100 mM) | Cayman Chemical Company | 90270 | |
| 30% acrylamide/bis solution 29:1 | Biorad | 1610156 | |
| 96-well plate reader | Biorad | N/A | |
| AFDye 647 azide plus | Click Chemistry Tools | 1482 | |
| Ammonium persulfate (APS) | Biorad | 1610700 | |
| Anti-GAPDH hFAB Rhodamine | Biorad | 12004167 | |
| Anti-rabbit Alexa 488 | Invitrogen | A11034 | |
| Anti-Tubulin hFAB Rhodamine | Biorad | 12004166 | |
| Biotin Azide | Click Chemistry Tools | 1265 | |
| Bis-tris, ultrapure | VWR | 715 | |
| Calcium chloride | J.T. Baker | 1332-1 | |
| Centrifuge 16,000xg, 4°C | Thermo Scientific | N/A | |
| Charcoal STRP FBS One Shot (DCC-FBS) | Life Technologies | A3382101 | |
| ChemiDoc Imager | Biorad | N/A | |
| Copper sulfate (1 mM) | VWR | BDH9312 | |
| Deoxycholic acid sodium salt monohydrate | MP Biomedicals | 102906 | |
| Detergent compatible (DC) assay | Biorad | N/A | |
| Dimethyl sulfoxide (DMSO) | VWR | 0231-500 mL | |
| DMEM, 1x | Wisent Inc | 319015CL | |
| Ethanol, anhydrous | N/A | N/A | |
| Fatty Acid Free BSA | MP Biomedicals | 219989950 | |
| Fast Blot Turbo Semi-dry transfer | Biorad | N/A | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 12483-020 | |
| FluoroTrans W PVDF (polyvinylidene fluoride) transfer membrane | Pall Life Sciences | BSP0161 | |
| HEPES (4-(2-Hydroxyethyl)-1-piperazinyl]-ethanesulfonic) acid | VWR | 5011 | |
| Humidified Incubator at 37°C and 5% CO2 | VWR | N/A | |
| Igepal CA-630 | Alfa Aesar | J61055 | |
| Image Lab Software | Biorad | N/A | |
| L-glutamine supplement solution | Wisent Inc | 609-065-EL | |
| Magnesium chloride | Fisher Scientific | BP214-500 | |
| Methanol | VWR | BDH1135 | |
| Myristic Acid (25 mM) | VWR | M0476-25G | |
| Palmitic acid (100 mM) | VWR | P0002-25G | |
| Penicillin-Streptomycin, 10x | Wisent Inc | 450201EL | |
| Pepstatin A (synthetic) | Enzo Life Sciences | ALX-260-085-M005 | |
| Phenylmethylsulfonyl fluoride | Enzo Life Sciences | ALX-270-184-G005 | |
| Phosphate buffered saline, 10x, pH 7.4 | VWR | 75801-000 | |
| Polyclonal Goat antibody to GFP (Affinity Purified) | Eusera | EU4 | |
| FluoroTrans W PVDF (polyvinylidene fluoride) transfer membrane | Pall Life Sciences | BSP0161 | |
| Potassium hydroxide | Ward's Science | 470302-100 | |
| Rabbit polyclonal antibody to GFP | Eusera | EU1 | |
| Sodium chloride | VWR | 0241-1KG | |
| Sodium Dodecyl Sulfate (SDS) | Fisher Scientific | BP166-500 | |
| Sodium pyruvate | Wisent Inc | 600-110-EL | |
| Streptavidin Alexa Fluor 680 conjugate | Thermo Fisher Scientific | S21378 | |
| Tris-(benzyltriazolylmethyl)amine (TBTA) (100 uM) | Click Chemistry Tools | 1061 | |
| Tris-(2-carboxyethyl)phosphine HCl (TCEP) (1mM) | Soltec Ventures | M115 | |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypsin/EDTA | Wisent Inc | 325-043-CL | |
| Tween 20 Reagent Grade 1L | VWR | 97062-332 | |
| WHEATON NextGen V Vials 3 mL | VWR | 89085-424 |
Referencias
- Zaballa, M. E., vander Goot, F. G. The molecular era of protein S-acylation: spotlight on structure, mechanisms, and dynamics. Critical Reviews in Biochemistry and Molecular Biology. 53 (4), 1-31 (2018).
- Martin, D. D. O., Beauchamp, E., Berthiaume, L. G. Post-translational myristoylation: Fat matters in cellular life and death. Biochimie. 93 (1), 18-31 (2011).
- Hallak, H., et al. Covalent binding of arachidonate to G protein alpha subunits of human platelets. The Journal of Biological Chemistry. 269 (7), 4713-4716 (1994).
- O'Brien, P. J., Zatz, M. Acylation of bovine rhodopsin by [3H]palmitic acid. The Journal of Biological Chemistry. 259 (8), 5054-5057 (1984).
- Liang, X., et al. Heterogeneous fatty acylation of Src family kinases with polyunsaturated fatty acids regulates raft localization and signal transduction. Journal of Biological Chemistry. 276 (33), 30987-30994 (2001).
- Thinon, E., Percher, A., Hang, H. C. Bioorthogonal chemical reporters for monitoring unsaturated fatty-acylated proteins. ChemBioChem. 17 (19), 1800-1803 (2016).
- Veit, M., Reverey, H., Schmidt, M. F. G. Cytoplasmic tail length influences fatty acid selection for acylation of viral glycoproteins. Biochemical Journal. 318 (1), 163-172 (1996).
- Sanders, S. S., et al. Curation of the mammalian palmitoylome indicates a pivotal role for palmitoylation in diseases and disorders of the nervous system and cancers. PLOS Computational Biology. 11 (8), 1004405(2015).
- Hannoush, R. N. Synthetic protein lipidation. Current Opinion in Chemical Biology. 28, 39-46 (2015).
- Martin, D. D. O., Hayden, M. R. Post-translational myristoylation at the cross roads of cell death, autophagy and neurodegeneration. Biochemical Society Transactions. 43 (2), 229-234 (2015).
- Young, F. B., Butland, S. L., Sanders, S. S., Sutton, L. M., Hayden, M. R. Putting proteins in their place: Palmitoylation in Huntington disease and other neuropsychiatric diseases. Progress in Neurobiology. 97 (2), 220-238 (2012).
- Hansen, A. L., Mukai, K., Schopfer, F. J., Taguchi, T., Holm, C. K. Sting palmitoylation as a therapeutic target. Cellular & Molecular Immunology. 16 (3), 236-241 (2019).
- Veit, M. Palmitoylation of virus proteins. Biology of the Cell. 104 (9), 493-515 (2012).
- Jiang, H., et al. Protein lipidation: Occurrence, mechanisms, biological functions, and enabling technologies. Chemical Reviews. 118 (3), 919-988 (2018).
- Greaves, J., et al. Molecular basis of fatty acid selectivity in the zDHHC family of S-acyltransferases revealed by click chemistry. Proceedings of the National Academy of Sciences of the United States of America. 114 (8), 1365-1374 (2017).
- Gao, X., Hannoush, R. N. A decade of click chemistry in protein palmitoylation: Impact on discovery and new biology. Cell Chemical Biology. 25 (3), 236-246 (2018).
- Tsutsumi, R., Fukata, Y., Fukata, M. Discovery of protein-palmitoylating enzymes. Pflügers Archiv - European Journal of Physiology. 456 (6), 1199-1206 (2008).
- Roth, A. F., Feng, Y., Chen, L., Davis, N. G. The yeast DHHC cysteine-rich domain protein Akr1p is a palmitoyl transferase. The Journal of Cell Biology. 159 (1), 23-28 (2002).
- Lobo, S., Greentree, W. K., Linder, M. E., Deschenes, R. J. Identification of a Ras Palmitoyltransferase in Saccharomyces cerevisiae. Journal of Biological Chemistry. 277 (43), 41268-41273 (2002).
- Ohno, Y., Kihara, A., Sano, T., Igarashi, Y. Intracellular localization and tissue-specific distribution of human and yeast DHHC cysteine-rich domain-containing proteins. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1761 (4), 474-483 (2006).
- Huang, K., et al. Huntingtin-interacting protein HIP14 Is a palmitoyl transferase involved in palmitoylation and trafficking of multiple neuronal proteins. Neuron. 44 (6), 977-986 (2004).
- Drisdel, R. C., Green, W. N. Labeling and quantifying sites of protein palmitoylation. BioTechniques. 36 (2), 276-285 (2004).
- Roth, A. F., Wan, J., Green, W. N., Yates, J. R., Davis, N. G. Proteomic identification of palmitoylated proteins. Methods. 40 (2), 135-142 (2006).
- Wan, J., Roth, A. F., Bailey, A. O., Davis, N. G. Palmitoylated proteins: purification and identification. Nature Protocols. 2 (7), 1573-1584 (2007).
- Martin, D. D. O., et al. Rapid detection, discovery, and identification of post-translationally myristoylated proteins during apoptosis using a bio-orthogonal azidomyristate analog. The FASEB Journal. 22 (3), 797-806 (2007).
- Kostiuk, M. A., et al. Identification of palmitoylated mitochondrial proteins using a bio-orthogonal azido-palmitate analogue. The FASEB Journal. 22 (3), 721-732 (2008).
- Martin, B. R., Wang, C., Adibekian, A., Tully, S. E., Cravatt, B. F. Global profiling of dynamic protein palmitoylation. Nature Methods. 9 (1), 84-89 (2012).
- Yap, M. C., et al. Rapid and selective detection of fatty acylated proteins using ω-alkynyl-fatty acids and click chemistry. Journal of Lipid Research. 51 (6), 1566-1580 (2010).
- Hang, H. C., Wilson, J. P., Charron, G. Bioorthogonal chemical reporters for analyzing protein lipidation and lipid trafficking. Accounts of Chemical Research. 44 (9), 699-708 (2011).
- Thinon, E., et al. Global profiling of co- and post-translationally N-myristoylated proteomes in human cells. Nature Communications. 5 (1), 4919(2014).
- Charron, G., Wilson, J., Hang, H. C. Chemical tools for understanding protein lipidation in eukaryotes. Current Opinion in Chemical Biology. 13 (4), 382-391 (2009).
- Hang, H. C., et al. Chemical probes for the rapid detection of fatty-acylated proteins in mammalian cells. Journal of the American Chemical Society. 129 (10), 2744-2745 (2007).
- Heal, W. P., et al. Site-specific N-terminal labelling of proteins in vitro and in vivo using N-myristoyl transferase and bioorthogonal ligation chemistry. Chemical Communications. 0 (4), 480-482 (2007).
- Forrester, M. T., et al. Site-specific analysis of protein S-acylation by resin-assisted capture. Journal of Lipid Research. 52 (2), 393-398 (2011).
- Brigidi, G. S., Bamji, S. X. Detection of protein palmitoylation in cultured hippocampal neurons by immunoprecipitation and acyl-biotin exchange (ABE). Journal of Visualized Experiments: JoVE. (72), e50031(2013).
- Blanc, M., et al. SwissPalm: Protein palmitoylation database. F1000Research. 4, 261(2015).
- Heal, W. P., Wickramasinghe, S. R., Leatherbarrow, R. J., Tate, E. W. N -Myristoyl transferase-mediated protein labelling in vivo. Organic & Biomolecular Chemistry. 6 (13), 2308-2315 (2008).
- Lin, D. T. S., Conibear, E. ABHD17 proteins are novel protein depalmitoylases that regulate N-Ras palmitate turnover and subcellular localization. eLife. 4, 11306(2015).
- Charron, G., et al. Robust fluorescent detection of protein fatty-acylation with chemical reporters. Journal of the American Chemical Society. 131 (13), 4967-4975 (2009).
- Alsabeeh, N., Chausse, B., Kakimoto, P. A., Kowaltowski, A. J., Shirihai, O. Cell culture models of fatty acid overload: Problems and solutions. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1863 (2), 143-151 (2018).
- Jordan, M., Schallhorn, A., Wurm, F. M. Transfecting mammalian cells: Optimization of critical parameters affecting calcium-phosphate precipitate formation. Nucleic Acids Research. 24 (4), 596-601 (1996).
- Martin, B. R., Cravatt, B. F. Large-scale profiling of protein palmitoylation in mammalian cells. Nature Methods. 6 (2), 135-138 (2009).
- Gao, X., Hannoush, R. N. Single-cell in situ imaging of palmitoylation in fatty-acylated proteins. Nature Protocols. 9 (11), 2607-2623 (2014).
- Muszbek, L., Haramura, G., Cluette-Brown, J. E., Cott, E. M. V., Laposata, M. The pool of fatty acids covalently bound to platelet proteins by thioester linkages can be altered by exogenously supplied fatty acids. Lipids. 34, 331-337 (1999).
- Brett, K., et al. Site-specific S-Acylation of influenza virus hemagglutinin. The location of the acylation site relative to the membrane border is the decisive factor for attachment of stearate. Journal of Biological Chemistry. 289 (50), 34978-34989 (2014).
- Shieh, P., et al. CalFluors: A universal motif for fluorogenic azide probes across the visible spectrum. Journal of the American Chemical Society. 137 (22), 7145-7151 (2015).
- Pelletier, A. R., et al. MealTime-MS: A machine learning-guided real-time mass spectrometry analysis for protein identification and efficient dynamic exclusion. bioRxiv. , 110726(2020).
- Gao, X., Hannoush, R. N. Method for cellular imaging of palmitoylated proteins with clickable probes and proximity ligation applied to Hedgehog, tubulin, and Ras. Journal of the American Chemical Society. 136 (12), 4544-4550 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados