Uso de la plataforma de tejido de barrera MicroSiM (μSiM) para modelar la barrera hematoencefálica
En este artículo
Resumen
Este informe proporciona protocolos para el ensamblaje, el cultivo celular y los ensayos en la plataforma μSiM para la construcción de modelos de barrera hematoencefálica.
Resumen
El microSiM (μSiM) es una plataforma de cultivo basada en membranas para modelar la barrera hematoencefálica (BBB). A diferencia de las plataformas convencionales basadas en membranas, el μSiM proporciona a los experimentadores nuevas capacidades, como la obtención de imágenes de células vivas, la señalización paracrina sin obstáculos entre las cámaras de "sangre" y "cerebro", y la capacidad de obtener imágenes directas de la inmunofluorescencia sin necesidad de extraer/volver a montar las membranas. Aquí demostramos el uso básico de la plataforma para establecer modelos de monocultivo (células endoteliales) y cocultivo (células endoteliales y pericitos) de la BHE utilizando membranas nanoporosas ultrafinas de nitruro de silicio. Demostramos compatibilidad tanto con cultivos celulares primarios como con cultivos de células madre pluripotentes inducidas humanas (hiPSC). Proporcionamos métodos para el análisis cualitativo de modelos de BBB mediante tinción de inmunofluorescencia y demostramos el uso de μSiM para la evaluación cuantitativa de la función de barrera en un ensayo de permeabilidad de moléculas pequeñas. Los métodos proporcionados deberían permitir a los usuarios establecer sus modelos de barrera en la plataforma, avanzando en el uso de la tecnología de chips de tejido para estudiar tejidos humanos.
Introducción
Los tejidos vivos están compartimentados por células especializadas que crean y mantienen barreras y regulan qué células y moléculas se transportan de un compartimento a otro. La regulación inadecuada de las funciones de barrera puede ser el origen tanto de enfermedades agudas como de enfermedades crónicas. La barrera hematoencefálica (BHE) es la barrera tisular más restrictivadel cuerpo humano. La disfunción de la barrera hematoencefálica subyace a una amplia gama de enfermedades del sistema nervioso central (SNC), como la enfermedad de Alzheimer2, la enfermedad de Parkinson3,4 y la esclerosis múltiple 5,6. La lesión de la barrera hematoencefálica también está relacionada con el deterioro cognitivo a largo plazo como resultado de trastornos agudos, como la sepsis7, la COVID-198 y el delirio postoperatorio9. El desarrollo de fármacos con el potencial de tratar trastornos cerebrales ha sido frustrantemente difícil debido al desafío de romper intencionalmente la barrera hematoencefálica para entregar moléculas bioactivas a objetivos enel cerebro. Por estas razones, los métodos para estudiar la función de la BHE in vitro son de suma importancia para la comprensión y el tratamiento de las enfermedades del SNC.
Los métodos básicos para medir la función barrera in vitro implican el establecimiento de una monocapa o cocultivo sobre una membrana semipermeable y la medición de la resistencia impartida por las células a la difusión de moléculas pequeñas o a las pequeñas corrientes eléctricas11,12,13,14. Si bien la aparición de los sistemas microfisiológicos (MPS) ha producido una gran cantidad de opciones para modelar la BHE en 3D15,16, la diversidad de geometrías de los sistemas dificulta la comparación de las mediciones de permeabilidad entre MPS o con los valores establecidos en la literatura. El establecimiento de valores basales confiables es particularmente importante en la investigación de BHE donde, debido a la extensa regulación de barrera por parte de las células endoteliales vasculares cerebrales, los valores de permeabilidad in vitro son altamente examinados 12,17,18. Por estas razones, las mediciones de permeabilidad a través de monocapas establecidas en membranas 2D seguirán siendo un elemento básico en los estudios de BBB en los próximos años. Esto es válido para otras barreras tisulares, incluidas las barreras epiteliales, donde los valores absolutos de permeabilidad basal se utilizan para validar y comparar modelos in vitro 19,20,21.
Con el objetivo de establecer una nueva herramienta valiosa para la comunidad de investigación de BBB, hemos introducido 22 yavanzado 23,24,25,26 el microdispositivoque presenta una plataforma de embrano de silicio (μSiM) para su uso en el modelado de tejido de barrera durante los últimos 5 años. La característica habilitante de la plataforma es una membrana ultrafina (<100 nm de espesor) con cientos de millones de nanoporos 27,28 o una mezcla de nanoporos y microporos29. Los chips de membrana independientes se producen en un "chip" de silicio de 300 μm que estabiliza las estructuras ultrafinas30 y permite manipularlas con pinzas para el montaje del dispositivo. Debido a su naturaleza ultrafina, las membranas tienen una permeabilidad que es dos órdenes de magnitud superior a la de las membranas convencionales grabadas con trazas utilizadas en dispositivos comerciales de cultivo de membranas31,32. En la práctica, esto significa que el obstáculo de la membrana para la difusión de moléculas más pequeñas que los nanoporos (<60 nm) es insignificante33. Por lo tanto, para las barreras celulares, solo las células y las matrices que depositan determinarán la velocidad de transporte de moléculas pequeñas desde los compartimentos apicales a los basales que están separados por la membrana34. El diseño del dispositivo y la naturaleza ultrafina de las membranas también proporcionan muchas ventajas para la microscopía óptica. Estos incluyen 1) la capacidad de seguir cultivos vivos utilizando contraste de fase o imágenes de campo claro, 2) la capacidad de teñir con fluorescencia e imágenes in situ sin la necesidad de extraer y transferir la membrana a un cubreobjetos, y 3) el hecho de que las membranas son más delgadas que las "rebanadas" confocales, de modo que los cocultivos directos tienen un espaciado más natural entre los tipos de células que el que se puede lograr con membranas grabadas con pistas de 6-10 μm de espesor.
Más recientemente, hemos avanzado la plataforma a un formato modular para facilitar el montaje rápido34 y la personalización35,36. Aprovechamos el formato modular para distribuir los componentes de los dispositivos entre nuestros laboratorios de bioingeniería y los laboratorios colaboradores de barrera cerebral. A continuación, desarrollamos conjuntamente protocolos para el ensamblaje de dispositivos, el monocultivo y el cocultivo, la tinción inmunofluorescente y la permeabilidad de moléculas pequeñas, y demostramos que estos métodos eran reproducibles entre laboratorios. Utilizando estos protocolos, también demostramos que la plataforma modular es compatible con una BHE validada desarrollada utilizando el método de cultivo endotelial extendido (EECM) para crear células endoteliales cerebrales de tipo microvascular (BMEC) a partir de células madre pluripotentes inducidas humanas (hiPSCs)37. El propósito del presente informe es revisar estos métodos con mayor detalle y, con la ayuda del video que lo acompaña, facilitar una adopción más amplia de la plataforma en la comunidad BBB.
Protocolo
1. Ensamblaje del dispositivo μSiM
NOTA: Este método describe el ensamblaje de los dispositivos. El chip de membrana tiene un lado de trinchera y un lado plano, que se pueden ensamblar de zanja hacia arriba o hacia abajo. Los dispositivos de excavación de zanjas se utilizan con mayor frecuencia para el cultivo celular.
- En un ambiente estéril (es decir, una campana de bioseguridad), prepare todos los materiales para el ensamblaje, incluidos los accesorios de ensamblaje, los componentes, las virutas de membrana y las pinzas.
- Coloque el chip de membrana en el centro del accesorio A1 con unas pinzas de viruta. La superficie plana de la viruta mira hacia abajo y el área de la zanja mira hacia arriba para los dispositivos de zanja hacia abajo, y viceversa para los dispositivos de zanja hacia arriba.
NOTA: Los siguientes pasos de montaje se ilustran utilizando el dispositivo de excavación de zanjas como ejemplo, que permite un área de crecimiento plana en la cámara superior. - Une el componente 1 al chip. Primero, retire las capas protectoras azules en ambos lados del componente 1 con pinzas rectas y colóquelo en el accesorio A1, con la cámara superior hacia abajo. Presione suavemente el componente 1 hacia abajo hasta que el adhesivo sensible a la presión (PSA) toque la viruta.
- Coloque el accesorio A2 en el accesorio A1 y aplique una presión firme en diferentes esquinas para garantizar un ajuste perfecto de la viruta y el componente.
NOTA: Asegúrese de no quitar la capa de PSA. Es una capa transparente y más rígida en comparación con las capas protectoras azules. - Une el componente 2 al componente 1 con el chip. Primero, prepare el componente 2 agarrando una esquina del componente 2 con pinzas rectas y despegándola de la hoja. Luego, tome la región del "triángulo" que no es PSA del componente 2 y juntos eliminen la capa protectora gruesa y transparente y la capa azul del componente 2, exponiendo la superficie del PSA. Coloque el componente 2 en el dispositivo B1, con el lado PSA hacia arriba.
- Coloque el componente 1 con el chip de membrana en el accesorio B1, con la cámara superior hacia arriba.
- Coloque el accesorio B2 en el componente 1 y aplique una presión firme en diferentes esquinas del accesorio B2.
- Saque el dispositivo ensamblado del dispositivo y use pinzas rectas para presionar las burbujas de aire en la parte inferior del dispositivo y selle los bordes del canal, evitando el contacto con la región de la membrana. Antes de usarlos para el cultivo celular, esterilize los dispositivos recién ensamblados con rayos ultravioleta (UV) durante 20 minutos.
2. Cultivo celular
NOTA: Este método describe los protocolos para cultivos primarios y derivados de hiPSC en la plataforma. Los métodos describen el monocultivo de células endoteliales en la cámara superior del dispositivo y el cocultivo de pericitos y células endoteliales con pericitos en la cámara inferior y células endoteliales en la cámara superior de los dispositivos ensamblados en zanjas. Para conocer las dimensiones y los volúmenes de la cámara, consulte la Tabla 1. Estos son los formatos más comunes; Sin embargo, se pueden utilizar otros diseños de cultivo celular en función de las necesidades del usuario.
- Preparación de la cámara de cultivo celular
- Ensamble los dispositivos según el protocolo detallado en la sección 1.
- Coloque los dispositivos en abrazaderas de manguera estériles. Antes del cultivo celular, esterilice las pinzas sumergiéndolas en etanol durante ≥20 min. Reesterilizar después de cada experimento para su reutilización.
- Cultive los dispositivos en una placa de Petri grande y estéril. Para mayor humedad, agregue una placa de Petri pequeña o una tapa de tubo cónico de 50 ml llena de agua estéril.
- Lave la cámara superior de los dispositivos dos veces con 100 μL de agua estéril. Para el cultivo celular en la cámara inferior, lavar la cámara inferior con 20 μl de agua estéril.
- Monocultivo de la línea celular hCMEC/D3 (BBB)
- Preparar la cámara de cultivo celular de acuerdo con la sección 2.1.
- Cubrir las cámaras superiores con 25 μg/cm2 de colágeno I y 5 μg/cm2 de fibronectina humana mezclada con solución salina tamponada con fosfato (PBS). Déjalo reposar durante 1-2 h a 37 °C o toda la noche a 4 °C.
- Retire la solución de recubrimiento y agregue 100 μL de medio endotelial precalentado con factor de crecimiento agotado (medio de ensayo) a la cámara superior y 20 μL a la cámara inferior. Para preparar el medio de ensayo, mezcle 100 ml de medio basal endotelial + 400 μl de factor de crecimiento fibroblástico humano + 40 μl de hidrocortisona + 100 μl de sulfato de gentamicina + 2 ml de suero fetal bovino.
- Paso de células hCMEC/D3 de acuerdo con el protocolo del fabricante; tripsinar las células en una incubadora a 37 °C durante 3-5 min y luego detener la tripsinización mediante la adición de medio endotelial precalentado. Transfiera la suspensión celular a un tubo de centrífuga y centrifugue a 200 × g durante 5 min a temperatura ambiente. Vuelva a suspender el gránulo celular en medios de ensayo y siembre las células en las cámaras superiores a una densidad de 40.000-60.000 células/cm2. Incubar los dispositivos a 37 °C con dióxido de carbono (CO 2) al 5% durante2-4 h para facilitar la adhesión celular. Por ejemplo, para lograr 40.000 células/cm2 en el chip de 0,37cm2 , añada 100 μL de una solución celular con una concentración de 150.000 células/ml a la cámara superior.
NOTA: Cultivamos y pasamos hCMEC/D3 de acuerdo con Hudecz et al.38, utilizando una formulación modificada de medio de crecimiento endotelial-2 (EGM-2) para el mantenimiento celular y un "medio de ensayo" reducido en factor de crecimiento después del subcultivo para los ensayos. Otras formulaciones de medios deben ser compatibles con los dispositivos, aunque recomendamos las formulaciones de medios de Hudecz et al.38 si los usuarios experimentan problemas con la supervivencia de hCMEC/D3. - Después de 2-4 h para la adhesión celular, intercambie con medio de ensayo fresco en ambas cámaras para eliminar las células muertas o no adheridas.
- Mantener los dispositivos a 37 °C con 5% de CO 2, intercambiando el medio de ensayo en ambas cámaras cada2-3 días hasta la experimentación. Por lo general, los ensayos se realizan después de 2 semanas de cultivo.
- Monocultivo de células similares a EECM-BMEC derivadas de hiPSC
- Preparar la cámara de cultivo celular de acuerdo con la sección 2.1.
- Prepare colágeno IV a partir de una solución de placenta humana agregando 5 ml de 0,5 mg/ml de ácido acético a 5 mg de colágeno IV para crear una solución de 1 mg/ml. Deje reposar la solución durante ≥4 h a 4 °C para que se reconstituya por completo. La solución es estable a 4 °C durante 2 semanas.
- Cubra las cámaras superiores con 100 μL de una proporción de 4:1:5 de colágeno IV, fibronectina bovina y agua estéril. Cubrir a 37 °C durante 2-4 h.
- Retire la solución de recubrimiento y agregue 100 μL de hECSR a temperatura ambiente a la cámara superior y 20 μL a la cámara inferior.
- Células tipo EECM-BMEC de paso según Nishihara et al.37; añadir una mezcla de enzimas de desprendimiento celular a las células y transferir a una incubadora a 37 °C durante 5-8 min. Pipetear la solución celular para singularizar y agregar a 4 veces el volumen del medio endotelial en un tubo de centrífuga. Centrifugar a 200 × g durante 5 min a temperatura ambiente; resuspender las células en hECSR y sembrar en las cámaras superiores a una densidad de 40.000 células/cm2. Incubar los dispositivos a 37 °C con 5% de CO 2 durante2-4 h para facilitar la adhesión celular. Por ejemplo, para lograr 40.000 células/cm2, agregue 100 μL de una solución celular a 150.000 células/mL.
- Después de 2-4 h para la adhesión celular, intercambiar con hECSR fresco en ambas cámaras para eliminar las células muertas o no adheridas.
- Mantener los dispositivos a 37 °C con 5% de CO 2, intercambiando hECSR en ambas cámaras cada1-2 días hasta la experimentación. Por lo general, los ensayos se realizan en el día 6 del cultivo.
- Cocultivo de hCMEC/D3 y pericito vascular primario del cerebro humano (VHBB)
- Antes de ensamblar el dispositivo, recubra las virutas de membrana con 2 μg/cm2 de poli-L-lisina (PLL) mezclada en PBS. Aplique 50-80 μL de PLL en una gota solo en el lado que quedará hacia abajo en el conjunto final del dispositivo. Complete el proceso de recubrimiento en 1-2 h a 37 °C o durante la noche a 4 °C.
- Retire la solución de recubrimiento. Lave las virutas de membrana con agua ultrapura estéril y déjelas secar.
- Ensamble los dispositivos según el protocolo detallado en la sección 1 anterior, con el lado recubierto de PLL hacia abajo, y prepare la cámara de cultivo celular de acuerdo con la sección 2.1.
- Recubrir las cámaras superiores de acuerdo con la sección 2.2.2.
- Añadir 50 μL de medio pericitario precalentado a las cámaras superiores y añadir 20 μL a los canales inferiores.
- Pase los HBVP de acuerdo con el protocolo del fabricante; tripsinar las células en una incubadora a 37 °C durante 3-5 min, luego detener la tripsinización mediante la adición de medio pericitario precalentado. Transfiera la suspensión de la celda a un tubo de centrífuga y centrifugue a 200 × g durante 5 min a temperatura ambiente. Resuspender el gránulo celular en medio pericitario y sembrar las células en las cámaras inferiores a una densidad de 14.000-25.000 células/cm2. Invierta los dispositivos, pero mantenga una interfaz de aire con las cámaras superiores para facilitar el intercambio de gases.
NOTA: La interfaz de aire requerida durante la inversión se puede lograr volteando los dispositivos después de colocarlos dentro de las abrazaderas de manguera y empujando hacia abajo en todas las esquinas antes de voltear, o colocando los dispositivos boca abajo en tiras paralelas de acrílico o silicona espaciadas lo suficiente como para mantener las cámaras superiores sin obstrucciones. Es posible que sea necesario optimizar la densidad de siembra para cada usuario. Para lograr 14.000 células/cm2, añadir 20 μL de una suspensión celular a ~590.000 células/mL. Tenga en cuenta que se pipetean 20 μL en la cámara inferior para evitar burbujas, pero la densidad se calcula utilizando el volumen de la cámara inferior de 10 μL. - Incubar las células a 37 °C con 5% de CO 2 durante2-4 h en posición invertida para facilitar la adhesión celular.
- Después de 2-4 h para la adhesión celular, voltee los dispositivos en posición vertical e cámbielos con medio de pericito fresco en ambas cámaras para eliminar las células muertas o no adheridas.
- Después de la siembra de pericitos, siembre hCMEC/D3s en la cámara superior, siguiendo los pasos 2.2.4-2.2.5. Cambie ambas cámaras al medio de ensayo.
- Mantener los dispositivos a 37 °C con 5% de CO 2, intercambiando el medio de ensayo en ambas cámaras cada1-2 días hasta la experimentación. El cocultivo de células primarias generalmente se mantiene durante 6-8 días antes de los ensayos.
NOTA: Si los monocultivos de HBVP se comparan con monocultivos de hCMEC/D3 o cocultivos de hCMEC/D3 y HBVP, se intercambiará el medio de pericitos con el medio de ensayo 2-3 días después de sembrar los HBVP.
- Cocultivo de células similares a EECM-BMEC derivadas de hiPSC y células similares a pericitos cerebrales (BPLC)
- Preparar la cámara de cultivo celular de acuerdo con la sección 2.1 y recubrir las cámaras superiores de acuerdo con los pasos 2.3.2-2.3.3.
- Retire la solución de recubrimiento y agregue 50 μL de Essential 6 Medium + 10% Suero Fetal Bovino a temperatura ambiente (E6 + 10% FBS) a la cámara superior.
- Pasaje de los BPLCs según Gastfriend et al.39; agregue una mezcla de enzimas de desprendimiento celular a las células y transfiéralas a una incubadora a 37 °C durante 5-15 minutos, hasta que ~ 90% de las células estén redondeadas. Pipetear la solución celular para singularizar y agregar 4 veces el volumen de DMEM/F12 en un tubo de centrífuga de 50 ml, utilizando un filtro celular de 40 μm para filtrar y singularizar completamente las células. Transfiera a un tubo de centrífuga de 15 ml, centrifugue a 200 × g durante 5 min a temperatura ambiente, vuelva a suspender el gránulo celular en E6 + 10% FBS y siembre las células en las cámaras inferiores a una densidad de 14,000-25,000 células/cm2. Invierta los dispositivos, pero mantenga una interfaz de aire con la cámara superior para facilitar el intercambio de gases.
NOTA: La interfaz de aire requerida durante la inversión se puede lograr volteando los dispositivos después de colocarlos dentro de las abrazaderas de manguera y empujando hacia abajo en todas las esquinas antes de voltear, o colocando los dispositivos boca abajo en tiras paralelas de acrílico o silicona espaciadas lo suficiente como para mantener las cámaras superiores sin obstrucciones. Es posible que sea necesario optimizar la densidad de siembra para cada usuario. Para lograr 14.000 células/cm2, añadir 20 μL de una suspensión celular a ~590.000 células/mL. Tenga en cuenta que se pipetean 20 μL en la cámara inferior para evitar burbujas, pero la densidad se calcula utilizando el volumen de la cámara inferior de 10 μL. - Incubar las células a 37 °C con 5% de CO 2 durante2-4 h en posición invertida para facilitar la adhesión celular.
- Después de 2-4 h para la adhesión celular, voltee los dispositivos en posición vertical e intercambie con E6 fresco + 10% FBS en ambas cámaras para eliminar las células muertas o no adheridas.
- Un día después de la siembra del pericito, siembre células similares a EECM-BMEC en la cámara superior, siguiendo los pasos 2.3.5-2.3.6. Cambie ambas cámaras a hECSR.
- Mantener los dispositivos a 37 °C con 5% de CO 2, intercambiando el medio de ensayo en ambas cámaras cada1-2 días hasta la experimentación. El cocultivo derivado de hiPSC generalmente se mantiene durante 7 días para las BPLC y 6 días para las células similares a EECM-BMEC antes de los ensayos.
NOTA: Si los monocultivos de BPLC se comparan con monocultivos de EECM-BMEC o cocultivos de EECM-BMEC y BPLC, intercambie E6 + 10% de FBS con hECSR 1 día después de sembrar los BPLC.
3. Inmunocitoquímica
NOTA: Este método describe un protocolo para la tinción inmunocitoquímica y la obtención de imágenes de células cultivadas en la parte superior y/o inferior de la membrana. El objetivo de este experimento es determinar la presencia y localización de proteínas clave que deben encontrarse en la BHE, como las proteínas adherentes y de unión estrecha, y las proteínas de identidad celular. Los métodos de tinción alternativos y vivos también son compatibles con la plataforma.
- Fijación y tinción en los dispositivos
- Coloque los anticuerpos primarios en hielo para descongelarlos.
- Prepare una solución de paraformaldehído (PFA) al 4% a temperatura ambiente (por ejemplo, diluya PFA al 16% en 3 veces su volumen de PBS) o enfríe metanol al 100% a -20 °C.
- Cree una solución de bloqueo adecuada de acuerdo con la Tabla 2. Almacenar en hielo.
NOTA: Puede ser necesario vórtice la solución para disolver completamente Triton X-100. - Fije las células pipeteando 20 μL de fijador (por ejemplo, PFA o metanol) en la cámara inferior y 50 μL en la cámara superior. Incubar los dispositivos durante 10 min (PFA) o 2 min (metanol) a temperatura ambiente.
- Lavar durante 3 x 5 minutos pipeteando 20 μL de PBS a través de la cámara inferior y 100 μL en la cámara superior.
- Bloquee durante 30 minutos a temperatura ambiente añadiendo 20 μL de la solución de bloqueo a la cámara inferior y 50 μL de solución de bloqueo en la cámara superior. Compruebe si hay burbujas en la cámara inferior.
- Prepare la solución primaria de anticuerpos diluyendo los anticuerpos en la solución de bloqueo de acuerdo con la Tabla 2. Almacenar en hielo.
- Manchar con los anticuerpos primarios añadiendo 20 μL de la solución de anticuerpos primarios a la cámara inferior y sustituyendo el volumen de la cámara superior por 50 μL de la solución de anticuerpos primarios. Compruebe si hay burbujas en la cámara inferior. Incubar durante 1 h a temperatura ambiente o toda la noche a 4 °C.
- Lavar durante 3 x 5 minutos pipeteando 20 μL de PBS a través de la cámara inferior y 100 μL en la cámara superior.
- Prepare la solución de anticuerpos secundarios diluyendo los anticuerpos en la solución de bloqueo de acuerdo con la Tabla 2. Almacenar sobre hielo protegido de la luz.
- Manchar con anticuerpos secundarios añadiendo 20 μL de solución de anticuerpos secundarios a la cámara inferior y sustituyendo el volumen de la cámara superior por 50 μL de la solución de anticuerpos secundarios. Compruebe si hay burbujas en la cámara inferior. Incubar durante 1 h a temperatura ambiente protegido de la luz.
- Lavar durante 3 x 5 minutos pipeteando 20 μL de PBS a través de la cámara inferior y 100 μL en la cámara superior.
- Haz una solución para la tinción nuclear. Diluir Hoechst 1:10.000 en PBS. Agregue 20 μL de la solución de tinción nuclear a la cámara inferior y reemplace el volumen de la cámara superior con 50 μL de la solución de tinción nuclear. Compruebe si hay burbujas en la cámara inferior. Incubar durante 3 minutos a temperatura ambiente protegido de la luz.
- Elimine la mancha añadiendo 20 μL de PBS a la cámara inferior y sustituyendo el volumen de la cámara superior por 100 μL de PBS. Tome imágenes de los dispositivos inmediatamente o guárdelos a 4 °C con la placa de Petri envuelta en parafilm y protegida de la luz hasta que esté lista para la obtención de imágenes.
- Imágenes confocales
NOTA: En esta sección se describen las imágenes de los dispositivos utilizando un microscopio confocal de disco giratorio invertido con un objetivo de 40x a larga distancia de trabajo (LWD) (agua, WD 590-610, apertura numérica 1,15) como ejemplo. Para conocer las distancias de trabajo y la compatibilidad de lentes, consulte el material complementario en McCloskey et al.34. También se toman imágenes de toda el área de la membrana con un objetivo de 10x para garantizar que las imágenes de 40x sean representativas de todo el campo. Por lo general, se toman en campo amplio.- Encienda el microscopio y abra el software de imágenes.
- Ajuste los canales de acuerdo con las propiedades del anticuerpo secundario y la tinción nuclear, utilizando el modo de imagen confocal. Optimice la potencia del láser y el tiempo de exposición para garantizar que la señal esté por encima del fondo y reduzca los artefactos de imagen.
- Para la tinción nuclear de Hoechst, utilice excitación 405, paso de banda (BP) de emisión 450/50, tiempo de exposición de 500 ms, 50 % de potencia láser. Para las etiquetas que utilizan un anticuerpo secundario conjugado con Alexa Fluor (AF) 488, utilice excitación 488, emisión 525/50BP, tiempo de exposición de 500 ms y 50 % de potencia láser. Para las etiquetas que utilizan un anticuerpo secundario conjugado con AF568, utilice la excitación 561, la emisión 600/50BP, el tiempo de exposición de 500 ms y la potencia del láser del 100%.
- Coloque el dispositivo en el soporte del dispositivo de portaobjetos del microscopio, con la cámara superior hacia arriba y colóquelo en el microscopio con un soporte para portaobjetos para microscopio. Encienda Live y seleccione el canal para la mancha nuclear. Encuentre la membrana usando un objetivo bajo, asegurándose de que la región transparente de la membrana de nitruro de silicio esté centrada, ya que la luz no se transmitirá a través de la región azul de silicona sólida. Una vez que el dispositivo esté correctamente centrado y se encuentre la capa celular, cambie al objetivo 40x, humedezca el objetivo y concéntrese en la región de la membrana utilizando la tinción nuclear como guía.
- Active la creación de imágenes de pila z y establezca el modo de escaneo en Inicio/Fin. Establezca el tamaño o el recuento de pasos. Usando la perilla de ajuste grueso en el microscopio, ajuste el inicio de la exploración a la parte superior de la capa de células endoteliales, usando la tinción nuclear como guía, y el final de la exploración en la parte inferior de la capa de pericitos, usando la tinción nuclear como guía. Verifique todos los canales para asegurarse de que todo se capturará en el campo de imágenes.
NOTA: Por lo general, usamos el paso automático, que es de ~ 0,2 μm en cortes. - Establezca el nombre de la imagen y presione Adquirir para iniciar la obtención de imágenes. Repita en diferentes regiones según sea necesario.
- Procese las imágenes confocales con ImageJ40 o Imaris.
- Para procesar en Imaris, arrastre el archivo de imagen al programa para abrirlo. Seleccione Sección en la barra de menú superior para ver una imagen 2D del plano x-y con las vistas correspondientes de los planos x-z e y-z. Seleccione Vista 3D en la barra de menú superior para ver una imagen 3D. Haz clic en la imagen y arrástrala para girarla. Seleccione Instantánea en la barra de menú superior para tomar una imagen.
4. Ensayo de muestreo de permeabilidad de moléculas pequeñas
NOTA: En esta sección se describe una metodología para las mediciones cuantitativas de las propiedades de barrera de los cultivos celulares. El objetivo de este experimento es detectar la concentración de una pequeña molécula fluorescente que atraviesa las capas celulares y entra en la cámara inferior de la plataforma. Estos datos se utilizan para calcular la permeabilidad celular.
- Técnica de muestreo
- Ensamble los dispositivos según el protocolo detallado en la sección 1 y cultive las líneas celulares deseadas como se describe en la sección 2. Incluya un dispositivo adicional que sirva como dispositivo de control recubierto sin celdas para medir la permeabilidad del sistema.
NOTA: Se recomienda un mínimo de tres réplicas técnicas por condición; sin embargo, solo se requiere una réplica del control recubierto. - Antes de comenzar el ensayo de muestreo, reemplace el medio en la cámara inferior con medio nuevo. Comprobar la confluencia de la monocapa endotelial en cada dispositivo bajo el microscopio. Tenga en cuenta cualquier espacio en las monocapas celulares, ya que esto afectará la difusión del tinte en la cámara inferior.
NOTA: Un cultivo endotelial sano debe ser 100% confluente. - Prepare la solución fluorescente de molécula pequeña (por ejemplo, 150 μg/mL de amarillo de Lucifer, 457 Da) en medio de cultivo celular. Preparar el exceso de volumen de la solución fluorescente de molécula pequeña que se utilizará para la preparación de las soluciones patrón que sirvan de referencia para calcular la concentración de la molécula pequeña fluorescente muestreada del canal inferior.
NOTA: Recomendamos la preparación de 400 μL de solución sobrante para ser utilizada como solución patrón con la mayor concentración de la pequeña molécula fluorescente. - Reemplace el medio en el pocillo superior con 100 μL de la solución fluorescente de molécula pequeña.
NOTA: Recomendamos usar un bolígrafo hidrofóbico para dibujar círculos alrededor de los puertos de muestreo y esperar hasta que la tinta hidrófoba se seque por completo antes de agregar una solución de tinte fluorescente. Esto evita la propagación del medio desde el canal inferior alrededor del puerto de muestreo en el paso 4.1.7. Recomendamos escalonar la adición de la solución fluorescente de molécula pequeña en el pozo superior, esperar 2 minutos antes de agregar la solución fluorescente al siguiente dispositivo, o trabajar en grupos de 3 (agregar la solución en tres dispositivos al mismo tiempo y esperar 5 minutos para agregar los siguientes tres dispositivos). - Incubar los dispositivos a 37 °C, 5% de CO2 durante 1 h.
- Durante una incubación de 1 h de duración en el paso anterior, prepare las soluciones patrón realizando diluciones en serie de 2 veces a partir de la solución fluorescente de molécula pequeña preparada en el paso 4.1.3. Pipetear 50 μL de cada solución en la placa negra de fondo plano de 96 pocillos por triplicado. Utilice un medio de cultivo de células en blanco como solución estándar de referencia.
NOTA: Para preparar soluciones estándar, recomendamos 11 diluciones seriadas a un volumen final de 200 μL y el uso de medio de cultivo celular como blanco para medir la intensidad fluorescente basal.- Transferir 200 μl de 400 μl de la solución de molécula pequeña fluorescente sobrante preparada en el paso 4.1.3 a un tubo que contenga 200 μl de medio, mezclar bien y transferir 200 μl de esta solución al siguiente tubo que contenga 200 μl de medio. Repita las diluciones 1:2 hasta que haya un total de 10 tubos. Pipetear 50 μL de la solución estándar más concentrada en la columna 1 por triplicado en la placa de 96 pocillos (B1, C1, D1), la2ª solución más concentrada en la columna 2 (B2, C2, D2), y así sucesivamente. Para la12ª columna de la placa, pipetear 50 μL de medio blanco por triplicado (B12, C12, D12).
- Realice los siguientes pasos para tomar muestras de la solución de molécula pequeña fluorescente del canal inferior.
- Retire la solución fluorescente de molécula pequeña del pocillo para detener el proceso de difusión.
- Coloque una punta que contenga 50 μL de medio en el puerto superior para que sirva como depósito insertando la punta con 50 μL en el puerto, levantando el dispositivo y expulsando suavemente la punta mientras se sujeta a la parte superior para estabilizarla. Deje el dispositivo. Asegúrese de que no haya burbujas en la punta de la pipeta ni aire en la punta de la pipeta para evitar agregar burbujas en la cámara inferior durante el muestreo.
- Agregue 50 μL de medio en el pocillo superior para evitar la interrupción de la monocapa celular durante el muestreo.
- Para tomar muestras de la solución desde el canal inferior, empuje una pipeta con una punta de pipeta vacía hasta su primera resistencia, inserte la punta en el puerto de muestreo y pipetee invertido 50 μL de la solución del canal inferior. Transfiera directamente a la placa negra de fondo plano de 96 pocillos que contiene las soluciones estándar.
NOTA: Recomendamos comprobar la monocapa celular bajo el microscopio inmediatamente después de la toma de muestras. En ocasiones, la extracción de medios del canal inferior puede provocar la interrupción de la capa celular en el pocillo superior, lo que puede causar mediciones de permeabilidad inconsistentes. Trabajar rápidamente a lo largo de los pasos de la versión 4.1.7 ayudará a evitar esto.
- Mida la intensidad de fluorescencia en un lector de microplacas utilizando los parámetros adecuados de excitación y longitud de onda de emisión para la pequeña molécula fluorescente utilizada. Para Lucifer Yellow, use una excitación de 428 nm y una emisión de 536 nm, con una ganancia óptima. La fluorescencia se mide desde la parte superior de la placa. Agregue la placa al lector de placas, resalte los pocillos con muestra (incluida la curva estándar) y seleccione Iniciar para leer la placa.
- Ensamble los dispositivos según el protocolo detallado en la sección 1 y cultive las líneas celulares deseadas como se describe en la sección 2. Incluya un dispositivo adicional que sirva como dispositivo de control recubierto sin celdas para medir la permeabilidad del sistema.
- Cálculo del valor de permeabilidad (véase el Archivo Suplementario 1 para la plantilla)
- Reste el valor promedio de intensidad de fluorescencia del medio en blanco de todos los valores de intensidad de fluorescencia medidos.
- Utilice la ecuación (1) para calcular la permeabilidad del sistema Ps:
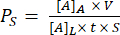 (1)
(1)
Donde [A]A es la concentración de la pequeña molécula fluorescente recogida del canal inferior, V es el volumen muestreado y añadido a la placa (0,050 mL), [A]L es la concentración de la pequeña molécula fluorescente añadida al pocillo superior (por ejemplo, 0,15 mg/mL), t es el tiempo de incubación (en s o min dependiendo de las unidades deseadas), y S es el área superficial de la membrana (0,014 cm2).- Calcule [A]A utilizando la ecuación obtenida trazando una curva estándar a partir de las salidas de intensidad de fluorescencia y las concentraciones conocidas de las soluciones estándar. Calcule las concentraciones (x) de las muestras experimentales insertando sus valores de intensidad de fluorescencia (y) en la ecuación.
NOTA: Utilice la parte de la curva estándar que es lineal. Recomendamos medir el área de la superficie de la membrana a partir de una imagen de la membrana tomada bajo el microscopio, ya que el área de la membrana puede variar según el número de lote y puede afectar significativamente los valores de permeabilidad calculados si difieren del control recubierto.
- Calcule [A]A utilizando la ecuación obtenida trazando una curva estándar a partir de las salidas de intensidad de fluorescencia y las concentraciones conocidas de las soluciones estándar. Calcule las concentraciones (x) de las muestras experimentales insertando sus valores de intensidad de fluorescencia (y) en la ecuación.
- Utilice la ecuación (2) para calcular la permeabilidad de la monocapa celular Pe:
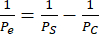 (2)
(2)
Donde PS es la permeabilidad del sistema calculada en el paso 4.2.2 y PC es el valor de permeabilidad del sistema del dispositivo de control revestido sin células.
Resultados
El montaje de un dispositivo de excavación de zanjas se muestra en la Figura 1. Los accesorios guían el ensamblaje de los componentes y el chip de membrana. El componente 1 es principalmente acrílico con una superficie PSA para adherirse al chip y una abertura en la cámara inferior y puertos para el acceso de la pipeta a la cámara inferior. El componente 2 es la capa de canal y contiene un "triángulo" no adhesivo y sin PSA en la parte superior derecha para el agarre. Los dispositivos de zanja hacia abajo proporcionan un área de crecimiento de cultivo celular plana en la cámara superior, mientras que los dispositivos de zanja hacia arriba tienen una superficie plana para el cultivo celular en la cámara inferior.
Realizamos monocultivos endoteliales y cocultivos de hCMEC/D3 y HBVP y de células similares a EECM-BMEC derivadas de hiPSC IMR90-4 y BPLC y adquirimos imágenes de fase utilizando un microscopio de contraste de fase Nikon Eclipse Ts2 y un objetivo de 10x (Figura 2). Se muestran las densidades óptimas de siembra para el cultivo celular primario (imágenes tomadas 1 día después de la siembra), así como las HBVP subsembradas (Figura 2A). Las imágenes finales de la fase de cocultivo y monocultivo (6 días de cultivo de células endoteliales) pueden ser difíciles de distinguir (Figura 2C), y la confirmación de un cocultivo celular primario exitoso puede requerir tinción con inmunofluorescencia (ver sección 3 del protocolo). También se ilustran las densidades de siembra de BPLC derivadas de hiPSC bajas, altas y óptimas (Figura 2B). El cocultivo derivado de hiPSC es más claro de distinguir en las imágenes de contraste de fase en comparación con los cocultivos primarios (Figura 2D). La siembra baja de BPLC da como resultado una cobertura deficiente de pericitos y aglomeración de pericitos, mientras que la resiembra da como resultado que la capa de pericitos se desprenda de la membrana. Además, el intercambio del medio en la cámara inferior demasiado rápido puede resultar en la pérdida de pericitos, ya que estas células son muy sensibles al cizallamiento. La cobertura óptima de los pericitos es de ~90% para un modelo de BBB, sin huecos en la capa endotelial.
En la Figura 3 (6 días de cultivo de células endoteliales) se ilustran imágenes representativas del cocultivo derivado de hiPSC teñido con inmunocolor. Los BPLC derivados de IMR90-4 se tiñeron para el marcador de pericitos PDGFRβ, y las células similares a EECM-BMEC derivadas de IMR90-4 se tiñeron para el marcador de unión adherente VE-cadherina. Hoechst se utilizó para teñir los núcleos. Las imágenes se adquirieron en un microscopio confocal de disco giratorio utilizando un objetivo LWD de 40x con cortes de 0,2 μm y se procesaron con Imaris. Ambas capas celulares se pueden visualizar aunque no se vea la nanomembrana delgada.
Realizamos el ensayo de permeabilidad de moléculas pequeñas basado en muestreo utilizando las mismas condiciones experimentales en dos laboratorios físicamente distantes en la Universidad de Berna, Suiza, y la Universidad de Rochester, NY, EE. UU. para demostrar la reproducibilidad interlaboratorio de los resultados (Figura 4)34. Las células similares a EECM-BMEC derivadas de hiPSC IMR90-4 se cultivaron en el dispositivo μSiM durante 2, 4 o 6 días y en filtros transwell durante 6 días. El ensayo se realizó utilizando 150 μg/mL de Amarillo de Lucifer (457 Da) en ambos laboratorios. La alta variabilidad en la permeabilidad de las células endoteliales cultivadas durante 2 días en el dispositivo indica que 2 días de cultivo fueron insuficientes para la maduración de la barrera. No hubo diferencias significativas en la permeabilidad entre los laboratorios tras la maduración de la barrera, a partir de los 4 días. También demostramos que la permeabilidad de las células endoteliales cultivadas en filtros μSiM y transwell durante 6 días coincidía con la publicada previamente40.
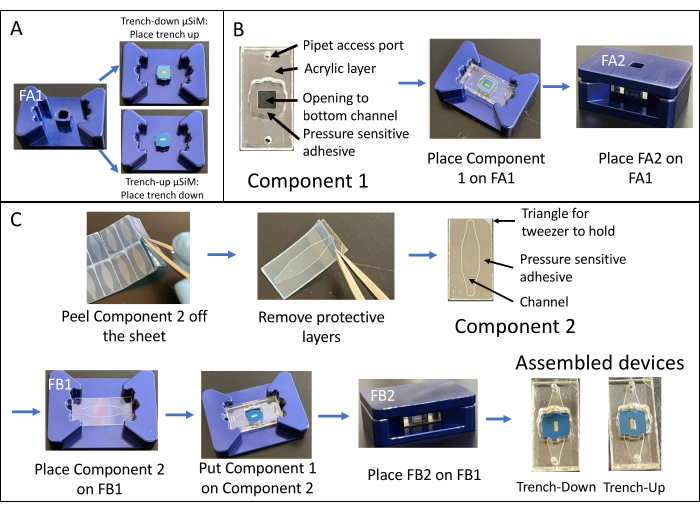
Figura 1: Pasos del ensamblaje de μSiM . (A) Prepare el chip colocándolo en el accesorio A1. Coloque la zanja de viruta hacia arriba para un dispositivo final de zanja. Coloque la zanja de viruta hacia abajo para un dispositivo de zanja final. (B) Unir el componente 1 al chip quitando las máscaras protectoras del componente 1 y colocándolo boca abajo en FA1. Pega aplicando presión con el accesorio A2. (C) Unir el componente 2 y el componente 1 retirando el componente 2 de su hoja y despegando las capas protectoras superiores. Coloque el canal hacia arriba en el dispositivo B1 y coloque el componente 1 encima del componente 2 boca arriba. Pega aplicando presión con el accesorio B2. Abreviaturas: FAn = fixture An; FBn = fixture Bn. Haga clic aquí para ver una versión más grande de esta figura.
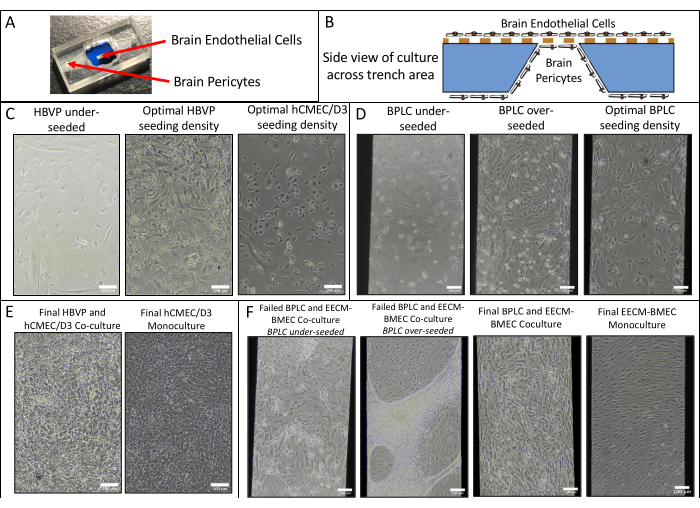
Figura 2: Esquema de las imágenes de cocultivo y contraste de fase representativas del cultivo celular en dispositivos. (A) Localización de la siembra de pericitos y células endoteliales. (B) Esquema de vista lateral de las ubicaciones de las celdas a través de la zanja del chip de membrana. (C) Imágenes representativas de densidades de siembra bajas y óptimas para la línea celular endotelial cerebral primaria HBVP y hCMEC/D3. Las imágenes se adquirieron 1 día después de la siembra (HBVP) y 2 h después de la siembra (hCMEC/D3). (D) Imágenes representativas de densidades de siembra bajas, altas y óptimas para células similares a pericitos cerebrales derivadas de hiPSC. Las imágenes se adquirieron 1 día después de la siembra. (E) Imágenes representativas del cocultivo final de HBVP y hCMEC/D3 y del monocultivo de hCMEC/D3. Las imágenes se adquirieron 8 días después de la siembra de HBVP y 7 días después de la siembra de hCMEC/D3. (F) Imágenes representativas de cocultivo celular fallido y exitoso de BPLC y EECM-BMEC y monocultivo celular similar a EECM-BMEC. Las imágenes se adquirieron 7 días después de la siembra de BPLC y 6 días después de la siembra de EECM-BMEC. Los cultivos de BPLC subsembrados no tienen suficiente cobertura, mientras que los cultivos de BPLC que se resembran crecerán en exceso y comenzarán a agruparse o retroceder. Barras de escala = 100 μm (C-F). Abreviaturas: HBVP = pericitos vasculares cerebrales humanos; hiPSC = célula madre pluripotente inducida humana; BPLC = células cerebrales similares a los pericitos derivadas de hiPSC. Haga clic aquí para ver una versión más grande de esta figura.
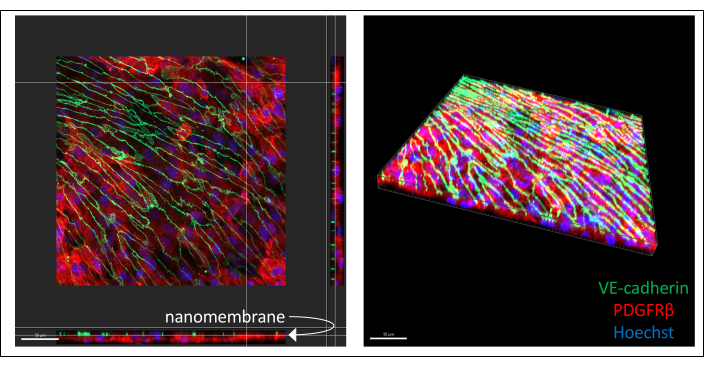
Figura 3: Imágenes representativas del cocultivo celular derivado de hiPSC teñido con inmunoalimentación en dispositivos. Las células se tiñeron para el marcador de células endoteliales VE-cadherina (verde), el marcador de pericitos PDGFRβ (rojo) y la tinción nuclear (azul). Se pueden ver dos capas de células muy próximas, separadas solo por una delgada nanomembrana de nitruro de silicio (la flecha blanca marca la ubicación de la membrana en la imagen de la izquierda). Barra de escala = 50 μm. Abreviaturas: hiPSC = célula madre pluripotente inducida humana; PDGFRβ = receptor beta del factor de crecimiento derivado de plaquetas. Haga clic aquí para ver una versión más grande de esta figura.
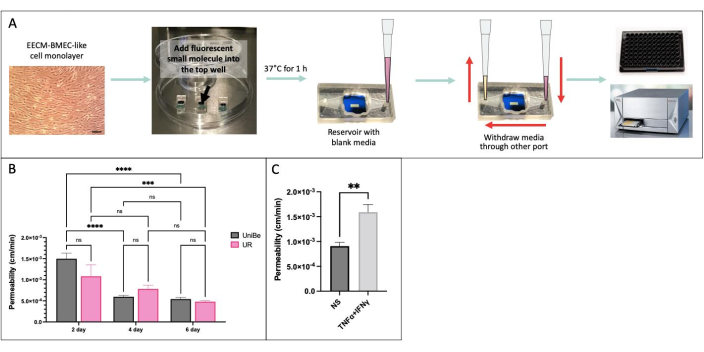
Figura 4: Ensayo de permeabilidad de moléculas pequeñas basado en muestreo . (A) Esquema del flujo de trabajo experimental. (B) Demostración de la reproducibilidad entre laboratorios entre dos laboratorios físicamente distantes en la Universidad de Berna (UniBe), Suiza, y la Universidad de Rochester (UR), NY, EE.UU.: las células endoteliales derivadas de hiPSC se cultivaron en el dispositivo μSiM durante 2, 4 o 6 días y en filtros transwell durante 6 días. El ensayo de permeabilidad se realizó con 150 μg/mL de amarillo de Lucifer (457 Da). La barra roja indica los datos de permeabilidad de fluoresceína sódica (376 Da) publicados anteriormente de las mismas células endoteliales derivadas de hiPSC cultivadas durante 6 días en filtros transwell40. N = 4-16 por grupo. Se utilizó ANOVA de dos vías con la prueba post hoc de Tukey, y las comparaciones solo se mostraron para p relevantes < 0,05. C) Demostración de la respuesta a las citocinas utilizando células similares a EECM-BMEC derivadas de hiPSC cultivadas en el μSiM durante 2 días; Se añadieron 0,1 ng/mL de TNFα + 2 UI/mL de IFNγ) o control del medio (no estimulado, NS) a la cámara superior durante 20 horas antes del ensayo de permeabilidad utilizando 150 μg/mL de Lucifer Yellow. N = 3 por grupo. Prueba t de Student, p < 0,05. Haga clic aquí para ver una versión más grande de esta figura.
| Área de superficie de siembra de la cámara superior | Volumen del pozo superior | Área de superficie de siembra de la cámara inferior | Volumen del canal inferior |
| ~37 mm2 | 100 μL (puede contener ≥115 μL) | ~42 mm2 | 10 μL (pipeta 20 μL para evitar burbujas) |
Tabla 1: Superficie crítica de μSiM y volúmenes.
| Blanco | Fijador | Solución de bloqueo | Dilución |
| VE-cadherina | 4 % de PFA o 100 % de MeOH | 5% GS + 0.4% Tx-100 o 10% GS + 0.3% Triton X-100 | 1:50 |
| CD31 | 4 % de PFA o 100 % de MeOH | 5% GS + 0.3-0.4% Triton X-100 | 1:100 |
| Claudin-5 | 100% MeOH | 5-10% GS + 0.3% Triton X-100 | 1:200 |
| ZO-1 | 100% MeOH | 5-10% GS + 0.3% Triton X-100 | 1:200 |
| Ocludina | 100% MeOH | 5-10% GS + 0.3% Triton X-100 | 1:50 |
| PDGFRβ | 4% PFA | 5% GS + 0.4% Triton X-100 | 1:100 |
| NG2 | 4% PFA | 5% GS + 0.4% Triton X-100 | 1:100 |
| Cabra α-Ratón IgG Alexa Fluor 488 | 1:200 | ||
| Cabra α-Ratón IgG Alexa Fluor 568 | 1:200 |
Tabla 2: Anticuerpos y métodos de tinción validados para inmunocitoquímica de cocultivo en dispositivos μSiM. Abreviaturas: PFA = paraformaldehído; MeOH = metanol; GS = suero de cabra.
Archivo complementario 1: Plantilla para el cálculo del valor de permeabilidad. Haga clic aquí para descargar este archivo.
Discusión
Si bien las virutas de membrana han sido diseñadas para brindar estabilidad, pueden agrietarse o romperse si se manipulan incorrectamente durante el ensamblaje. Por lo tanto, es fundamental agarrar el chip en las muescas de la pinza de virutas y colocarlo suavemente en el accesorio. Al manipular los dispositivos en general, se deben tomar precauciones adicionales para no golpear ni dejar caer los dispositivos. Durante la unión de la viruta de membrana al accesorio A1, el chip debe colocarse plano y centrado en el pilar del accesorio A1 para evitar que la membrana se agriete durante la unión al componente 1. Además, se debe evitar cualquier contacto con las capas de PSA expuestas después de quitarse las máscaras protectoras. Al manipular el componente 2 después de quitar las máscaras protectoras, es aconsejable sostenerlo a lo largo del borde del componente y usar pinzas para agarrar la esquina triangular que no tiene PSA.
Si bien se describieron protocolos de cultivo celular para posibles modelos de BHE, el modelo de cocultivo BMEC/pericito de la BHE descrito aquí puede ser suficiente o insuficiente dependiendo del contexto fisiológico y de las cuestiones de interés. Por ejemplo, el tráfico de células inmunitarias se produce principalmente en las vénulas postcapilares del cerebro41,42. En estas regiones, un espacio perivascular separa la barrera BMEC/pericitos de los limitantes gliales establecidos por los astrocitos. Por lo tanto, en las vénulas postcapilares, la unidad neurovascular (VU) comprende dos barreras físicamente separadas en serie, y los pies terminales astrocíticos no entran en contacto directo con la barrera sanguínea BMEC/pericitos, que está bien representada por el modelo actual. Si el objetivo es un modelo de NVU que tenga en cuenta el impacto de los factores secretados por los astrocitos en la barrera hematológica, se podría añadir un compartimento de astrocitos al dispositivo que permita el intercambio de factores solubles a través del espacio perivascular. Este ejemplo se ilustró anteriormente34 y podría ampliarse para incluir otras células, como la microglía y las neuronas, en un compartimento "cerebral" 3D. La arquitectura modular de la plataforma permite utilizar estrategias de ensamblaje simples para lograr estas reconfiguraciones, de modo que la plataforma sea tan simple o compleja como sea necesario para abordar las hipótesis en cuestión. Cada configuración de cultivo celular; sin embargo, debe optimizarse para nuevas líneas celulares y multicultivos. Por ejemplo, debido a las propiedades de las membranas de nitruro de silicio, es posible que sea necesario ajustar las soluciones de recubrimiento en comparación con las placas de cultivo de tejidos. La inclusión de fibronectina generalmente ayuda en la unión celular y la supervivencia. Además, los usuarios podían cultivar células endoteliales y pericitos en direcciones opuestas. En este caso, puede ser necesario modificar, por ejemplo, la forma en que se realizan e interpretan las mediciones de permeabilidad. Sin embargo, proporcionar pasos para este tipo de cultura está más allá del alcance de este documento.
Otro desafío que se puede encontrar durante el cultivo celular es la rápida evaporación de los medios, ya que los dispositivos pueden ser más sensibles a las alteraciones en el medio ambiente en comparación con las placas y matraces estándar de cultivo de tejidos. Si se observa un exceso de evaporación o se ralentiza el crecimiento celular, se deben medir todos los parámetros críticos de la incubadora para garantizar ajustes precisos. Se puede agregar más agua a la tapa de tejido o a la pequeña placa de Petri colocada dentro de la cámara de cultivo celular, o se deben intercambiar medios con más frecuencia. Además, las burbujas pueden entrar en el canal inferior y atascarse en la zanja para los dispositivos de excavación de zanjas. Si bien se pueden eliminar, es más fácil evitar agregar burbujas en primer lugar. Para ello, es importante comprobar que no haya burbujas en la punta de la pipeta ni aire en el extremo de la punta de la pipeta antes de pipetear los medios en la cámara inferior. Además, la evaporación de los medios en el canal puede provocar un espacio entre la superficie de los medios y la parte superior del puerto. Se puede pipetear un pequeño volumen de medios en un puerto hasta que el medio llegue a la superficie del puerto opuesto, después de lo cual los medios se pueden intercambiar en ese puerto opuesto. Si bien los medios hECSR y E6 + 10% FBS no deben calentarse en el baño de agua, otros medios se pueden precalentar para reducir la formación de burbujas. Si entra una burbuja en la cámara inferior, se puede eliminar pipeteando rápidamente 100 μL a través del canal. Sin embargo, este método puede provocar contaminación entre cámaras o medios derramados por la superficie del dispositivo. También puede alterar las capas celulares. Alternativamente, los medios se pueden eliminar primero del canal y luego volver a introducirse con un volumen de 50 μL. Sin embargo, quitar primero los medios puede dar lugar a una mayor formación de burbujas en el canal. Si una burbuja no está directamente debajo del área de la membrana, puede dejarse en el canal sin efectos sobre el cultivo celular.
La adhesión y el crecimiento de los pericitos, como se demuestra en la Figura 2, pueden ser un desafío. El uso de una densidad de siembra optimizada es esencial para la formación de una capa con una proporción de células pericitos a endoteliales fisiológicamente relevante. Además, como los pericitos son sensibles al cizallamiento, todos los intercambios de medios en el canal deben realizarse muy lentamente para proteger las células. Para el cultivo de BPLC, se puede lograr una mejor adhesión recubriendo la cámara inferior con 800 μg/mL de colágeno tipo IV o 100 μg/mL de fibronectina.
La inmunocitoquímica en los dispositivos aquí descritos permite el análisis cualitativo de la salud y la función celular. Los métodos de tinción en placas de cultivo de tejidos u otras plataformas deben ser directamente traducibles a la plataforma. Para el cultivo celular solo en la cámara superior, después de la fijación, se puede agregar PBS en la cámara inferior y dejarse para los pasos restantes, con el bloqueo y la tinción realizados solo en la cámara superior. Esto minimiza los riesgos de romper las membranas o de que entren burbujas en la cámara inferior. Para la tinción de cocultivo, recomendamos utilizar ambas cámaras en todos los pasos. Es importante tener en cuenta que la viscosidad del fijador y PBS es diferente a la de los medios. Por lo tanto, puede ser más fácil agregar burbujas en la cámara inferior, y se debe tener especial cuidado al verificar si hay aire en las puntas de las pipetas en el extremo de la punta antes de pipetear en la cámara inferior.
El protocolo descrito para el ensayo de permeabilidad de moléculas pequeñas permite la evaluación funcional y cuantitativa de la función barrera de las células endoteliales cultivadas en el dispositivo μSiM. Un problema que puede surgir durante este ensayo es la extracción de burbujas de aire en la pipeta durante la recogida de muestras desde el canal inferior en el paso del protocolo 4.1.7.4. Para evitar este problema, es importante asegurarse de que la punta esté sellada en el puerto antes de comenzar la recolección de muestras y que la muestra no se extraiga demasiado rápido. Si eso no resuelve el problema, el tamaño de las puntas utilizadas puede ser demasiado pequeño o demasiado grande para caber en los puertos; utilice los consejos que se enumeran en la Tabla de materiales. Si se miden valores de permeabilidad inesperadamente altos a pesar de una monocapa confluente de aspecto saludable, se debe comprobar la integridad de la monocapa para detectar alteraciones durante la recogida de muestras. Recomendamos comprobar siempre la monocapa bajo el microscopio inmediatamente después de la recogida de la muestra. Si la monocapa sigue intacta y sana, se puede fijar la muestra y evaluar los marcadores biológicos de la función de barrera, por ejemplo, mediante inmunotinción de las proteínas de unión. Por el contrario, si se miden valores de permeabilidad inesperadamente bajos, es importante asegurarse de que se muestrean 50 μL de medio desde el canal inferior sin burbujas de aire. Si el medio sale del puerto de muestreo tan pronto como se coloca la punta del depósito, ese medio debe recogerse antes de colocar la pipeta en el puerto de muestreo, ya que la mayor parte de la pequeña molécula fluorescente estará presente en el volumen inicial de 10 μL muestreado desde el canal inferior. Dibujar círculos alrededor de los puertos con un bolígrafo hidrofóbico o colocar una cinta hidrofóbica con un orificio alrededor del puerto evita que se extiendan los medios bombeados pasivamente. Si se retiran burbujas durante el muestreo o no se retira la muestra completa de 50 μl, no se debe utilizar la muestra. Alternativamente, se puede determinar el volumen exacto y utilizarlo en el cálculo de la permeabilidad; sin embargo, esto solo debe hacerse si el volumen eliminado es de ≥40 μL, lo que corresponde a ~98-99% de recuperación de colorante34.
Divulgaciones
J.L.M. es cofundador de SiMPore y tiene una participación accionaria en la empresa. SiMPore está comercializando tecnologías ultrafinas basadas en silicio, incluidas las membranas utilizadas en este estudio.
Agradecimientos
J.L.M., B.E., T.R.G., M.C.M., P.K., M.T., K.C. y L.W. fueron financiados por la subvención R33 HL154249 de los NIH. J.L.M. fue financiado por R44 GM137651. M.M. fue financiado por el Premio del Programa Schmidt del Instituto Del Monte de Neurociencia, Universidad de Rochester. M.T. fue financiado por RF1 AG079138. K.C. fue financiado por la Fundación Internacional para la Investigación Ética.
Materiales
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| CD31 Polyclonal antibody | Thermo Fisher Scientific | PA5-32321 | |
| Claudin-5 mouse IgG antibody, 4C3C2 | Thermo Fisher Scientific | 35-2500 | |
| Goat α-Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | |
| Goat α-Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | |
| Hoechst 33342 | Life Technologies | H3570 | |
| NG2, mouse IgG2a, 9.2.27 | Millipore | MAB2029 | |
| Occludin mouse IgG antibody, OC-3F10 | Thermo Fisher Scientific | 33-1500 | |
| PDGFRβ, rabbit IgG antibody, 28E1 | Cell Signaling Technology | 3169 | |
| VE-cadherin mouse IgG2B Clone # 123413 | R&D Systems | MAB9381 | |
| ZO-1 rabbit IgG antibody, polyclonal | Thermo Fisher Scientific | 40-2200 | |
| Chemicals, peptides, and recombinant proteins | |||
| 100% Methanol | VWR | 101443-718 | Can be substituted with similar products |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 28908 | Can be substituted with similar products |
| Accutase | Thermo Fisher Scientific | A1110501 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| B27 supplement | Thermo Fischer Scientific | 17504044 | |
| bFGF | R&D Systems | 233-FB-025 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Collagen, Type I solution from rat tail | Sigma-Aldrich | C3867-1VL | Can be substituted with similar products |
| DMEM/Ham’s F12 | Thermo Fisher Scientific | 11320033 | |
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Essential 6 medium | Thermo Fisher Scientific | A1516401 | |
| Fetal bovine serum (FBS) | Peak Serum | PS-FB1 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Fibronectin human protein, plasma | ThermoFisher Scientific | 33016015 | Can be substituted with similar products |
| hESFM | Thermo Fisher Scientific | 11111044 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | 861502 | |
| Normal goat serum | Thermo Fisher Scientific | 500627 | Can be substituted with similar products |
| PBS without calcium, magnesium | Cytiva | SH30256.01 | Can be substituted with similar products |
| Pericyte Medium | ScienCell | 1201 | Use complete kit (includes supplements) |
| Poly-L-Lysine, 10 mg/mL | ScienCell | 0413 | |
| Triton X-100 | JT Baker | X198-05 | Can be substituted with similar products |
| UltraPure DNase/RNase-Free Distilled Water | Invitrogen™ | 10977015 | Can be substituted with similar products |
| Experimental models: Cell lines | |||
| Blood-brain barrier hCMEC/D3 cell line | Sigma-Aldrich | SCC066 | |
| Human brain vascular pericytes | ScienCell | 1200 | |
| iPS(IMR90)-4 human induced pluripotent stem cells | WiCell | RRID:CVCL_C437 | |
| Glassware and Plasticware | |||
| 150 mm TC-treated Cell Culture Dish with 20 mm Grid | Falcon | 353025 | |
| Clamps | VWR | MFLX06832-10 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Flat 96-well non-binding microplates | Greiner Bio-One | 655900 | |
| Microscope Slide Device Holder | SiMPore | USIM-SB | Dimensions compatible with micropscope slide holders |
| Nunc 15 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339651 | |
| Nunc 50 mL Conical Sterile Polypropylene Centrifuge Tubes | Thermo Fischer Scientific | 339653 | Tube caps can be filled with water for cell culture |
| P20-200 pipette tips | VWR | 76322-516 | Alternate brands may not seal as effectively into ports |
| Transwell filters (12 well, 12 mm, 0.4 μm pore size, PC) | CoStar | 3401 | |
| Instruments | |||
| 10X Objective (For Andor) | Nikon Instruments Inc. | MRD00105 | Air; WD: 4 mm; NA 0.45 |
| 10X Objective (For Nikon) | Nikon Instruments Inc. | MRP40102 | Air; WD: 6.2 mm; NA 0.25 |
| 40X Objective (LWD) (For Andor) | Nikon Instruments Inc. | MRD77410 | Water immersion; WD: 590-610 mm; NA 1.15 |
| Andor Spinning Disc Confocal microscope | Oxford Instruments, Andor | ||
| Nikon Eclipse Ts2 Phase Contrast Microscope | Nikon Instruments Inc. | Can be substituted with similar products | |
| TECAN Infinite M200 | TECAN | Can be substituted with similar products | |
| Other | |||
| Advanced PAP Pen | Millipore Sigma | Z672548 | 2 mm tip is recommended |
| Assembly kit with fixtures | SiMPore | USIM-JIGSET | Including fixure A1, A2, B1, and B2 |
| Camera Adapter for Microscopes | AmScope | CA-CAN-SLR Canon SLR / D-SLR | Φ23.2 - Φ30 adapter fits Nikon Eclipse Ts2 |
| Canon EOS Rebel SL3 DSLR Camera | Canon | EOS 250D, BH #CAEDRSL3B, MFR #3453C001 | Can be substituted with similar products |
| Cell strainer, 40 µm | Millipore Sigma (Corning) | CLS431750 | |
| Component 1 | SiMPore | USIM-C1 | |
| Component 2 | SiMPore | USIM-C2 | |
| Membrane chips | SiMPore | NPSN100-1L | Other chips formats are available |
| SMD handling tweezer double angle | Techni-Tool | 758TW003 | "Chip Tweezers" |
| Stainless steel precision type GG tweezer | Techni-Tool | 758TW534 | "Straight Tweezers" |
| Software | |||
| Fiji | ImageJ | For image processing | |
| Fusion | Oxford Instruments, Andor | Instructions for version 2.3.0.44 | |
| i-control | TECAN | Instructions for version 2.0 | |
| Imaris | Oxford Instruments | For image processing. Instructions for version 9.9.0 |
Referencias
- Villabona-Rueda, A., Erice, C., Pardo, C. A., Stins, M. F. The evolving concept of the blood brain barrier (BBB): from a single static barrier to a heterogeneous and dynamic relay center. Frontiers in Cellular Neuroscience. 13, 405 (2019).
- Nation, D. A., et al. Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nature Medicine. 25 (2), 270-276 (2019).
- Ferrari, C. C., Tarelli, R. Parkinson's disease and systemic inflammation. Parkinsons Disease. 116 (3), 436813 (2011).
- Koch, E. V., Ledwig, V., Bendas, S., Reichl, S., Dietzel, A. Tissue barrier-on-chip: a technology for reproducible practice in drug testing. Pharmaceutics. 14 (7), 1451 (2022).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
- Ortiz, G. G., et al. Role of the blood-brain barrier in multiple sclerosis. Archives of Medical Research. 45 (8), 687-697 (2014).
- Orhun, G., et al. Association between inflammatory markers and cognitive outcome in patients with acute brain dysfunction due to sepsis. Archives of Neuropsychiatry. 56 (1), 63-70 (2019).
- Chen, Y., Yang, W., Chen, F., Cui, L. COVID-19 and cognitive impairment: neuroinvasive and blood-brain barrier dysfunction. Journal of Neuroinflammation. 19 (1), 222 (2022).
- Hughes, C. G., et al. Endothelial activation and blood-brain barrier injury as risk factors for delirium in critically ill patients. Critical Care Medicine. 44 (9), e809-e817 (2016).
- Saraiva, C., et al. Nanoparticle-mediated brain drug delivery: Overcoming blood-brain barrier to treat neurodegenerative diseases. Journal of Control Release. 235 (10), 34-47 (2016).
- Jolliet-Riant, P., Tillement, J. P. Drug transfer across the blood-brain barrier and improvement of brain delivery. Fundamental & Clinical Pharmacology. 13 (1), 16-26 (1999).
- Abbott, N. J., et al. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2009).
- Siflinger-Birnboim, A., et al. Molecular sieving characteristics of the cultured endothelial monolayer. Journal of Cellular Physiology. 132 (1), 111-117 (1987).
- Bischoff, I., et al. Pitfalls in assessing microvascular endothelial barrier function: impedance-based devices versus the classic macromolecular tracer assay. Scientific Reports. 6, 23671 (2016).
- van der Helm, M. W., van der Meer, A. D., Eijkel, J. C., van den Berg, A., Segerink, L. I. Microfluidic organ-on-chip technology for blood-brain barrier research. Tissue Barriers. 4 (1), e1142493 (2016).
- Osaki, T., Shin, Y., Sivathanu, V., Campisi, M., Kamm, R. D. In vitro microfluidic models for neurodegenerative disorders. Advanced Healthcare Materials. 7 (2), (2018).
- Girard, S. D., et al. High and low permeability of human pluripotent stem cell-derived blood-brain barrier models depend on epithelial or endothelial features. FASEB Journal. 37 (2), e22770 (2023).
- Vigh, J. P., et al. Transendothelial electrical resistance measurement across the blood-brain barrier: a critical review of methods. Micromachines. 12 (6), 685 (2021).
- Lea, T., et al., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bioactives on Health: in vitro and ex vivo models. , (2015).
- Felix, K., Tobias, S., Jan, H., Nicolas, S., Michael, M. Measurements of transepithelial electrical resistance (TEER) are affected by junctional length in immature epithelial monolayers. Histochemistry and Cell Biology. 156 (6), 609-616 (2021).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Mossu, A., et al. A silicon nanomembrane platform for the visualization of immune cell trafficking across the human blood-brain barrier under flow. Journal of Cerebral Blood Flow and Metabolism. 39 (3), 395-410 (2019).
- Castro Dias, M., et al. Brain endothelial tricellular junctions as novel sites for T-cell diapedesis across the blood-brain barrier. Journal of Cell Science. 134 (8), jcs253880 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Khire, T. S., et al. Microvascular mimetics for the study of lukocyte-endothelial interactions. Cellular and Molecular Bioengineering. 13 (2), 125-139 (2020).
- Salminen, A. T., et al. Endothelial cell apicobasal polarity coordinates distinct responses to luminally versus abluminally delivered TNF-alpha in a microvascular mimetic. Integrative Biology: Quantitative Biosciences from Nano to Macro. 12 (11), 275-289 (2020).
- DesOrmeaux, J. P. S., et al. Nanoporous silicon nitride membranes fabricated from porous nanocrystalline silicon templates. Nanoscale. 6 (18), 10798-10805 (2014).
- Hill, K., et al. Second generation nanoporous silicon nitride membranes for high toxin clearance and small format hemodialysis. Advanced Healthcare Materials. 9 (4), e1900750 (2020).
- Salminen, A. T., et al. Ultrathin dual-scale nano- and microporous membranes for vascular transmigration models. Small. 15 (6), e1804111 (2019).
- Gillmer, S. R., et al. Predicting the failure of ultrathin porous membranes in bulge tests. Thin Solid Films. 631, 152-160 (2017).
- Ishimatsu, R., et al. Ion-selective permeability of ultrathin nanopore silicon membrane as studied using nanofabricated micropipet probes. Analytical Chemistry. 82 (17), 7127-7134 (2010).
- Kim, E., et al. A structure-permeability relationship of ultrathin nanoporous silicon membrane: a comparison with the nuclear envelope. Journal of American Chemical Society. 130 (13), 4230-4231 (2008).
- Snyder, J. L., et al. An experimental and theoretical analysis of molecular separations by diffusion through ultrathin nanoporous membranes. Journal of Membrane Science. 369 (1-2), 119-129 (2011).
- McCloskey, M. C., et al. The modular µSiM: a mass produced, rapidly assembled, and reconfigurable platform for the study of barrier tissue models in vitro. Advanced Healthcare Materials. 11 (18), e2200804 (2022).
- Mansouri, M., et al. The modular microSiM reconfigured: integration of microfluidic capabilities to study in vitro barrier tissue models under flow. Advanced Healthcare Materials. 11 (21), e2200802 (2022).
- Su, S. -. H., et al. A tissue chip with integrated digital immunosensors: In situ brain endothelial barrier cytokine secretion monitoring. Biosensors and Bioelectronics. 224, 115030 (2023).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Hudecz, D., et al. Ultrathin silicon membranes for in situ optical analysis of nanoparticle translocation across a human blood-brain barrier model. ACS Nano. 14 (1), 1111-1122 (2020).
- Gastfriend, B. D., Stebbins, M. J., Du, F., Shusta, E. V., Palecek, S. P. Differentiation of brain pericyte-like cells from human pluripotent stem cell-derived neural crest. Current Protocols. 1 (1), e21 (2021).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. FASEB Journal. 34 (12), 16693-16715 (2020).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- Bechmann, I., Galea, I., Perry, V. H. What is the blood-brain barrier (not). Trends in Immunology. 28 (1), 5-11 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados