Method Article
Un sistema de cultivo hepático totalmente humano para aplicaciones de desarrollo de fármacos
En este artículo
Resumen
Los avances técnicos recientes permitieron la producción a escala de una plataforma in vitro para aplicaciones de metabolismo y toxicidad de fármacos. Un sistema hepático 2D+ totalmente humano (TV2D+) proporciona resultados fisiológicamente relevantes utilizando métodos tradicionales de cultivo bidimensional. Este protocolo apoyará a los usuarios finales en la configuración, el mantenimiento y la aplicación del sistema.
Resumen
Encontrar un modelo de cultivo a largo plazo y relevante para el ser humano para los hepatocitos humanos primarios (PHH) para estudios farmacológicos y toxicológicos sigue siendo un desafío. Las plataformas de modelos in vitro actuales suelen ser incómodas y complejas, carecen de estabilidad fenotípica a lo largo del tiempo y no admiten múltiples lotes de PHH, careciendo de reproducibilidad experimental y flexibilidad. Aquí, proporcionamos un protocolo detallado para la descongelación, el recubrimiento y el mantenimiento de un sistema hepático 2D+ totalmente humano (TV2D+), que aprovecha las técnicas y equipos de cultivo bidimensionales (2D) estándar al tiempo que mantiene la longevidad y la estabilidad fenotípica a lo largo del tiempo que suelen acompañar a los sistemas tridimensionales (3D) más complejos. Los resultados muestran la adhesión y el porcentaje de plateabilidad en TV2D+ en función de la densidad de siembra de PHH, así como una funcionalidad estable durante al menos 2 semanas en cultivo. Se evalúa un rango de densidades de siembra de PHH para lograr un cultivo exitoso a largo plazo. Cuando se establecen correctamente, las PHH en TV2D+ se organizan en colonias de hepatocitos, expresan un marcador hepático específico y mantienen la viabilidad, la integridad arquitectónica y los niveles fisiológicamente relevantes de albúmina y urea. Esta combinación única de atributos hace que el sistema TV2D+ sea un modelo hepático adecuado para una variedad de aplicaciones farmacológicas y toxicológicas.
Introducción
La predicción de la seguridad y eficacia terapéutica es una parte importante del desarrollo preclínico de fármacos. Sin embargo, los modelos hepáticos preclínicos in vitro convencionales tienen una capacidad limitada para imitar con precisión el microambiente celular hepático in vivo y mantener la funcionalidad y morfología de los hepatocitos a lo largo del tiempo. Se necesitan modelos que proporcionen una competencia metabólica estable durante más de 1 semana para evaluar los compuestos de recambio lento o investigar los resultados asociados con la exposición subaguda o crónica. Las pruebas in vivo en animales a menudo no logran predecir la eficacia y el riesgo del fármaco debido a las diferencias de especies traslacionales en los mecanismos de depuración hepática humana1. Los modelos hepáticos actuales in vitro bidimensionales (2D), como el monocultivo tradicional de hepatocitos humanos primarios (PHH) o los cultivos sándwich, carecen de estabilidad fenotípica y longevidad en el cultivo, lo que lleva a la pérdida de la función hepatocelular clave y la integridad arquitectónica a lo largo del tiempo2. Un método alternativo consiste en la formación de esferoides de hepatocitos tridimensionales (3D), lo que ofrece un microambiente más relevante que el cultivo 2D. Sin embargo, este método está limitado por la disponibilidad de materias primas, la selección del lote donante de PHH, la reproducibilidad y la pérdida de viabilidad con el aumento del tamaño de los esferoides 3,4,5,6. Se han introducido plataformas multicelulares mediante las cuales las PHH se siembran con células alimentadoras en placas de tamaño fijo y micropatrón. Aunque estos modelos pueden permitir tiempos de cultivo más largos, las células alimentadoras no humanas utilizadas en estas plataformas pueden alterar los resultados experimentales y limitar su aplicación debido a la contribución innata de fondo al aclaramiento del fármaco y a los perfiles metabólicos 1,7. El sistema hepático 2D+ totalmente humano TruVivo (TV2D+) descrito recientemente en Weaver, et al8, se desarrolló para abordar algunas de las limitaciones de los métodos tradicionales, de cocultivo y de cultivo 3D de PHH. Las células no hepáticas reducen las diferencias entre especies en el metabolismo y la producción paracrina y proporcionan el apoyo necesario para los hepatocitos primarios de una manera reproducible y robusta que no puede ser proporcionada por las células hepáticas no parenquimatosas correspondientes de un solo lote donante debido a limitaciones en la expansión, el fenotipo y el rendimiento. Las células alimentadoras elegidas pudieron expandirse de manera consistente antes de su uso y carecían de la necesidad de transformación o diferenciación. Como se describe en Glicklis et al.4 y Khetani et al.5, los modelos de cultivo 3D como los esferoides de hepatocitos tienen dificultades de reproducibilidad debido a la variabilidad del donante y al mantenimiento de la consistencia en el tamaño de los esferoides, lo que afecta a la difusión de nutrientes en esferoides de más de 200 μm, lo que conduce a una disminución de la viabilidad y la funcionalidad. Al igual que la formación de esferoides 3D, el sistema TV2D+ se basa en el autoensamblaje de PHH; sin embargo, las colonias de PHH formadas se dispersan sobre el área de la superficie del pozo a una profundidad de una sola celda en lugar de compactarse en un solo agregado. Este método de cultivo puede ser útil para abordar la variabilidad de los donantes, lo que permite que los PHH se siembren, se cultiven y mantengan la funcionalidad básica a varias densidades de siembra. El sistema TV2D+ también puede aumentar la robustez del manejo del usuario debido a la pérdida durante la manipulación o al equipo especializado necesario para realizar el cultivo extendido en esferoides 3D.
El sistema TV2D+ combina el cultivo 2D estándar con la longevidad y la estabilidad fenotípica que suelen acompañar a los sistemas 3D. El protocolo descrito en este documento proporciona instrucciones paso a paso para los usuarios con conocimientos básicos de cultivo de tejidos en laboratorios equipados con equipos estándar, como cabinas de bioseguridad, centrífugas e incubadoras de CO2 . Cada paso del proceso se describe en detalle, incluida la preparación de los medios, la descongelación, el enchapado y el mantenimiento del sistema de cultivo resultante. El protocolo también contiene un método para determinar la funcionalidad básica de los hepatocitos, la albúmina y la urea, así como el análisis de imágenes inmunofluorescentes para determinar la unión de la PHH para la normalización. Cuando se establecen correctamente, las PHH en TV2D+ se organizan en colonias de hepatocitos, imitando la morfología hepática nativa, y mantienen una viabilidad prolongada, integridad arquitectónica y niveles fisiológicamente relevantes de albúmina y urea durante al menos 2 semanas8. Debido a que el sistema puede permitir un rango de densidades de siembra de PHH, puede ser útil para aumentar la disponibilidad de lotes de PHH menos placables que tengan características donantes deseables. Esta combinación de accesibilidad y funcionalidad hace que TV2D+ sea un modelo hepático adecuado para una variedad de aplicaciones farmacológicas y toxicológicas.
Protocolo
Este protocolo sigue las directrices del comité de ética de Lifenet Health. El manuscrito no contiene ningún estudio con participantes humanos ni estudios en animales realizados por ninguno de los autores. Todas las células se aislaron del tejido del donante con el consentimiento total de Lifenet Health para fines de investigación.
1. Preparación media
- Descongele un biberón en cada medio de descongelación de la célula del alimentador, el suplemento A, el suplemento B y el suplemento C (ver Tabla de materiales) en un baño de agua a 37 °C o 16-24 h a 4 °C.
- Alícuota toda la botella (10 ml) del medio de descongelación de la célula alimentadora en un tubo cónico de 15 ml o 50 ml.
NOTA: El tamaño del gránulo de la celda será más fácil de ver con un tubo cónico de 15 ml. - Agregue 4.5 mL de suplemento B y 11 mL de suplemento A a un frasco de medio de recubrimiento (75 mL) (consulte la Tabla de Materiales) para hacer un medio de recubrimiento completo.
NOTA: El medio de recubrimiento completo tiene una concentración de FBS <5% v/v. - En un frasco aparte, agregue 100 ml de medio de cultivo (consulte la Tabla de materiales), 1 ml de suplemento C y 14 ml de suplemento A para hacer un medio de cultivo completo.
NOTA: El medio de cultivo completo tiene una concentración de FBS <1% v/v - Conservar el suplemento C restante y el suplemento A a -20 °C hasta la preparación media de la semana 2.
NOTA: Los ciclos repetidos de congelación y descongelación reducirán la vida útil de los suplementos. Se recomienda congelar y descongelar solo una vez. - Antes de su uso, calentar 10 ml de medio de descongelación de células alimentadoras, medio de descongelación de hepatocitos, medio de siembra completo y medio de cultivo completo durante 20-30 min en un baño de agua a 37 °C.
2. Descongelación, conteo y colocación de placas en células alimentadoras humanas (Figura 1A)
- Cultive las células alimentadoras aproximadamente 1 h antes de sembrar las PHH. Descongele las células alimentadoras (ver Tabla de materiales) en un baño de agua a 37 °C durante 1-2 min.
NOTA: Evite la exposición prolongada (p. ej., >2 min) controlando la descongelación y retirando el vial cuando el líquido se afloje en el criovial cuando se invierte. - Inmediatamente después de descongelar, coloque las celdas alimentadoras en hielo.
- Utilizando técnicas asépticas, en una cabina de bioseguridad (BSC), añadir células recién descongeladas a 10 mL de medio de descongelación de células alimentadoras.
- Utilice una pipeta de 1000 μL para lavar el vial una vez con 1 mL de suspensión de medio de célula/descongelación y recoja.
- Centrifugar a 400 x g durante 4 min a temperatura ambiente (RT).
- Deseche con cuidado el sobrenadante para no alterar el gránulo celular mediante pipeteo o aspiración endouterina. Vuelva a suspender el gránulo de celda en 1 ml de medio de siembra completo y cuente las celdas de alimentación.
NOTA: Las células alimentadoras se pueden contar usando naranja de acridina y yoduro de propidio (AOPI) en un contador de células automatizado o azul de tripano usando un hemacitómetro. Los recuentos de células pueden variar según la tecnología y el usuario. Para obtener los mejores resultados, cuente las muestras duplicadas y mantenga la coherencia en la metodología elegida. - Diluir la suspensión celular a 100.000 células/ml utilizando el medio de siembra completo.
- Coloque 500 μL (50.000 células) por pocillo de la suspensión celular diluida en una placa de 24 pocillos recubierta de colágeno (consulte la Tabla de materiales).
- Agite la placa en un movimiento Norte (N)-Sur (S)-Este (E)-Oeste (W) usando un movimiento hacia adelante y hacia atrás en la dirección N-S 2 veces seguido del mismo movimiento E-W. Repita este protocolo de agitación 2 veces más para un total de 3 rondas.
NOTA: Realice la agitación con una fuerza moderada para evitar salpicaduras en la tapa de la placa y al mismo tiempo ayudar en la distribución de las células (consulte el video). - Incubar a 37 °C/5% CO2 durante 60 min.
- Vea la unión de la célula alimentadora antes de proceder a la descongelación de los hepatocitos.
NOTA: La fijación aceptable de la celda alimentadora es visualmente aproximadamente 50% confluente.
3. Descongelación, recuento y siembra de hepatocitos humanos primarios (Figura 1B)
- Después de 30 minutos de cultivo de células alimentadoras, filtre el medio de descongelación de hepatocitos precalentado a través de una unidad de filtro de polietersulfona (PES) de 0,2 μm.
- Descongele los PHH en un baño de agua a 37 °C durante 1-2 min.
NOTA: Evite la exposición prolongada (p. ej., >2 min) controlando la descongelación y retirando el vial cuando el líquido se afloje en el criovial cuando se invierte. - Inmediatamente después de descongelar, coloque los PHH en hielo.
- En un BSC, vierta la suspensión de PHH en el medio de descongelación de hepatocitos.
NOTA: Evite pipetear suspensiones de células PHH cuando sea posible. Lo más importante es no realizar pipeteo durante la transferencia de PHH descongelados desde el medio criovial al medio de descongelación. - Utilice una pipeta de 1000 μL para lavar el vial 3-4 veces pipeteando suavemente 1 ml de suspensión de hepatocito/medio de descongelación en el vial y recogiendo el lavado vertiéndolo de nuevo en el medio de descongelación.
- Tape e invierta suavemente la suspensión PHH descongelada 5 veces.
- Girar a 100 x g durante 8 min a RT.
- Deseche con cuidado el sobrenadante para no alterar el gránulo celular mediante pipeteo o aspiración endouterina. A la pared del tubo cónico, agregue 3 ml de medio de recubrimiento completo.
- Balancee el tubo cónico de lado a lado para resuspender el gránulo celular.
- Agregue 5 ml adicionales de medio de siembra completo a los hepatocitos resuspendidos.
- Cuente los PHH.
NOTA: Las PHH se pueden contar usando AOPI en un contador celular automatizado o azul de tripano usando un hemacitómetro. Los recuentos de células pueden variar según la tecnología y el usuario. Para obtener los mejores resultados, cuente las muestras duplicadas y mantenga la coherencia en la metodología elegida. - Diluir la suspensión celular hasta la densidad de siembra deseada (300.000-600.000 PHHs/mL) utilizando el medio de siembra completo.
NOTA: La densidad óptima de siembra de hepatocitos puede variar de un lote a otro. La densidad de siembra recomendada para un lote determinado se proporcionará en el certificado de análisis (COA). Utilice la siguiente ecuación para determinar los hepatocitos/ml para una placa de 24 pocillos.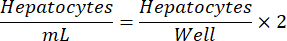
- De las celdas de alimentación enchapadas, retire el medio mediante pipeteo o aspiración endouterina.
NOTA: Para garantizar la viabilidad de las celdas de alimentación, se recomienda cambiar no más de 3 pocillos a la vez. - Coloque inmediatamente 500 μL (150.000-300.000 células) por pocillo de la suspensión de hepatocitos diluida en la placa de colágeno prerrecubierta de 24 pocillos que contiene las células alimentadoras.
- Agite la placa con un movimiento N-S-E-W utilizando un movimiento hacia adelante y hacia atrás en la dirección N-S 2 veces seguido del mismo movimiento E-W. Repita este protocolo de agitación 2 veces más para un total de 3 rondas.
NOTA: Realice la agitación con una fuerza moderada para evitar salpicaduras en la tapa de la placa y, al mismo tiempo, ayudar en la distribución celular. - Incubar a 37 °C/5% CO2 durante 2-4 h. Durante los primeros 60 minutos de cultivo, agite la placa cada 15 minutos con un movimiento N-S-E-W como en el paso 3.15 anterior.
- Después de la incubación, retire la placa de la incubadora y colóquela en BSC.
- Agite la placa y retire todo el medio de recubrimiento mediante pipeteo o aspiración al vacío.
NOTA: Para garantizar la viabilidad del cultivo, se recomienda cambiar no más de 3 pocillos a la vez. - Agregue inmediatamente 500 μL de medio de cultivo completo precalentado a cada pocillo.
4. Mantenimiento
- Alícuota y precalentar el medio de cultivo completo en un baño de agua a 37 °C durante 20-30 min. Se necesitan aproximadamente 13,5 ml de medio para una placa de 24 pocillos.
- Alimente los cultivos diariamente con 500 μL por pocillo de medio de cultivo completo fresco y precalentado.
NOTA: Para garantizar la viabilidad del cultivo, se recomienda cambiar no más de 3 pocillos a la vez. - Prepare un medio de cultivo completo fresco cada 7 días.
5. Recogida de muestras de sobrenadante de cultivo para la medición de albúmina y urea
- En los días 7, 10 y 14, recoja 500 μL de medio de los pocillos de muestra deseados en un tubo de microcentrífuga, como se muestra en la Figura 1C.
- Centrifugar la(s) muestra(s) a 320 x g durante 10 min a 4 °C hasta obtener residuos de gránulos.
- Utilice una pipeta para transferir los sobrenadantes de la muestra a los nuevos tubos de microcentrífuga, evitando la interrupción del gránulo.
- Realice las muestras en el ensayo de albúmina y/o urea (véanse las secciones 10 y 11, respectivamente).
NOTA: Las muestras pueden almacenarse a temperaturas de -20 °C a -80 °C durante 2 semanas.
6. Día de tinción I
PRECAUCIÓN: El tampón de fijación contiene paraformaldehído. El paraformaldehído puede causar daño ocular, irritación de la piel y toxicidad en los órganos. Trabaje en un área con buena ventilación y use el equipo de protección personal (EPP) adecuado.
- Después de la recolección de muestras de medio en el día 14, agregue 300 μL de tampón de fijación (ver Tabla de Materiales) a cada pocillo a teñir, como se muestra en la Figura 1C. Tiñe un mínimo de 2 pocillos.
- Incubar a 4 °C durante 20-60 min.
- Prepare 1 tampón de permeabilización (ver Tabla de Materiales) agregando 5 mL de solución madre 10x a 45 mL de PBS 1x (ver Tabla de Materiales).
NOTA: El tampón de permeabilización 1x se puede almacenar a 4 ° C durante 1 mes. - Lavar 2 veces con 300 μL de 1x tampón de permeabilización en hielo.
- Añadir 300 μL de citoqueratina 18 del anticuerpo primario (ver Tabla de Materiales) utilizando una dilución 1:1000 en tampón de permeabilización 1x en hielo.
NOTA: Como mínimo, incube un pocillo con 1x tampón de permeabilización solo para un control secundario de solo anticuerpos. - Incubar 16-24 h a 4 °C.
7. Día de tinción II
- Al día siguiente, extraiga el anticuerpo primario mediante pipeteo o aspiración endouterina.
- Lavar 2 veces con 300 μL por pocillo de 1x tampón de permeabilización en hielo.
- Añadir 300 μL de anticuerpo secundario fluorescente (ver Tabla de Materiales) utilizando una dilución 1:500 en tampón de permeabilización 1x (incluir solo control secundario).
NOTA: Evite la luz cuando use anticuerpos fluorescentes. - Incubar durante 30-45 min a 4 °C en oscuridad.
- Extraer el anticuerpo secundario mediante pipeteo o aspiración endouterina.
- Lavar 2 veces con 300 μL por pocillo de 1x tampón de permeabilización en hielo.
- Lavar 1 vez con 300 μL por pocillo de 1x PBS.
- Agregue 150 μL de medio de montaje 4′,6-diamidino-2-fenilindol (DAPI) (ver Tabla de Materiales) a cada pocillo e incube durante 15 min a RT en la oscuridad.
NOTA: La placa puede envolverse en parafilm y almacenarse a 4 °C en la oscuridad durante 1 semana. - Vista bajo un microscopio fluorescente. Capture 5 imágenes de cada canal fluorescente específico para cada pocillo utilizando la lente del objetivo de 10x (asegúrese de que una imagen tenga una barra de escala).
NOTA: DAPI tiene una excitación/emisión de 358 nm/461 nm. Utilice un microscopio fluorescente equipado con los filtros de detección adecuados tanto para DAPI como para el fluoróforo de anticuerpos secundarios.
8. Análisis de ImageJ (Figura 2)
NOTA: Se recomienda utilizar la versión 1.52a o superior de ImageJ.
- Abra una imagen que contenga una barra de escala en ImageJ. Haga clic en el icono de línea recta y dibuje una línea con la longitud exacta de la barra de escala [Figura 2 (1)]
NOTA: Si es necesario, haga clic en el icono de la lupa para acercar o alejar la imagen. - Haga clic en la pestaña Analizar . Resalte y haga clic en Establecer escala.
- Cambie Distancia conocida a la distancia de la barra de escala. Cambie Unidades de longitud a las unidades de la barra de escala. Aplique globalmente la configuración marcando Global. Haga clic en Aceptar para establecer la escala.
NOTA: Una vez que se aplica esta configuración, cada imagen abierta mostrará el área calculada del campo de visión en unidades ingresadas por el usuario. - Abra una imagen solo DAPI en ImageJ. Haga clic en la pestaña Proceso y resalte Restar fondo. Elimine el fondo 50 píxeles a la vez hasta que las áreas sin manchar estén negras.
NOTA: Si la imagen no contiene fondo, este paso no es necesario. - Haga clic en la pestaña Imagen y resalte Tipo. Haga clic en 8 bits para hacer que la imagen esté en escala de grises [Figura 2 (2)].
- Umbral de la imagen de forma manual o automática para incluir todas las partículas DAPI (tenga cuidado de no superar manualmente el umbral) [Figura 2 (3)]. Haga clic en la pestaña Imagen y resalte Ajustar. Haga clic en Umbral. Haga clic en Aplicar cuando haya terminado.
- Haga clic en la pestaña Proceso y resalte Binario. Haga clic en Cuenca hidrográfica.
- Haga clic en la pestaña Analizar y resalte /haga clic en Analizar partículas [Figura 2 (4)]. Establece el tamaño en 5-infinito y la circularidad en 0,00-1,00. En la pestaña desplegable Mostrar , seleccione Contornos. Asegúrese de que los resultados de visualización, el resumen y los agujeros de inclusión estén marcados. Haga clic en Aceptar.
NOTA: El rango de partículas deseado se puede ajustar si el umbral produce píxeles de fondo. - Registre el resultado del recuento como DAPI TOTAL.
- Abra una imagen combinada de citoqueratina 18/DAPI en ImageJ.
- Utilice el icono multipunto [Figura 2 (5)] para contar manualmente todas las partículas de DAPI no teñidas para la citoqueratina 18.
- Registre el resultado como CELDAS ALIMENTADORAS. Utilice la siguiente ecuación para determinar el DAPI de los hepatocitos.
DAPI de hepatocitos = DAPI total - DAPI de la célula alimentadora
9. Cuantificación del total de hepatocitos adheridos y porcentaje de adhesión (plaquetabilidad)
- Cree un factor de escala para el área de cultivo de 24 pocillos utilizando la siguiente ecuación. Las mediciones del campo de visión se pueden encontrar en la parte superior de cada imagen abierta [Figura 2 (2), recuadro verde].
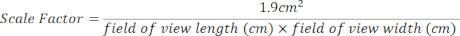
- Calcule el total de hepatocitos adheridos utilizando la siguiente ecuación.
Hepatocitos adheridos = Factor de escala × DAPI de hepatocitos - Calcule el porcentaje de adhesión de los hepatocitos utilizando la siguiente ecuación.
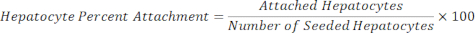
10. Ensayo de albúmina
- Mida la producción de albúmina utilizando un ensayo de inmunoadsorción enzimática tipo sándwich (ELISA) (ver Tabla de materiales) en muestras diluidas a 1:200.
NOTA: Para mayor precisión, el usuario confirma que las muestras se encuentran dentro del rango lineal de la curva estándar. El kit especificado proporciona todos los materiales e instrucciones para realizar el ensayo. - Normalice las concentraciones de la muestra a los hepatocitos adheridos utilizando la siguiente ecuación.
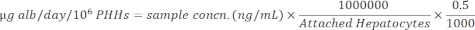
11. Ensayo de urea
PRECAUCIÓN: El reactivo ácido de nitrógeno ureico en sangre (BUN) contiene ácido sulfúrico. La concentración de ácido sulfúrico en el reactivo ácido BUN se considera corrosiva. No ingerir. Trabaje en un área con buena ventilación y use el EPP adecuado.
- La síntesis de urea se mide utilizando un método de monóxido de diacetilo modificado (ver Tabla de Materiales).
- Diluir 53,3 μL de 75 mg/dL de urea en 346,7 μL de medio de cultivo completo para hacer el Estándar #1 (100 μg/mL)
- Etiquete los tubos 2-8 y utilice una dilución seriada 1:2 para hacer los estándares de ensayo de urea (Tabla 1).
- Agregue 10 μL de muestra o patrón a los pocillos de una placa de 96 pocillos de fondo transparente y paredes negras (consulte la Tabla de materiales).
- Añadir 150 μL de reactivo BUN a cada pocillo que contenga la muestra. Prepare el reactivo BUN mezclando 1/3 del reactivo de color BUN con 2/3 del reactivo ácido BUN. Utilice la siguiente ecuación para ayudar en los cálculos.
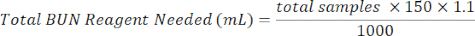
Reactivo de color BUN (mL) = Reactivo BUN total necesario × 0,333
Reactivo ácido BUN (ml) = Reactivo BUN total necesario × 0,667 - Placa de incubación durante 90 min en horno o incubadora a 60 °C.
- Lea la absorbancia de la placa inmediatamente a 540 nm y 650 nm.
- Cree una curva estándar restando la absorbancia en blanco y de fondo (650 nm) de todas las muestras y estándares. Genere una línea de mejor ajuste mediante un análisis de regresión lineal.
- Determine la concentración de muestra desconocida a partir de la curva estándar.
- Normalice las concentraciones de la muestra a hepatocitos adheridos utilizando la siguiente ecuación.
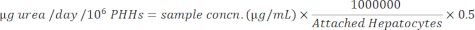
Resultados
El método general de siembra, cultivo y pruebas básicas de funcionalidad del sistema de cultivo hepático implica técnicas y análisis comunes de cultivo celular primario, como se ilustra en la Figura 1. La adhesión de los hepatocitos y el porcentaje de plaquetabilidad se calcularon el día 14 mediante el análisis ImageJ de al menos cinco imágenes de citoqueratina 18 y tinción de DAPI por pocillo (Figura 2). En la Figura 3 se muestran imágenes representativas de PHH cultivadas con células alimentadoras. Las diversas densidades de siembra hepática mostraron diferencias visuales de confluencia en función de la densidad de siembra y mantuvieron la morfología cuboidal hepática típica durante 14 días de cultivo. Se capturaron imágenes de los lotes A y B de donantes de hepatocitos para cada densidad de siembra probada (Figura 4A). El porcentaje promedio de plastibilidad para el donante B (89.04% ± 3.99%, 198,552 ± 49,885 PHHs) fue mayor que el donante A (66.08% ± 6.67%, 146,128 ± 33,063 PHHs) en todas las densidades de siembra utilizadas (Figura 4B). El donante A tuvo un porcentaje significativamente mayor de plaquetabilidad con 150.000 PHH/pocillo (76,07% ± 12,87%) en comparación con 250.000-300.000 PHH/pocillo (62,75% ± 9,64%). El donante B no mostró diferencias significativas en el porcentaje de plaquetabilidad de los hepatocitos. El donante B presentó la menor plaquetabilidad de hepatocitos (85,78% ± 13,25%) con la mayor densidad de siembra, 300.000 PHH/pocillo. Al igual que el donante A, el donante de siembra B a 150.000 PHHs/pocillo tuvo el mayor porcentaje de plaquetabilidad de los hepatocitos (94,75% ± 15,07%).
La producción de albúmina y la síntesis de urea se midieron en tres puntos temporales durante el período de cultivo de 14 días y se normalizaron a hepatocitos adheridos calculados. En general, el donante A presentó un aumento de la producción de albúmina en comparación con el donante B (41,32 ± 4,58 μg de alb/día/106 PHH vs. 34,66 ± 10,03 μg de alb/día/106 PHH) (Figura 5). Los donantes A y B tuvieron la mayor producción de albúmina al sembrar hepatocitos con 150.000 PHHs/pocillo, 45,91 ± 5,96 μg alb/día/106 PHHs y 48,67 ± 20,44 μg alb/día/106 PHHs, respectivamente. No se observaron diferencias significativas en la producción de albúmina en las densidades de siembra utilizadas. Como afirman Baudy et al.3, es deseable que los sistemas microfisiológicos hepáticos mantengan una producción constante de albúmina y síntesis de urea con menos del 50% de cambio durante 14 días de cultivo. El coeficiente de variación (CV) se calculó dividiendo la media por la desviación estándar de los días 7, 10 y 14. Todas las muestras se ejecutaron por duplicado. El CV para la producción de albúmina durante el período de cultivo de 14 días a 150.000 PHHs/pocillo fue del 12,24% para el donante A y del 37,97% para el donante B, por debajo del criterio deseado del 50%. Se observó una alta varianza en la producción de albúmina tanto en el donante A como en el donante B cuando se sembraron a 250.000 y 300.000 PHH/pocillo. A estas densidades de siembra, ambos donantes experimentan una fuerte disminución en la producción de albúmina entre los días 7, 10 y 14 de cultivo (donante CV A, 22,49% y donante B, 45,07%).
La síntesis de urea del donante B (95,09 ± 18,91 μg de urea/día/106) aumentó en comparación con la del donante A (64,92 ± 4,66 μg de urea/día/106 PHH) cuando se promediaron los datos específicos del lote de los días 7, 10 y 14 de PHH (Figura 6). El donante B (113,49 ± 37,34 μg de urea/día/106 PHHs) y el donante A (69,12 ± 17,06 μg de urea/día/106 PHHs) tuvieron la mayor síntesis de urea durante un período de cultivo de 14 días sembrando a una densidad de 150.000 PHHs/pocillo y 200.000 PHHs/pocillo, respectivamente. Ambos lotes donantes tuvieron la menor producción de urea y el CV más alto, con 300.000 PHH/pocillo. No se observaron diferencias significativas en la síntesis de urea en las densidades de siembra utilizadas. El CV más bajo para la síntesis de urea para el donante A se observó cuando se cultivó a 250.000 HPP/pocillo (23,11%) y 200.000 PHH/pocillo para el donante B (28,26%). Como se destaca en estos resultados, la densidad de siembra óptima para un lote dado de PHH depende del nivel de confluencia deseado en el momento del ensayo y de la naturaleza de los resultados que se están midiendo; Es posible que una mayor densidad de siembra no siempre se correlacione con una señal o un rango dinámico más altos.
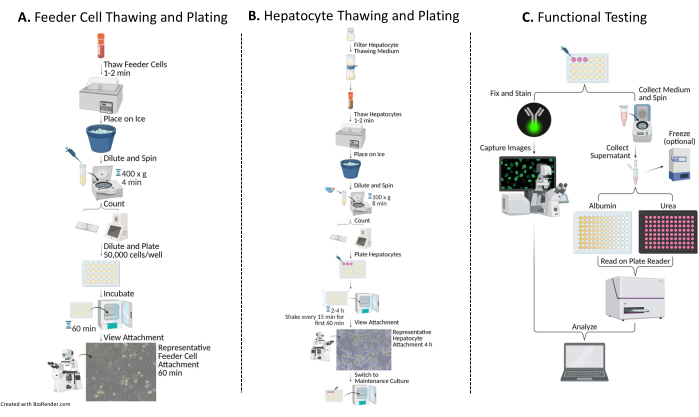
Figura 1: Diagrama de flujo de siembra, cultivo y pruebas funcionales de hepatocitos con células alimentadoras. (A) Las células alimentadoras se descongelan en un medio de descongelación específico (ver Tabla de Materiales), se resuspenden en un medio de siembra completo (ver Tabla de Materiales) y se cuentan las células. Las células se diluyen, se siembran y se incuban durante 60 min a 37 °C/5% CO2. (B) Los hepatocitos se descongelan en un medio de descongelación específico (ver Tabla de materiales), se resuspenden en un medio de siembra completo y se cuentan las células. Los hepatocitos se diluyen y se siembran con células alimentadoras. Las células se incuban durante 2-4 h a 37 °C/5% CO2, agitando en un movimiento N-S-E-W cada 15 min durante los primeros 60 min de cultivo. El medio de siembra se sustituye por un medio de cultivo completo precalentado para el mantenimiento del cultivo (véase la Tabla de materiales). Los cultivos se alimentan diariamente. (C) En los días 7, 10 y 14, se recolectan muestras de medio para pruebas de albúmina y urea. Después de la recolección de muestras el día 14, las células se fijan y se tiñen con el anticuerpo Citoqueratina 18 (ver Tabla de Materiales) 16-24 h a 4 °C. Además, se incuban en un anticuerpo secundario apropiado, se lavan y se montan con DAPI (ver Tabla de materiales) para su captura y análisis de imágenes. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Análisis de imágenes con el software ImageJ. Procesamiento ImageJ de las imágenes capturadas. Paso 1: se aplica una escala a todas las imágenes en función de la barra de escala específica del microscopio. Paso 2: se cambia el tipo de imagen. Paso 3: se aplica un límite de umbral a las partículas DAPI seleccionadas. Paso 4: se realiza un análisis de partículas y se registra el recuento. Paso 5: para determinar el número de celdas alimentadoras adjuntas, se cuenta una imagen combinada con la herramienta multipunto. Haga clic aquí para ver una versión más grande de esta figura.
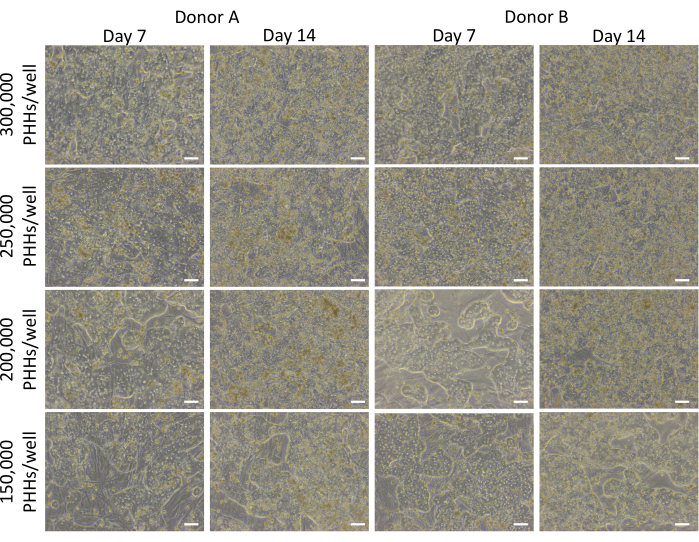
Figura 3: Morfología de varias densidades de siembra hepática cultivadas con células alimentadoras. Imágenes representativas en los días 7 y 14 de PHHs cultivadas con células alimentadoras (50.000 células/pocillo) a densidades de siembra hepática de 150.000, 200.000, 250.000 y 300.000 PHHs/pocillo. Las imágenes se tomaron con una lente de objetivo de 10x en un microscopio de contraste de fase invertida. Barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
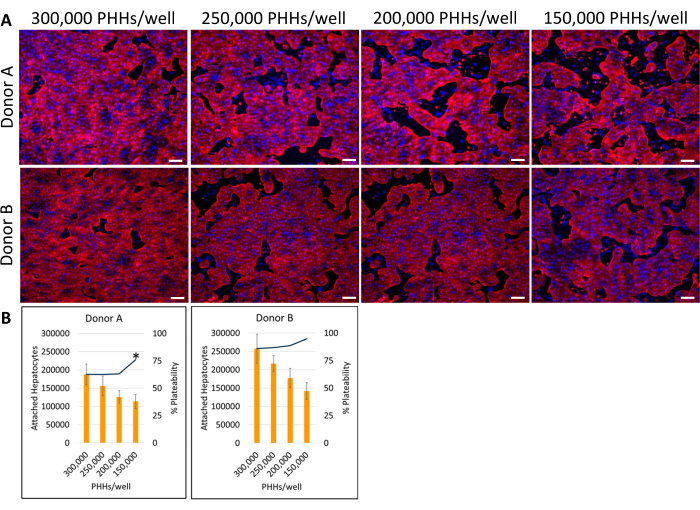
Figura 4: Inmunocitoquímica fluorescente de varias densidades de siembra hepática cultivadas con células alimentadoras. (A) Imágenes representativas de tinción de citoqueratina 18 (rojo) en el día 14 a densidades de siembra hepática de 150.000, 200.000, 250.000 y 300.000 PHH/pocillos. Se fijaron dos pocillos para cada densidad de siembra durante 30 min a 4 °C. Los pocillos se incubaron 16-24 h a 4° C con anticuerpo primario a 1:1000. Se utilizó un anticuerpo secundario a 1:500 durante 30 min a 4 °C en oscuridad. Se añadió tinción nuclear DAPI (azul) a los pocillos durante 15 min a temperatura ambiente. Las imágenes se tomaron utilizando una lente de objetivo de 10X en un microscopio fluorescente invertido. Barra de escala = 100 μm. (B) Se calcularon los hepatocitos adheridos y el porcentaje de plaquetabilidad de varias densidades de siembra hepática calculadas utilizando ImageJ. *p ≤ 0.05, al porcentaje de plateabilidad para 200,000, 250,000 y 300,000 PHH/pocillo. Las barras de error representan la desviación estándar (n ≥ 5 imágenes por condición). Haga clic aquí para ver una versión más grande de esta figura.
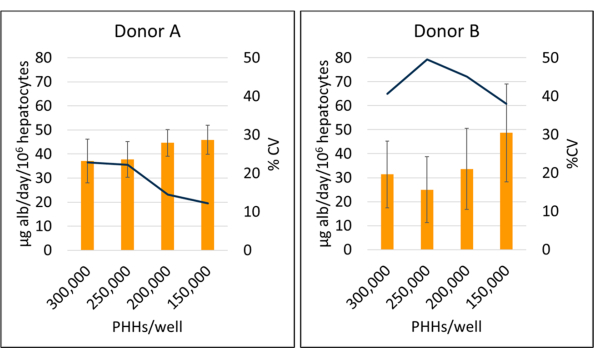
Figura 5: Producción de albúmina de hepatocitos cultivados con células alimentadoras. Producción de albúmina a partir de densidades de siembra hepática de 150.000, 200.000, 250.000 y 300.000 PHHs/pocillo. Las columnas representan el promedio de 14 días de microgramos de albúmina/día normalizados al total de hepatocitos unidos. Una línea representa CV entre los días 7, 10 y 14. Las barras de error representan la desviación estándar (n ≥ 2 pocillos por condición con réplicas). Haga clic aquí para ver una versión más grande de esta figura.
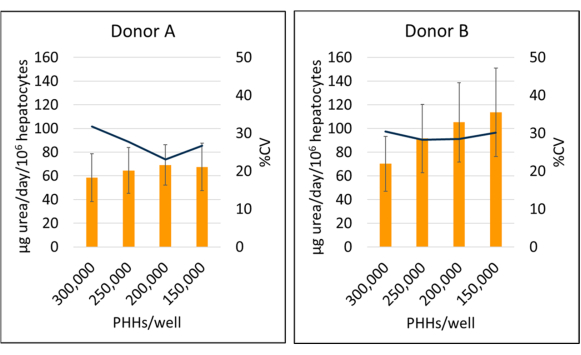
Figura 6: Síntesis de urea de hepatocitos cultivados con células alimentadoras. Síntesis de urea a partir de densidades de siembra hepática a 150.000, 200.000, 250.000 y 300.000 PHHs/pocillo. Las columnas representan el promedio de 14 días de μg de urea/día normalizado al total de hepatocitos adheridos. Una línea representa %CV entre los días 7, 10 y 14. Las barras de error representan la desviación estándar (n ≥ 2 pocillos por condición con réplicas). Haga clic aquí para ver una versión más grande de esta figura.
| Estándar (S) # | Concentración (μg/mL) | Solución de urea (μL) | Cultivo completo (μL) |
| 1 | 100 | 53.3 75 mg/dL de stock | 346.7 |
| 2 | 50 | 100 (Solución S1) | 100 |
| 3 | 25 | 100 (Solución S2) | 100 |
| 4 | 12.5 | 100 (Solución S3) | 100 |
| 5 | 6.26 | 100 (Solución S4) | 100 |
| 6 | 3.125 | 100 (Solución S5) | 100 |
| 7 | 1.5625 | 100 (Solución S6) | 100 |
| Espacio en blanco | 0 | 0 | 100 |
Tabla 1: Preparación de la muestra estándar de urea. Con 75 mg/dL de urea madre, prepare una solución de urea de 100 μg/mL. Alícuota los volúmenes sugeridos para alcanzar la concentración final de la curva estándar.
Discusión
El sistema de cultivo hepático descrito puede establecerse en laboratorios que están equipados con instrumentación estándar de cultivo de tejidos. Compuesto por PHH cultivadas con células alimentadoras, el sistema permite al usuario cultivar PHH durante al menos dos semanas con producción estable de albúmina y síntesis de urea. Debido a la variabilidad de los lotes de donantes de PHH, solo se recomienda su uso en el sistema de PHH preseleccionados y calificados. Aunque el número de PHH adheridas varía según el lote donante y la densidad de siembra, la plastibilidad relativa sigue siendo similar dentro de cada lote donante. Si bien se recomiendan las densidades de siembra recomendadas, los datos anteriores sugieren que la densidad de siembra de hepatocitos se puede ajustar para diferentes necesidades experimentales; sin embargo, debe tenerse en cuenta que la siembra de un mayor número de PHH puede no proporcionar resultados funcionales más altos o más consistentes. El análisis de los lotes de PHH evaluados mostró el CV más bajo para la producción de albúmina y la síntesis de urea utilizando densidades de siembra más bajas de 150.000 PHHs/pocillo y 200.000 PHHs/pocillo; sin embargo, no se encontraron diferencias significativas entre la albúmina y la urea en ninguna densidad de siembra. Las densidades de siembra más altas de 250,000 PHHs/pocillo y 300,000 PHHs/pocillo muestran una mayor disminución de albúmina y urea durante el período de cultivo de 14 días. La variabilidad inherente del donante en la plaquetabilidad puede afectar la consistencia de la producción de albúmina y la síntesis de urea a 250.000 PHH/pocillo y 300.000 PHH/pocillo para los lotes de donantes analizados. Al igual que los esferoides de hepatocitos grandes, la resiembra de PHH en el sistema TV2D+ puede tener efectos negativos en el cultivo y la funcionalidad a largo plazo de los PHH.
Todos los pasos de descongelación, enchapado y mantenimiento son fundamentales para el éxito de la cultura y la generación de datos; Sin embargo, hay varios errores comunes que los usuarios inexpertos pueden evitar. Los PHH son altamente susceptibles a daños secundarios a la fluctuación de temperatura, el esfuerzo cortante y la exposición al aire 9,10. Se deben tomar precauciones al descongelar los PHH para evitar períodos de descongelación prolongados y un pipeteo excesivo. El uso de un método de vertido manual, un temporizador y la transferencia inmediata del baño de agua al hielo reducirá estos errores comunes que pueden afectar la viabilidad y la capacidad de los PHH. Además, con los problemas de la cadena de suministro cada vez más comunes, puede ser difícil obtener placas recubiertas de colágeno. Para superar este problema se puede utilizar el recubrimiento manual de placas tratadas con cultivo de tejidos utilizando soluciones comerciales de colágeno tipo I (5-10 μg/cm2); Sin embargo, para un rendimiento y consistencia óptimos, se recomienda utilizar placas de colágeno prerrecubiertas. En el proceso de transición del cultivo solo de células alimentadoras a la introducción de PHH, es fundamental evitar que la capa de células alimentadoras se seque. Nunca permita que el aire se exponga a las celdas de alimentación. Cualquier tiempo de exposición al aire puede conducir a una mala calidad de la capa de células alimentadoras, lo que tendrá un impacto negativo en el cultivo a largo plazo de PHH. Es una buena práctica permitir que quede una pequeña cantidad de medio residual entre los cambios de medio. En ocasiones, los PHH pueden contener un exceso de residuos procedentes del aislamiento, lo que puede dificultar la visualización de la morfología. Para ayudar con este problema, agite la placa antes de un cambio medio y use la aspiración endouterina. Finalmente, al realizar un cambio de medio, aspire con cuidado el medio gastado, teniendo cuidado de no perturbar las células cultivadas. Pipetee un volumen medio fresco por el costado del pocillo para evitar pipetear directamente sobre la capa celular. El usuario también debe evitar la exposición al aire en cada cambio de medio, utilizando el cambio recomendado de 3 pocillos (Secciones 3 y 4). También hay que tener en cuenta que un cambio diario de medio es ideal pero no obligatorio.
Aunque los microscopios fluorescentes se han vuelto comunes en la mayoría de los laboratorios, el software necesario para realizar análisis de imágenes específicas puede incurrir en gastos adicionales. ImageJ se puede descargar de forma gratuita, lo que la convierte en una herramienta de análisis de imágenes de fácil acceso. Los pasos del protocolo proporcionan una base para la que el usuario puede necesitar optimizar, específicamente el análisis de partículas de la tinción DAPI; sin embargo, en ausencia de capacidad de obtención de imágenes fluorescentes, los valores de fijación de PHH en el día 14 se proporcionan en certificados de análisis específicos del lote. Un umbral deficiente dará lugar a un recuento inexacto de las partículas DAPI. También se recomienda verificar el área de superficie de las partículas DAPI individuales antes de establecer una exclusión de tamaño. Esto se puede lograr utilizando el icono ovalado [Figura 2 (1), icono circular debajo de la pestaña Editar ] y dibujando un círculo que abarque la partícula DAPI. La pestaña Analizar se puede utilizar para medir el área de la partícula DAPI seleccionada. Las mediciones específicas se pueden seleccionar utilizando el Conjunto de medidas en la pestaña Analizar [paso 8.9 y Figura 2 (4)].
Los métodos actuales para el cultivo de PHH implican el uso de recubrimientos como el colágeno-I para aumentar la adhesión celular en monocultivos bidimensionales tradicionales11 o la superposición con una matriz extracelular, como el Matrigel de base murina, una técnica comúnmente conocida como "cultivo sándwich"12,13,14,15 . Si bien la técnica de cultivo en sándwich mejora la morfología y la polaridad de la PHH a lo largo del tiempo en comparación con el monocultivo tradicional, ambos enfoques aún carecen de estabilidad fenotípica a largo plazo en el cultivo para la mayoría de los lotes placables de PHH. Otro método utilizado para cultivar PHH es la fabricación de esferoides 3D; sin embargo, como ya han señalado Glicklis et al.4, puede haber desafíos técnicos con la reproducibilidad del tamaño del esferoide debido a la variabilidad del donante. En un esfuerzo por hacer un modelo hepático fisiológicamente más relevante, se han desarrollado modelos multicelulares. Como describen Ware et al.7, mediante el uso de micropatrones, los fibroblastos murinos y las células endoteliales sinusoides hepáticas primarias humanas rodeadas de PHH permitieron tiempos de cultivo in vitro más prolongados. Sin embargo, la creación de micropatrones puede ser un proceso complejo y que requiere mucho tiempo, y las células alimentadoras no humanas pueden contribuir al fondo de las señales metabólicas, lo que limita la utilidad de esta plataforma en ciertas aplicaciones. El uso de varias células no hepáticas, incluidos los fibroblastos dérmicos humanos y de rata y las células endoteliales de la aorta bovina como células alimentadoras para el cocultivo de hepatocitos, ha demostrado una secreción de albúmina y una formación de uniones estrechas similares a los cocultivos de células alimentadoras de origen hepático16. Sin embargo, el mecanismo de interacciones entre las células alimentadoras no hepáticas TV2D+ y las PHH en cultivo debe investigarse más a fondo para comprender mejor la influencia en la estabilidad y funcionalidad de las PHH en este sistema. El sistema de cultivo descrito previamente por Weaver et al.8 puede cultivar con éxito PHHs en colonias hepáticas hasta por 42 días, formando extensas redes canaliculares biliares. Las PHH cultivadas en este sistema mantuvieron una funcionalidad hepática clave, incluida la actividad del citocromo 1A2, 2B6 y 3A4 y la actividad enzimática basada en la uridina 5′-difosfo-glucuronosiltransferasa (UGT), la formación de metabolitos de fase I y II, la producción de albúmina y la síntesis de urea durante al menos 22 días in vitro sin Matrigel. Este sistema de cultivo produce resultados estables y fisiológicamente relevantes que se adaptan fácilmente a cualquier laboratorio para aplicaciones farmacológicas y toxicológicas. Aunque las funciones clave de PHH se mantienen en el sistema TV2D+, no se han realizado comparaciones directas con el modelo de esferoide 3D; sin embargo, los trabajos futuros que comparen los mismos donantes de PHH entre los sistemas de cultivo resultarán valiosos para determinar los límites y ventajas de ambos métodos.
Las aplicaciones potenciales de TV2D+ incluyen la evaluación del aclaramiento metabólico y las interacciones farmacológicas de compuestos de baja rotación, la lesión hepática inducida por fármacos y la evaluación del riesgo de agroquímicos. La predicción precisa del aclaramiento hepático de fármacos nuevos y emergentes se basa en un cultivo estable y prolongado de PHH con retención de la funcionalidad hepatocelular clave, lo que es particularmente difícil cuando se evalúan compuestos de baja rotación. Además, la evaluación del riesgo y la toxicidad hepática inducida por sustancias químicas son problemas de salud importantes, y los modelos actuales no proporcionan la estabilidad y la funcionalidad a largo plazo en el cultivo para evaluar con precisión la posible toxicidad química crónica que puede ser secundaria a la exposición aguda. Los PHH sanos y enfermos cultivados en TV2D+ mostraron diferencias características en la función y la disposición lipídica que se mantuvieron a lo largo del tiempo17. Estos estudios respaldan a TV2D+ como una herramienta prometedora para una variedad de aplicaciones farmacológicas y toxicológicas.
Divulgaciones
JO, LW, EG, EL, SP y JW son empleados de LifeNet Health, la organización sin fines de lucro que produce TV2D+.
Agradecimientos
Nos gustaría agradecer a Mellissa Keller y Wendy Hetman por su ayuda con la revisión de manuscritos y figuras.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 µm PES filter unit | Thermo Fisher Scientific | 565-0020 | User preference |
| 15 mL or 50 mL conical tubes | Thermo Fisher Scientific | 352196 or 352070 | User preference |
| Alexa Fluor 555, goat anti-rabbit | Thermo Fisher Scientific | A-21428 | Other secondary antibodies can work |
| Anti-Cytokeratin 18 antibody | abcam | ab24561 | Necessary using same dilution |
| AOPI | Nexcelom | CS2-0106-5mL | Used for Cellometer counting |
| Biosafety cabinet | Labconoco | 3460801 | User preference |
| Black-walled, clear bottom, 96-well plate | Thermo Fisher Scientific | 165305 | User preference |
| Centrifuge | Thermo Fisher Scientific | Sorvall X4R | Capable of speeds up to 400 x g |
| Collagen coated plate, 24-well | Greiner Bio-One | 662950 | Rat tail collagen coating |
| Counting slides | Nexcelom | CHT4-SD100-002 | Used for Cellometer counting |
| Culture medium | LifeNet Health | MED-TCCM | |
| Culture supplement | LifeNet Health | MED-TCSC | |
| DAPI | Thermo Fisher Scientific | 00-4959-52 | Contains mounting medium |
| DPBS (-Ca, -Mg) | Thermo Fisher Scientific | 14190250 | User preference |
| Feeder cell supplement | LifeNet Health | MED-TCSA | |
| Feeder cell thawing medium | LifeNet Health | MED-FCTM | |
| Fluorescent microscope | Zeiss | AxioObserver Z1 | Equipped with user specific filters |
| Hepatocyte thawing medium | LifeNet Health | MED-HHTM4C-50ML | |
| Human albumin ELISA kit | abcam | ab108788 | Necessary if using same dilution |
| Human feeder cells | LifeNet Health | PHFC24 | |
| Humidified incubator | VWR | 97025-842 | Capable of 5% CO2 |
| IC Fixation buffer | Thermo Fisher Scientific | 00-8222-49 | Paraformaldehyde based, 10% formalin can also be used |
| ImageJ | National Insitute of Health | Version 1.52a | 1.52a or higher |
| Inverted phase contrast microscope | Olympus | CK40-F100 | User preference |
| Microcentrifuge tubes | VWR | 20170-022 | User preference |
| Micropipettes (various sizes) | USA Scientific | ErgoOne | User preference |
| Permeabilization buffer (10x) | Thermo Fisher Scientific | 00-8333-56 | Other permeabilization buffers can work |
| Plate reader | BMG Labtech | CLARIOstar | Capable of reading absorbance 450-640 nm |
| Plating medium | LifeNet Health | MED-TCPM | |
| Plating supplement | LifeNet Health | MED-TCSB | |
| Primary human hepatocytes | LifeNet Health | various | Catalog number may vary based on lot number |
| Secondary antibody | Thermo Fisher Scientific | A-21428 | User preference |
| Serological pipet controller | Gilson | F110120 | User preference |
| Storage bottle 100–500 mL | VWR | 76311-770 | User preference |
| Urea Nitrogen (BUN) Test | Stanbio | 0580-250 | |
| Water bath | PolyScience | WBE05 | Capable for use at 37 °C |
Referencias
- Khetani, S. R., Bhatia, S. N. Microscale culture of human liver cells for drug development. Nature Biotechnology. 26 (1), 120-126 (2008).
- Swift, B., Pfeifer, N. D., Brouwer, K. L. Sandwich-cultured hepatocytes: an in vitro model to evaluate hepatobiliary transporter-based drug interactions and hepatotoxicity. Drug Metabolism Reviews. 42 (3), 446-471 (2010).
- Baudy, A. R., et al. Liver microphysiological systems development guidelines for safety risk assessment in the pharmaceutical industry. Lab on a Chip. 20 (2), 215-225 (2020).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Khetani, S. R., et al. Microengineered liver tissues for drug testing. Journal of Laboratory Automation. 20 (3), 216-250 (2015).
- Monckton, C. P., Brown, G. E., Khetani, S. R. Latest impact of engineered human liver platforms on drug development. APL Bioengineering. 5 (3), 031506 (2021).
- Ware, B. R., Durham, M. J., Monckton, C. P., Khetani, S. R. A cell culture platform to maintain long-term phenotype of primary human hepatocytes and endothelial cells. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 187-207 (2018).
- Weaver, J. R., et al. The morphology, functionality, and longevity of a novel all human hepatic cell-based tri-culture system. Toxicology In Vitro. 86, 105504 (2023).
- Li, W., et al. Matrix stiffness and shear stresses modulate hepatocyte functions in a fibrotic liver sinusoidal model. American Journal of Physiology, Gastrointestinal and Liver Physiology. 320 (3), G272-G282 (2021).
- Thompson, S. M., et al. Heat stress induced cell death mechanisms in hepatocytes and hepatocellular carcinoma: in vitro and in vivo study. Lasers in Surgery and Medicine. 46 (4), 290-301 (2014).
- Mooney, D., et al. Switching from differentiation to growth in hepatocytes: control by extracellular matrix. Journal of Cellular Physiology. 151 (3), 497-505 (1992).
- Berthiaume, F., Moghe, P. V., Toner, M., Yarmush, M. L. Effect of extracellular matrix topology on cell structure, function, and physiological responsiveness: hepatocytes cultured in a sandwich configuration. The FASEB Journal. 10 (13), 1471-1484 (1996).
- Hamilton, G. A., et al. Regulation of cell morphology and cytochrome P450 expression in human hepatocytes by extracellular matrix and cell-cell interactions. Cell and Tissue Research. 306 (1), 85-99 (2001).
- Orkin, R. W., et al. A murine tumor producing a matrix of basement membrane. Journal of Experimental Medicine. 145 (1), 204-220 (1977).
- Sivaraman, A., et al. A microscale in vitro physiological model of the liver: predictive screens for drug metabolism and enzyme induction. Current Drug Metabolism. 6 (6), 569-591 (2005).
- Goulet, F., Normand, C., Morin, O. Cellular interactions promote tissue-specific function, biomatrix deposition and junctional communication of primary cultured hepatocytes. Hepatology. 8 (5), 1010-1018 (1988).
- Odanga, J. J., Breathwaite, E. K., Presnel, S., LeCluyse, E. L., Weaver, J. R. Characterization of primary human hepatocytes from diseased and healthy livers in an all-human cell based triculture system. The Toxicologist, a Supplement to Toxicological Sciences. , 4283 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados