Method Article
Perfusión de Langendorff modificada para prolongar los tiempos de perfusión de injertos cardíacos de roedores
En este artículo
Resumen
Este artículo demuestra la factibilidad de lograr tiempos de perfusión más largos (4 h) de injertos cardíacos murinos sin pérdida de función mediante el empleo de presiones de perfusión más bajas (30-35 mmHg) que las fisiológicas (60-80 mmHg) durante Langendorff.
Resumen
A pesar de los importantes avances en el diagnóstico y tratamiento de las enfermedades cardiovasculares (ECV), el campo necesita urgentemente una mayor investigación y avances científicos. Como resultado, la innovación, la mejora y/o la reutilización del conjunto de herramientas de investigación disponibles pueden proporcionar mejores bancos de pruebas para el avance de la investigación. La perfusión de Langendorff es una técnica de investigación extremadamente valiosa para el campo de la investigación de las ECV que puede modificarse para adaptarse a una amplia gama de necesidades experimentales. Esta adaptación se puede lograr personalizando una gran cantidad de parámetros de perfusión, incluida la presión de perfusión, el flujo, la perfusión, la temperatura, etc. Este protocolo demuestra la versatilidad de la perfusión de Langendorff y la viabilidad de lograr tiempos de perfusión más largos (4 h) sin pérdida de la función del injerto mediante el uso de presiones de perfusión más bajas (30-35 mmHg). Lograr tiempos de perfusión prolongados sin daño del injerto y/o pérdida de función causada por la técnica en sí tiene el potencial de eliminar los elementos de confusión de los resultados experimentales. En efecto, en circunstancias científicas en las que los tiempos de perfusión más largos son relevantes para las necesidades experimentales (es decir, tratamientos farmacológicos, análisis de respuestas inmunológicas, edición de genes, preservación de injertos, etc.), presiones de perfusión más bajas pueden ser clave para el éxito científico.
Introducción
El campo de la investigación cardiovascular ha experimentado importantes avances en el diagnóstico y tratamiento de las enfermedades cardiovasculares (ECV). Sin embargo, a pesar de la disminución general de las tasas de incidencia y mortalidad, las ECV siguen siendo la principal causa de muerte a nivel mundial 1,2. Este hecho alarmante pone de relieve la necesidad de aumentar la investigación y el avance científico, que sin duda depende de la precisión y previsibilidad de las herramientas de investigación disponibles. Como resultado, existe una necesidad constante de innovación, mejora y/o reutilización del conjunto de herramientas de investigación. Por ejemplo, la perfusión cardíaca retrógrada o de Langendorff, una técnica disponible para el campo desde hace más de un siglo, puede modificarse fácilmente para cubrir una gama más amplia de necesidades científicas y lograr una gama más amplia de aplicaciones.
El aislamiento del injerto cardíaco del resto del organismo durante la perfusión de Langendorff proporciona un importante grado de control sobre una amplia gama de parámetros experimentales, incluyendo la temperatura, la solución circulante, las presiones de perfusión coronaria, etc.3,4,5,6,7. La manipulación de estos parámetros facilita la simulación de un gran número de escenarios cardíacos que pueden ser aprovechados para avanzar en los avances científicos 5,8,9,10. Entre estos parámetros, la presión de perfusión es probablemente el escenario experimental más pasado por alto11.
Durante Langendorff, las presiones de perfusión exhiben una correlación directa con la frecuencia cardíaca, las presiones sistólicas/diastólicas máximas y el consumo de oxígeno11. Esta correlación proporciona un control directo y preciso sobre la cantidad de trabajo producido por los injertos cardíacos, que se puede ajustar para satisfacer las necesidades experimentales individuales. A pesar de esta valiosa capacidad de control, el campo ha gravitado históricamente hacia el uso de presiones de perfusión más altas (60-80 mmHg), sometiendo a todos los injertos cardíacos a una alta demanda de trabajo, independientemente de las necesidades experimentales 8,12,13,14,15. Las consecuencias de esta demanda innecesariamente alta de trabajo surgen del principio general de que el exceso de trabajo tiende a provocar un fracaso prematuro. Esto parece ser particularmente cierto para los injertos cardíacos perfundidos a través de Langendorff, ya que la naturaleza no fisiológica de este método y la falta de apoyo a la recuperación presente in vivo parecen exacerbar el fracaso del injerto. Esta pérdida prematura de la función del injerto limita significativamente la perfusión y los tiempos experimentales. En efecto, en circunstancias en las que los tiempos de perfusión más largos son más relevantes para las necesidades experimentales (es decir, tratamientos farmacológicos, análisis de respuestas inmunológicas, edición de genes, preservación del injerto, etc.), se puede permitir un menor trabajo cardíaco a cambio de una mayor durabilidad del injerto.
Este protocolo demuestra la viabilidad de utilizar presiones de perfusión más bajas (30-35 mmHg) durante Langendorff, así como el efecto significativo que estas representan para la función del injerto cardíaco a lo largo del tiempo en comparación con presiones de perfusión más altas (60-80 mmHg). Además, los hallazgos de este manuscrito destacan la importancia de priorizar la personalización de la amplia gama de parámetros de perfusión para satisfacer mejor las necesidades experimentales.
Protocolo
Este estudio se lleva a cabo siguiendo el Comité Institucional de Cuidado y Uso de Animales (IACUC) del Hospital General de Massachusetts.
1. Diseño del sistema
- Ensamble el sistema con los tres componentes de doble camisa, que incluyen una trampa de burbujas, un depósito, un oxigenador, una bomba peristáltica y un circulador de agua.
- Fije todos los componentes encamisados a un soporte de abrazadera. Conecte los componentes en secuencia con tubos de silicona en dos secuencias diferentes (Figura 1A).
- Secuencia 1 - Patrón de flujo de agua a través de la camisa (líneas continuas en la Figura 1A):
- Conecte el flujo de salida del circulador de agua a la entrada inferior de la camisa de la trampa de burbujas mediante un tubo de 36 G. Esto garantizará que la perfusión se mantenga a la temperatura adecuada (37 °C) antes de llegar al corazón, ya que el agua perderá calor a medida que viaja a través de los otros componentes del sistema.
- Conecte la entrada superior de la camisa de la trampa de burbujas a la entrada inferior de la camisa del depósito usando un tubo del mismo tamaño.
- Posteriormente, conecte la entrada superior de la camisa del depósito a la entrada inferior de la camisa del oxigenador.
- Finalmente, conecte la entrada superior del oxigenador a la entrada del circulador de agua.
- Secuencia 2 - Patrón de flujo del perfusado a través del sistema (líneas discontinuas en la Figura 1A)
- Conecte los conectores luer a ambos lados del tubo de 16 G. Fije el primer extremo a la base del depósito y aliméntelo a través del cabezal de la bomba peristáltica. Conecte el otro extremo a una de las entradas de la bobina de silicona dentro del oxigenador.
- Conecte una segunda pieza de tubo de 16 G, provista de conectores Luer Lock en ambos extremos, en la segunda entrada de la bobina de silicona del oxigenador a la entrada en la trampa de burbujas con la protuberancia larga.
- Conecte una pieza más corta de tubo de 16 G, equipada con conectores luer, a la salida no utilizada de la trampa de burbujas a una válvula de bloqueo luer de tres vías.
- En el lado opuesto de la válvula de tres vías, conecte un trozo de tubo de 16 G con una segunda válvula luer en el otro extremo. Esta segunda válvula se encuentra inmediatamente encima del embalse. Conecte el lado opuesto de la válvula a más tubos de 16 G, seguidos del sensor de presión.
- Conecte un tubo de menor diámetro ( ̃3,7 mm) al puerto vertical de la válvula de tres vías con un conector a la cánula (angiocath de 14 G). El perfusionado fluye desde el reservorio al oxigenador a través de la trampa de burbujas antes de recircular de nuevo al reservorio a través de la conexión de la cánula aórtica.
- Secuencia 1 - Patrón de flujo de agua a través de la camisa (líneas continuas en la Figura 1A):
2. Preparación de la perfusión
- Prepare la base de perfusión, 0,96% de tampón Krebs-Henseleit, 9,915 mM de dextrano, 25 mM de bicarbonato de sodio, 1,054 mM de albúmina sérica bovina, 1% de estreptococo de pluma, 0,13% de insulina, 0,02% de hidrocortisona, 0,5% de heparina y 2,75 mM de cloruro de calcio y lleve a volumen con agua destilada.
3. Configuración del sistema de perfusión
- Conecte dos jeringas de 10 ml a los puertos de ventilación superior y lateral de la trampa de burbujas.
- Agregue el perfusado base (75 mL) al depósito. Encienda la bomba peristáltica y ajuste el circulador de agua a 37 °C.
- Conecte una línea de oxígeno (95%O2 y 5% CO2) a la tercera entrada del oxigenador y oxigene la perfusión a un pO2 mínimo de 400 mmHg.
- Asegure un puerto de inyección al puerto vertical de la válvula de tres vías inmediatamente después de la trampa de burbujas. Conecte una aguja de infusión alada con una jeringa de 1 ml al puerto de inyección (utilizado para la toma de muestras). Golpee suavemente el puerto de inyección o extraiga la perfusión con la jeringa de 1 ml para eliminar las burbujas introducidas en el circuito.
- Una vez que la perfusión de la base haya alcanzado la temperatura y el nivel de oxígeno, realice una lectura inicial de los parámetros bioquímicos para asegurar la correcta concentración de iones (Tabla 1) y una correcta oxigenación.
NOTA: Los niveles de iones y pH deben leerse después de que la solución haya alcanzado la temperatura (37 °C) y se haya oxigenado con la mezcla de gases adecuada (95% O2, 5% CO2). - Ponga a cero el sensor de presión soltando el tubo conectado y permita que el flujo de perfusión a través del sensor abierto y la cánula se equilibre. Una vez equilibrado, presione el botón cero en la caja del sensor y vuelva a sujetar el tubo. Registre las presiones de base antes de la conexión del corazón al sistema para flujos que oscilan entre 1 mL/min y 15 mL/min.
- Perfusión a baja presión
- Goteo de adenosina: Realice una reserva inicial de 20 mM de adenosina en la base perfusiva. Disuelva la adenosina colocando el tubo en un baño de agua tibia y mezclando por inversión.
- Diluir la adenosina madre hasta una concertación de 0,06 mg/ml en perfusión de base y añadirla a una jeringa de 50 ml.
- Conecte una aguja de infusión alada a la jeringa de 50 ml y conéctela al puerto de inyección de la válvula de tres vías. Fije la jeringa a una bomba de jeringa y ajústela a una velocidad de infusión de 166,6 μL/min.
NOTA: Las burbujas se liberan del puerto de infusión golpeando o moviendo ligeramente el puerto.
- Perfusión a alta presión:
- Aislamiento de glóbulos rojos empaquetados (glóbulos rojos):
- Recolectar 10-12 mL de sangre entera de rata a través de una punción cardíaca de una rata donante.
- Centrifugar la sangre a 2000 x g durante 10 min.
- Retire la capa de plasma y capa leucitaria mediante pipeteo.
- Vuelva a suspender los glóbulos rojos en perfusión sin cloruro de calcio en una proporción de 1:1 (p. ej., 5 ml de glóbulos rojos: 5 ml de perfusión) mediante mezcla inversa.
- Repita los pasos 3.8.1.2-3.8.1.4 dos veces para un total de 3 lavados.
- Después del último lavado, vuelva a suspender las células en perfusión en una proporción de 1:1 y agregue la mezcla al sistema de perfusión, que ya contiene los 75 mL de base de perfusión.
- Permita que las células se distribuyan uniformemente a través del sistema y mida el hematocrito de la perfusión utilizando una máquina de hematología. El hematocrito oscila entre el 5% y el 7%.
- Aislamiento de glóbulos rojos empaquetados (glóbulos rojos):
4. Preparación de la obtención de injertos cardíacos
- Prepare completamente el sistema de perfusión antes del inicio de la adquisición para minimizar el tiempo de isquemia fría.
- Preparar los instrumentos quirúrgicos. Las herramientas quirúrgicas incluyen almohadillas azules, cinta quirúrgica, suturas de seda 5-0, hisopos de algodón, jeringas de solución salina (50 mL y 10 mL), tijeras de operación, fórceps, micro tijeras, micro pinzas, pinza Halstead, 30 U de heparina, 16 G de tubo para lavado portal, 14 G de tubo para canulación del corazón, 16 G de angiocath, angiocath modificado de 14 G con manguito, sensor de presión, cubitera con hielo, placa de Petri de 47 mm, gasa.
- Cree una cánula modificada insertando un anillo delgado de tubo (diámetro interior [ID] 0,167 mm, diámetro exterior [OD] 2,42 mm) en la cánula de 14 G, creando un efecto de manguito.
- Retire la aguja de la cánula y agregue una gota de superpegamento debajo del anillo. Deslice con cuidado el anillo a 1/4 de pulgada por encima de la base de la cánula. Deje que el pegamento se seque antes de usarlo.
- Corte la cánula lo más cerca posible del manguito en ángulo y elimine los bordes afilados.
- Llene una jeringa de 60 ml con solución salina heparinizada (0,03 U/ml) para el lavado de la vena porta. Conecte la jeringa al sensor de presión, seguido del tubo de lavado de 16 G.
- Conecte una jeringa de 10 mL de solución salina heparinizada (0,03 U/mL) al tubo de 14 G. Conecte el otro extremo del tubo a la cánula aórtica y enjuague para eliminar las burbujas de aire.
- Colocar la cánula aórtica en una placa de Petri de 47 mm con gasa y rellena de solución salina. Deje la placa de Petri en hielo hasta que el corazón esté conectado al sistema de perfusión.
5. Obtención de injerto cardíaco
- Anestesiar a las ratas en una cámara anestésica con isoflurano al 3%.
- Una vez que no se noten los reflejos, retire la rata de la cámara, colóquela en el espacio quirúrgico y administre isoflurano continuo (3%) a través de una mascarilla.
- Después de la prueba de pellizco del dedo del pie, heparinizar al animal a través de la vena del pene con 30 U de heparina.
- Afeita la rata por todo el abdomen y la parte superior del pecho. Retire las virutas de piel del campo quirúrgico. Tape cada extremidad con cinta adhesiva para asegurarse de que no se mueva durante la cirugía.
- Haga una incisión horizontal en la línea media en la piel de la parte inferior del abdomen, exponiendo los músculos abdominales.
- Haga una segunda incisión horizontal en la línea media en los músculos abdominales, exponiendo los órganos internos.
- Revela el esternón, asegúralo con un hemostático y retíralo cranealmente para exponer el hígado y la vena porta. Cánula la vena porta con un angiopato de calibre 16.
- Conecte la jeringa de 60 ml de solución salina heparinizada al angiocatio y cree una incisión en la vena cava inferior y la aorta abdominal para la ventilación. Enjuague toda la cantidad de solución salina a través de la vena porta.
NOTA: La presión de lavado debe permanecer alrededor de 10 mmHg. - Haz un corte horizontal en el diafragma, seguido de un corte proximal a través de las costillas a ambos lados del esternón para revelar la cavidad torácica.
- Retire el corazón de la cavidad y colóquelo inmediatamente en la placa de Petri con solución salina en hielo.
- Identifique el arco aórtico, pincélelo con hemostáticos y exponga la aorta descendente limpiando cualquier tejido conectivo restante.
- Realice un corte horizontal a mitad de camino a través de la aorta descendente y cánula con el angiocatio de 14 G.
NOTA: No rompa la válvula aórtica con la cánula. - Asegure la cánula a través de una sutura sobre el manguito y suelte el hemostático.
- Deje que el corazón permanezca en hielo hasta que se coloque en el sistema de perfusión.
6. Inicio de la perfusión
- Ajuste el caudal de la bomba peristáltica a 1,0 mL/min.
NOTA: La cánula aórtica se maneja siempre en un ángulo de 90° con respecto al corazón para evitar la introducción de burbujas en las coronarias (Figura 1B). - Pese el corazón con la cánula antes de conectar el corazón al sistema.
NOTA: La cánula aórtica debe estar completamente libre de burbujas de aire. - Conecte la cánula al conector del sistema e inicie un temporizador.
- Una vez que el corazón tenga una contracción completa, aumente el flujo en incrementos de 0,2 ml/min mientras observa de cerca las presiones.
- Detenga los aumentos de caudal cuando se alcancen las presiones deseadas o hasta que se alcance un mínimo de 3,5 mL/min.
- Perfusión a baja presión
- Para presiones entre 30-35 mmHg, utilice un caudal de 4,5 mL/min.
- Ponga en marcha la bomba de jeringa de adenosina.
- Perfusión a alta presión
- Para presiones entre 70-80 mmHg, utilice un caudal mínimo de 5,0 mL/min.
- Ponga en marcha la bomba de jeringa de adenosina.
- Perfusión a baja presión
7. Balón intraventricular:
- Conecte un pequeño balón de látex (50 μL) a un catéter con balón (2 mm de diámetro, 15 cm de largo) con una punta cónica (1,4 mm de diámetro).
- Conecte el catéter a un sensor de presión a través de un conector Luer Lock y asegure toda la configuración a un soporte de abrazadera.
- Llene el balón/catéter/sensor de presión con aproximadamente 200 μL de solución salina a través de una jeringa conectada al extremo superior del sensor de presión y elimine las burbujas del interior del sensor, el catéter y el balón.
- Calibre el sensor de presión con un esfigmómetro.
- Haga una pequeña incisión horizontal por encima de la aurícula izquierda. Desinfle el globo estirando la jeringa en la parte superior del sensor de presión e insertándola en el ventrículo izquierdo.
- Inicie la adquisición de datos e infle el balón hasta que la presión diastólica sea de 0 mmHg.
8. Muestreo
- Recopile la frecuencia cardíaca, el flujo aórtico y la presión coronaria después de los primeros 20 minutos de perfusión y cada hora a partir de entonces.
9. Fin/limpieza
- Al final de la perfusión, extraiga el corazón del sistema y péselo para estimar el edema.
- Cortar el vértice del corazón mediante un corte circunferencial y congelar rápidamente en nitrógeno líquido para los análisis posteriores a la perfusión.
- Cortar una pieza circunferencial del corazón para obtener imágenes histológicas y tinción. Deseche el resto del corazón y la cánula.
- Enjuague todos los componentes del sistema agregando grandes cantidades de agua desionizada (DI) en el depósito y haciendo funcionar la bomba peristáltica. Recoge el agua en un cubo externo.
- Repita el paso 9.4 dos o tres veces.
- Enjuague bien todos los puertos de muestra y los tubos del sensor de presión.
- Llene el depósito con 600 ml de agua desionizada y 3 ml de bomba de detergente de laboratorio en todo el sistema.
- Apague el calentador de agua, el tanque de oxígeno y la bomba peristáltica.
Resultados
Se extrajeron corazones de ratas Lewis macho adultas (250-300 g de peso corporal) y se perfundieron a presiones de perfusión altas (70-80 mmHg) o bajas (30-35 mmHg) (n = 3 por grupo). Los efectos de la presión de perfusión sobre la función cardíaca general y la salud se determinaron mediante la recopilación de la frecuencia cardíaca, el edema y la función ventricular izquierda.
Se determinó una clara correlación entre la frecuencia cardíaca y las presiones de perfusión (Figura 2). La frecuencia cardíaca fue estadísticamente más alta en los corazones de alta presión en comparación con los corazones de baja presión en todos los puntos temporales, excepto en el primero (60 min, Figura 2A,B). Curiosamente, los corazones de baja presión parecen pasar por un período de ajuste al comienzo de la perfusión, en el que la frecuencia cardíaca tardó unos 30 minutos en estabilizarse y alcanzar los niveles que se mantuvieron durante el resto de la perfusión (Figura 2A). También se observó una gran diferencia en la presión del pulso ventricular izquierdo (LVPP) entre los grupos, siendo la LVPP de los corazones de alta presión estadísticamente más alta que la de los corazones de baja presión en cada punto temporal (Figura 3B). Esta alta demanda sostenida de trabajo resultó en una pérdida progresiva de la función en los corazones de alta presión, con una disminución estadística de la PPVI después de 2 h de perfusión (Figura 3A,B). Por otra parte, no se observó pérdida de función en los corazones perfundidos con presiones bajas, y la LVPP permaneció inalterada durante todo el tiempo de perfusión (Figura 3A,B). Al igual que en el LVPP, los corazones de alta presión mostraron una mayor contracción del músculo cardíaco (dP/dt máx.) y relajación (dP/dtmin) durante todo el tiempo de perfusión en comparación con los corazones de baja presión (Figura 3C, D). En consecuencia, los corazones de alta presión sufrieron una pérdida progresiva de la contractilidad y de la capacidad de relajación, siendo ambos parámetros estadísticamente superiores a 1 h de tiempo de perfusión en comparación con la última hora de perfusión. De manera diferente, la contractilidad del músculo cardíaco y las capacidades de relajación fueron comparativamente bajas en el grupo de baja presión y permanecieron sin cambios durante 4 h de tiempo de perfusión (Figura 3C,D). Además de los efectos funcionales, las altas presiones de perfusión durante períodos prolongados de tiempo también exacerban la retención de líquido intersticial dentro de los injertos cardíacos, lo que conduce al edema. Este edema se cuantificó semi-en el cambio porcentual de peso y dio lugar a que los corazones de alta presión tuvieran un aumento de peso estadísticamente mayor en comparación con los corazones perfundidos a bajas presiones (Figura 2C).
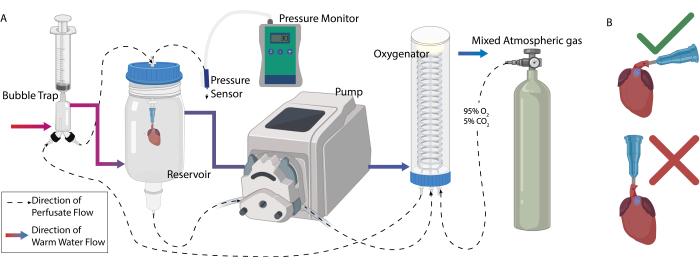
Figura 1: Configuración del sistema de perfusión. (A) Configuración general de la perfusión. Las líneas discontinuas representan el orden en el que se conectaron los componentes del sistema para optimizar la circulación del perfusado. Las líneas sólidas de color representan el orden en el que se conectaron los componentes para optimizar la temperatura de perfusión. (B) La forma adecuada de manipular el corazón después de la canulación para evitar el vaciado del catéter y la introducción de aire en las coronarias. Haga clic aquí para ver una versión más grande de esta figura.
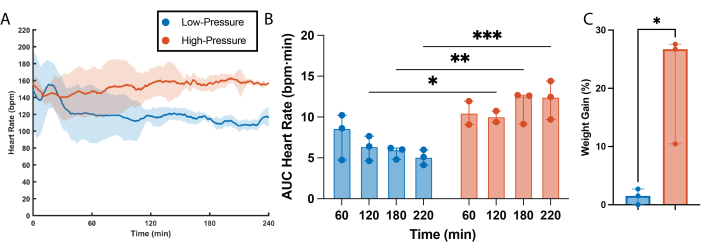
Figura 2: Efectos de la presión sobre la frecuencia cardíaca y el edema. (A) Frecuencia cardíaca obtenida a partir de las mediciones del balón intraventricular. La línea continua es la mediana de los grupos experimentales. El área sombreada es el rango intercuartílico. (B) Área bajo la curva (AUC) de los datos de frecuencia cardíaca por cada hora de perfusión. (C) Porcentaje de peso ganado después de 4 h de perfusión a presiones bajas y altas. Todos los datos se expresan como mediana ± rango intercuartílico (RIC). *p < 0,01, **p < 0,05, ***p < 0,001. Haga clic aquí para ver una versión más grande de esta figura.
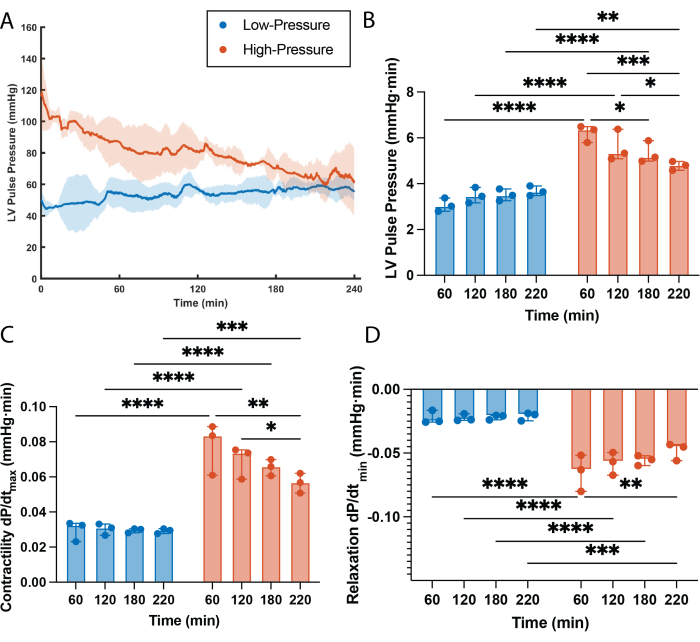
Figura 3: Efectos de la presión sobre la función ventricular izquierda. (A) Presión sistólica máxima trazada a lo largo del tiempo, denotada como presión de pulso ventricular izquierdo (LVPP). La línea continua es la mediana de los grupos experimentales. El área sombreada es el rango intercuartílico. (B) El área bajo la curva LVPP (AUC) por cada hora de perfusión. (C) Contractilidad del músculo cardíaco cuantificada a partir de la derivada máxima del pulso de presión. (D) Relajación del músculo cardíaco cuantificada a partir de la derivada mínima del pulso de presión. Todos los datos se expresan en mediana ± rango intercuartílico. *p < 0,01, **p < 0,05, ***p < 0,001, ****p < 0,0001. Haga clic aquí para ver una versión más grande de esta figura.
| Ion | Concentración (mmol/L) |
| Na+ | 135–145 |
| K + | <6.00 |
| Ca +2 | 1.0–1.3 |
| Cl - | 96–106 |
Tabla 1: Rango aceptable de concentración de iones en la perfusión.
Discusión
La perfusión de Langendorff es una técnica extremadamente flexible que permite una adaptación y un ajuste impresionantes para satisfacer una amplia gama de necesidades experimentales. Esta adaptación está permitida por la capacidad de ajuste significativa de la mayoría de los parámetros de perfusión, incluidas las presiones de perfusión. Debido a la naturaleza retrógrada de Langendorff, las presiones de perfusión son equivalentes a las presiones de perfusión coronaria, que desempeñan un papel esencial en la función cardíaca. Se sabe que las presiones de perfusión coronaria (PPC) controlan directamente el trabajo cardíaco, ya que una amplia gama de índices cardíacos (es decir, presión ventricular izquierda, contractilidad (dP/dtmáx.), tensión de la pared, rigidez ventricular) son directamente proporcionales a la PPC 16,17,18. Históricamente, el campo ha utilizado presiones de perfusión, y en efecto CPP, entre 60 mmHg y 80 mmHg en un intento de imitar las condiciones fisiológicas 5,8,15,19,20,21. Sin embargo, la naturaleza no fisiológica de la perfusión retrógrada ex vivo de la máquina, en combinación con la alta demanda de trabajo, conduce a una pérdida de la función cardíaca con el tiempo (Figura 3). Por otra parte, las presiones de perfusión más bajas (30-35 mmHg), a pesar de no reproducir con precisión las condiciones fisiológicas de los corazones de rata in vivo, disminuyen inherentemente la demanda de trabajo cardíaco y logran tiempos de perfusión prolongados (4 h) sin la pérdida de función con el tiempo (Figura 3), y disminuyen el edema del injerto (Figura 2C). El uso de presiones de perfusión más bajas, aunque signifique una desviación de la PPC fisiológica, parece proporcionar ventajas importantes sobre el uso de presiones de perfusión fisiológicas, ya que la eliminación de la pérdida de función dependiente de la técnica existente durante la perfusión de Langendorff mejora la técnica en un sistema modelo más preciso y predecible con un potencial significativo para avanzar en la investigación cardiovascular. En particular, las áreas de investigación que se benefician y/o requieren tiempos de perfusión prolongados para alcanzar relevancia científica (es decir, tratamientos farmacológicos, análisis de respuestas inmunológicas, edición genética, preservación de injertos normotérmicos, etc.) son cada vez más importantes en la batalla contra las ECV.
La perfusión de Langendorff es, sin lugar a dudas, una herramienta esencial para el campo de la investigación cardiovascular. Por lo tanto, junto con los importantes beneficios que esta técnica científica representa para la comunidad investigadora, conlleva un importante nivel de complejidad científica. En efecto, hay varios pasos críticos dentro de este protocolo que requieren una estandarización cuidadosa, principalmente para evitar el daño del injerto cardíaco antes, durante e inmediatamente después de iniciar la perfusión. La primera posibilidad de daño del injerto es discreta durante el lavado de la vena porta. Este lavado con solución salina heparinizada tiene como objetivo eliminar la mayor cantidad de sangre completa posible del injerto cardíaco con un doble propósito. En primer lugar, sirve como una forma de eutanasia a través de la exanguinación. En segundo lugar, minimiza las posibilidades de coagulación dentro del injerto cardíaco durante la extracción, la canulación y el transporte, ya que se sabe que la sangre total de rata tiene tiempos de vestimenta extremadamente cortos22,23. Sin embargo, después de cientos de perfusiones cardíacas exitosas, se hizo evidente que la presión aplicada al organismo de la rata durante el lavado es de suma importancia, con la presión de lavado ideal de alrededor de 10 mmHg. Las presiones más altas de lavado de la vena porta parecen provocar daño en la vasculatura del injerto cardíaco, lo que conduce a un aumento de la resistencia vascular (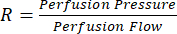 ). Una mayor resistencia vascular da como resultado que las presiones de perfusión objetivo se alcancen a tasas de flujo más bajas. Este desequilibrio entre la presión y el flujo coronario se transmite en la presión de pulso del ventrículo izquierdo (LVPP) producida, lo que resulta en una variabilidad significativa.
). Una mayor resistencia vascular da como resultado que las presiones de perfusión objetivo se alcancen a tasas de flujo más bajas. Este desequilibrio entre la presión y el flujo coronario se transmite en la presión de pulso del ventrículo izquierdo (LVPP) producida, lo que resulta en una variabilidad significativa.
El siguiente caso de posible daño del injerto cardíaco es durante la conexión del injerto al sistema mediante la introducción de burbujas de aire en las coronarias. Las burbujas de aire pueden introducirse fácilmente por un mal manejo del corazón canulado (Figura 1B) o por una eliminación inadecuada de las burbujas del sistema de perfusión aguas arriba de la trampa de burbujas24. Debido a la naturaleza retrógrada de esta configuración, cualquier introducción de aire dará lugar a una embolia gaseosa cardíaca, lo que provocará lesiones isquémicas, fibrilación y, muy comúnmente, la muerte del injerto. Por último, el último paso crítico para garantizar el éxito del protocolo se produce durante el inicio de la perfusión. A diferencia de la gran mayoría de los manuscritos que reportan utilizar Langendorff como técnica, el inicio de la perfusión en este protocolo se realiza a flujos relativamente bajos (1 mL/min) con aumentos incrementales (+0,2 mL/min), lo que garantiza un control completo sobre las presiones de perfusión 5,8,15,19,20,21 . Este aumento incremental del caudal y, por tanto, de la presión, es fundamental, ya que los cambios bruscos de presión aumentan irreversiblemente la resistencia vascular y alteran el delicado equilibrio flujo/presión.
La alta resistencia vascular en las perfusiones de Langendorff controladas por presión es muy importante, ya que las presiones de perfusión objetivo se alcanzan a flujos más bajos y los injertos resultan infraperfundidos. La gran dependencia de este equilibrio perfecto entre flujo y presión es probablemente la mayor limitación de este protocolo, ya que cualquier daño previo del injerto, intencional (es decir, conservación prolongada del frío, insulto de isquemia caliente, infarto de miocardio, etc.) o no intencional, conduce a un aumento de la resistencia vascular. En efecto, este protocolo es particularmente útil para la investigación en la que el experimento comienza después del inicio de la perfusión (es decir, tratamientos farmacológicos, análisis de respuesta inmunológica, edición de genes, preservación de injertos normotérmicos, etc.) pero no antes. Esta limitación es un ejemplo perfecto de una Langendorff que no se ajusta a todos los propósitos y se debe tener especial cuidado en adaptar los parámetros de perfusión para satisfacer mejor las necesidades experimentales.
Divulgaciones
SNT tiene solicitudes de patentes relevantes para este estudio y forma parte del Consejo Asesor Científico de Sylvatica Biotech Inc., una empresa centrada en el desarrollo de tecnología de preservación de órganos. Todos los intereses contrapuestos son administrados por MGH y Partners HealthCare de acuerdo con sus políticas de conflicto de intereses.
Agradecimientos
Este trabajo contó con el apoyo de una generosa financiación para S.N.T. de los Institutos Nacionales de Salud de EE. UU. (K99/R00 HL1431149; R01HL157803) y la Asociación Americana del Corazón (18CDA34110049). También agradecemos la financiación del Instituto Nacional de Salud de los Estados Unidos (R01DK134590; R24OD034189), la Fundación Nacional de Ciencias (EEC 1941543), la Beca Eleanor y Miles Shore de la Facultad de Medicina de Harvard, la Fundación de la Familia Polsky, el Premio Claflin al Académico Distinguido en nombre del Comité Ejecutivo de Investigación de MGH y el Hospital Shriners para Niños Boston (Subvención #BOS-85115).
Materiales
| Name | Company | Catalog Number | Comments |
| 5-0 Suture | Fine Scientific Tools | 18020-50 | |
| 14 G Angiocath | Becton Dickinson | 381867 | |
| 16 G Angiocath | Becton Dickinson | 381957 | |
| 24 mm Heart Chamber adaptors | Radnoti | 140132 | |
| Balloon Catheter | Radnoti | 170423 | |
| BD Slip Tip Sterile Syringes- 10 mL | Fisher Scientific | 14-823-16E | |
| BD Slip Tip Sterile Syringes- 1 mL | Fisher Scientific | 14-823-434 | |
| BD Slip Tip Sterile Syringes- 50 mL | Fisher Scientific | 14-820-11 | |
| Bovine Serum Albumin | Sigma | A7906 | |
| Bubble Trap Compliance Chamber | Radnoti | 130149 | |
| Calcium Chloride | Sigma | C7902 | |
| Clamp Holder | United Scientic | RTCLMP1 | |
| Dextran | Sigma | 31389 | |
| DIN8 Extension Cable | Iworx | SKU C-DIN-EXT | |
| Falcon High Clarity 50 mL conical tubes | Fisher Scientific | 14-432-22 | |
| GSC Go Science Crazy Cast Iron Support Ring Stand | Fisher Scientific | S13748 | |
| Heart Chamber | Radnoti | 140160 | |
| Heated Water Circulator bath | Cole Parmer | N/A | |
| Heparin sodium Injection | Medplus | G-0409-2720-0409-2721 | |
| Hydrocortisone | Solu-Cortef | MGH Pharmacy | |
| Insulin | Humulin R | MGH Pharmacy | |
| Insvasive Fluid Filled Blood Pressure Sensor | Iworx | SKU BP-10x | |
| Iworx Data Acquisition System | Iworx | IX-RA-834 | |
| Krebs-Henseleit Buffer | Sigma | K3753 | |
| Left Ventricular Pressure Balloon | Radnoti | 170404 | |
| Masterflex L/S Easy-Load II Pump Head for Precision Tubing, PPS Housing, SS Rotor | VWR | MFLX77200-60 | |
| Masterflex L/S Standard Digital Pump Systems | VWR | MFLX07551-30 | |
| Membrane Oxygenating Chamber | Radnoti | 130144 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| Polyethylene Tubing | Fisher Scientific | 14-170-12H | |
| Precision Pump Tubing-16 | VWR | MFLX96410-16 | |
| Sodium Bicarobonate | Sigma | 5761 | |
| Standard PHD ULTRA CP Syringe Pump | Harvard Aparatus | 88-3015 | |
| Tygon Transfer Tubing | VWR | MFLX95702-03 |
Referencias
- Cardiovascular Diseases (cvds). World Health Organization Available from: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (2021)
- Amini, M., Zayeri, F., Salehi, M. Trend analysis of cardiovascular disease mortality, incidence, and mortality-to-incidence ratio: Results from global burden of disease study 2017. BMC Public Health. 21 (1), 401 (2021).
- Aune, S. E., Yeh, S. T., Zelinski, D. P., Angelos, M. G. Measurement of hydrogen peroxide and oxidant stress in a recirculating whole blood-perfused rat heart model. Resuscitation. 82 (2), 222-227 (2011).
- Lateef, R., Al-Masri, A., Alyahya, A. Langendorff's isolated perfused rat heart technique: A review. Int J Basic Clin Pharmacol. 4 (6), 1314-1322 (2015).
- Herr, D. J., Aune, S. E., Menick, D. R. Induction and assessment of ischemia-reperfusion injury in Langendorff-perfused rat hearts. J Vis Exp. (101), e52908 (2015).
- Vervoorn, M., et al. Extended normothermic ex situ heart perfusion without functional decline. J Heart Lung Transplant. 43 (4), S156 (2024).
- Moeslund, N., et al. Ex-situ oxygenated hypothermic machine perfusion in donation after circulatory death heart transplantation following either direct procurement or in-situ normothermic regional perfusion. J Heart Lung Transplant. 42 (6), 730-740 (2023).
- Testai, L., Martelli, A., Cristofaro, M., Breschi, M. C., Calderone, V. Cardioprotective effects of different flavonoids against myocardial ischaemia/reperfusion injury in Langendorff-perfused rat hearts. J Pharm Pharmacol. 65 (5), 750-756 (2013).
- Watanabe, M., Okada, T. Langendorff perfusion method as an ex vivo model to evaluate heart function in rats. Methods Mol Biol. 1816, 107-116 (2018).
- Chang, X., et al. Cardioprotective effects of salidroside on myocardial ischemia-reperfusion injury in coronary artery occlusion-induced rats and Langendorff-perfused rat hearts. Int J Cardiol. 215, 532-544 (2016).
- Neely, J. R., Liebermeister, H., Battersby, E. J., Morgan, H. E. Effect of pressure development on oxygen consumption by isolated rat heart. Am J Physiol. 212 (4), 804-814 (1967).
- Matsuura, H., et al. Positive inotropic effects of atp released via the maxi-anion channel in Langendorff-perfused mouse hearts subjected to ischemia-reperfusion. Front Cell Dev Biol. 9, 597997 (2021).
- Louradour, J., et al. Simultaneous assessment of mechanical and electrical function in Langendorff-perfused ex-vivo mouse hearts. Front Cardiovasc Med. 10, 1293032 (2023).
- Ueoka, A., et al. Testosterone does not shorten action potential duration in Langendorff-perfused rabbit ventricles. Heart Rhythm. 19 (11), 1864-1871 (2022).
- Reichelt, M. E., Willems, L., Hack, B. A., Peart, J. N., Headrick, J. P. Cardiac and coronary function in the Langendorff-perfused mouse heart model. Exp Physiol. 94 (1), 54-70 (2009).
- Abel, R. M., Reis, R. L. Effects of coronary blood flow and perfusion pressure on left ventricular contractility in dogs. Circ Res. 27 (6), 961-971 (1970).
- Arnold, G., Morgenstern, C., Lochner, W. The autoregulation of the heart work by the coronary perfusion pressure. Pflugers Arch. 321 (1), 34-55 (1970).
- Iwamoto, T., Bai, X. J., Downey, H. F. Coronary perfusion related changes in myocardial contractile force and systolic ventricular stiffness. Cardiovasc Res. 28 (9), 1331-1336 (1994).
- Rossello, X., Hall, A. R., Bell, R. M., Yellon, D. M. Characterization of the Langendorff perfused isolated mouse heart model of global ischemia-reperfusion injury: Impact of ischemia and reperfusion length on infarct size and LDH release. J Cardiovasc Pharmacol Ther. 21 (3), 286-295 (2016).
- Headrick, J. P., Peart, J., Hack, B., Flood, A., Matherne, G. P. Functional properties and responses to ischaemia-reperfusion in Langendorff perfused mouse heart. Exp Physiol. 86 (6), 703-716 (2001).
- Noly, P. E., Naik, S., Tang, P., Lei, I. Assessment of ex vivo murine biventricular function in a Langendorff model. J Vis Exp. (190), e64384 (2022).
- Garcia-Manzano, A., Gonzalez-Llaven, J., Lemini, C., Rubio-Poo, C. Standardization of rat blood clotting tests with reagents used for humans. Proc West Pharmacol Soc. 44, 153-155 (2001).
- Lewis, J. H., Van Thiel, D. H., Hasiba, U., Spero, J. A., Gavaler, J. Comparative hematology and coagulation: Studies on rodentia (rats). Comp Biochem Physiol A Comp Physiol. 82 (1), 211-215 (1985).
- Motayagheni, N. Modified Langendorff technique for mouse heart cannulation: Improved heart quality and decreased risk of ischemia. MethodsX. 4, 508-512 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados