Administración de compuestos IV
Visión general
Fuente: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Universidad de Notre Dame, en
Hay muchas rutas utilizadas para la administración del compuesto en las ratas y ratones de laboratorio. Protocolos pueden, sin embargo, requieren el uso de las rutas menos comunes: intracardiaca, bandolero y las inyecciones de retro-orbital. Formación especializada es esencial para estos procedimientos a realizarse con éxito. Justificación para estas rutas puede necesitar obtener la aprobación institucional cuidado Animal y el Comité uso (IACUC).
Principios
Administración intracardiaca se ha utilizado en una variedad de aplicaciones, incluyendo el desarrollo de un modelo animal de metástasis del cáncer de hueso, así como un examen de los efectos de entrega intracardiaca directa sobre el resultado de infarto de miocardio. Este procedimiento se realiza mediante el uso de un ultrasonido para guiar la aguja en el lugar correcto en el corazón. 2 sin embargo, cuando realizado correctamente utilizando las señales adecuadas, este procedimiento puede realizarse sin el uso de la ecografía.
Debido a la naturaleza invasiva del procedimiento, el uso de la inyección intracardiaca debe estar científicamente justificado en un protocolo IACUC. Inyección de solo supervivencia debería estar permitida. Este procedimiento requiere el uso de un anestésico general, inhalante o inyectable, según los lineamientos establecidos dentro de una organización. Selección de las agujas debe ser el tamaño más pequeño posible que permita la viscosidad del material inyectado; generalmente, se utiliza una aguja de calibre 27-30. Gama de volúmenes de inyección de 100 μl a un máximo de 300 μl.
Inyecciones intravenosas en la cola de los ratones son difíciles y a menudo fracasada. Una ruta alternativa de la administración intravenosa es a través del plexo retro orbital. Mientras que esta técnica requiere entrenamiento y habilidad para realizar, estudios han demostrado que existe una mayor tasa de éxito con la inyección de retro-orbital que con inyección en la vena lateral de la cola. 3, 4, 5 La anestesia es necesaria para evitar que el ratón se mueva durante el procedimiento. Anestesia general inhalante entregados ya sea a través de una campana o una cámara de inducción conectada a un vaporizador de precisión es eficaz. Sin embargo, si va a usar inhalantes, ten en cuenta que el animal comenzará a recuperarse rápidamente una vez que se retira de la cámara, así que uno debe estar listo para realizar la inyección. Cuando múltiples inyecciones deben realizarse, se recomienda un anestésico oftálmico tópico (tetracaína o proparacaine).
La estructura venosa orbital de rata y el ratón son diferentes. El ratón tiene un seno o la convergencia de varios barcos, incluyendo la vena supraorbitaria, vena nasal dorsal, la vena palpebral inferior y las venas temporales superficiales que llenan el espacio en la órbita del ojo. En el área orbital de la rata, hay una red o plexo de vasos. Como con todas las inyecciones, la aguja seleccionada debe ser el tamaño más pequeño posible; generalmente un 27-30 medidor de aguja. Aunque ha habido informes de mayores volúmenes, el volumen máximo es 150 μL por ojo. 3, 4, 5 Se recomienda una inyección por ojo al día, con un total de dos inyecciones por ojo para los procedimientos de supervivencia. También, debe haber al menos un intervalo de un día entre las inyecciones. Para un procedimiento de evaluadora, pueden administrarse volúmenes de hasta 500 μl.
A pesar de la controversia, sigue siendo necesario para algunos estudios el uso de la almohadilla de pie como un sitio de la inyección. Se ha demostrado que cuando se inyecta a través de la almohadilla del pie, la respuesta de anticuerpos en algunas cepas de ratón era significativamente más fuerte que cuando se inyecta en el corvejón. 6 Todos los animales deben ser vigilados de cerca para detectar signos de dolor, nivel de consumo de alimentos y para la deambulación normal. Uno mismo-mutilación del pie puede ocurrir en la medida del pie destruido. Esto es un signo de dolor crónico. Cualquier animal que demuestra uno mismo-mutilación debe ser llamado inmediatamente a la atención del personal veterinario.
Mediciones de bandolero deben hacerse todos los días tan pronto como se ha producido inflamación evidente. Extremos deben estar colocados según las pautas IACUC. Generalmente, el animal debe ser sacrificado cuando la lesión o el tumor interfiere con la capacidad del animal de andar o alcanzar comida y agua. El volumen máximo que se puede inyectar en un bandolero es 50 μl. Una aguja de calibre 29-30 se recomienda para la inyección.
Procedimiento
1. intracardiaca inyección
- Hitos y posicionamiento: posicionar el ratón o rata en recumbency lateral derecho (con el lado izquierdo hacia arriba) o en recumbency dorsal e identificar los hitos.
- Coloque el corazón aproximadamente nivel con el punto del codo y justo a la izquierda del esternón.
- Inserte la aguja entre las costillas en el punto del codo.
- En un animal de recumbency dorsal, inserte la aguja en el paralelo de pecho a la mesa.
- En un animal de recumbency lateral, inserte la aguja en el tórax perpendicular a la mesa.
- Inyección del artículo
- Asegúrese de que hay un mínimo movimiento de la aguja una vez que se inserta en el corazón para evitar que el músculo está roto y lo que causa hemorragia en el saco pericárdico, como esto compromete la función cardiaca.
- Aspirar la jeringa para determinar la ubicación apropiada. A menudo es un flash de la sangre en el centro de la jeringa.
- Sostenga la jeringa para que la mano no es reposicionarse en la jeringa para la inyección una vez que la aguja se ha posicionado en el corazón.
- Inyectar el artículo de manera lenta y constante.
- Retire la aguja lentamente para minimizar el sangrado.
- Ratones que sufren dificultad respiratoria, convulsiones, cianosis, ataxia prolongada u otras secuelas relacionadas con el trauma de la inyección deben ser evaluados por el personal veterinario y sacrificados según su recomendación.
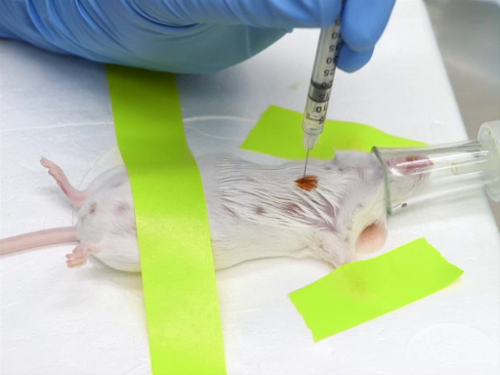
Figura 1. Inyección intracardiaca en ratones.
2. intravenosa inyección utilizando el plexo retro-orbital
- Sitios de inyección y posicionamiento
- Colocar el animal sobre una superficie plana en recumbency lateral.
- Inserte la aguja en el ángulo medial del ojo con un ángulo de 45° para la nariz.
- La profundidad de la aguja debe ser suficiente para penetrar los tejidos conjuntivales y avanzar detrás de la órbita ocular y en el plexo ocular. Al colocar la aguja, no debería encontrar el hueso en la parte posterior de la órbita.
- Coloque el dedo índice en la parte superior de la cabeza con el pulgar en la mandíbula.
- Tire suavemente hacia atrás y hacia abajo para tensar la piel y sobresalen del globo ocular.
- Tenga cuidado de no aplicar presión sobre la tráquea y restringir el flujo de aire.
- Inyección
- Coloque la aguja detrás del ojo y no intra uso.
- Asegúrese de que la aguja tiene un mínimo movimiento una vez insertado en el plexo retro orbitario, o los vasos rompen causando sangrado y la pérdida del agente en los tejidos detrás del ojo. Sostenga la jeringa para que la mano no es reposicionarse en la jeringa para la inyección una vez que la aguja se ha posicionado en el plexo retro orbital.
- No aspire con la jeringa, como se derrumbará los vasos.
- Inyectar el artículo de manera lenta y constante.
- Retire la aguja y aplicar presión ligera en los ojos para controlar el sangrado y para proporcionar hemostasia.
- Ratones que experimentara inflamación, conjuntivitis, u otras secuelas relacionadas con el trauma de la inyección deben ser evaluados por el personal veterinario y tratados o eutanasia según su recomendación

Figura 2. Inyección orbital retra en ratones.
3. bandolero inyección
- Moderación, coloque el animal en un tubo de seguridad con un pie trasero aislado y extender sujetando la piel por encima de la rodilla.
- Limpiar los pies con agua o con alcohol para eliminar los desechos antes de inyectar.
- Inyectar por vía subcutánea en el centro de las patas traseras, formando una pequeña ampolla en el sitio de inyección. Para evitar el vaso sanguíneo que corre a lo largo del pie, inyectar justo al lado de la línea media paralela a la nave.
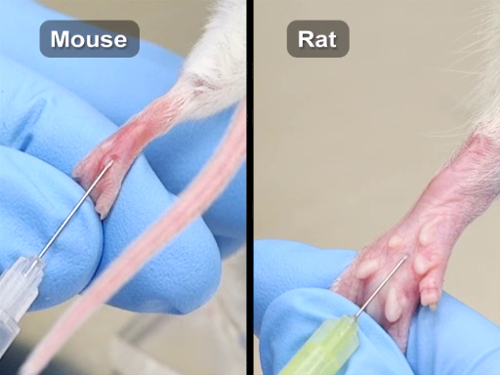
Figura 3. Inyección de bandolero en ratones y ratas.
Aplicación y resumen
La administración de compuestos en animales puede tener un efecto significativo tanto el bienestar de los animales y el resultado de los datos experimentales y valor científico. El método apropiado de suministro es esencial para el éxito del experimento. Muchos factores deben ser considerados para determinar la mejor ruta, incluyendo el objetivo científico del estudio, el pH de la sustancia, el volumen de la dosificación requerida, la viscosidad de la sustancia y el bienestar de los animales. Conocimientos técnicos también es un requisito para todos los métodos de inyección.
Referencias
- Morton, D.A., Jennings, M., Buckwell, A., Ewbank, R., Godfrey, C., Holgate, B., Inglis, I., James, R., Page, C., Sharman, I., Verschoyle, R., Westall, L., and Wilson, A.B. 2001. Refining procedures for the administration of substances Report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Members of the Joint Working Group on Refinement. Laboratory Animals. 35. 1-41
- Prendiville , T.W., Qing, M., Lin, Z., Zhou, P., He, A., and Pu, W.T. 2014. Ultrasound-guided Transthoracic Intramyocardial Injection in Mice. Journal of Visualized Experiments. 90 | e51566.
- Yardeni, T., Eckhaus, M., Morris, H.D., Huizing, M., and Hoogstraten-Miller, S. 2001. Retro-orbital injection in mice. Lab Animal. 40:5. 155-171.
- Steel, C., Stephens, A., Hahto, S., Singletary, S., Ciavarra, R. 2008. Comparison of the lateral tail vein and the retro-orbital sinus as routes of intravenous drug delivery in a transgenic mouse model. Lab Anim. 37. 26-31.
- Timm, K.I. 1989. Orbital venous anatomy of the Mongolian gerbil, with comparison to the mouse, hamster, and rat. Laboratory Animal Science. 39:3. 262-265.
- Kamala, T. 2007. Hock immunization: a humane alternative to mouse footpad injections. Journal of Immunological Methods. 328. 204-214.
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Administración de compuestos IV
Lab Animal Research
51.9K Vistas

Técnicas de manipulación y sujeción de roedores
Lab Animal Research
175.3K Vistas

Procedimientos de atención básica
Lab Animal Research
28.1K Vistas

Fundamentos de la crianza y destete
Lab Animal Research
35.8K Vistas

Identificación de roedores I
Lab Animal Research
54.9K Vistas

Identificación de roedores II
Lab Animal Research
25.7K Vistas

Administración de compuestos I
Lab Animal Research
101.1K Vistas

Administración de compuestos II
Lab Animal Research
35.1K Vistas

Administración de compuestos III
Lab Animal Research
31.6K Vistas

Extracción de sangre I
Lab Animal Research
172.4K Vistas

Extracción de sangre II
Lab Animal Research
73.7K Vistas

Mantenimiento e inducción de la anestesia
Lab Animal Research
50.9K Vistas

Consideraciones para la cirugía de roedores
Lab Animal Research
22.5K Vistas

Necropsia diagnóstica y recolección de tejidos
Lab Animal Research
58.3K Vistas

Recolección de tejidos estériles
Lab Animal Research
34.9K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados