Extracción de sangre I
Visión general
Fuente: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Universidad de Notre Dame, en
Colección de la sangre es un requisito común para estudios de investigación que involucran a ratones y ratas. El método de retiro de la sangre en ratones y ratas es dependiente sobre el volumen de sangre necesitada, la frecuencia del muestreo, el estado de salud del animal para purgarse y el nivel de habilidad del técnico. 1 todos sangrados del seno discutidas retro-orbital de métodos, sangrados de snip de cola inicial y sangra intracardiaca-requieren el uso de una anestesia general.
Principios
Antes del procedimiento de purga, se determinará el tipo de muestra requerida. Procedimientos experimentales pueden requerir sangre entera, plasma o suero. Para sangre entera, debe agregarse un anticoagulante a la muestra. Plasma, que contiene fibrinógeno y otros factores de coagulación cuando se separó de los glóbulos rojos, se puede extraer de una muestra anticoagulada. Suero se obtiene a través de muestras de sangre sin anticoagulante. El suero será el resultado de la centrifugación de la muestra una vez que ha formado un coágulo. Como la muestra se haya coagulado, el suero no contiene fibrinógeno u otros factores de la coagulación. Suero y plasma se obtienen mediante el uso de una centrifugadora de ejecutar a 2200-2500 RPM durante un mínimo de 15 minutos.
Para una muestra que debe ceder sangre entera o plasma, debe usarse un anticoagulante adecuado. Anticoagulantes utilizados para animales de laboratorio son heparina, citrato de sodio y ácido de etilendiamina tetraacético (EDTA); selección de la cual se basa en las necesidades de investigación. Secuestrar una forma líquida de EDTA, heparina y citrato de sodio-puede cargarse directamente en la jeringa para recubrir las superficies. Esto permite el contacto de anticoagulante directamente como se extrae la sangre, ayudando en la prevención de la coagulación. Como coágulos de sangre de rata más rápidos que la sangre más mamífero, es esencial utilizar la proporción correcta de anticoagulante a la sangre para recolección de sangre.
Selección de la aguja se basa en el tamaño del animal y el sitio de la venopunción. En general, cuanto mayor sea el diámetro de la aguja, más rápidamente la muestra puede ser recogida. Menos daño a las células de la sangre es otro beneficio de agujas más grandes. Sin embargo, la principal desventaja para gran diámetro agujas es el daño potencial a la nave. En ratones y ratas, las opciones de la gama del tamaño de agujas de calibre 20 a 29 que son 0.5-1.5 pulgadas de longitud. Si una aguja es demasiado larga, no sólo es incómodo de usar, pero tener el espacio extra en la aguja podría resultar en coagulación. El tamaño de aguja adecuado se enumera para cada método en la sección de procedimientos.
El tamaño de la muestra requerida también debe ser predeterminado. Debido al pequeño tamaño del ratón o de rata, la cantidad máxima de colección de la sangre debe calcularse para un sangrado de supervivencia. Un ratón medio peso 25 gramos tiene un volumen total de sangre de 1,8 ml; la rata promedio de peso de 250 gramos tiene un volumen total de sangre de 16 ml. Para una muestra de sangre solo en un ratón o rata sin reposición de líquidos, el volumen máximo de sangre que se puede quitar es el 10% de la volemia total o 7.7-8 μl/g. Así para un ratón medio, 10% de su volumen de sangre es 193-200 μl. Para una rata promedio de 250 gramos, esto equivale a 1.9-2.0 ml. estudios han demostrado que la eliminación de más del 15% del volumen de la sangre puede causar shock hipovolémico. 1,2 sin embargo, con el reemplazo flúido, hasta un 15% del volumen total de sangre- o 12 μl/g-puede ser quitado. Para un ratón de 25 gramos, esto equivale a 300 μL; para una rata de 250 gramos, equivale a 3 ml. Para reposición de líquidos, los líquidos deben ser calentados y dados por vía subcutánea.
Si es necesario tomar varias muestras, se reduce el volumen de sangre dibujado. El volumen de sangre máxima que puede obtenerse por semana es no más de 7,5% el volumen total de sangre, o 6 μl/g. Para un ratón de 25 gramos, esto equivale a 145-150 μL por semana. Para una rata de 250 gramos, esto equivale a 1.45 1.50 ml por semana. Si el muestreo se producirá cada 2 semanas, se puede dibujar hasta el 10% del volumen total de sangre (8 μl/g). Esto es equivalente a 200 μL cada 2 semanas por un ratón medio y hasta 2.00 ml cada 2 semanas para una rata de 250 gramos. Un estudio realizado en ratas con el peso promedio de 250 gramos, reveló que cuando se eliminaron los volúmenes de sangre de 15-20%, le tomó más de 29 días para niveles en la sangre normalizar. 1,2 para colección de sangre repetida, reposición de líquidos no permite un mayor volumen de sangre o muestras de sangre más frecuentes, como sólo sustituye a volumen. El animal va a necesitar tiempo para reponer las células de la sangre.
El uso del plexo retro orbital ha sido una práctica común en el pasado. Sin embargo, han surgido muchas preocupaciones sobre la humanidad de este procedimiento. Durante el procedimiento, movimiento excesivo del tubo hematocrito una vez colocado en el canto medial del ojo puede causar daño a los tejidos circundantes, dando por resultado la hinchazón de los párpados o las membranas conjuntivales. Los tejidos inflamados pueden causar el globo ocular sobresale lo suficiente para que se bloqueen el cierre del párpado, potencialmente dando por resultado la sequedad corneal y el daño. Dolor de la hinchazón puede provocar arañazos y uno mismo-mutilación que provoca enucleación del ojo. Colocación inadecuada del tubo de hematocrito durante un sangrado retro orbital puede cortar el nervio óptico, resultando en ceguera. Si el tubo de hematocrito se avanza en un ángulo incorrecto, el ojo puede ser forzado fuera de la órbita, permitiendo que los párpados a caer detrás del globo ocular. Si esto ocurre, es muy difícil reemplazar correctamente el ojo en el zócalo. Otros problemas que pueden surgir incluyen fractura de los huesos frágiles de la órbita, penetración del globo ocular que resulta en la pérdida de humor vítreo, o la formación de un hematoma detrás del ojo que puede causar dolor extremo debido a la presión en el ojo y sus alrededores estructuras. A pesar de todas estas preocupaciones, si un técnico especializado realiza el procedimiento y el animal es completamente anestesiado con anestesia general, como el isoflurano inhalantes anestesia, sangrado retro orbital ha demostrado ser un método eficaz de la sangre colección en roedores.
La estructura anatómica de la zona orbital es diferente entre el ratón y la rata. El ratón tiene la retro-orbital del seno, una colección de vasos que crear un seno en la zona orbital. En la órbita del ojo de rata, hay un plexo de vasos que desembocan detrás de ese ojo; sin embargo, no forman un seno, como en el ratón. En consecuencia, es más fácil de realizar este procedimiento en ratones. Para la colección de muestreo repetitivo mediante el plexo retro orbitario, un mínimo de 10 días entre sangrados es necesaria para permitir que los tejidos de la zona a curar. Aunque se recomienda la anestesia general, el procedimiento puede realizarse en ratones sin anestesia general si se aplica un anestésico oftálmico tópico, como proparacaine o tetracaína, antes del procedimiento. Las ratas no tienen el sino de retro-orbital, y porque sus membranas alrededor de la órbita son mucho más fuertes, es obligatorio para anestesiar para este procedimiento.
Serie muestras de pequeño volumen pueden obtenerse utilizando un método de clip de cola. La primera amputación de la cola debe ser limitada a una extremidad de la cola, aproximadamente 0.5-1.0 mm de longitud en ratones y 2.0 mm en ratas. 1 que el procedimiento de recorte de cola para recolección de sangre permite colecciones serie interrumpiendo la costra o coágulo del original corte en el extremo de la cola. Por lo general, no es necesaria adicional amputación de la punta de la cola. Volúmenes de sangre recogieron gama de 20-100 μL para ratones y 75-150 μL para las ratas. La cantidad recogida es variable entre los animales y puede ser influenciada por la edad, el estado de salud y peso.
La muestra de un recorte de cola puede contener sangre arterial y venosa, con contaminación de producto tejido. La calidad de la muestra disminuye si la cola está acariciando o "ordeñada" para obtener más sangre. Para aumentar el flujo sanguíneo, la cola puede ser calentada con compresas tibias, una lámpara de calor o inmersión en agua caliente. Se aplicará presión hasta la punta de la cola para la hemostasia, y animales deben medirse cada 5-10 minutos para lograr hemostasia ha sido. Hemostasia se retrasa a menudo con muestreo repetitivo. Un polvo astringente puede usarse para la hemostasia. Para la amputación inicial, se recomienda anestesia (general o local). Sangrado posterior no requieren anestesia, sobre todo porque los animales se convierten en habituado al procedimiento. Anestesia causará una caída en la presión arterial, dificulta la recolección de sangre con esta técnica.
Una alternativa a un recorte de cola es el nick de vaso de cola. Este procedimiento se realiza fácilmente en ratones y ratas. Sin embargo, al igual que con el recorte de la cola, las muestras pueden estar contaminadas con productos de tejido, especialmente en el ratón. Para las ratas, se inserta una aguja hipodérmica en el vaso y se recoge la sangre desde el centro de la aguja. Un estudio demostró el uso de un torniquete colocado sobre el sitio de punción de la aguja para facilitar la recolección de sangre. 3 No se utiliza una jeringa para extraer la sangre fuera de la nave, como la presión generada de la jeringa derrumbará el buque. Este método también puede utilizarse para tomar muestras de la serie, como un coágulo puede ser removido para hacer el sitio a sangrar otra vez. Como con unas tijeras la cola, es imprescindible para asegurar la hemostasia aplicando presión en el sitio y segunda verificación al animal cada 5-10 minutos.
A menudo, los estudios requieren una evaluadora, muestra grande de la sangre que se recolecta a través exsanguination mediante una purga intracardiaca o la vena cava caudal. 4 aproximadamente la mitad del volumen total de sangre se puede recoger de un ratón o una rata por punción cardiaca. Esto es equivalente a 40 μl/g o 1 ml aproximadamente para un ratón de 25 gramos promedio. Una rata de 250 gramos produciría aproximadamente 10 ml de sangre. El animal debe ser anestesiado para exsanguination. Anestesia inhalante o narcosis de CO2 puede ser utilizado por un técnico competente; también puede utilizarse anestesia inyectable. Sin embargo, puede haber una disminución en la presión arterial y circulación, lo que podría disminuir la cantidad de sangre recogida.
El método de la vena cava caudal requiere que el animal se profundamente anestesiados para exponer quirúrgicamente el buque. CO2 narcosis no es suficiente, el corazón debe vencer como el animal respiración durante el retiro de la sangre. Durante el procedimiento, muy rápido de retiro de la sangre puede causar la nave a colapsar en el bisel de la jeringa, ocluir la apertura y prevención colección de sangre. Además, las paredes de los vasos son delgadas, y así movimiento de la mano y la aguja debe evitarse para prevenir ruptura o filtración de sangre desde el sitio de entrada de la aguja. Como no se que pasa la aguja por la piel, este método resulta en la colección de una muestra estéril. Métodos de eutanasia adyuvante deben emplearse para asegurar que el animal no se recupera de la anestesia. Este método es a menudo seguido de perfusión cardiaca o aórtica.
El método intracardiaco puede ser realizado con el animal restringido manualmente una vez que está anestesiado (método cerrado), o el corazón puede estar expuesto quirúrgicamente según el protocolo para el método de recogida de sangre de la vena cava caudal (método abierto). El método cerrado, los puntos de interés de colocación de la aguja son el surco formado por la caja torácica en el proceso del xiphoid, en lado izquierdo del animal.
Procedimiento
1. retro-orbital sangrar
- Equipo
- Preparar una campana o cámara de inducción anestésica, para administrar un gas anestésico como isoflurano. Cuando se usa una campana de cristal, es imprescindible que el líquido anestésico no entra en contacto con el animal, para evitar la absorción a través de la piel. Puede utilizar una plataforma con agujeros pequeños.
- Se prefieren los tubos de microhematocrito que 75 50 microlitros. Mylar tubos envueltos son menos propensos a romperse entre los dedos del operador y deben considerarse como una medida de seguridad.
- Varios espesores de toalla de papel y otros materiales de aislamiento, se colocan en la superficie de trabajo para mantener el calor del cuerpo del animal durante el procedimiento.
- Preparación y posicionamiento del animal
- El animal está anestesiado con una inhalación de anestésica como isoflurano, en una cámara de inducción anestesia campana de vacío o de gas, a efecto.
- Una vez que el animal está completamente anestesiado, se retira y se coloca en recumbency lateral.
- El ojo es resaltado colocando un dedo en la parte superior de la cabeza y a lo largo de la línea de la mandíbula y tirando de la piel y abajo.
- Evite aplicar presión a la tráquea, ya puede contraer u ocluir la vía aérea que causa muerte por asfixia.
- Retiro de la sangre
- El microhematocrito se coloca en el canto medial del ojo y dirigido caudalmente en un ángulo de 30-45° del plano de la nariz.
- Aplique presión girando suavemente el tubo de hematocrito. Esto corta a través de las membranas conjuntivales y ruptura del plexo ocular.
- La sangre fluye por acción capilar en el tubo de hematocrito.
- No empujar tan profundo que golpeó el hueso en la parte posterior de la cavidad ocular.
- Una vez que la sangre comience a fluir, mantener la presión para mantener el ojo resaltado.
- Para recoger varios tubos de sangre, no es necesario colocar el tubo siguiente en el plexo ocular, como la sangre seguirá fluyendo y se pueden recoger ya que viene desde el ángulo del ojo intermedio.
- Para detener el sangrado, suelte la piel y deje que el ojo volver a la posición normal. Aplique presión en la órbita para asegurar la hemostasia.
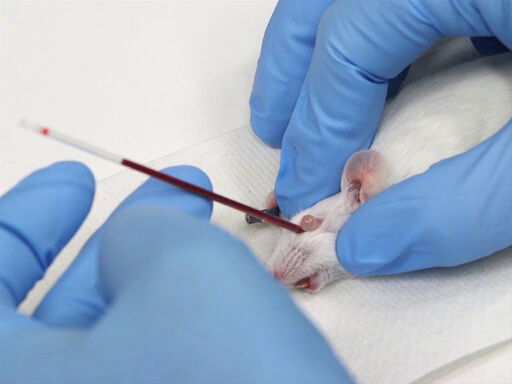
Figura 1. Retiro de la retro orbital sangre en ratones.
2. procedimientos de purga cola: recorte de cola y cola nick
- Equipo
- Una hoja de bisturí estéril, preferiblemente una hoja número 11 o una hoja de afeitar de un solo lado, se utiliza para hacer la amputación inicial para el método de recorte de la cola. Tijeras no deben utilizarse porque el corte de tijeras es el triturado, promoviendo así la coagulación y reducción del flujo sanguíneo. Para el procedimiento de nick de cola, una hoja de bisturí número 11 o 15 se utiliza para hacer el corte.
- Se prepara un tubo de sujeción que permite el acceso a la cola del ratón.
- Toallas de papel absorbente o gasa se utilizan como sustrato para realizar el recorte de la cola.
- También se requieren tubos o los tubos de hematocrito.
- Polvo hemostático debe estar disponible para ayudar en la hemostasia.
- Sistema de seguridad para
- El animal se coloca en el tubo que la cola es accesible. Para restrainers tipo de Broome, el animal se tiró grupa primero en el tubo. Para otros tubos, el animal se coloca la cabeza primero.
- Animales están asegurados en el tubo de tal manera que no pueden dar la vuelta o retirar la cola.
- Algunos ratones permitirá la colección del snip y la sangre de cola con moderación manual mínimo si pueden agarrar una superficie áspera.
- Algunas ratas requerirá anestesia inhalatoria para este método de recolección de sangre.
- Retiro de la sangre
- La cola se limpia con agua tibia para eliminar los residuos y provocan ligera vasodilatación. No use agua caliente.
- Para el recorte de la cola, la cola se extiende y se corta el final de la cola (0.5-1 mm para los ratones y hasta 2 mm para las ratas) con la hoja de bisturí.
- Para el nick de la cola, la cola se extiende y se hace un corte con la hoja de bisturí aproximadamente 2/3 la distancia de la grupa, directamente sobre la vena lateral de la cola.
- Puede acariciar la cola de cuadril a la punta para estimular el flujo sanguíneo; sin embargo, esto reducirá la calidad de la muestra.
- La sangre es recopilada de la punta o el nick usando los tubos de hematocrito o permitida a gotear en un frasco de colección.
3. colección de sangre cardiaca
- Equipo
- Para un ratón, una jeringa 3 de cc con un calibre de 22-25 x 1" la aguja se prefiere. Las jeringas más pequeñas no tienen la misma presión y pueden hacer más difícil retiro de la sangre. Agujas de menores calibre 25 restringen el flujo sanguíneo, llevando a aumento de la coagulación y dañan a las células de la sangre. Agujas más cortas que 1" no pueden alcanzar el nivel del corazón procedente del diafragma.
- Para una rata, una jeringa de 10-12 cc con un calibre 18 x 1.5" de la aguja es preferible. Dependiendo del tamaño de la rata, una jeringa más pequeña no puede mantener el volumen de sangre entera a recogerse, y así la jeringa tendría que cambiarse durante el procedimiento. Agujas de menores calibre 20 restringen el flujo de la sangre, conduciendo a mayor coagulación. Agujas más cortas de 1,5" pueden no alcanzar el nivel del corazón cuando se aproxima desde el diafragma.
- Se utiliza un tubo de recogida de sangre de tamaño suficiente para contener la sangre recogida.
- Sistema de seguridad para
- Restricción adecuada es esencial para el éxito de este método. El animal se lleva a cabo por el pescuezo con el cuerpo colgando verticalmente. Es importante que el cuerpo recto evitar la desviación del corazón o una torsión del pecho.
- Una posición alternativa es recumbency dorsal cuando se coloca la aguja entre las costillas en lado izquierdo del animal. Esto es especialmente útil para las ratas muy grandes o cuando varios animales para purgarse.
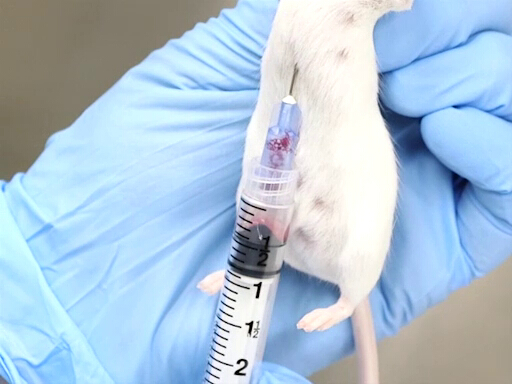
Figura 2. Retiro de sangre cardiaca con ratón sostenido verticalmente.
- Retiro de la sangre
- El enfoque del aspecto posterior, punción de la membrana se logra más fácilmente cuando el ratón o rata se lleva a cabo verticalmente por el pescuezo.
- La aguja se avanza en la muesca justo a la izquierda de xifoides del animal.
- La aguja debe estar paralela a la columna vertebral y colocado justo debajo de las costillas.
- El corazón está situado aproximadamente a la altura del codo.
- Colocar la aguja, de bisel, en el pecho y perfore el corazón.
- Aplicar ligera presión con la jeringa. Si la aguja está en el corazón, la sangre fluirá en la jeringa.
- Espere hasta que la sangre ha llenado la jeringa antes de añadir más presión en la jeringa.
- El acercamiento lateral de lado izquierdo del animal requiere posicionar el animal en recumbency dorsal.
- El punto de entrada se mide contra el punto del codo en la pared torácica. El corazón está situado aproximadamente a la altura del codo.
- La aguja es insertada perpendicular al plano de la mesa en un punto a medio camino en la pared torácica medida dorsoventralmente.
- Colocar la aguja, de bisel, en el pecho y perfore el corazón.
- Aplicar ligera presión con la jeringa. Si la aguja está en el corazón, la sangre fluirá en la jeringa.
- Espere hasta que la sangre ha llenado la jeringa antes de agregar el adicional de la contrapresión en la jeringa.
- El enfoque del aspecto posterior, punción de la membrana se logra más fácilmente cuando el ratón o rata se lleva a cabo verticalmente por el pescuezo.
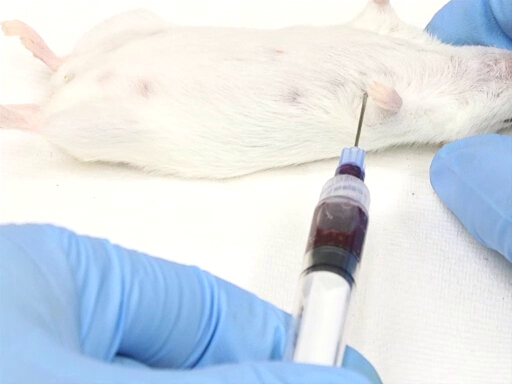
Figura 3. Retiro de la sangre cardíaca con el ratón en la posición de recumbency dorsal.
- Consejos técnicos
- El corazón normal se encuentra con el vértice apuntando hacia la izquierda. En raras ocasiones, puede invertirse el corazón, resultando en dificultad para perforar el corazón.
- Excesiva presión sobre la jeringa puede colapsar el corazón, ocluyendo el bisel de la aguja y parar el flujo de sangre hacia la jeringa.
- Aplicando presión y soltar varias veces iniciará la coagulación en la jeringa.
- Suavemente aplicar presión sobre el hígado puede forzar el volumen adicional de sangre en el sistema circulatorio, haciéndolo disponible para retiro.
4. posterior vena cava retiro de la sangre
- Equipo
- Se utiliza una jeringa TB con una aguja de calibre 25-29 para colección de sangre en el ratón. Para las ratas, una jeringa de 10-12 cc con un calibre de 22-25 x 1" la aguja se requiere.
- Una plataforma quirúrgica, bandeja de disección u otra superficie para asegurar al animal es necesario, junto con lazos, cintas o pasadores para fijar las extremidades en posición.
- Anestesia inyectable o inhalación es necesario. Si se utiliza anestesia inhalatoria, es deseable que el anestésico se entregue a través de un vaporizador de precisión con un cono de nariz. La duración del procedimiento es tal que una cámara de inducción sin suministro de gas anestésico adicional no proporcionará suficiente tiempo para completar el retiro de la sangre antes de que el animal revive.
- Tijeras de iris para el ratón, o sala de operaciones sharp-blunt tijeras para la rata, es necesario, junto con pinzas de pulgar de pequeño atraumáticas y una esponja de 2 "x 2" gasa.
- Sistema de seguridad para
- Cuando el animal está completamente anestesiado, como determinado por la presión del dedo del pie o pizca de cola, el animal se coloca en recumbency dorsal.
- Las extremidades están aseguradas a la plataforma con cinta o alfileres. Los miembros deben extenderse lejos del cuerpo.
- Retiro
- La piel se levanta y se hace una pequeña incisión transversal a través de la piel justo por encima de la pelvis en las hembras, o justo por encima del prepucio en los machos.
- Lo de las tijeras se coloca en el corte, y se realiza una incisión de línea media a través de la piel de la pelvis/prepucio el xifoides.
- La piel se refleja lateralmente a cada lado. Disección Roma puede ser necesaria para aflojar el músculo subyacente.
- Se levanta el músculo, y se hace una pequeña incisión transversal a través del músculo justo encima del corte de la piel.
- Lo de las tijeras se coloca en el abdomen y se realiza una incisión de línea media a través del músculo a la xifoides. Asegúrese de ángulo punto las tijeras hacia arriba para evitar cualquier órganos de corte.
- Corte transversal a lo largo de la curva de las costillas a cada lado. Ejercicio extra cuidado de no pinchar el hígado.
- Mueva suavemente los intestinos a la izquierda del animal para exponer la vena cava posterior.
- Coloque una gasa sobre el hígado y estar el índice y el dedo medio sobre el hígado.
- Con la otra mano, introducir la aguja, de bisel hacia arriba, en la vena cava a medio camino entre el cruce de los vasos renales y la bifurcación ilíaca.
- Retire lentamente la sangre mientras se aplica presión sobre el hígado.
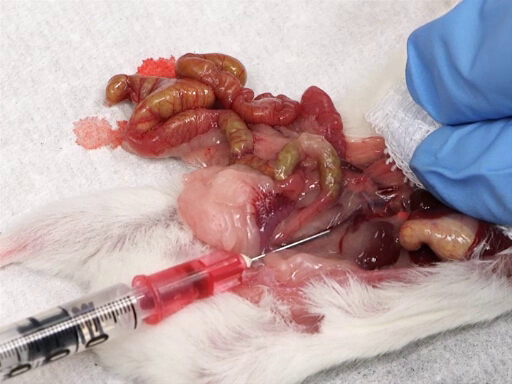
Figura 4. Retiro de la sangre de la vena cava posterior.
Aplicación y resumen
Colección de la sangre de las ratas y ratones se puede lograr con una variedad de técnicas. Aunque muchos factores, como tamaño de muestra, frecuencia de muestreo y el tamaño y edad del animal influyen en esto, el componente más esencial es el nivel de habilidad del técnico que realiza la recogida de la muestra. Para los métodos descritos aquí, el uso apropiado de anestésicos es también crucial para las muestras de la calidad y el bienestar de los animales.
Referencias
- Guidelines for the survival bleeding of mice and rats. 2010.
- Diehl, K.H., Hull, R., Morton, D., Pfister, R., Rabemampianina, Y., Smith, D., Vidal, J.M., and van de Vorstenbosch, C. 2001. A good practical guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21. 15-23.
- Omaye, S.T., Skala, J.H., Gretz, M.D., Schaus, E.E., and Wade, C.E. 1987. Simple method for bleeding the unanaesthetized rat by tail venipuncture. Laboratory Animals. 21. 261-264.
- Adeghe, A.J-H. and Cohen, J. 1986. A better method for terminal bleeding of mice. Laboratory Animals. 20. 70-72.
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Extracción de sangre I
Lab Animal Research
172.5K Vistas

Técnicas de manipulación y sujeción de roedores
Lab Animal Research
175.5K Vistas

Procedimientos de atención básica
Lab Animal Research
28.1K Vistas

Fundamentos de la crianza y destete
Lab Animal Research
35.9K Vistas

Identificación de roedores I
Lab Animal Research
55.0K Vistas

Identificación de roedores II
Lab Animal Research
25.7K Vistas

Administración de compuestos I
Lab Animal Research
101.2K Vistas

Administración de compuestos II
Lab Animal Research
35.1K Vistas

Administración de compuestos III
Lab Animal Research
31.6K Vistas

Administración de compuestos IV
Lab Animal Research
52.0K Vistas

Extracción de sangre II
Lab Animal Research
73.8K Vistas

Mantenimiento e inducción de la anestesia
Lab Animal Research
50.9K Vistas

Consideraciones para la cirugía de roedores
Lab Animal Research
22.5K Vistas

Necropsia diagnóstica y recolección de tejidos
Lab Animal Research
58.4K Vistas

Recolección de tejidos estériles
Lab Animal Research
35.0K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados