Les solides cristallins sont divisés en quatre types : moléculaires, ioniques, métalliques et covalents en fonction du type d'unités constitutives et de leurs interactions interparticulaires.
Solides moléculaires
Les solides cristallins moléculaires, tels que la glace, le saccharose (sucre de table) et l'iode, sont des solides composés de molécules neutres comme unités constitutives. Ces molécules sont maintenues ensemble par des forces intermoléculaires faibles telles que les forces de dispersion de London, les interactions dipôle-dipôle ou les liaisons hydrogène, qui dictent leurs propriétés (tableau 1).
L'intensité des forces d'attraction entre les unités présentes dans les différents cristaux varie considérablement, ce qui se reflète au niveau des points de fusion de ces cristaux.
Les petites molécules apolaires symétriques, comme H2, N2, O2 et F2, ont des forces de dispersion faibles et elles forment des solides moléculaires avec des points de fusion très bas (inférieurs à −200 °C). Les substances composées de molécules apolaires de plus grande taille ont des forces d'attraction plus importantes et fondent à des températures plus élevées.
Les solides moléculaires composés de molécules polaires ayant des moments dipolaires permanents fondent à des températures encore plus élevées. Le solide SO2 et le sucre de table en sont des exemples. Les liaisons hydrogène intermoléculaires sont principalement responsables du maintien du réseau tridimensionnel de ces solides moléculaires, comme on le voit dans l'eau congelée ou la glace.
Les propriétés des solides moléculaires dépendent de l'efficacité de l'assemblage de leurs unités constitutives, les molécules, en trois dimensions. Comme les forces intermoléculaires dépendent du contact, une plus grande symétrie des molécules constitutives garantit un assemblage compact et étroit dans la structure cristalline avec des attractions intermoléculaires élevées. Cela augmente le point de fusion. La symétrie plus basse des molécules empêche l'assemblage efficace. Les forces intermoléculaires ne sont donc pas aussi efficaces et le point de fusion est plus bas.
Solides ioniques
Les solides cristallins ioniques, comme le chlorure de sodium, sont composés d'ions positifs et négatifs qui sont maintenus ensemble par de fortes attractions électrostatiques.
Les solides ioniques ont des points de fusion élevés en raison des fortes attractions ioniques. On peut avoir une approximation de la force de l'interaction ionique entre les cations et les anions dans un solide ionique grâce à la force électrostatique, donnée par la loi de Coulomb :
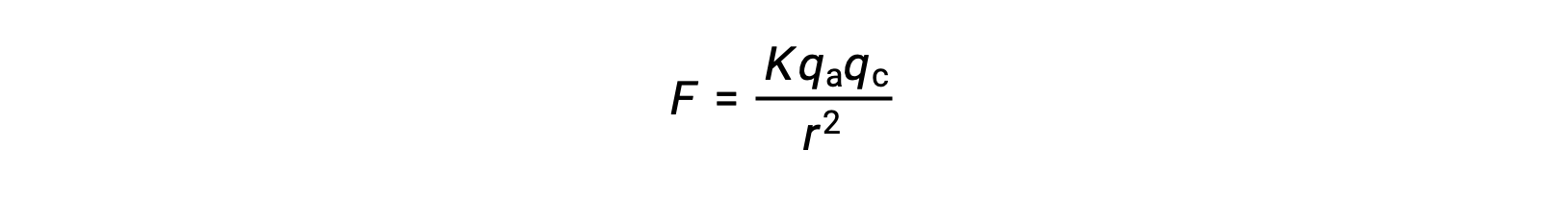
Ici, K est une constante de proportionnalité, r est la distance entre les charges, et qa et qc représentent respectivement les charges sur les anions et les cations. Plus la charge sur les cations et les anions est élevée, plus la force de l'attraction ionique est grande. De même, l'assemblage étroit des anions et des cations dans le réseau cristallin réduit la distance entre les charges, ce qui entraîne des forces d'attraction ionique plus importantes.
Les solides ioniques sont durs, ils ont également tendance à être fragiles et ils se brisent plutôt que de se plier. Leur fragilité est attribuée à la présence d'interactions d'attraction (cation-anion) et de répulsion (cation–cation et anion–anion) dans le réseau cristallin. Comme les ions ne peuvent pas se déplacer librement en raison des forces coulombiennes importantes, les solides ioniques ne conduisent pas l'électricité. Cependant, à l'état fondu ou lorsqu'ils sont dissous dans l'eau, les ions deviennent libres de se déplacer et ils conduisent l'électricité.
Tableau 1. Caractéristiques des solides moléculaires et ioniques.
| Type de solide cristallin | Type de particule constitutive | Type d'attractions | Propriétés | Exemples |
| Solides moléculaires | Molécules | Forces intermoléculaires (Fim) : forces de dispersion, forces dipôle-dipôle, liaisons hydrogène | Dureté variable, fragilité variable, points de fusion bas, un mauvais conducteur de chaleur et d'électricité | Ar, H2O (glace), CO2 (glace carbonique), I2, C12H22O11 (saccharose) |
| Solides ioniques | Ions | Électrostatiques | Dur, fragile, points de fusion élevés à très élevés, conducteur d'électricité à l'état fondu et dissous | NaCl (sel de table), MgO(oxyde de magnésium), Al2O3 (alumine) |
Une partie de ce texte a été adaptée d'Openstax, Chimie 2e, Section 10.5 : L'état solide de la matière.
Du chapitre 11:

Now Playing
11.15 : Solides moléculaires et ioniques
Liquides, solides et forces intermoléculaires
16.2K Vues

11.1 : Comparaison moléculaire des gaz, liquides et solides
Liquides, solides et forces intermoléculaires
39.5K Vues

11.2 : Forces intermoléculaires vs intramoléculaires
Liquides, solides et forces intermoléculaires
83.3K Vues

11.3 : Forces intermoléculaires
Liquides, solides et forces intermoléculaires
54.6K Vues

11.4 : Comparaison des forces intermoléculaires : point de fusion, point d'ébullition et miscibilité
Liquides, solides et forces intermoléculaires
43.2K Vues

11.5 : Tension superficielle, capillarité et viscosité
Liquides, solides et forces intermoléculaires
27.0K Vues

11.6 : Changement d'état
Liquides, solides et forces intermoléculaires
18.3K Vues

11.7 : Changement d'état : vaporisation et condensation
Liquides, solides et forces intermoléculaires
16.7K Vues

11.8 : Pression de vapeur saturante
Liquides, solides et forces intermoléculaires
33.6K Vues

11.9 : Équation de Clausius-Clapeyron
Liquides, solides et forces intermoléculaires
54.4K Vues

11.10 : Changement d'état : fusion et congélation
Liquides, solides et forces intermoléculaires
12.0K Vues

11.11 : Changement d'état : sublimation et condensation solide
Liquides, solides et forces intermoléculaires
16.4K Vues

11.12 : Courbes de température de changement d'état
Liquides, solides et forces intermoléculaires
21.7K Vues

11.13 : Diagrammes de phases
Liquides, solides et forces intermoléculaires
37.9K Vues

11.14 : Structures des solides
Liquides, solides et forces intermoléculaires
13.3K Vues
See More