13.11 : Catalyse
La présence d'un catalyseur influence la vitesse d'une réaction chimique. Un catalyseur est une substance qui peut augmenter la vitesse de réaction sans être consommée pendant le processus. Une compréhension de base du rôle des catalyseurs lors des réactions chimiques peut être interprétée à partir du concept des mécanismes de réaction et des profils énergétiques.
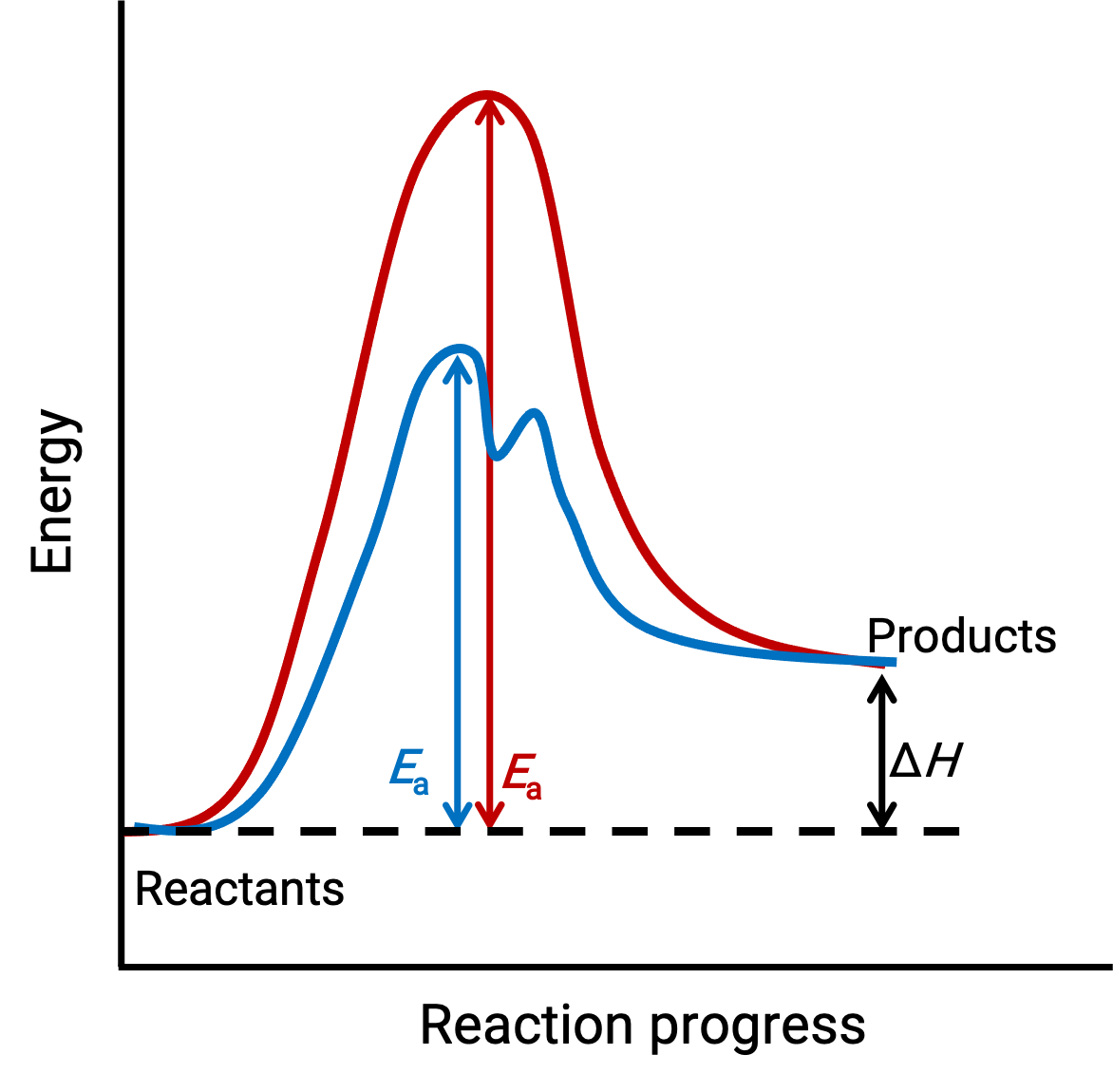
L'image illustrée représente les profils de réaction pour un processus chimique endothermique qui progresse en l'absence (courbe rouge) et en présence (courbe bleue) d'un catalyseur.
Les deux courbes représentent la même réaction globale : elles commencent et se terminent aux mêmes énergies (dans ce cas, les produits ont plus d'énergie que les réactifs ; par conséquent, la réaction est endothermique). Toutefois, leurs mécanismes de réaction sont différents. La réaction non catalysée se déroule via un mécanisme en une étape (avec un seul état de transition observé). En revanche, la réaction catalysée suit un mécanisme en deux étapes (deux états de transition sont observés) avec nettement moins d'énergie d'activation. Cette différence entre les chemins de réaction illustre le rôle du catalyseur en fournissant un autre mécanisme de réaction possible avec une énergie d'activation plus basse, accélérant ainsi les réactions.
Le mécanisme de réaction catalysée n'a pas besoin d'impliquer un nombre plus élevé d'étapes élémentaires que le mécanisme non catalysé. Cependant, il doit fournir un chemin de réaction alternatif dont l'étape déterminante de la vitesse est plus rapide (avec un Ea, ou une énergie d'activation, plus faible).
Une réaction catalytique peut être classée comme étant homogène ou hétérogène, en fonction des états physiques dans lesquels existent les catalyseurs et les réactifs au cours du processus catalytique.
Catalyse homogène
Dans une catalyse homogène, le catalyseur est présent dans la même phase que les réactifs – solide, liquide ou gaz. Au cours du processus, le catalyseur interagit avec le réactif pour former une substance intermédiaire, qui se décompose ou réagit avec un autre réactif en une ou plusieurs étapes pour régénérer le catalyseur d'origine et former le produit final.
Un exemple de catalyse homogène est le processus chimique impliquant la décomposition de l’ozone dans la haute atmosphère terrestre. L'ozone est une molécule relativement instable qui se décompose pour produire de l'oxygène diatomique. Cette réaction de décomposition est cohérente avec le mécanisme suivant en deux étapes :
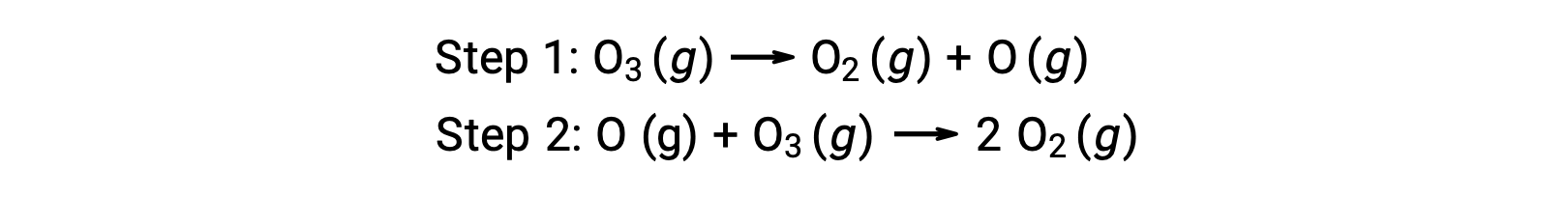
De nombreuses substances peuvent catalyser la décomposition de l'ozone. Par exemple, on croit que la décomposition de l'ozone catalysée par l'oxyde nitrique se produit par le biais du mécanisme en trois étapes suivant :
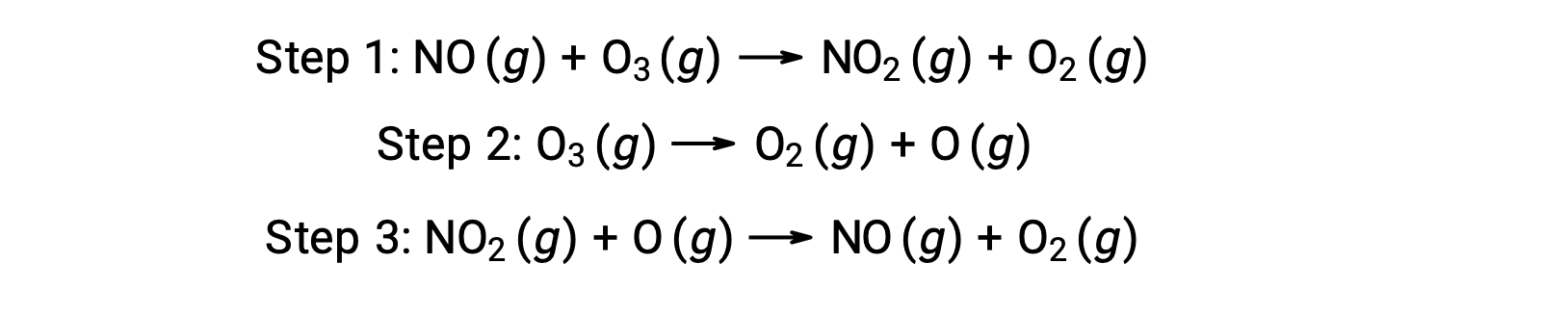
Cependant, la réaction globale est la même pour le mécanisme non catalysé en deux étapes et pour le mécanisme catalysé par NO en trois étapes :
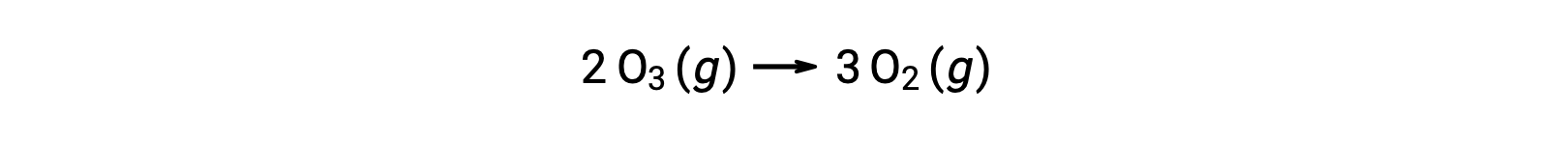
Dans la réaction catalysée, notez que NO est un réactif dans la première étape du mécanisme et un produit dans la dernière étape. C'est un autre trait caractéristique d'un catalyseur : bien qu'il participe à la réaction chimique, il n'est pas consommé par la réaction. De plus, dans cette catalyse homogène, le réactif et le catalyseur existent en phase gazeuse.
Catalyse hétérogène
Dans une catalyse hétérogène, le catalyseur est présent dans une phase différente (généralement un solide) que les réactifs. Ces catalyseurs fonctionnent généralement en fournissant une surface active sur laquelle une réaction peut se produire. Les réactions en phase gazeuse et liquide catalysées par des catalyseurs hétérogènes se produisent à la surface du catalyseur plutôt qu'à l'intérieur de la phase gazeuse ou liquide.
La catalyse hétérogène implique généralement les processus suivants :
- L'adsorption du ou des réactifs sur la surface du catalyseur
- L'activation du ou des réactifs adsorbés
- La réaction du ou des réactifs adsorbés
- La désorption du ou des produits de la surface du catalyseur
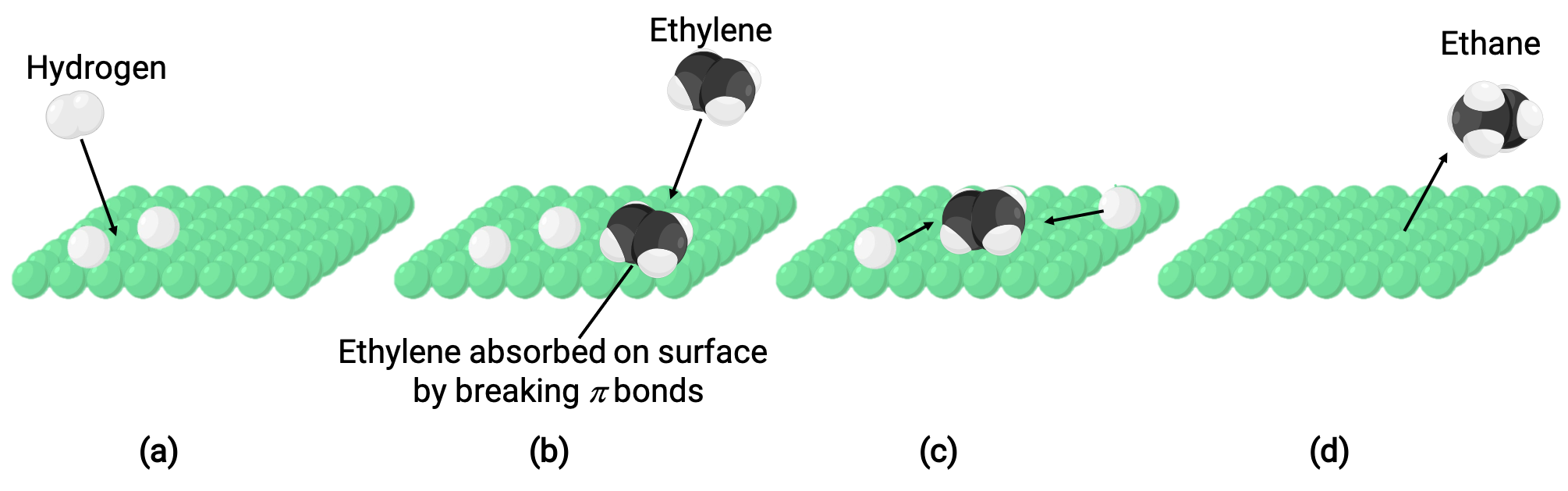
L'image illustrée représente le mécanisme réactionnel impliquant la catalyse hétérogène de l'éthylène et de l'hydrogène gazeux sur une surface solide de nickel, formant de l'éthane gazeux (C2H4 + H2 ⟶ C2H6) :
(a) L'hydrogène est adsorbé sur la surface du nickel. Au cours du processus, des liaisons hydrogène-hydrogène sont rompues pour former des liaisons nickel-hydrogène.
(b) L'éthylène s'adsorbe également sur la surface du nickel en rompant la liaison-pi carbone-carbone et en formant des liaisons nickel–carbone.
(c) Les atomes d'hydrogène se diffusent à travers la surface et forment de nouvelles liaisons carbone-hydrogène lorsqu'ils entrent en collision pour former de l'éthane (C2H6).
(d) Les molécules d'éthane se détachent de la surface du nickel.
La catalyse hétérogène est utilisée pour fabriquer industriellement des produits chimiques tels que l'ammoniac, l'acide nitrique, l'acide sulfurique et le méthanol. Des catalyseurs hétérogènes sont également utilisés dans les pots catalytiques de la plupart des automobiles à essence.
Ce texte est adapté de Openstax, Chimie 2e, Section 12.7 : Catalyse.
Du chapitre 13:

Now Playing
13.11 : Catalyse
Cinétique chimique
26.5K Vues

13.1 : Vitesse de réaction
Cinétique chimique
50.8K Vues

13.2 : Mesure des vitesses de réaction
Cinétique chimique
24.2K Vues

13.3 : Concentration et loi des vitesses de réaction
Cinétique chimique
29.7K Vues

13.4 : Détermination de l'ordre de réaction
Cinétique chimique
54.7K Vues

13.5 : Loi de vitesse intégrée : dépendance de la concentration sur le temps
Cinétique chimique
34.2K Vues

13.6 : Demi-vie d'une réaction
Cinétique chimique
34.0K Vues

13.7 : La vitesse de réaction dépend de la température
Cinétique chimique
80.8K Vues

13.8 : Tracés d'Arrhenius
Cinétique chimique
38.1K Vues

13.9 : Mécanismes de réaction
Cinétique chimique
25.1K Vues

13.10 : Étape cinétiquement déterminantes
Cinétique chimique
31.5K Vues

13.12 : Enzymes
Cinétique chimique
80.3K Vues