Un acide fort est un composé qui se dissocie totalement dans une solution aqueuse et produit une concentration d'ions hydronium égale à la concentration initiale d'acide. Par exemple, l'acide bromhydrique 0,20 M se dissocie complètement dans l'eau et produit 0,20 M d'ions hydronium et 0,20 M d'ions bromure.

D'autre part, une base forte est un composé qui se dissocie totalement dans une solution aqueuse et produit des ions hydroxyde. Par exemple, 0,015 M de KOH, l'hydroxyde d'un métal du groupe 1, se dissociera complètement et produira 0,015 M de OH- et 0,015 M de K+.
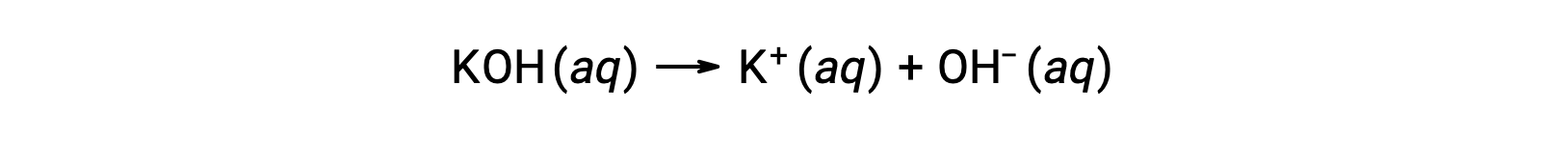
Les hydroxydes des métaux du groupe 2, comme l'hydroxyde de baryum [Ba(OH)2] et l'hydroxyde de strontium [Sr(OH)2], sont également des bases fortes et ils possèdent deux ions hydroxyde. Cela les amène à produire une solution plus basique que NaOH ou KOH à la même concentration. Par exemple, 0,015 M de Ba(OH)2 produit 0,015 M de Ba+ et 0,030 M d'hydroxyde.
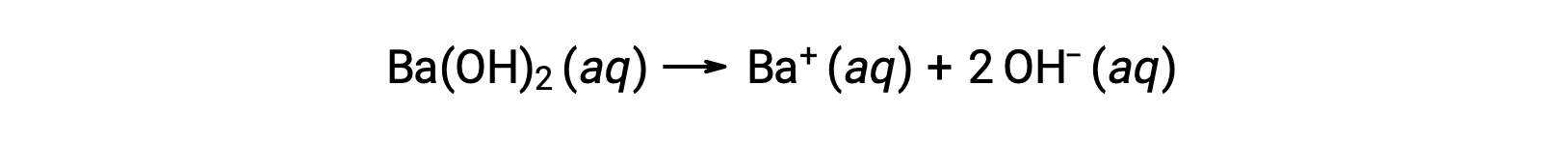
Comme les acides forts et les bases fortes se dissocient totalement, les rapports molaires peuvent être utilisés pour déterminer leurs concentrations en hydronium et hydroxyde, qui peuvent à leur tour être utilisées pour calculer le pH ou le pOH d'une solution. Par exemple, une solution de HCl 0,030 M produira des ions hydronium 0,03 M. Par conséquent, le pH de cette solution sera de

Le pOH de la même solution peut être déterminé à l'aide de la formule
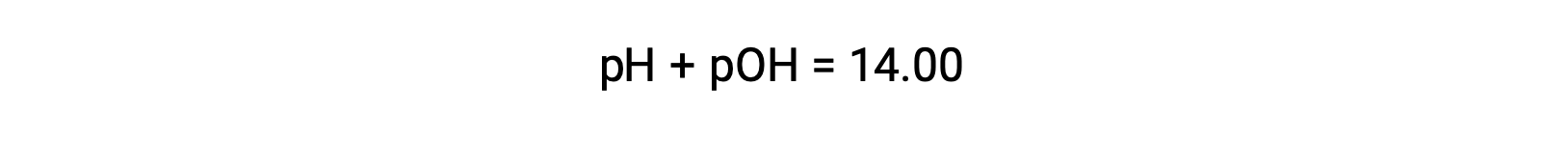
Comme le pH de la solution est de 1,52, son pOH peut être calculé comme suit

De même, la concentration des ions hydroxyde produits par des bases fortes peut être utilisée pour déterminer le pOH d'une solution à l'aide de l'équation
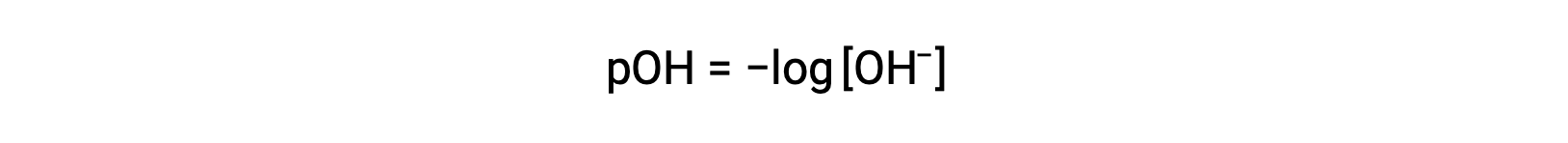
L'équation ci-dessus peut également être utilisée pour déterminer la concentration en ions hydroxyde lorsque le pOH est connu. Par exemple, si le pOH d'une solution est 3,00,
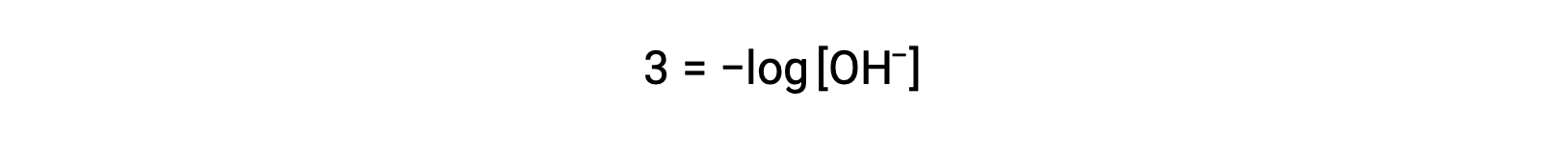
La multiplication des deux côtés par −1 donne
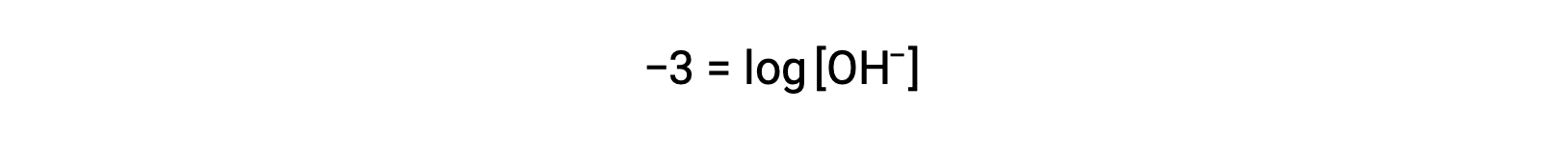
Maintenant, prenez l'antilog des deux côtés
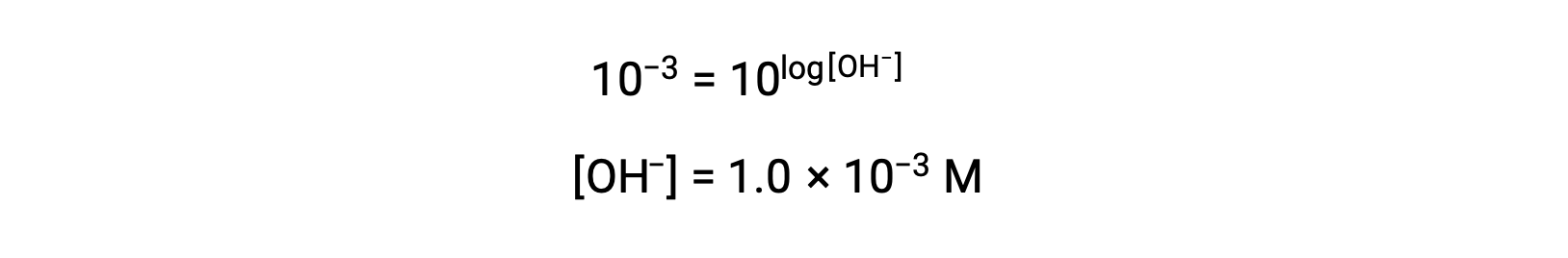
Ainsi, la concentration en ions hydronium de la solution ayant un pOH de 3 est de 1,0 × 10−3 M. Une méthode similaire peut être utilisée pour déterminer la concentration en ions hydronium d'une solution si son pH est connu.
Du chapitre 15:

Now Playing
15.6 : Acides forts et solutions basiques
Acides et bases
30.7K Vues

15.1 : Acides et bases de Bronsted-Lowry
Acides et bases
88.4K Vues

15.2 : Forces des acides/bases et constantes de dissociation
Acides et bases
59.2K Vues

15.3 : L'eau : un acide et une base selon Bronsted-Lowry
Acides et bases
48.7K Vues

15.4 : Échelle de pH
Acides et bases
66.9K Vues

15.5 : Forces relatives des paires acide-base conjuguées
Acides et bases
44.5K Vues

15.7 : Solutions d'acides faibles
Acides et bases
36.9K Vues

15.8 : Solutions de base faible
Acides et bases
22.0K Vues

15.9 : Mélanges d'acides
Acides et bases
19.3K Vues

15.10 : Les ions comme acides et bases
Acides et bases
22.8K Vues

15.11 : Détermination du pH des solutions salines
Acides et bases
42.8K Vues

15.12 : Polyacides
Acides et bases
28.3K Vues

15.13 : Force des acides et structure moléculaire
Acides et bases
30.2K Vues

15.14 : Acides et bases de Lewis
Acides et bases
42.5K Vues