Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une réversible, méthode non-invasive pour les mesures de résistance des voies aériennes et d'échantillonnage du liquide de lavage broncho-alvéolaire chez des souris
Dans cet article
Résumé
Des mesures répétées de la physiologie respiratoire rongeurs et prélèvement de cellules inflammatoires des voies respiratoires sont souhaitables, mais généralement pas possible. Nous décrivons ici une méthode reproductible pour intubation par voie orale souris qui permet des mesures répétées de l'hyperréactivité des voies aériennes et prélèvement de cellules inflammatoires des voies aériennes.
Résumé
Airway hyperréactivité (PA) des mesures et des broncho-échantillonnage liquide de lavage (BAL) sont essentielles pour les modèles expérimentaux d'asthme, mais les procédures maintes reprises d'obtenir de telles mesures dans le même animal ne sont généralement pas faisable. Ici, nous démontrons protocoles pour l'obtention de souris mesures répétées de la procréation assistée et broncho-liquide de lavage. Les souris ont été contestées par voie intranasale sept fois plus de 14 jours avec un allergène puissant ou fictive traitée. Avant le premier défi, et dans les 24 heures suivant chaque épreuve intranasale, les mêmes animaux ont été anesthésiés, intubés par voie orale et ventilés mécaniquement. Procréation assistée, évaluée en comparant les courbes dose-réponse de la résistance du système respiratoire (RRS) induite par l'augmentation des doses intraveineuses de l'acétylcholine (Ach) de chlorure entre imposture et allergènes animaux contestées, ont été déterminés. Par la suite, et par la même l'intubation, le poumon gauche a été un lavage de sorte que le dénombrement différentiel des cellules des voies respiratoires peut être effectuée. CesDes études révèlent que des mesures répétées de la procréation assistée et la collecte de liquide de LBA sont possibles à partir des mêmes animaux et que l'hyperréactivité bronchique maximale et éosinophilie des voies aériennes sont atteintes dans les 7-10 jours suivant le début du test de provocation. Cette nouvelle technique permet de réduire de façon significative le nombre de souris nécessaires à l'expérimentation longitudinale et est applicable à diverses espèces de rongeurs, des modèles de maladies des voies respiratoires et des instruments de physiologie.
Protocole
Provocation allergénique:
- Souris C57BL / 6, 4-8 semaines d'âge, sont anesthésiés dans une chambre en plexiglas étanche à l'air purgé avec un isoflurane 3,2% en vapeur d'oxygène mélange pendant 10 minutes pour atteindre profonde anesthésie générale.
- Défis allergènes par voie intranasale (45μL OVA (22,5 mg) et 7μL A. oryzae (7 mg) dans du PBS) sont administrés, chaque mardi, jeudi et dimanche, pour un total de sept demandes consécutives.
Anesthésie:
- Avant chaque test de provocation, et à la suite du défi 7, les souris sont administrés une injection intrapéritonéale de 48 mg / kg étomidate (2 mg / ml), avant de les placer dans un récipient lumière exclusion.
- Sujet reste en prise jusqu'à ce que l'absence de réponse observable neurologique est détectée lors de l'application d'une pression sur les pattes de derrière (min 5-10).
Intubation:
- Lampe à rayonnement thermique, maintenue à une diposition pour assurer le maintien de ~ 37 ° C de la température centrale du corps, doit se concentrer sur le sujet tout au long de la procédure pour éviter l'hypothermie. Un thermomètre rectal doit être utilisé au moins dans un premier temps de confirmer euthermia quelle que soit la source de chaleur utilisée.
ÉTAPES CRITIQUES Tous les liquides et les instruments reçus par les animaux de laboratoire doivent être stériles; procédures doivent être effectuées dans des conditions strictes d'asepsie. Hypothermie prolongée sous anesthésie mènera à des données aberrantes et / ou la mort des animaux. Compétence à toutes les procédures invasives devraient être élaborés en utilisant des animaux décédés avant d'essayer travail sur les animaux vivants. Lubrifiant ophtalmique devrait être utilisé pour prévenir les abrasions cornéennes d'animaux sous anesthésie générale. - Souris anesthésiées sont retirés du récipient et placé dans la position couchée (jusqu'à la face ventrale), sur la table de pléthysmographe, ajusté à un angle de 45 °.
- Une bande de caoutchouc qui entoure le tableau est inséré Behind la rangée supérieure des incisives de manière à obtenir l'objet en place. Avec des pincettes dans la main droite, poignée, d'étendre et soulevez la languette de la bouche avant de la fixer en place avec un métal abaisse dans la main gauche; permettant ainsi une voie aérienne sans entrave pour l'intubation.
- Un fil de diamètre 0,8 mm à fibre optique, reliée à une source de lumière, est inséré à travers l'étendue angiocathéter et 10 mm au-delà de la pointe. Comme le dépresseur est stabilisé avec la main gauche, la fin illuminé du fil à fibre optique est guidé à travers la cavité buccale et du pharynx par la droite jusqu'à ce que les cordes vocales sont visualisés. Le fil est ensuite passée sous une visualisation directe à travers les cordes vocales en mouvement et dans la trachée, cadencées pour se produire lorsque les cordons sont ouverte au maximum.
- La angiocathéter passe ensuite sur le fil de fibre optique dans la trachée jusqu'à l'extrémité du cathéter se trouve dans la partie médiane de la trachée. Pour les souris 17-22 grammes, ce qui correspond à un segment de cathéter 10 mm restant visible pariween le connecteur et l'extrémité de la mâchoire inférieure du crâne du sujet s. Le montant réel par lequel le cathéter est insérée doit être déterminée par inspection directe de la trachée de 2-3 souris cathétérisés de la taille et des antécédents pertinents génétique.
- Le fil de fibre optique est retirée et une intubation réussie est confirmée par l'observation régulière de grandes respirations rythmiques (excursions du thorax et de l'abdomen) qui suit immédiatement fin à l'occlusion du connecteur avec le pouce. Une réponse d'étouffement, indépendamment de signes d'occlusion du pouce, respiration irrégulière, ou d'autres difficultés respiratoires sont indicatives de angiocathéter mauvais positionnement et indiquent généralement une intubation œsophagienne.
Échec étape essentielle pour inverser rapidement une intubation oesophagienne peut être mortelle. Si l'intubation oesophagienne est suspectée, le cathéter doit être rapidement retiré et réinséré lorsque l'animal a repris une respiration normale. L'étomidate est l'anesthésique de choix, d'unll anesthésiques rongeurs disponibles, cet agent provoque le moins de toxicité cardiovasculaire (hypotension, arythmie, arrêt cardiaque). - Table Basse pléthysmographe jusqu'au parallèle avec la table de travail et tourner à 180 ° jusqu'à ce que l'objet en face du port ventilateur. Tournez animal sur son côté avant de brancher le ventilateur.
- Une intubation est en outre confirmée lorsque, après fixation d'une connexion étanche à l'air et en activant le ventilateur (fonctionnement à 150 cycles / minute, 9 ml / g du volume courant, 100% d'oxygène), on voit thoraco excursion de phase avec le ventilateur.
Voie intraveineuse:
- A 10 mm, 27ga aiguille est retirée de son connecteur de seringue par voie de fusion le droit, et à la flexion de l'aiguille 90 ° à mi-chemin en utilisant une pince stérile et hémostatique de sorte que la face en biseau dans l'angle. L'extrémité non biseautée est reliée à la tubulure PE10 menant à l'orifice d'injection IV.
- Pour éviter potentiellementembolisation air fatal, le tube et l'aiguille sont purgés avec 37 ° C, 0,9% de NaCl par la seringue de 1 ml. L'orifice d'injection comprend une aiguille 27ga, poussé à travers un trou percé dans le bouchon d'un tube de centrifugeuse de 15 ml. Le bouchon est rempli avec une solution saline telle que l'extrémité de l'aiguille est immergée en permanence, ce qui réduit la probabilité que l'air est entraîné dans l'aiguille et injecté par voie intraveineuse.
- Avec la souris en restant sous la lampe de chauffage, l'aiguille est alignée à l'opposé de la caudale parallèle à la queue et au-dessus de la veine latérale. L'aiguille est dirigée légèrement en dessous de la peau, tout dirigé crânialement sur la longueur de la veine s et poussé sous-cutanée à la courbure. Placement réussi IV est confirmée par l'observation de reflux du sang dans le tube IV avec une légère traction sur le piston de la seringue. En outre, il devrait être libre écoulement à travers la ligne IV lors de l'injection de 50-100 ul solution saline dans la veine de la queue. Veines de la queue occasionnels ne peuvent pas être stable canule. Dans èmeinstances ESE, la souris peut être pivoté de 180 degrés par rapport à l'autre côté et l'autre queue IV généralement accessible sans difficulté.
- Après retrait de la lampe de chaleur à partir de la configuration, l'objet est enfermé dans le pléthysmographe, par la suite fixé comme étanche à l'air avec l'application de colliers de serrage 4.
ÉTAPE CRITIQUE Permettre la lampe de chaleur à rester sur chauffera l'air dans la chambre pléthysmographe et éventuellement modifier les mesures ultérieures de R RS stérilité des aiguilles iv et solutions doivent être maintenus. Stérilisation des aiguilles est réalisé en immergeant et le rinçage avec de l'éthanol à 70% suivi d'un rinçage et le rinçage avec une solution saline stérile avant insertion iv. Par ailleurs, la queue doit être nettoyé avec de l'éthanol à 70% ou alcool isopropylique avant l'insertion iv.
Mesures de résistance des voies aériennes:
- Résistance de pic est déterminée par dosage continu du quotient dpt / V (WHEre DPt est la variation de la pression trachéale et V est le débit d'air) à des points de volume pulmonaire égal (70% du volume courant). DPt est déterminée en utilisant un transducteur de pression relié à la angiocathéter trachéale. Pour déterminer V, les variations de pression pléthysmographe sont calibrés aux variations de volume sur les chaînes physiologiques étudiés. Le différentiel de volume pléthysmographe au fil du temps, tel que calculé par le module préampli, est V. Après avoir établi une ligne de base stable R RS (variation <5% plus de 3 minutes), cinq doses successives (volume = 2 poids corporel ul / g) de plus en plus des concentrations de chlorure d'acétylcholine (0,058, 0,18, 0,59, 1,58 et 5,8 mg / kg de poids corporel, dans une solution saline à 0,9% à un pH de 7,4, maintenu sur de la glace et de la main-réchauffé avant chaque injection) sont injectés sur une seconde via l'iv, avec chaque dose administrée après son retour de la R RS de base, jusqu'à un triplement de la résistance de base (environ 12 cm H 2 O x ml -1 x sec, c'est à dire 200%augmentation de la résistance des voies aériennes au-dessus de la ligne de base typique d'environ 4 cm H 2 O x -1 x sec ml) est atteint. La concentration provocatrice de Ach, en mg / g de poids corporel, qui provoque une augmentation de 200% en R RS à partir de valeurs de référence (appelé PC 200), est calculée par interpolation mathématique des Ach-R RS courbes dose-réponse.
- Une fois PC 200 valeurs ont été atteints, les attaches de libération, et de démanteler le pléthysmographe. Un maximum de 5 doses croissantes de Ach est donnée. La gamme de concentration Ach donnée ci-dessus est adapté pour la réalisation PC 200 valeurs pour la plupart des souches de souris naïves.
Quand une étape critique de base d'environ 4 cm H 2 O x ml -1 x sec est mis en place sur l'écran pour la résistance 30 secondes, un pl de sérum physiologique 60 peut être injecté par voie iv à confirmer que le plan de l'anesthésie a été atteint. Avec une anesthésie complète, il n'y aura paschangement important dans la résistance, une augmentation de la résistance ou de mouvement des membres ou de la queue représente un signe de détresse physique et indique la nécessité d'une anesthésie supplémentaire. - Retirer IV de la veine de la queue, puis débranchez l'animal du ventilateur, le maintien d'une compagnie aérienne brevetée en gardant la canule trachéale en place. Les animaux ne parviennent pas à reprendre occasionnels respiration spontanée immédiatement. Dans ces cas, la respiration peut être encouragé en massant doucement le thorax.
Respiration spontanée étape cruciale doit être établie avant le transfert vers la chambre de récupération, sinon décès se produiront. - À la reprise de la respiration spontanée, les souris sont transférées avec une canule trachéale en place, dans une chambre de purge avec 100% d'O 2 et de maintenir à 37 ° C en utilisant une lampe chauffante. Dans 15-20 minutes, les souris respirent fortement et commence à déplacer leurs extrémités, à quel point le cathéter trachéal peut être retiré et les animaux safely transférée dans leurs cages réguliers.
ÉTAPE CRITIQUE La voie aérienne est facilement obstrué chez la souris connaissance à cause de l'acétylcholine induite par hyper-salivation et est la principale raison de l'asphyxie décès lié à des souris anesthésiées suite des mesures physiologiques des voies respiratoires. Pour cette raison, la canule trachéale doit rester en place, même chez les souris non soumis à un lavage broncho-alvéolaire, jusqu'à ce qu'ils soient réveillable et ne doit pas être retiré tant que l'hyper-salivaton a cessé.
Lavage broncho-alvéolaire:
- Collection de liquide de lavage broncho est sûr quand la souris se remettre suffisamment leur gag (~ 20 min après le placement en chambre de récupération) reflex. Le réflexe nauséeux est évaluée en faisant délicatement coulisser la angiocathéter entrants et sortants; évident toux ou difficulté indiquent que le réflexe nauséeux est de retour.
ÉTAPE CRITIQUE Permettre trop prolongée d'un temps de récupération va grandement diminuer til efficience de retour BAL de souris individuelles: ainsi, le réflexe nauséeux doit être surveillée toutes les quelques minutes, à la suite de la période de 20 min suggéré de repos. Si les souris sont incapables de tolérer la procédure de lavage en raison de l'éveil partiel, 3,2% isoflurane vapeur peut être utilisé. - Un fil métallique de guidage intubation (0.5mm OD), avec une courbure continue de ~ 30 ° dirigé vers le lobe gauche du poumon, est inséré dans le angiocathéter. Le fil de guidage et angiocathéter sont avancés conjointement dans le lobe gauche du poumon, de telle sorte que le cathéter (moyeu exclu) s'étend au-delà des dents de devant que de 1 mm.
Le non ÉTAPE CRITIQUE d'isoler poumon gauche permettra de réduire considérablement le rendement, tout en améliorant la probabilité de mort de l'animal. Des précautions doivent être prises pour veiller à ce que la pointe du guide-fil ne passe pas par l'extrémité ouverte de la angiocathéter. Faire progresser le angiocathether avec la pointe métallique en saillie pourrait entraîner une déchirure trachéale et la mort en raison de la trachéel la rupture. - Garder le angiocathéter en place, le fil guide est retiré et 300 ul de PBS (pH 7,4, stérile) est introduite dans le poumon gauche via une seringue de 1 ml. Immédiatement après, tout en dressant le piston de la seringue pour créer une pression négative, la angiocathéter lentement (3 s) retirée pendant le massage intense du poumon. Un retour BAL de 100-200 ul est attendue.
- Retourner immédiatement à la souris un lavage à 37 ° C, 100% d'O 2 chambre tout en continuant à masser le thorax. Souris placer sur son côté gauche jusqu'à guérison complète (~ 20 min). Les animaux sont ensuite replacés dans leurs cages.
PÉRIODE D'APPLICATION:
Par souris, toute la procédure ne devrait pas prendre plus de 1 heure à accomplir:.. Étape 3-4, 5-10 min; étapes 5-21, 10 min; Etape 22, 20-30 min; Steps 23-24,. 10 min. Avec compétence accrue et par des sujets stupéfiante dans le protocole, jusqu'à 3 souris / heure peuvent être traitées.
RepsRésultats sentatives:
Hyperréactivité des voies aériennes chez la souris, telle que déterminée par des mesures de PC 200 valeurs, est une conséquence de l'activation et de recrutement pour les poumons des cellules T et la sécrétion de la cytokine IL-135-7. Ainsi, hyperréactivité des voies aériennes n'est pas la conséquence inévitable de défi voies respiratoires avec l'allergène, mais dépend plutôt d'un compartiment de cellules T immunitaire est intact et le temps requis pour les réponses des lymphocytes T à se développer dans le cadre de l'exposition aux allergènes répété. Comme le montre la Fig. 2a, hyperréactivité des voies aériennes, défini comme PC 200 valeurs qui sont nettement inférieurs par rapport aux valeurs de référence, élaborées après 5 défis allergènes sans augmentation significative après le sixième défi. Pour des raisons qui ne sont pas entièrement comprises, la réactivité bronchique a diminué (PC 200 valeurs plus) après la provocation allergénique premier (fig. 2a). Des tendances similaires sont visibles en comparant les courbes dose-réponse pour Ach les mêmes souris (fig. 2b). However, il est évident ici que hyperréactivité des voies aériennes plein développe brusquement après la provocation allergénique cinquième, tels que les souris deviennent plus de 30 fois plus sensible à Ach entre les défis quatrième et sixième. Ensemble, ces résultats indiquent que les mesures les plus fiables de la procréation assistée sont obtenus après six défis allergènes (12 jours); mesures à timepoints antérieures sont susceptibles de produire des données très variables. Les souris à plusieurs reprises contestées par voie intranasale avec le véhicule (solution saline) ne se développent pas hyperréactivité des voies aériennes, et, à toutes les doses de Ach donnés, R RS mesures ne s'écarte pas sensiblement de valeurs de référence (Fig. 3 et données non présentées).
Avant l'apparition de la procréation assistée robuste, le type cellulaire dominant des voies respiratoires induite par un allergène était le neutrophiles (fig. 4). Conformément à la tendance de la procréation assistée, cependant, éosinophilie progressivement renforcé avec provocation allergénique répétée et l'éosinophile est devenu le type de cellule numériquement dominante dans le liquide de LBA after le sixième défi, qui coïncide avec une baisse marquée des effectifs neutrophis (Fig. 4). Les macrophages ont d'abord augmenté en nombre avec les premiers défis allergènes et quelques fluctuations dans l'abondance par la suite. L'abondance des lymphocytes n'a pas changé de manière significative quel que soit le nombre de défis allergènes et, paradoxalement, compte tenu de leur importance primordiale pour le modèle, sont généralement la cellule moins nombreux dans le liquide de LBA.
Mesures de résistance des voies aériennes chez les souris recevant provocation allergénique ni ne échantillonnage BAL n'a pas varié au cours des 17 jours d'expérimentation. Échantillonnage répété le liquide de LBA en l'absence de mesures de la physiologie des voies aériennes ou provocation allergénique ont également été réalisées et ont montré que l'amélioration des neutrophiles et de macrophages dans les voies qui ne sont pas conservées au-delà de 5 jours (données non présentées). Ces résultats démontrent que l'éminent neutrophilie observée chez les souris allergènes contestées est en grande partie le résultat de la procédure et not l'antigène.
Dans le contrôle, PBS-contesté souris, des mesures de résistance des voies aériennes ne variait pas de façon significative au fil du temps. Macrophages et des neutrophiles améliorée, mais pas des éosinophiles, le recrutement de liquide de LBA a également été observée chez ces souris, semblable à ces changements observés chez les souris recevant seulement un échantillonnage répété le liquide de LBA (fig. 4 b, d). Ensemble, ces données soulignent l'importance de l'allergène, et non pas les différentes manipulations des voies respiratoires, l'induction de l'inflammation des voies aériennes à la fois (éosinophile) allergique et la procréation assistée.
Des résultats similaires peuvent être attendus utilisant des allergènes par voie intranasale analogues à la protéinase que nous avons utilisé ici. Cependant, de nombreux chercheurs utilisent l'ovalbumine pour induire une maladie pulmonaire allergique. Après une période appropriée d'amorçage intradermique ou intrapéritonéale (1-2 semaines) avec de l'ovalbumine précipite un sel d'aluminium, un phénotype de l'asthme robuste, y compris hyperréactivité des voies aériennes, on peut s'attendre dans les 24 heuresaprès un défi unique intranasale avec de l'ovalbumine soluble.
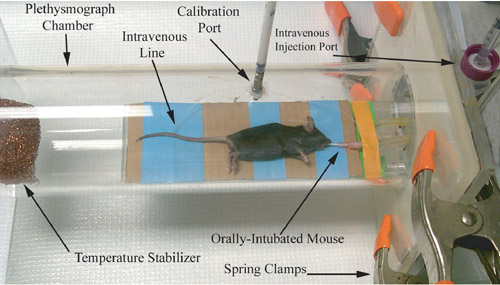
Figure 1. Représentation photographique d'un pléthysmographe rongeur, immédiatement avant l'enregistrement des voies aériennes mesure physiologie.

Figure 2. Mesures de résistance des voies aériennes. A) À des fins statistiques, ANTILOG PC 200 valeurs sont rapportées. Notez la forte augmentation de la PC 200 après antilog premier défi et une diminution subséquente à la suite de nouveaux défis. B) la résistance du système respiratoire (RCV): Notez la raideur des Ach-RRS courbes dose-réponse après défis sixième et septième. Les barres d'erreur représentent SEM.
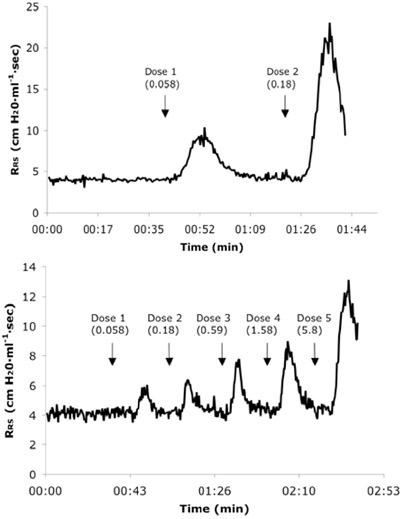
Figure 3. Représentant en temps réel du système respiratoire résidencestance (R RS) tracés à partir d'un allergène naïve (A) et 6X contesté de la souris (B) recevant des doses consécutives IV de Ach. Les valeurs de dose sont présentés en mg / kg unités.

Figure 4. Différentielles compte de cellules immunitaires dans les échantillons de lavage broncho-alvéolaire provenant des poumons gauche de souris traitées avec 7 défis consécutifs par voie intranasale. Pour cent (%) l'abondance des cellules du système immunitaire chez les souris traitées avec l'allergène (A) ou de PBS (B). Nombre total de cellules du système immunitaire des souris traitées avec l'allergène (C) ou de PBS (D). Les valeurs représentées sous forme de moyenne + / - SEM.
Discussion
L'étude de l'asthme, et diverses autres maladies obstructives des voies aériennes, constitue un domaine actif et croissant de la recherche biomédicale. Une composante importante de l'asthme lié à la recherche expérimentale est la capacité à mesurer les variations de taille des voies aériennes dans des conditions variables. Rétrécissement des voies respiratoires excessive en réponse au défi provocateur, une fonction canonique de l'asthme et des maladies pulmonaires liées à une propriété e...
Remerciements
Nous remercions le Dr W. Mintzer pour la suggestion de réaliser à fibre optique intubation orotrachéale. Soutenue par des subventions U19AI070973, R01AI057696, K02HL75243 et R01HL082487 de la National Institutes of Health.
matériels
Airway physiologie logiciel de mesure (Rescomp) a été spécialement préparé (Millenium Premier Group, 415-519-4371).
Les données ont été analysées à l'aide d'un poste de travail PC sous Windows XP équipé d'un processeur Pentium III (Intel, Inc Santa Clara, CA) et une analogique 17 broches pour signal numérique convertisseur (National Instruments, # PC-LPM16).
Un petit animal voies respiratoires physiologie poste de travail a été spécialement assemblé (Millenium Premier Group) à l'aide des capteurs de pression disponibles dans le commerce (pièce n ° TRD5700 et TRD4510), des modules de préampli (pièce n ° MAX2270), le châssis (n ° de pièce MAX1320, le tout à partir Buxco, Inc Wilmington, Caroline du Nord ) et un pléthysmographe animaux personnalisée de petite taille.
0,5 mm de diamètre externe de fibre optique fil, connecté à une source de lumière (Cole Palmer Illuminateur, 41722 séries)
Ventilateur (Harvard Apparatus Souris Ventilateur, # 687)
10 mm, aiguille 27ga (BD Biosciences, cat. No. 309602)
Lampe chauffante
1 ml seringue (BD Biosciences, cat. No. 305109)
4 pinces (pince poney printemps 3200)
0,5 mm fil externe pour le guide de l'intubation
Hémacytomètre
Lames de microscope Superfrost / plus (chat Fisher. No. 12-550-15)
Shandon Filtre Cartes (Thermo chat. No. 5991022)
Coulissant cellule différentielle tache (chat Fisher. No. 122911)
Microscope optique (Leica)
Cytospin 3 (Shandon)
20 ga, 1,25 pouces, cathéters intraveineux PROTECTIV (Smith médicale)
0,5 mm en fibre optique polymère (Edmund Optics # NT02-532).
Références
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Adler, A., Cieslewicz, G., Irvin, C. G. Unrestrained plethysmography is an unreliable measure of airway responsiveness in BALB/c and C57BL/6 mice. J. Appl. Physiol. 97, 286-292 (2004).
- Bates, J. The use and misuse of penh in animal models of lung disease. Am. J. Respir. Cell Mol. Biol. 31, 373-374 (2004).
- Lundblad, L. K., Irvin, C. G., Adler, A., Bates, J. H. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Grunig, G. Requirement for IL-13 independently of IL-4 in experimental asthma. Science. 282, 2261-2263 (1998).
- Corry, D. B. Requirements for allergen-induced airway hyperreactivity in T and B cell-deficient mice. Mol. Med. 4, 344-355 (1998).
- Corry, D. B. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J. Exp. Med. 183, 109-117 (1996).
- Amdur, M. O., Mead, J. Mechanics of respiration in unanesthetized guinea pigs. Am J Physiol. 192, 364-368 (1958).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon