Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation des Courges drosophile chromosomes polytènes pour marquage de l'anticorps
Dans cet article
Résumé
Ce protocole vidéo illustre la technique de squash utilisés dans le laboratoire de Johansen pour préparer Drosophile Chromosomes polytènes pour l'étiquetage des anticorps.
Résumé
Drosophile a longtemps été un modèle de système de prédilection pour étudier la relation entre la structure de la chromatine et la régulation des gènes en raison des avantages cytologique fournie par le géant de chromosomes polytènes salivaires des glandes du stade larvaire tiers. Dans ce tissu les chromosomes subissent de nombreux cycles de réplication, en l'absence de la division cellulaire donnant naissance à environ 1000 exemplaires. L'ADN reste alignée après chaque cycle réplicatif résultant dans des chromosomes fortement agrandie qui fournissent une occasion unique de mettre en corrélation la morphologie chromatine avec la localisation des protéines spécifiques. En conséquence, il a été un haut niveau d'intérêt dans la définition des modifications épigénétiques présents à des gènes différents et à différentes étapes du processus de transcription. Un outil important pour de telles études est l'étiquetage des chromosomes polytènes avec des anticorps à l'enzyme, facteur de transcription, ou la modification des histones d'intérêt. Ce protocole vidéo illustre la technique de squash utilisés dans le laboratoire de Johansen pour préparer la drosophile chromosomes polytènes pour l'étiquetage des anticorps.
Protocole
Le protocole suivant pour la préparation des chromosomes polytènes de squash est adaptée de la procédure décrite dans Johansen et al. (2009).
1. Culture de larves de drosophile troisième stade
Afin d'obtenir optimale chromosomes polytènes de haute qualité des préparations de squash, des conditions de culture sont essentiels fréquentés (c'est à dire, placer environ 20 ponte des mouches femelles dans une norme de 4 bouteille volée "et changer pour une nouvelle bouteille chaque jour). Sélectionnez la plus grosse des individus de la première récolte de l'escalade troisième stade larvaire pendant qu'ils sont encore nomades, mais juste avant la nymphose. Nous avons régulièrement la culture à 21 ° C mais 18 ° C donnera plus gros chromosomes qui peuvent être plus adaptés à certaines fins, comme par exemple lorsque la bande / interbandes régions ont besoin d'être visualisés à haute résolution.
2. Matériaux de squash polytènes
- Pinces à dissection Drummond (2)
- Boîtes de Pétri (60 x 15 mm)
- Lames de microscope givré (n ° 12-544-3 Fisher) (poly-lysine)
- 22 x 22 mm glisse n ° couvrent 15 (Fisher n ° 12-520B) (enduits de Sigmacote; Sigma # SL2)
- 22 x 40 mm glisse n ° couvrent 15 (Fisher n ° 12-530B)
- Kim-lingettes
- Microscope à contraste de phase avec l'objectif 20X
- Petite Dewar (par exemple, fiole à vide ou un thermos bouteille)
- Pince longue
- Lames de rasoir
- Coplin Jarre
- Caoutchouc-Maid ou le plateau de Tupperware (ou équivalent Bac plombable)
- Parafilm (coupé en carrés 22 mm)
- 175 g de poids
3. Fixatifs et solutions
- Stocks de formaldéhyde 5X. Préparer une nouvelle solution de 0,74 g. paraformaldéhyde dans 4,0 ml de dH 2 O et avec 28 l de KOH 1N. Chaude à 65 ° C pour dissoudre le paraformaldéhyde et stocker ensuite sur la glace.
- Fixateur 1. Préparer une nouvelle solution de 0,5 ml PBS 10X, 50 pl Triton X-100, 3,45 ml dH 2 O et 1,0 ml d'un stock de formaldéhyde 5X. Chaud pour disperser le Triton X-100 et l'utilisation en 1 heure.
- Fixateur 2. Préparer une nouvelle solution de 1,5 ml dH 2 O, 2,5 ml d'acide acétique glacial et 1,0 ml d'un stock de formaldéhyde 5X et d'utiliser moins de 1 heure.
- Solution d'acide Lactoacetic. Préparer une solution de 1 ml d'acide lactique, 2 ml dH 2 O, et 3 ml d'acide acétique.
4. Préparation polytènes de squash chromosome:
- Rincer à l'eau et les larves de transfert à PBS dans une boîte de culture tissulaire pour la dissection.
- Saisir l'extrémité de la bouche des crochets avec une paire de pinces, tenir le corps environ 2 / 3 du chemin vers le bas avec l'autre paire, et tirez sur la bouche des crochets de sorte les glandes salivaires sont exposés. Séparer les glandes salivaires du cerveau et des yeux antennaire disques, et de disséquer le cadavre de graisse et les tissus associés par les glandes.
- Ajouter 200 microlitres de fixateur 1 dans le premier puits d'une lame de deux dépression bien et 200-300 microlitres de 2 fixatif pour bien deux. Transfert une paire de glandes salivaires à la fois pour une même fixateur dans un et incuber pendant le temps requis pour l'épitope cible, habituellement environ 1-2 minutes. (Remarque: certains épitopes, comme pour la plupart des modifications des histones, peuvent nécessiter 5 minutes ou plus de fixation.)
- Pince en utilisant le transfert des glandes salivaires à 2 fixateur dans le puits 2 et incuber pendant deux minutes.
- Transfert des glandes à 10-30 ul de solution d'acide Lactoacetic sur une lamelle propre Sigmacoted. Abaissez délicatement une lame de microscope polylysine enduit sur la lamelle et, sans appliquer une pression verticale, ramasser la lamelle afin glandes sont entre la lame et la lamelle. Immédiatement faciliter la lyse cellulaire et chromosomique propagation en prenant soin saisir la lamelle avec une pince sur un bord et doucement se déplaçant légèrement en arrière, en essayant de minimiser toute pression verticale sur le tissu. Sinon, utiliser le côté gomme d'un crayon ou même un doigt pour déplacer doucement la lamelle en arrière. Notez que tout retard dans le déplacement de la lamelle en arrière est susceptible de diminuer la propagation des armes chromosomiques comme ils auront tendance à devenir plus rigides à l'exposition à la solution d'acide Lactoacetic. Opacité de la solution est souvent une bonne indication de la séparation des cellules. Tapotant doucement la lamelle oblique (pour éviter une pression verticale) avec le côté gomme d'un crayon à quelques reprises peut aussi aider à propager chromosomiques.
- Examine immédiatement le tissu sous un microscope à contraste de phase avec un objectif 20 ou 40x pour déterminer si les chromosomes sont bien réparties.
- Lorsque la propagation chromosomique est suffisant, mettre la diapositive avec le côté lamelle sur une pile de nettoyage Kim-lingettes. Placez une seconde Kim-tampon sur le dessus et aplatir les chromosomes en plaçant votre pouce sur l'endroit où la lamelle est positionné et en appuyant fermement, en évitant tout mouvement horizontal de la lamelle qui cisaillementles chromosomes.
- Examinez la lame à nouveau sous le microscope afin de déterminer si la préparation est adaptée pour l'usage prévu. Si les chromosomes ont déménagé de façon significative sur les écraser, utiliser moins de volume de solution d'acide Lactoacetic dans vos préparations ultérieures. Répétez les étapes 4.1 à 4.8 jusqu'à ce qu'un nombre suffisant de diapositives appropriées ont été obtenues. Placez 175 g de poids sur la lamelle de la glisse.
- Remplir un petit Dewar (par exemple, une bouteille thermos) à l'azote liquide. En utilisant une pince à long, tremper glisser dans l'azote liquide 2 jusqu'à l'arrêt ébullition, retirez diapositives et utiliser immédiatement le bord d'une lame de rasoir propre à un coin flip off à la lamelle. Si diapositive sera utilisée immédiatement, placer dans un bocal de Coplin avec du PBS à 4 ° C. Sinon recueillir les glisser dans une jarre de Coplin remplie d'éthanol à 95%. Examiner la lamelle une fois le gel est sublimé pour confirmer que le tissu adhère à la diapositive et ne pas rester avec la lamelle. Répéter avec le reste de la glisse jusqu'à ce que toutes les diapositives sont stockées soit dans du PBS (pour une utilisation au sein de plusieurs heures) ou de l'éthanol (pour le stockage à long terme).
Les résultats représentatifs
La première étape critique pour l'obtention de haute qualité de la préparation de squash polytènes est de faire croître les larves grasses avec des noyaux des glandes salivaires grands. La seconde est une bonne technique à la procédure épandage, qui peut prendre un peu de pratique. Une astuce pour réussir la propagation améliorée est de trouver le volume minimal de solution d'acide lactoacetic pendant l'étape de l'écrasement. Cela favorisera la propagation suffisante de chromosomes sans générer des forces excessives streaming qui peuvent se laver les bras du chromosome loin. Il est également intéressant de noter que tout retard dans le déplacement de la lamelle en arrière permettra de réduire la propagation des armes chromosomiques, ils deviennent plus rigides lorsqu'ils sont exposés à la solution d'acide Lactoacetic.
Si tout va bien, il devrait y avoir de nombreux bien répartis chromosomes polytènes. La figure 1 montre un exemple d'une telle préparation, double marqué avec un marqueur pour les régions interbandes en vert et avec un colorant qui colore les régions bagué en bleu. Si l'insuffisance d'épandage est obtenue, les chromosomes se ressemblent petites boules, comme le montre la figure 2. D'autre part, si une trop grande propagation a eu lieu, le chomosomes sera trop mince et étendu ou, dans certains cas, fragmentée en petits morceaux comme le montre la figure 3.
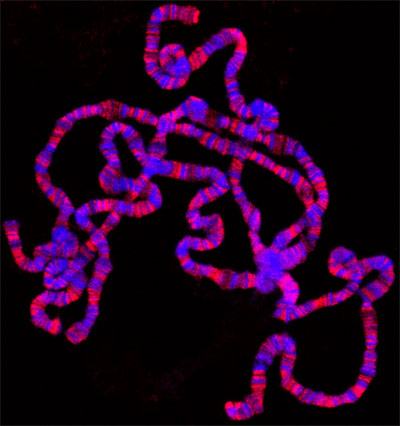
Figure 1. Préparation de squash polytènes doubles étiquetés avec l'anticorps de la JIL-1 histone kinase H3S10 (en rouge) et Hoechst (bleu).
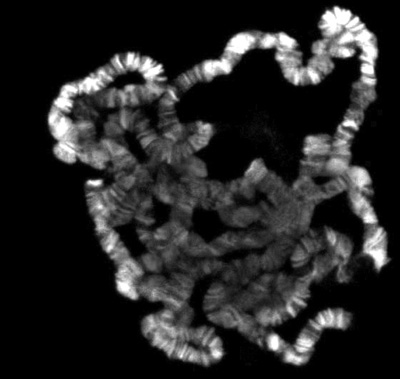
Figure 2. Courges polytènes avec la propagation insuffisante.

Figure 3. Courges polytènes avec trop de propagation.
Discussion
L'inclusion d'acides acétique et lactique dans les protocoles conventionnels de fixation facilite la résolution de squash et deux interbandes bras chromosomique propagation mais malheureusement, certains épitopes ne survivent pas à ce traitement. Un exemple d'un tel épitope est H3S10ph (Cai et al., 2008). Depuis traitement à l'acide a aussi l'inconvénient qu'il désaltère la fluorescence intrinsèque des protéines étiquetées GFP, DiMario et al. (2006) a récemment dé...
Remerciements
Nous remercions Mme V. Lephart pour l'entretien des stocks de volée Ce travail a été soutenu par les Instituts nationaux de la santé de subvention (GM62916) et la National Science Foundation subvention (MCB0817107).
Références
- Cai, W., Bao, X., Deng, H., Jin, Y., Girton, J., Johansen, J., Johansen, K. M. RNA polymerase II-mediated transcription at active loci does not require histone H3S10 phosphorylation in Drosophila. Development. 135, 2917-2925 (2008).
- DiMario, P., Rosby, R., Cui, Z. Direct visualization of GFP-fusion proteins on polytene chromosomes. Dros. Inf. Serv. 89, 115-118 (2006).
- Johansen, K. M., Cai, W., Deng, H., Bao, X., Zhang, W., Girton, J., Johansen, J. Methods for studying transcription and epigenetic chromatin modification in Drosophila polytene chromosome squash preparations using antibodies. Methods. 48, 387-397 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon