Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement et culture de cellules progénitrices embryonnaires aviaires valvulaire
Dans cet article
Résumé
Cet article propose une méthode pour isoler et cultiver la caille ou de poulet HH14 - Soupape de cellules endocardiques et HH25 cellules mésenchymateuses coussin de soupape.
Résumé
Bonne formation et la fonction des valves cardiaques embryonnaires humaines est indispensable à la progression du développement. Le coeur embryonnaire précoce est un tube en U de l'endocarde entouré par myocarde. Le myocarde sécrète cardiaques gelée, une matrice riche en acide hyaluronique gélatineux, dans le auriculo-ventriculaire (AV) de jonction et des voies d'écoulement (OFT) lumen. Au stade HH14 valvulogenesis commence quand un sous-ensemble de cellules endocardiques recevoir des signaux du myocarde, l'endocarde subissent à la transformation mésenchymateuse (TEM), et envahissent la cardiaques gelée. Au stade HH25 les coussins valvulaires sont entièrement mesenchymalized, et c'est ce mésenchyme qui forme éventuellement l'appareil valvulaire et septale du cœur. Comprendre les mécanismes qui déclenchent et modulent les processus de différenciation cellulaire et l'EMT sont importantes en raison de leur connexion à de graves malformations cardiaques congénitales. Dans cette étude, nous présentons les méthodes pour isoler pré-EMT endocardique et post-EMT cellules mésenchymateuses, qui sont les deux phénotypes cellulaires différents du coussin prevalvular. Pré-EMT cellules endocardiques peuvent être cultivées avec ou sans le myocarde. Post-EMT cellules mésenchymateuses coussin AV peuvent être cultivées à l'intérieur des gels de collagène mécaniquement contraint ou sans stress. Ces 3D dans des modèles in vitro imitent les principaux événements morphogéniques valvulaire et sont utiles pour déconstruire les mécanismes de valvulogenesis stade précoce et tardive.
Protocole
1. Préparation
- Incuber cailles fertiles ou des oeufs de poule au stade 14 - (environ 2 jours) ou 25 (environ 4,5 jours) à 60% d'humidité et 37 ° C.
- Préparer la solution stérile de Earl saline équilibrée (EBSS)
- Ajouter 100 ml EBSS 10X à 600 ml d'eau 18 MQ
- Ajouter 2,2 g de bicarbonate de sodium
- Ajuster le pH de la solution à 7,2
- Porter la solution jusqu'à 1000 ml
- Stériliser la solution en passant par un filtre de 0,2 um
- Préparer stériles M199 milieu de culture.
- Ajouter 1 paquet de poudre à M199 700 ml d'eau 18 MQ.
- Ajouter 2,2 g de bicarbonate de sodium
- Ajuster le pH de la solution à 7,2.
- Ajouter 10 ml (1%) de pénicilline-streptomycine
- Porter la solution jusqu'à 1000 ml
- Stériliser la solution en passant par un filtre de 0,2 um
- Ajouter 1 mL stérile 100X Insulin-transferrine-Selenium-G complément
- Ajouter 10 ml (1%) de sérum de poulet stériles
- Préparer trois dimensions des gels de collagène à une concentration de collagène de 1,5 mg / ml. Des travaux antérieurs dans notre laboratoire a montré que la concentration en collagène de plus de 1,5 mg / ml fournit une matrice qui est trop rigide pour biomécaniquement les cellules se déplacer à travers. Les concentrations gel de collagène inférieure à 1,5 mg / mL ont des fibres de collagène si peu que le bouquet de cellules peuvent déchiqueter les fibres localement, produisant une île de cellules.
- Ajoutez les lignes suivantes glacée réactifs à un tube à centrifuger stérile de 15 ml dans l'ordre:
- 3X M199: Volume = volume total nécessaire / 3
- Stérile 18 MQ eau: Volume = volume total nécessaire (M199 volume + volume de sérum de poulet + 0,1 M de NaOH volume de volume de collagène +)
- Sérum de poulet stérile: Volume = volume total nécessaire * 0,01
- Collagène de queue de rat i: concentration des stocks = Volume (concentration du gel de collagène * volume total nécessaire) / collagène
- Stérile NaOH 0,1 M: Volume du volume de collagène = 0,2 *
Remarque: La quantité d'eau, 0,1 M de NaOH, et de collagène ajoutée varie selon la concentration de la solution stock de collagène.
- Mélanger la solution de collagène bien avec une pipette stérile.
- Immédiatement le transfert de 0,3 mL de la solution de collagène dans 1,9 cm 2 puits secteur de croissance. Ceci est une solution de collagène assez pour couvrir complètement le bien et de fournir un gel qui est d'environ 3 mm d'épaisseur. Une épaisseur de gel d'au moins 250 pm est nécessaire pour les études de l'invasion cellulaire.
- Laisser la solution de collagène pour un gel d'au moins 1 heure à 37 ° C, 5% de CO 2, et 100% d'humidité.
- Ajoutez les lignes suivantes glacée réactifs à un tube à centrifuger stérile de 15 ml dans l'ordre:
2. Pré-EMT isolement cellulaire endocardique et de la Culture
- L'isolement des embryons
- Placer un morceau de ruban pouce de long en laboratoire au cours de la plus grande extrémité de l'œuf. C'est là que la cellule d'air est située. La bande stabilise la coquille d'oeuf de caille fragiles.
- Doucement la zone de ponction scellés de l'œuf dans la cellule d'air avec la pointe de ciseaux courbes stérilisés.
- Coupez un trou dans la partie enregistrée de l'œuf qui est assez grande pour permettre le jaune de passer à travers. Démarrer le trou à la perforation et à l'extérieur coupés en forme de spirale. Assurez-vous de couper à travers la membrane externe, mais éviter de percer le jaune.
- Lorsque le trou dans la coquille est complète, de visualiser l'embryon de caille. L'embryon est normalement situé sur le côté supérieur du jaune.
- Commencer à verser le jaune d'œuf à travers le trou percé dans l'œuf avec une seule main. Tenir une pince # 55 dans l'autre main. Comme l'embryon sort de l'œuf sur le dessus du jaune, faites glisser doucement la pince à épiler # 55 sous l'embryon et le retirer de la jaune. Note: Pour les œufs de poule, l'isolement d'embryon implique la fissuration de l'œuf de poulet sur un pointu, surface propre et casser l'oeuf dans un plat de Pétri de 100 mm. L'embryon doit être situé sur le côté supérieur du jaune. Faites glisser doucement # 55 pinces sous l'embryon et le retirer de la jaune.
- Placez l'embryon dans un plat de 100 mm de Petri contenant de la glace-froid, EBSS stérile.
- Stade des embryons, selon les critères de Hamburger et Hamilton 1. Les embryons au stade 14 - 13 sont passés scène, mais pas encore à l'étape 15, avec 20 à 21 somites et un bourgeon queue. Une caractéristique clé de l'étape 14 - embryons est l'angle de la tête, ce qui est légèrement supérieur à 90 ° par rapport au corps.
- Retirer le cœur à partir d'embryons de caille au stade 14 - avec une pince à épiler # 55 en coupant transversalement où le canal AV et l'OFT de prendre contact avec la paroi thoracique. Placez les coeurs ensemble sur un côté de la boîte de Pétri.
- Recueillir les coeurs isolés avec une pipette de transfert stérile et les placer dans un nouveau plat de 100 mm de Pétri remplie de stériles, glacée EBSS.
- Couper le OFT et les canaux AV transversalement des ventricules du # 55 pincettes.
- Section des canaux restants AV et / ou voies d'éjection (OFT) longitudinalement.
- Régler une pipette pour un volume de 20 uL. Utilisez cette pipette pour aspirer six longitudinalement coupé canaux AV et OFT.
- Expulser les canaux AV et OFT sur le gel de collagène. Aspirer toute EBSS excès de la surface du gel.
- Utilisez # 55 pinces à orienter les explants de sorte qu'ils sont à plat et que le côté lumineux face au gel de collagène. Essayez de ne pas percer le gel de collagène avec la pince à épiler.
- Après 2 heures à 37 ° C et 5% de CO 2, retirez le myocarde des explants avec # 55 pincettes. Les cellules endocardiques doit être laissé à la surface du gel de collagène. Alternativement, le myocarde ne peut être laissé sur l'explant. Avec l'enlevés myocarde, les cellules endocardiques avec subissent pas EMT sans intervention. Avec le myocarde présentent un sous-ensemble de cellules endocardiques va se transformer en mésenchyme, mais le degré de transformation peut être modulée par des facteurs externes. Remarque: Même si le myocarde ne sera laissé sur le explant doit être autorisé au moins 2 heures à joindre à la moyenne gel avant est ajouté.
- Ajouter 0,4 ml à chaque milieu M199 explants puits contenant.
- Culture des cellules à 37 ° C, 5% de CO 2, et 100% d'humidité.
3. Post-EMT Coussin AV cellule d'isolement mésenchymateuses et de la Culture
- Crack l'œuf de poulet sur une forte surface propre et casser l'oeuf dans un plat de Pétri de 100 mm. L'embryon doit être situé sur le côté supérieur du jaune. Ramassez l'embryon avec # 5 pincettes en saisissant les membranes qui entourent l'embryon, puis placer l'embryon dans un plat de Pétri de 100 mm rempli de glace-froid, EBSS stérile.
- Stade des embryons, selon les critères de Hamburger et Hamilton 1. Caractéristiques d'un stade de 25 embryons comprennent coude distinctes et les articulations du genou et de la pigmentation des yeux légère.
- Isoler les cœurs de tous les embryons HH25 et placer les coeurs ensemble sur un côté de la boîte de Pétri.
- Recueillir les coeurs isolés avec une pipette de transfert stérile et les placer dans un nouveau plat de 100 mm de Pétri remplie de stériles, glacée EBSS.
- Isoler la région AV de tous les cœurs à la fois. Placez l'AVS ainsi que sur un côté de la boîte de Pétri. Agiter doucement la région AV à éliminer tout le sang, ce qui peut affecter la viabilité cellulaire.
- Recueillir les isolés AV avec une pipette de transfert stérile et les placer dans un nouveau plat de 100 mm de Pétri remplie de stériles, glacée EBSS.
- Séquentiellement isoler les coussins de l'AV. Assurez-vous qu'il n'ya pas présents sur les coussins du myocarde AV.
- Recueillir les coussins isolés avec une pipette de transfert stérile et les placer dans un tube à centrifuger stérile de 15 ml.
- Faites tourner les coussins au fond du tube à centrifuger à 15 xg pendant 3 minutes.
- Utiliser une pointe de 1000 ml stériles pour enlever autant de surnageant EBSS que possible sans déranger les coussins.
- Ajouter 1 ml de 0,25% de trypsine-EDTA qui a été pré-chauffé à 37 ° C. Autoriser les coussins à incuber dans de la trypsine jusqu'à ce qu'ils soient complètement dissous, ce qui est normalement d'environ 3-5 minutes.
- Ajouter 100 ul de sérum de poulet pour le tube à centrifuger pour étancher la trypsine.
- Pellet les cellules à 160 xg pendant 5 minutes. Enlever le surnageant avec une solution stérile, pointe uL 1000.
- Resuspendre les cellules dans 2 ml de milieu M199 et mélanger par pipetage. Prenez 10 ul de la suspension cellulaire à compter sur hématimètre et déterminer le nombre total de cellules qui ont été isolées
- Déterminer le nombre de gels de collagène sera effectué en fonction du nombre de cellules isolées. Les cellules ont besoin d'être étalées à une densité de 2 x 10 5 cellules / mL avec un volume de 250 uL de gel.
- Pellet les cellules à 160 xg pendant 5 minutes. Enlever le surnageant avec une solution stérile, pointe uL 1000.
- En utilisant le protocole ci-dessus, ajouter 3X M199, l'eau, du sérum de poulet, de collagène, et 0,1 M de NaOH, dans cet ordre, au culot cellulaire. Mélanger à la pipette en douceur.
- Ajouter 250 uL de chaque zone de croissance de 1,9 cm 2 bien.
- Laisser la solution de collagène pour un gel d'au moins 1 heure à 37 ° C, 5% de CO 2, et 100% d'humidité.
- Ajouter 0,4 ml de milieux de culture et incuber pendant la nuit.
- Pour continuer à cultiver les gels dans des conditions sans stress, libérer les gels sur les côtés de la culture ainsi l'aide d'une pipette stérile de 200 uL. Mécaniquement contraints cultures sont des gels qui restent attachées sur les côtés de la culture ainsi.
4. Les résultats représentatifs
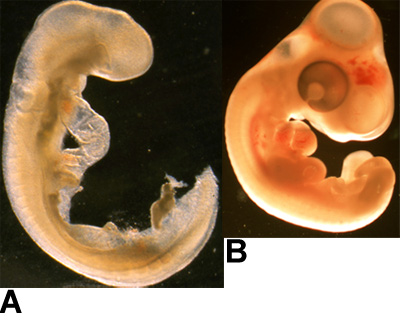
Figure 1:. Exemples d'embryons (A) HH14-cailles embryon, et (B) HH25 embryon de poulet sont montrés ici.
fig2.jpg "alt =" Figure 2 "/>
Figure 2: HH14 soupapes explants endocardique après 2 heures de culture (A) avec le présent myocarde, ou (B) avec le myocarde enlevé..
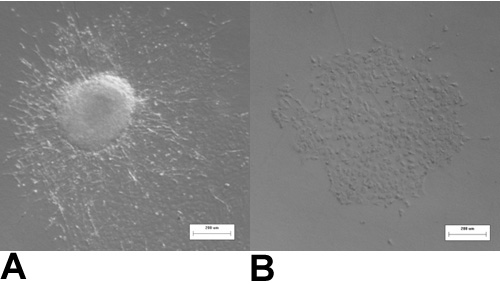
Figure 3:. HH14 soupapes explants endocardique (A) Avec le présent myocarde, la plupart des cellules subissent endocardique à la transformation mésenchymateuses et ont une forme de fuseau, phénotype mésenchymateux après 48 heures de culture. (B) Lorsque le myocarde est enlevé toutes les cellules de maintenir un caillou en forme, le phénotype endocardique après 48 heures dans la culture.

Figure 4:. Cellules HH25 cellules mésenchymateuses dans le robinet d'un gel de collagène sont arrondis immédiatement après le semis.

Figure 5:. HH25 cellules mésenchymateuses en culture (A) Après 48 heures de culture dans un gel de collagène de la contrainte HH25 cellules mésenchymateuses commencent à se répandre. (B) HH25 cellules dans un gel de collagène sans stress 7 jours après l'ensemencement et 6 jours après la libération ont compacté le gel d'environ 50% de la superficie d'origine.
Discussion
La méthode pour isoler les cellules endocardiques du stade HH14 - coeurs initialement développé par Runyan et Markwald fournit un environnement contrôlé, dans un environnement in vitro pour étudier les facteurs qui déclenchent et modulent embryonnaire EMT 2. HH14 - explants endocardique cultivées sans myocarde ne subira pas d'EMT sans intervention biomécaniques ou biochimiques. Si le myocarde est à gauche sur l'explant il signalera un sous-ensemble de ...
Déclarations de divulgation
Remerciements
Cette recherche est soutenue par la Fondation Hartwell, l'American Heart Association (Scientist Development Grant # 0830384N) et la Fondation Leducq: 07CVD04 mitrale.
matériels
| Name | Company | Catalog Number | Comments |
| Extra fine Bonn scissors, curved | Fine Science Tools | 14085-08 | |
| Dumont tweezers #55 | World Precision Instruments, Inc. | 14099 | |
| Dumont tweezers #5 | World Precision Instruments, Inc. | 14098 | |
| Sterile transfer pipettes | Samco Scientific, Thermo Fisher Scientific | 2041S | |
| 4-well culture plates | Nalge Nunc international | 176740 | |
| Sterile disposable filter units, PES, 0.2 μm pore size membrane | Nalge Nunc international | 566-0020 | |
| Sterile 15 mL centrifuge tubes | Corning | 430828 | |
| Sterile petri dishes, 100 mm x 15 mm | VWR international | 25384-342 | |
| Laboratory tape | VWR international | 89097-920 | |
| Rat-tail collagen I | BD Biosciences | 354236 | |
| 10X Earl’s Balanced Salt Solution | Quality Biological, Inc. | 119-064-131 | |
| M199 powder | Invitrogen | 31100-035 | |
| Penicillin-Streptomycin | Invitrogen | 15140-122 | |
| Insulin-Transferrin-Selenium-G supplement (100X) | Invitrogen | 41400-045 | |
| Chicken serum | Invitrogen | 16110-082 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200-056 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| Sodium hydroxide solution, 1.0 N | Sigma-Aldrich | S2770 | |
| Fertile quail eggs (Coturnix coturnix) | Lake Cumberland Game Bird Farm | ||
| Fertile chicken eggs (Gallus gallus) | Cornell University Poultry Farm |
Références
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. J Morphol. 88, 49-92 (1951).
- Runyan, R. B., Markwald, R. R. Invasion of mesenchyme into three-dimensional collagen gels: A regional and temporal analysis of interaction in embryonic heart tissue. Developmental Biology. 95, 108-108 (1983).
- Butcher, J. T., Norris, R. A., Hoffman, S., Mjaatvedt, C. H., Markwald, R. R. Periostin promotes atrioventricular mesenchyme matrix invasion and remodeling mediated by integrin signaling through Rho/PI 3-kinase. Developmental Biology. 302, 256-256 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon