Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un modèle Optic Nerve Crush blessures murins pour étudier la rétine de survie des cellules ganglionnaires
Dans cet article
Résumé
Ce protocole montre comment rétrograde marquer les cellules ganglionnaires de la rétine, et la façon de faire ultérieurement une lésion du nerf optique écraser dans le but d'analyser la rétine survie des cellules ganglionnaires et l'apoptose. Il s'agit d'un modèle de maladie expérimentale pour différents types de neuropathie optique, notamment un glaucome.
Résumé
Blessure au nerf optique peuvent conduire à une dégénérescence axonale, suivie par une mort progressive des cellules ganglionnaires de la rétine (CGR), qui se traduit par une perte de vision irréversible. Des exemples de telles maladies à l'homme comprennent traumatiques neuropathie optique et une dégénérescence du nerf optique dans le glaucome. Elle est caractérisée par des modifications typiques de la tête du nerf optique, progressive dégénérescence du nerf optique, et la perte de cellules ganglionnaires de la rétine, si incontrôlée, conduisant à une perte de vision et de cécité.
L'écrasement du nerf optique (ONC) modèle de lésion de la souris est un modèle expérimental pour la maladie importante neuropathie optique traumatique, glaucome, etc Dans ce modèle, la lésion par écrasement du nerf optique conduit à l'apoptose des cellules rétiniennes ganglionnaires progressive. Ce modèle de la maladie peut être utilisée pour étudier les processus généraux et les mécanismes de mort neuronale et de la survie, ce qui est essentiel pour le développement de mesures thérapeutiques. En outre, les approches pharmacologiques et moléculaires peuvent être utilisés dans ce modèle afin d'identifier et de tester le potentiel de réactifs thérapeutiques pour traiter différents types de neuropathie optique.
Ici, nous offrons une démonstration étape par étape de (I) l'étiquetage de base rétrograde de cellules ganglionnaires de la rétine (CGR) au jour 1, (ii) des blessures écrasement du nerf optique au jour 4, (III) Récolte des rétines et analyser la survie au jour du CJR 11, et le résultat Représentant (IV).
Protocole
Tous les équipements et les réactifs utilisés sont stériles. Toutes les expériences sur les animaux ont été approuvés par le soin des animaux et utilisation comité (ACUC) à l'IEN / NIH (protocole de l'étude des animaux IEN-570), et ont été réalisées selon les directives du NIH et des règlements.
1. Étiquetage base rétrograde des cellules ganglionnaires rétiniennes (CGR), au Jour 1
Le but de cette procédure est de marquer les cellules ganglionnaires de la rétine rétrograde par injection d'un colorant traceur neuronal dans le colliculus supérieur de la souris trois jours avant la lésion par écrasement du nerf optique. Le colorant sera rétrograde prises par les cellules ganglionnaires de la rétine et fournit un marqueur de la CGR de vie (figure 1). Cette approche donne étiquetage reproductible de CGR viable avec peu de variation 1-5.
- Profondément anesthésier la souris. Nettoyez les cheveux sur le dessus de la tête. Placez la souris dans un petit appareil de stéréotaxie. Oinment protecteur est appliqué sur les deux yeux. Désinfecter la peau de la tête à trois reprises chacun utilisant un iodophore et un gommage alcool à 70%.
- Faire une incision dans la peau d'exposer le crâne, et le garder propre et sec à l'aide de peroxyde d'hydrogène à 3%.
- Identifier et marquer le bregma. Percez un trou au-dessus du colliculus supérieur à 2,9 mm derrière le bregma et 0,5 mm latéralement à la ligne médiane de chaque hémisphère 7. Pendant le forage, appliquer une solution saline à l'endroit où le trou est creusé pour prévenir les blessures de chaleur secondaire.
- L'utilisation d'un appareil de mesure stéréotaxique et d'une seringue Hamilton, injecter le colorant traceur FluoroGold neurones (1 pi de 3% dans une solution saline fluorochrome) très lentement dans le colliculus supérieur de chaque hémisphère à une profondeur de 1,6 mm de la surface osseuse du cerveau.
- Suture du site d'incision. Donner une injection sous-cutanée de la buprénorphine pour l'analgésie.
- Déplacez la souris à un endroit chaud et sec et de le surveiller jusqu'à ce qu'il soit capable de maintenir une posture droite, et le retourner dans sa cage à la maison. Pour les trois premiers jours après la procédure de labellisation, les analgésiques systémiques (par exemple, buprénorphine) et pommade antibiotique sont donnés deux fois par jour et de la souris est étroitement surveillée.
2. Optic blessures écrasement du nerf au jour 4
Dans cette procédure, nous allons appliquer une lésion par écrasement du nerf optique de causer un dommage aux primaires des axones (figure 2), ce qui conduira à une mort progressive des cellules ganglionnaires de la rétine.
- Trois jours après l'application colorant traceur, la souris est profondément anesthésié. En utilisant un microscope à dissection, la conjonctive d'un œil est incisé au sujet de la position 04 heures en utilisant une paire de ciseaux à ressort.
- Doucement les muscles détourner l'orbite et les mettre de côté. Exposer le nerf optique blanche à sa sortie du globe oculaire. Prenez grand soin de ne pas endommager les vaisseaux sanguins.
- Avec l'aide d'une paire de pinces à action croisée, appliquer une lésion par écrasement du nerf optique, à environ 2 mm de l'œil pendant environ 3 secondes. Prenez grand soin de ne pas endommager l'artère ophtalmique pour provoquer des saignements.
- Après achèvement de la lésion par écrasement, l'incision est suturée.
- Avant la souris se remet de l'anesthésie, donner une injection sous-cutanée de la buprénorphine pour l'analgésie.
- Déplacez la souris à un endroit chaud et sec et de le surveiller, jusqu'à ce qu'il soit capable de maintenir une posture droite et le retourner dans sa cage à la maison. Pour les trois premiers jours après la procédure de blessure par écrasement, les analgésiques systémiques (par exemple, buprénorphine) et pommade antibiotique sont donnés deux fois par jour et de la souris est étroitement surveillée.
3. Récolte les rétines et analyser la survie RGC au 11e jour
Le but de cette procédure est de récolter le retinaeto d'analyser la rétine survie des cellules ganglionnaires.
- Au jour 11 (7 jours après l'ONC), la souris est euthanasié par le CO 2 de perfusion et dislocation cervicale.
- Les yeux sont énucléés avec l'aide d'une pince en exerçant une pression à l'orbite.
- Les yeux sont fixés dans une solution de paraformaldéhyde 4% pendant deux heures et lavées dans du PBS à trois reprises. Disséquer la rétine. La procédure de dissection rétine a déjà été publiée auparavant par Jove en 2010 par Gustmann, S. et al. 6, et donc ne sera pas décrite ici.
- Images des cellules ganglionnaires de la rétine survivants sont prises en utilisant un microscope à fluorescence dans des régions définies de la rétine, et la densité des cellules ganglionnaires de la rétine peut être compté. Un résultat représentatif des cellules marquées par fluorescence ganglionnaires de la rétine, avec ou sans lésion du nerf optique est écraser le montre la figure 3.
4. Les résultats représentatifs:
Pour analyser la rétine survie des cellules ganglionnaires, sept jours après une lésion du nerf optique, écraser, les rétines ont été récoltés, fixe, aplaties et montées. Images rétiniennes ont été prises avec un microscope à fluorescence. Par rapport à la normale r indemneetina (gauche, normal), le nombre de CGR viables (vert, marqués de façon rétrograde par le colorant FluoroGold neurones traceur injecté dans le colliculus supérieur) est significativement plus faible dans les rétines avec une blessure par écrasement du nerf optique (à droite, ONC) (Figure 3) .
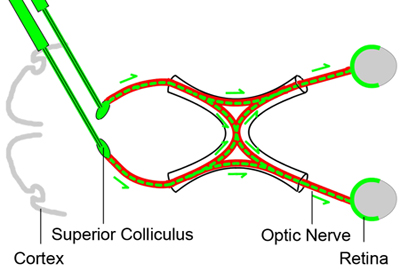
Figure 1. L'étiquetage de base rétrograde de cellules ganglionnaires de la rétine
Pour compter les cellules viables ganglionnaires de la rétine à différents moments après une lésion nerveuse écraser optique, les cellules ganglionnaires de la rétine sont étiquetés rétrograde par injection d'un colorant traceur neuronal (couleur verte) dans le colliculus supérieur dans les trois jours avant le cerveau du nerf optique ( rouge) écrasent blessure. Depuis les axones des cellules ganglionnaires de la rétine résider dans le colliculus supérieur, le colorant sera repris par le CGR rétrograde et fournit un marqueur de la CGR vie.
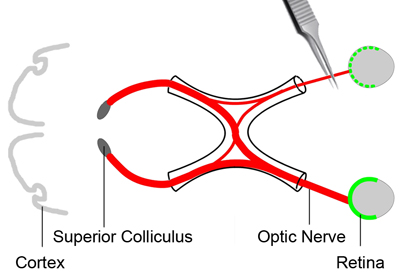
Figure 2. Optic blessure par écrasement du nerf
Afin d'analyser l'état de la survie des cellules ganglionnaires de la rétine, une blessure par écrasement est appliquée au nerf optique (rouge) de causer un dommage aux primaires des axones. Cela conduira à une mort progressive des cellules ganglionnaires de la rétine. Trois jours après le traceur colorant (vert) d'injection, la souris est anesthésiée. La conjonctive d'un œil est incisé. Détourner les muscles orbitaux et les mettre de côté. Exposez le nerf optique à sa sortie du globe oculaire. Appliquer une lésion par écrasement du nerf optique, à environ 2 mm de l'œil pendant environ 3 secondes à l'aide d'une paire de pinces à action croisée.
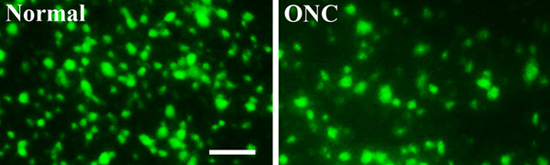
Figure 3. Marqué par fluorescence des cellules ganglionnaires de la rétine, avec ou sans lésion du nerf optique, écraser
Pour analyser la rétine survie des cellules ganglionnaires, sept jours après une lésion du nerf optique, écraser, les rétines ont été récoltés, fixe, aplaties et montées. Images rétiniennes ont été prises avec un microscope à fluorescence. Par rapport à la rétine indemne normal (à gauche, normal), le nombre de CGR viables (vert, marqués de façon rétrograde par le colorant FluoroGold neurones traceur injecté dans le colliculus supérieur) a été significativement plus faible dans les rétines avec une blessure par écrasement du nerf optique (à droite, ONC ) (figure 3). Barre d'échelle: 50 um
Discussion
Le modèle du nerf optique écraser blessures murin est utile d'étudier le processus de la mort et la survie du CJR. Ce modèle est également souvent utilisé pour étudier les effets de différents réactifs et les gènes de l'apoptose et la survie du CJR. Un avantage de ce modèle est qu'il a un degré élevé de reproductibilité avec des variations minimes.
Cependant, une attention particulière est requise en plusieurs étapes dans ce modèle. Premièrement, lors de la lé...
Déclarations de divulgation
Remerciements
Notre recherche est soutenu par le Programme de recherche intra-muros des NIH, l'Institut National Eye.
matériels
| Name | Company | Catalog Number | Comments |
| Stereotaxic apparatus | ASI Instruments | SAS-4100 | |
| Dissecting microscope | World Precision Instruments, Inc. | PZMIV-BS | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel Blades #15 | Fine Science Tools | 10015-00 | |
| Microdrill | Fine Science Tools | 18000-17 | |
| Suture needle | Fine Science Tools | 12050-03 | |
| Spring scissors | Fine Science Tools | 16144-13 | |
| Dumont #5 forceps | Fine Science Tools | 11252-50 | |
| Hamilton syringe | Hamilton Co | 88400 | |
| Gauze sponges | Office Depot | 674889 | |
| Fluorochrome | Sigma-Aldrich | 39286 | |
| Alcohol | Sigma-Aldrich | 459844 | 70% |
| H2O2 | Sigma-Aldrich | H3410 | 3% |
Références
- Yoles, E. GM1 reduces injury-induced metabolic deficits and degeneration in the rat optic nerve. Investigative ophthalmology & visual science. 33, 3586-3591 (1992).
- Fisher, J. Vaccination for neuroprotection in the mouse optic nerve: implications for optic neuropathies. J Neurosci. 21, 136-142 (2001).
- Levkovitch-Verbin, H. RGC death in mice after optic nerve crush injury: oxidative stress and neuroprotection. Investigative ophthalmology & visual science. 41, 4169-4174 (2000).
- Li, Y. VEGF-B inhibits apoptosis via VEGFR-1-mediated suppression of the expression of BH3-only protein genes in mice and rats. The Journal of clinical investigation. 118, 913-923 (2008).
- Tang, Z. Survival effect of PDGF-CC rescues neurons from apoptosis in both brain and retina by regulating GSK3beta phosphorylation. The Journal of experimental medicine. 207, 867-880 (2010).
- Gustmann, S., Dunker, N. In vivo-like organotypic murine retinal wholemount culture. J Vis Exp. , (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon