Method Article
In vivo laser axotomie en C. elegans
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Un protocole de couper dans les neurones C. elegans Avec un laser pulsé MicroPoint est présenté. Nous décrivons la mise en place du système, immobilisant les vers, et la rupture des neurones marqués. Les avantages comprennent un système relativement peu coûteux et la capacité à rompre les processus neuronaux ou des cellules ablation In vivo.
Résumé
Les neurones communiquent avec d'autres cellules par l'intermédiaire des axones et des dendrites, prolongements de membrane mince qui contiennent des spécialisations pré-ou post-synaptique. Si un neurone est endommagé par une blessure ou une maladie, il peut se régénérer. Cell-facteurs intrinsèques et extrinsèques influencent la capacité d'un neurone à se régénérer et restaurer la fonction. Récemment, le nématode C. elegans a émergé comme un organisme modèle idéal pour identifier les gènes et les voies de signalisation qui influencent la régénération des neurones 1-6. Le principal moyen pour initier la régénération neuronale dans C. elegans est médiée par laser de coupe, ou axotomie. Pendant axotomie, un processus marqué par fluorescence neuronale est rompu à l'aide d'impulsions à haute énergie. Initialement, la régénération neuronale en C. elegans a été examiné en utilisant un laser femtoseconde amplifiée 5. Cependant, les études de régénération ultérieures ont montré que d'un laser pulsé conventionnels peuvent être utilisés pour séparer précisément les neurones in vivo et d'obtenir une réponse semblable régénératrice 1,3,7.
Nous présentons un protocole pour la réalisation in vivo laser axotomie dans le ver utilisant une MicroPoint laser pulsé, un système clé en main qui est facilement disponible et qui a été largement utilisée pour l'ablation des cellules ciblées. Nous décrivons aligner le laser, le montage du vers, la coupe des neurones spécifiques, et d'évaluer la régénération ultérieure. Le système offre la possibilité de couper un grand nombre de neurones dans les vers de multiples cours d'une expérience. Ainsi, le laser axotomie comme décrit ici est un système efficace d'initier et d'analyser le processus de régénération.
Protocole
1. Assemblage du système
Les composants spécifiques de notre système sont décrites ci-dessous. Lorsqu'il est correctement assemblé, l'utilisateur doit être capable de se concentrer au microscope d'une seule main, déplacer la scène avec l'autre (que ce soit avec la souris ou le joystick), activer le laser avec la pédale, et avoir une vue claire de la sur- image à l'écran.
- MicroPoint laser monté sur le port épifluorescence d'un microscope composé. Nous utilisons un Nikon 80i, mais toute la portée des recherches de qualité droite ou inversée devrait fonctionner. Le système comprendra une MicroPoint dichroïques personnalisés, ce qui devrait correspondre au fluorophore que les étiquettes les cellules dont vous voulez couper. Cellules marquées par des fluorophores coupe alternatif exige dichroïques supplémentaire. En outre, un générateur d'impulsions et pédale fournis avec le système MicroPoint.
- 100x, objectif 1,4 huile de NA pour pratiquer la chirurgie et l'évaluation de la régénération, ainsi que des objectifs supplémentaires que nécessaire pour placer l'échantillon sur la lame. Nous utilisons un plan de Nikon Apo VC pour la chirurgie, et de trouver qu'un 4x est utile de se concentrer grossier et trouver de l'échantillon.
- Motorisé scène avec le joystick. Une scène avec une précision extrêmement élevée et la répétabilité est inutile, puisque la scène est seulement utilisé pour le ciblage. Nous utilisons un Avant OptiScan II (voir la discussion).
- Caméra. La caméra doit fournir une cadence suffisante pour concentrer et cibler les neurites étiquetés avec l'objectif 100x, tout en visualisant l'image sur l'écran d'ordinateur. Nous préférons atténuant la lumière d'éclairage lors de la procédure axotomie pour éviter d'éventuels effets confondants de la photo-blanchiment ou de dommages (voir 1.7, ci-dessous). Ainsi, la caméra doit être suffisamment sensible pour s'adapter à ce niveau de lumière réduite. Nous utilisons un Hamamatsu Orca 05G, et trouver que l'imagerie à 16,3 Hz est suffisante. Equivalent caméras pourraient être substitués.
- Logiciels d'ordinateurs, de surveiller et d'imagerie qui peut piloter la caméra. De plus, nous utilisons le logiciel d'imagerie à manipuler la platine motorisée avec une souris (voir la discussion).
- Tableau de l'Air. Cette exigence peut varier selon l'emplacement, mais depuis la chirurgie est réalisée avec un objectif 100x, on trouve l'isolement de vibration pour être indispensable.
- Approvisionnement léger avec guide de lumière et le mécanisme de l'obturateur pour éclairer le fluorophore. Le guide de lumière va attacher à la MicroPoint. Le mécanisme de l'obturateur est utile pour réduire l'intensité d'éclairage indépendamment du laser. Nous utilisons un Avant Lumen 200 ou un Leica EL6000, et atténuer jusqu'à 80% de l'intensité lumineuse totale pour axotomie.
2. Configuration laser
Un protocole détaillé d'abord aligner et centrer le laser est fourni avec le système laser MicroPoint. Nous supposons que la procédure a été suivie avec succès lors de l'installation initiale. Cela comprend l'alignement des lasers avec la ligne de mire dans l'oculaire. Ici nous fournissons un protocole pour l'entretien régulier de focalisation du laser et l'intensité.
Comme indiqué dans le manuel MicroPoint, le laser à azote pulsé est capable de d'endommager gravement l'oeil humain. Il faut prendre soin de ne jamais regarder directement le faisceau laser. Une fois installé, le filtre barrière doit bloquer les rayons en toute sécurité à travers les oculaires.
Couper les neurones dans un organisme de la taille d'un grain de sable peut être difficile. Depuis la zone de dégâts infligés par le laser est très faible, il est essentiel de connaître la localisation en trois dimensions de l'accent du laser afin de cibler précisément l'échantillon. La focalisation du laser est trouvé en utilisant la lame en miroir. Tout d'abord, nous vérifions que l'emplacement z de la focalisation du laser correspond à l'objet de la voie d'imagerie. Ensuite, l'emplacement en xy de l'accent des dommages est marqué avec réticule dans le logiciel d'imagerie.
Mise au point dans le plan z
- Poussez dans le neutre de densité du filtre ND16 (figure 1a). Nous utilisons des filtres de densité neutre dans le chemin épi-illumination à atténuer le laser tout en se concentrant. Pour encore plus fine se concentrant, pousser à la fois dans l'ND16 et ND4 filtres fluorescents.
- Réglez le laser MicroPoint d'une impulsion avec l'interrupteur tourné vers 'Select' (figure 1b), puis déplacez la roue de filtre à la longue barrière appropriée filtre passe-(figure 1c).
- Placer la lame en miroir sur la scène et se concentrer sur son sein trous avec l'objectif 4X en utilisant la lumière transmise.
- Ajouter une goutte d'huile d'immersion à la diapositive en miroir et se recentrer sur trous avec l'objectif 100X. Ouvrez l'obturateur de caméra avec le chemin optique de commutation de levier (Figure 1d) et l'obturateur laser (figure 1e). Si nécessaire, réduire l'intensité lumineuse transmise pour que les bords des trous d'épingle sont nettes: ce sera l'aide à se concentrer exactement.
- Appuyez sur la pédale. Ceci devrait produire un petit trou dans le miroir si le laser est focalisé correctement.
- Focus du microscope, légèrement au-dessus du plan de la diapositive en miroir et tirer à nouveau le laser. Cela devrait faire un encore plus petittrou que le premier coup, ou ne laissent aucune trace du tout. Répétez en se concentrant sous la diapositive en miroir.
- Si un trou n'est pas produit en 2.5, ou si un plus grand trou est produite lorsque nous nous concentrons ci-dessus ou en dessous de la surface du miroir, de recentrer le laser avec la bague de mise sur la tête d'ablation. Vérifiez que le trou est toujours bien aligné avec la ligne de mire dans l'oculaire. Avec une utilisation cohérente, l'accent plan z rarement besoin d'être ajusté.
Mise au point dans le plan xy
- Suivez les étapes 2.1 à 2.3 ci-dessus et appuyez sur la pédale pour faire un petit trou dans la diapositive miroir.
- Initier 'Live' mode de capture de «acquérir» des éléments du menu. Dans la «mesure» la barre d'outils sélectionnez 'ROI' éditeur, puis sélectionnez l'outil "double croix" et faites glisser le réticule pour les aligner avec le centre du trou de nouvelles. Cliquez sur 'Enregistrer ROI' Quitter éditeur 'et ensuite et reprendre le mode de capture en direct.
- Activez le réglage «souris XY" dans les éléments à manipuler la scène avec la souris.
- Tirez le filtre à densité neutre (s) à la position originale (s), définissez la impulsions laser à 10, et retirer la lame miroir.
Réglage de la puissance du laser
- La puissance du laser doit être ajustée à la puissance minimum nécessaire pour couper le neurone de votre choix. Réglez la puissance en déplaçant la plaque atténuateur (figure 1f) tout en coupant vers vivants (décrit ci-dessous). Si la puissance du laser est trop élevé, il causera des dommages périphériques ou le souffle d'un trou dans le ver. Si la puissance du laser est trop faible, il ne sera pas rompre le neurone. Une fois que le système a été mis en place, la position atténuateur rarement besoin d'être changé. Si le laser devient faible, et la plaque atténuateur doit être déplacé de continuer à réduire, il pourrait être un signe que le colorant dans la cellule de teinture doit être remplacé (voir la discussion).
3. Immobiliser les vers
- Préparer une solution de 3% agarose fondu dans le M9 (KH2PO4 22mm, 42mm Na2HPO4, 85mm de NaCl, 1 mM MgSO4). Distribuer 5 ml d'agarose fondu dans un tube Falcon de 15 ml. Remplir un autre tube avec de l'eau. Placer les tubes dans un élément de chauffage modulaire mis à 55 ° C. Remplir l'élément chauffant à l'eau pour créer des bains d'eau mini pour chaque tube. Remarque: agarose peuvent être préparés en grande quantité à l'avance et refondu pour des expériences ultérieures.
- Placez deux couches de ruban d'étiquetage sur chacun des deux lames et une lame propre entre ces diapositives. Verser une goutte d'agarose en utilisant une pipette ampoule en plastique pour le milieu de la lame propre et placer une autre perpendiculaire à la première glissière de sorte que la résultante d'agarose pad est l'épaisseur de deux morceaux de ruban adhésif (figure 2). Retirez l'une des deux lames du pavé après 30 secondes. Rincez et stocker la pipette en plastique dans le tube rempli d'eau pour une utilisation avec le faucon diapositives suivantes.
- Ensuite, placez 3-5 uL de 0,10 ou 0,05 um um billes de polystyrène au centre du pad. Ajouter les vers 50-10 exprimant la protéine fluorescente dans les neurones d'intérêt. Si les neurones d'intérêt sont asymétriquement distribuées sur le côté droit ou gauche du ver, utiliser un pick platine pour retourner vers telle sorte que le bon côté vers le haut. Worms doivent être placées sur des lames dans les 10 minutes de préparation des plaquettes d'agarose.
- Placez délicatement une lamelle sur le vers. Après avoir placé la lamelle, ne pas le déplacer par rapport à la plaquette d'agarose comme cela va bouleverser la cuticule et de détruire les vers. Placer la lame préparée sur la platine du microscope.
4. Couper les neurones
- La lumière directe dans les oculaires avec le levier de commutation du chemin optique. Focus sur le ver à couper avec l'objectif 4X, déposer une goutte d'huile sur la lamelle, et passer à l'objectif 100X. Retour sur le trajet optique de la caméra.
- Utilisez la souris pour déplacer le neurone de votre choix sous le centre du réticule. Appuyez sur la pédale au feu du laser et de rompre le processus neuronaux. Si nécessaire, deux ensembles d'impulsions peuvent être utilisées pour couper les neurones. Dans un premier temps, il est utile de suivre précisément les neurones ont été rompus dans les vers individuels afin d'évaluer la régénération ultérieure. Quand elle est réalisée correctement, laser axotomie produit une petite pause dans le neurone sans causer des dommages importants aux tissus de la peau environnante ou d'autres neurones (voir figure 3). Dans certains cas, une petite cicatrice peut se former autour du site de la lésion.
- Récupérer les vers en supprimant la lamelle dans un mouvement direct vers le haut, en faisant attention que les vers restent sur le pavé d'agarose. Ne faites pas glisser la lamelle hors tension. Ensuite, coupez le pavé autour de l'aiguille vers avec une pince-nez et le lieu de la section d'agarose sur une plaque fraîchement ensemencé contenant NGM OP50 8. Placer 10 uL de solution stérile M9 sur le pad pour libérer les vers des billes d'agarose et retirez.
5. Score à la régénération des neurones
- Préparer agarose pad tel que décrit dans l'étape 2.2.
- Placez les vers dans 3-5 μ L de billes de polystyrène. Appliquer une lamelle. Les diapositives peuvent être préparés de façon séquentielle, ou bien tous les vers peuvent être préparées à l'avance et les diapositives conservées dans des boîtes de culture 10 cm, contenant chacune une Kimwipe humide pour conserver l'humidité agarose.
- Utiliser l'objectif 100X pour visualiser les neurones rompus. Dans de nombreux neurones, une souche neuronale distale vers le site restera coupée. Nous utilisons la présence de ce vestige comme une indication que le neurone était en effet rompu (Figure 4). La présence de cette souche, il est possible de distinguer un neurone qui a été coupé et régénérés à partir de celui qui n'a pas été coupé. Remarque: les deux souches distale et proximale d'abord rétracter après avoir été coupé.
- Évaluer la régénération. Une variété de paramètres peuvent être déterminés. Un test simple est de savoir si le neurone lésé a formé un cône de croissance (figure 4a) et régénéré, ou non (figure 4b). Alternativement, la longueur des neurites peut être tracée et comparée.
6. Les résultats représentatifs
Comme exemple, nous décrivons la caractérisation de la régénération de l'acide γ-aminobutyrique (GABA) neurones moteurs. Ces neurones, qui résident dans la corde nerveuse ventrale et d'étendre les processus circonférentiellement à la moelle nerf dorsal, sont essentiels pour la locomotion appropriés 9. Neurones GABA peuvent être visualisées en exprimant un fluorophore génétiquement codés, tels que la protéine fluorescente verte (GFP), sous le contrôle de l'-47 UNC ou UNC -25 promoteurs (souches EG1285 et CZ1200, respectivement, disponible au Centre de génétique de C. elegans ).
Mont-L4 étape vers tel que décrit, retournez le ver de sorte que le GABA des neurones sur le côté droit sont vers le haut, et placer la lamelle. Couper 1-3 de la commissure postérieure de chaque ver, à mi-chemin entre les cordes dorsales et ventrales. Évitez de couper des commissures qui traversent ou fasciculées aux commissures d'autres, comme elles sont difficiles à marquer plus tard. Récupérez des vers tels que décrits.
18 à 24 heures après une axotomie réussie, le ver aura récupéré de la chirurgie et d'exposition de locomotion normale et la ponte des comportements. Jeter les vers qui sont morts ou malades. Remontez le reste comme décrit, et d'évaluer la régénération. Nous visent généralement à évaluer au moins 30 neurones coupé par condition expérimentale. En oxIs12 animaux, généralement 60-70% de L4 rompu neurones GABA aura initié une structure de cône de croissance, comme en témoigne l'élargissement de la membrane à la pointe et l'extension de succursales neurites plusieurs années, et ont migré à partir du site coupés (figure 4a). Dans de nombreux cas, les cônes de croissance aura migré à renouer avec la moelle épinière dorsale, une commissure adjacentes neuronaux, ou le moignon distal. Les 30% restants de neurones aura soit initiée sans croissance, formant un moignon proximal sur le site de axotomie, ou auront prolongé que de petites filopodes (figure 4b).

Figure 1. Le laser pulsé UV axotomie système. Composants spécifiques sont: (a) Les filtres ND (b) impulsion de sélecteur (c) levier de roue à filtres (d) du chemin optique de commutation de levier (e) d'obturation au laser et (f) la plaque d'atténuateur.
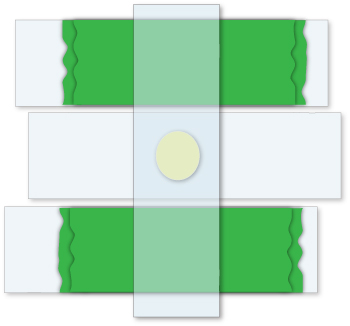
Figure 2. Préparation d'un pad d'agarose. Pour préparer un tampon d'agarose de l'épaisseur désirée, deux couches de ruban (vert) sont placés sur deux lames. Une lame est placée entre les deux premiers, et une goutte d'agarose est alors ajouté à la lame propre. Enfin, un quatrième diapositive est placé perpendiculairement aux trois premiers, résultant en un pad qui est l'épaisseur de deux morceaux de ruban.
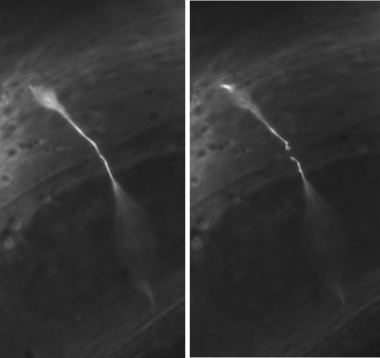
Figure 3. Représentant GABA axotomies neurone. Dans une expérience typique, le GABA neurone commissures sont sectionnés au milieu de la face latérale du ver. Une commissure coupé est montré juste avant (à gauche) et après (à droite) axotomie. Toutes les images ont été prises avec un objectif 100x.
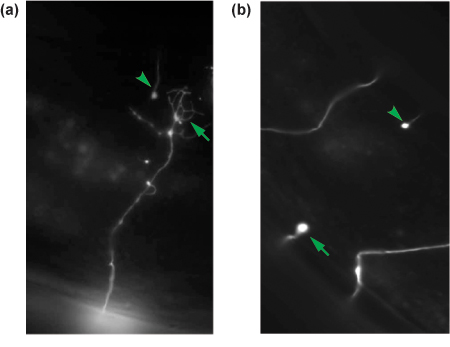
Figure 4. Des résultats représentatifs de axotomies neurone GABA. 24 h après l'axotomie axones sectionnés sont marqué pour la régénération. Un axone régénérer avec un cône de croissance (flèche) est montré en (a) alors qu'un non-régénération des axones est considéré comme un moignon proximal (flèche) en (b). Le moignon distal de chaque axone coupé est montré dans chaque panneau (tête de flèche) et est une indication que l'axone a été sectionné.
Discussion
Une variété de systèmes laser ont été utilisées pour couper neurites en C. elegans, et plusieurs études ont examiné leurs performances en détail 3,7,10,11. Le laser utilisé MicroPoint dans notre protocole est un système clé en main qui est facile à configurer et à entretenir, et est disponible à un faible coût à des chercheurs par rapport à un système Ti-Sapphire laser. Comparé à un système de Ti-Saphir, cependant, le laser MicroPoint est susceptible de causer des dommages à une zone plus large, qui peut être désavantageux pour certaines applications. Si un système Ti-Saphir est souhaité, un excellent protocole sur la construction d'un tel système est disponible 12.
Le protocole actuel peut être effectuée sur une variété de neurones en C. elegans; toutefois, nous notons que les différences de capacités de régénération entre les types distincts de neurones sont attendus 13. En outre, les différents milieux transgéniques peuvent affecter le succès de régénération. Bien que le pourcentage de régénération de neurones GABA est assez uniforme entre les différentes souches marqueur transgénique, nous avons noté une augmentation globale légère de régénération dans juIs76 14 vs 15 oxIs12 vers. Différences entre les marqueurs des neurones tactile ont également été décrites 2.
Nous préférons pour immobiliser les vers avec des microbilles, plutôt que des anesthésiques que les perles entraîner plus rapide et plus cohérente l'immobilisation 16. Ceci est également avantageux que nous sommes en mesure d'observer la régénération gratuite de tous les effets possibles de confusion en raison de l'anesthésie 17. Une alternative sans anesthésie méthode pour l'immobilisation est l'utilisation de dispositifs microfluidiques. L'utilisation de la microfluidique pour axotomie a été largement décrite 17-22.
Nous constatons que l'utilisation cohérente, les fonctions laser le mieux quand la coumarine 440 dans la cellule colorant est changé une fois par semaine suivant la procédure décrite dans le manuel MicroPoint. Si nécessaire, le curseur d'atténuation peut être utilisé pour augmenter la puissance, mais cela peut être une indication de colorant vieux ou mauvais alignement au laser. En outre, la cellule colorant a une durée de vie limitée et auront éventuellement besoin d'être reconstruit ou remplacé (voir Dépannage).
Il peut être difficile à manœuvrer le neurite cible sous la ligne de mire qui marquent la focalisation du laser, en particulier si l'animal n'est pas complètement paralysé. Nous constatons que une étape manuelle n'est pas optimale à cet effet, même si elle est certainement utilisable. Une étape joystick à commande motorisée est plus précis, et nous constatons que l'aide du logiciel qui supporte l'image en faisant glisser avec la souris pour déplacer la platine motorisée est la meilleure. Éléments de Nikon offre cette fonction et est décrite dans ce protocole, mais le package microgestionnaire libre, ainsi que des logiciels d'imagerie, peuvent avoir des fonctionnalités similaires. Une autre façon de cibler amende est de déplacer le focus laser, plutôt que de l'animal. Un galvanomètre faisceau mécanisme de direction est disponible comme un add-on pour le laser MicroPoint, si cette approche est préférable.
Outre son application à l'étude de la régénération neuronale, le laser peut être utilisé pour l'ablation d'autres types cellulaires, comme la peau, des muscles ou des cellules spécialisées, ou de perturber spécifiques synapses neuronales 23-27. Par ailleurs, les voies de régulation de la dégénérescence des neurones qui accompagne une blessure ou la maladie pourraient être étudiés avec ce système. En tant que tel, l'utilisation de lasers pulsés continuera à faire la lumière sur les facteurs génétiques et les changements de cellules biologiques qui facilitent la régénération neuronale et d'autres processus pertinents.
Dépannage:
Décrites ici sont des problèmes courants et leurs solutions associées.
- Le laser ne coupe pas correctement. C'est probablement parce que soit le laser est hors de discussion (voir section 2), ou le colorant dans la cellule de teinture doit être remplacé (voir MicroPoint manuel). Alternativement, la cellule de teinture peut-être besoin d'être remplacé ou reconstruit.
- Les vers se déplacent sur agarose pad. Cela est généralement un signe que le tampon d'agarose est trop humide. Nous constatons que coussinets doivent être laissés pendant environ 30 secondes avant vers sont placés sur eux pour contourner ce problème. Vous pouvez également essayer d'utiliser plus la taille (0,05 um) microbilles.
- La reprise de vers est difficile et inefficace. Cela peut être causé par l'enlèvement lamelle incorrecte ou par un tampon sec agarose. Si le tampon est trop sec, vous pouvez remarquer que les axones de développer un aspect perlé. Dans certains cas, c'est parce que les vers ne sont pas mis sur le tapis assez tôt après qu'il a été fait. Alternativement, un ancien stock de solution d'agarose peut avoir une concentration supérieure à 3% après la fusion répétée.
Déclarations de divulgation
Remerciements
Le travail dans le laboratoire est financé par Hammarlund: subventions des NIH R01-01 et NS066082 T32GM007223, la Fondation Beekman, et la Ellison Medical Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| 0,05 um billes de polystyrène | Polysciences, Inc | 08691 | |
| 0,10 um billes de polystyrène | Polysciences, Inc | 00876 | |
| Agarose GPG / LE | Américaine bioanalytiques | 00972 | Ultra pur |
| Polystyrène Falcon 14 ml à fond rond Tube | BD Biosciences | 352057 | 17 x 100 mm de style, apyrogène |
| Thermo Scientific Plaine des lames de microscope préalablement nettoyées | Erie Scientific Company | 420-004T | 3 "x 1" x 1 mm |
| Lamelles | VWR | 48366 205 | 18 mm x 18 mm n ° 1 1 / 2 |
| KIMTECH Kimwipes sciences | Kimberly-Clark | 34155 | |
| BD Falcon 100 x 15mm style boîte de Pétri | BD Biosciences | 351029 | |
| Bande vierge 3/4w x 500L | TimeMed | T-512 | |
| Huile à immersion | Nikon | Type A, sd = 1,515 | |
| EG1285 ou CZ1200 | C. elegans génétique Centre | http://www.cbs.umn.edu/CGC/strains/ | |
| OptiScan II | Scientifique préalable | ||
| NIS-Elements Ar ou Br | Nikon | ||
| Système MicroPoint ablation laser | Photoniques scientifique | ||
| Microscope composé | Nikon | Eclipse 80i | |
| Hamamatsu caméra | Hamamatsu Photonics | Modèle C8484-05G01 | |
| Dell Precision T3400 PC avec Intel Core 2 Duo | Dell | ||
| Windows XP Professionnel | Microsoft | Version 2002, Série Pack 3 | |
| Double bain sec Incubateur | Fisher Scientific | Commandes analogiques | |
| 4X plan Fluor objectif | Nikon | ||
| 100X plan Apo objectif du pétrole VC | Nikon | ||
| Dumont # 5 / 45 pince | Dumont | 11251-35 | Dumoxel pointes standard, peuvent également utiliser # 7 |
| Microscope à dissection | Nikon | SMZ800 | Avec NI-150 Illuminateur à haute intensité |
Références
- Hammarlund, M., Nix, P., Hauth, L., Jorgensen, E. M., Bastiani, M. Axon regeneration requires a conserved MAP kinase pathway. Science. 323, 802-806 (2009).
- Ghosh-Roy, A., Wu, Z., Goncharov, A., Jin, Y., Chisholm, A. D. Calcium and Cyclic AMP Promote Axonal Regeneration in Caenorhabditis elegans and Require DLK-1 Kinase. Journal of Neuroscience. 30, 3175-3183 (2010).
- Wu, Z. Caenorhabditis elegans neuronal regeneration is influenced by life stage, ephrin signaling, and synaptic branchi ng. Proceedings of the National Academy of Sciences. 104, 15132-15137 (2007).
- Yan, D., Wu, Z., Chisholm, A. D., Jin, Y. The DLK-1 Kinase Promotes mRNA Stability and Local Translation in C. elegans Synapses and Axon Regeneration. Cell. 138, 1005-1018 (2009).
- Yanik, M. F. Neurosurgery: Functional regeneration after laser axotomy. Nature. 432, 822-822 (2004).
- Gabel, C. V., Antoine, F., Chuang, C., Samuel, A. D. T., Chang, C. In vivo nanosecond laser axotomy: cavitation dynamics and vesicle transport. Optics Express. 16, 9884-9894 (2008).
- Rao, G. N., Kulkarni, S. S., Koushika, S. P., Rau, K. R. In vivo nanosecond laser axotomy: cavitation dynamics and vesicle transport. Optics Express. 16, 9884-9894 (2008).
- Wood, W. B. The Nematode Caenorhabditis Elegans. , Cold Spring Harbor Laboratory Press. (1988).
- McLntire, S. L., Jorgensen, E., Kaplan, J., Horvitz, H. R. The GABAergic nervous system of Caenorhabditis elegans. Nature. 364, 337-341 (1993).
- Bourgeois, F., Ben-Yakar, A. Femtosecond laser nanoaxotomy properties and their effect on axonal recovery in. C. elegans. Optics Express. 15, 8521-8531 (2007).
- Chung, S., Mazur, E. Femtosecond laser ablation of neurons in C. elegans for behavioral studies. Applied Physics A: Materials Science & Processing. 96, 335-341 (2009).
- Steinmeyer, J. D. Construction of a femtosecond laser microsurgery system. Nature Protocols. 5, 395-407 (2010).
- Wang, Z., Jin, Y. Genetic dissection of axon regeneration. Current Opinion in Neurobiology. , Forthcoming (2010).
- Huang, X., Cheng, H. -J., Tessier-Lavigne, M., Jin, Y. MAX-1, a Novel PH/MyTH4/FERM Domain Cytoplasmic Protein Implicated in Netrin-Mediated Axon Repulsion. Neuron. 34, 563-576 (2002).
- McIntire, S. L., Reimer, R. J., Schuske, K., Edwards, R. H., Jorgensen, E. M. Identification and characterization of the vesicular GABA transporter. Nature. 389, 870-876 (1997).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in C. elegans in Methods in Cell Biology: Caenorhabditis elegans: Modern Biological Analysis of an Organism. , Elsevier Academic Press. Forthcoming Forthcoming.
- Guo, S. X. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nature Methods. 5, 531-533 (2008).
- Zeng, F., Rohde, C. B., Yanik, M. F. Sub-cellular precision on-chip small-animal immobilization, multi-photon imaging and femtosecond-laser manipulation. Lab on a Chip. 8, 653-656 (2008).
- Rohde, C. B., Zeng, F., Gonzalez-Rubio, R., Angel, M., Yanik, M. F., F, M. Microfluidic system for on-chip high-throughput whole-animal sorting and screening at subcellular resolution. Proceedings of the National Academy of Sciences. 104, 13891-13895 (2007).
- Hulme, S. E., Shevkoplyas, S. S., Apfeld, J., Fontana, W., Whitesides, G. M. A microfabricated array of clamps for immobilizing and imaging C. elegans. Lab on a Chip. 7, 1515-1523 (2007).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Current Opinion in Neurobiology. 19, 561-567 (2009).
- Samara, C. Large-scale in vivo femtosecond laser neurosurgery screen reveals small-molecule enhancer of regeneration. Proceedings of the National Academy of Sciences. , (2010).
- Nelson, F. K., Riddle, D. L. Functional study of the Caenorhabditis elegans secretory-excretory system using laser microsurgery. Journal of Experimental Zoology. 231, 45-56 (1984).
- Sulston, J. E., White, J. G. Regulation and cell autonomy during postembryonic development of Caenorhabditis elegans. Developmental Biology. 78, 577-597 (1980).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Developmental Biology. 87, 286-300 (1981).
- Allen, P. B. Single-synapse ablation and long-term imaging in live C. elegans. Journal of Neuroscience Methods. 173, 20-26 (2008).
- Pujol, N. Distinct Innate Immune Responses to Infection and Wounding in the C. elegans Epidermis. Current biology. CB 18, 481-489 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon