Method Article
Visualisation de MG53 médiation réparation de la membrane cellulaire utilisant In vivo Et In vitro Systèmes
Dans cet article
Résumé
Décrites ici sont des protocoles utilisés pour visualiser le processus dynamique de MG53 médiation réparation de la membrane cellulaire chez les animaux entiers et au niveau cellulaire. Ces méthodes peuvent être appliquées pour étudier la biologie cellulaire de refermeture membrane plasmique et la médecine régénérative.
Résumé
Réparation de lésion aiguë de la membrane cellulaire est un processus élémentaire de physiologie cellulaire normale et réparation de la membrane défectueuse a été lié à de nombreuses maladies dégénératives humaines. La découverte récente de MG53 comme un élément clé de la machinerie rescellage membrane permet une meilleure compréhension moléculaire de la biologie de base de réparation des tissus, ainsi que pour les applications potentielles translationnelle en médecine régénérative. Ici, nous détaillons les protocoles expérimentaux pour explorer la fonction in vivo de MG53 dans la réparation des blessures musculaires en utilisant des protocoles d'exercice sur tapis roulant sur des modèles de souris, pour tester la capacité de la membrane ex vivo par la mesure de réparation de l'entrée du colorant dans les fibres musculaires isolées, et pour le suivi du processus dynamique du trafic vésiculaire MG53-médiation et de réparation dans la membrane cellulaire des cellules cultivées en utilisant la microscopie confocale de cellules vivantes.
Protocole
1. Course sur tapis roulant pour avoir révélé l'étendue des blessures musculaires dans des modèles murins
- Établir l'angle de la surface de tapis roulant pour une utilisation au cours du protocole en cours. Généralement, un niveau plat ou un angle compris entre 7 ° et 15 ° degrés en descente ou en montée est utilisé. Certains tapis roulants ont dans l'appareil intégrante de régler l'inclinaison tandis que d'autres nécessitent le tapis roulant pour être élevés par d'autres moyens.
- Placez un bac ou un tampon de laboratoire bleue sous le tapis roulant avant de mettre les animaux dans le tapis roulant pour recueillir tous les déchets des animaux pendant le protocole de fonctionnement.
- Avant de souris qui doivent être acclimatés à l'environnement du tapis roulant. Il s'agit de placer les animaux dans le tapis roulant pendant 15 minutes avec le réseau électrique hors tension et le moteur d'entraînement par courroie sur la ceinture, mais ne bouge pas (c'est à dire avec la vitesse à 0 m / s).
- Tournez sur la grille de motivation électrique. L'intensité et la fréquence des impulsions utilisées peuvent généralement être contrôlés sur des tapis roulants, mais varie d'un fabricant à l'autre. Généralement, l'intensité maximale n'est pas nécessaire de motiver les souris de courir tout une fréquence élevée (au moins une fois toutes les deux secondes) permettra d'améliorer la conformité.
- Activer la ceinture de tapis roulant pour commencer le protocole en cours. Une vitesse initiale d'environ 5 mètres / min devrait être utilisé pour une période d'échauffement pour les souris. La vitesse du tapis roulant peut être accéléré lentement, généralement en ajoutant 1-2 mètres / min pour chaque minute suivant le début du tapis roulant.
- Respect des animaux dans la plupart des protocoles peuvent être améliorés par la réalisation d'une série de courts tirages (5 minutes) à la vitesse d'échauffement de 3 à 10 jours avant la course commence expérimentale.
- Un exercice d'épuisement aiguë implique généralement d'augmenter la vitesse du tapis roulant avec le temps jusqu'à une vitesse maximale (généralement <30 m / m) est atteint et maintenu jusqu'à ce que la souris montrent des signes d'épuisement. Critères pour juger de l'épuisement varient, mais comprennent généralement une souris dépenser plus que la moitié du temps sur le réseau électrique ou 5 secondes consécutives sur le réseau électrique sans revenir à la surface du tapis roulant. Après une souris individuelle est épuisé, il peut être enlevé du tapis roulant et le temps total de course peuvent être enregistrées.
- Changement de l'angle du tapis roulant peut être utilisé dans des essais en marche aiguë d'augmenter la charge d'exercice (avec un angle vers le haut) ou pour induire endommager les contractions excentriques (avec une descente d'angle) qui déchirent les membranes de 1 sarcolemme des fibres musculaires. Bleu Evans peut être injecté dans des animaux avant de telles procédures pour une utilisation comme colorant histologique d'identifier les fibres musculaires endommagées 2,3.
- L'entraînement en endurance courir protocoles fournissent une charge d'exercice à l'animal au cours d'une période de temps prolongée (jusqu'à mois) afin de produire de remodelage du muscle ou du système cardiovasculaire. Warm up procédure est la même que ci-dessus (étape 1.5), cependant la vitesse maximale est généralement plus faible et le temps de fonctionnement peut être assez long (> 1 heure).
- Après achèvement de courir les souris peuvent être retournés dans leur cage. Tapis de course deviennent habituellement très sale tandis que les souris sont en cours, notamment sur les protocoles longs. Il est nécessaire de nettoyer le tapis roulant, généralement avec un spray d'éthanol à 70%, après chaque utilisation.
2. Ex Vivo dosage de la capacité de réparation de la membrane des fibres musculaires isolés après UV-laser Dommages
- Disséquer la couche superficielle de la court fléchisseur des orteils (FDB) du muscle du pied de la souris. D'abord, couper la peau de l'ouverture exclusive à la ligne médiane en prenant soin de ne pas endommager le muscle en dessous, puis faire des coupes horizontales et enlever la peau. Le tendon du muscle plat blanc FDB (tendon proximal) peut être vu attaché à l'os calcanéum. Carrément séparée du tendon par forceps et de rompre la clôture tendon de site de fixation, prenez le tendon libre par des pinces et tirez doucement jusqu'à séparer les FDB à partir des tissus environnants tout en réduisant les tissus conjonctifs qui restent attachés. En voyant la branche distale des tendons aux chiffres individuels du FDB peut être enlevée par une coupe où ces tendons se connecter à la couche profonde du muscle.
- Mettez le faisceau musculaire FDB dans 1 ml de solution de collagénase pré-chauffé à 37 ° C dans un tube Eppendorf de 1,5 ml, coller le tube dans une orientation horizontale dans un 37 ° C agitateur orbital et serrer à 200 rpm pendant 65 min. Les temps d'incubation peut être ajustée pour assurer une digestion suffisante, ce qui est indiqué par une apparence effiloché et la couleur pâle du muscle.
- Transférer soigneusement le faisceau FDB digérés dans un tube de centrifugeuse 1,5 ul contenant ~ 600 ul de 2,5 Ca 2 + via Tyrode un bout de 1 ml avec une pipette bout coupé qui a un diamètre suffisant pour permettre à l'ensemble digérée facilement passer à travers sans interruption. Délicatement retourner le tube pour secouer les fibres lâches du faisceau.
- Couper une pointe de pipette 30 uL de sorte que le diameter n'est que légèrement plus petit que le faisceau musculaire (entre 15 - 20 m de diamètre) Utiliser la pipette à la tire doucement le faisceau dans la pipette et ensuite le repousser dans la solution.. Répétez ce processus jusqu'à ce que la majorité des fibres sont dissociées de l'ensemble.
- Mélangez bien par des fibres dissociées tournant doucement le tube, prenez la quantité désirée et déposez-le sur un plat à fond de verre delta T. Le volume de chargement varie en fonction de l'efficacité de l'isolement et le nombre de fibres utiles qui sont nécessaires sur un plat pour un protocole particulier. Les fibres restantes peuvent être stockés dans le tube à 4 ° C pendant environ 6 heures pour des études supplémentaires.
- Laisser le plat tranquille pendant 5 minutes. Ceci permet aux fibres d'adhérer au fond de verre de la vaisselle.
- Placer le plat à fond de verre sur un microscope confocal équipé d'un laser UV. Observez les fibres sous microscopie de phase à un grossissement> 100X pour vérifier la présence d'un motif de stries normales et une droite, tige comme la forme.
- Ajouter FM1-43 ou FM4-64 colorants styrylpyridinium 4 à la solution à une concentration finale de 2,5 uM 5.
- Pour induire des dommages à la position de la fibre dans la fenêtre d'imagerie afin que la fibre est orientée à un angle de 45 ° à partir du haut à gauche du champ de vue en bas à droite (figure 1). Irradier une zone de pixels 5x5 (environ 0.9μmx0.9μm) de la membrane plasmique à l'aide d'un laser UV (80 MW ou plus, 351/364 nm) mis à la puissance maximale pendant 5 secondes. La région irradiée doit diviser la membrane plasmique, c'est la moitié de la boîte 5x5 devrait être à l'intérieur de la fibre, tandis que le reste devrait être en dehors de la fibre (figure 1).
- Capture d'images d'entrée colorant dans la fibre à des intervalles de 5 secondes chacun pour un maximum de 5 minutes.
- Répétez l'étape 2.8 pour pas plus de 3 fibres par plat, comme le colorant fluorescent sera finalement endocytosée dans la fibre et compliquer toute analyse des données. Après 3 fibres d'un nouveau plat doit être préparé à l'étape 2.5.
- Analyser les données en calculant la variation d'intensité de fluorescence (AF / F 0) entre chaque image capturée pour mesurer la quantité d'entrée colorant. Ceci nécessite la mesure de la moyenne de fluorescence d'une zone d'environ 200 um 2 en utilisant des logiciels d'analyse comme la disposition du public ImageJ (http://rsbweb.nih.gov/ij/). A titre de comparaison entre les fibres, le calcul suivant doit être faite pour chaque image: AF / F 0, où F 0 est la moyenne de fluorescence de la région d'intérêt dans la première image capturée (t = 0; avant l'accident), et Af est le changement de fluorescence de chaque trame suivante (FF 0).
3. En direct d'imagerie cellulaire confocale de surveiller le processus dynamique de réparation de la membrane cellulaire
- Micropipettes ont été fabriqués à partir de PYREX capillaires. Le capillaire est placé sur un extracteur micropipette et tiré par le programme préétabli (chaleur = 695; Tirez = 50; Vel .= 55; Temps = 250).
- Micropipette était attaché à un 3 axes (xyz) micromanipulateur.
- Les cellules sont transfectées avec l'ADN plasmidique en utilisant des méthodes normales sur un fond de verre plat du delta T. Les médias devraient être mis à 2.5mm Ca 2 + du tampon de Tyrode avant les expériences commencent.
- Plats en verre contenant des cellules transfectées ont été placés sur un microscope confocal à balayage laser, avec l'objectif 40X huile d'immersion 1.3NA.
- Le aiguë des cellules vivantes dommages a été réalisée en insérant la micropipette dans la membrane cellulaire et ensuite rentrer rapidement la micropipette hors de la cellule 3,6. Consécutive images de cellules vivantes ont été obtenus à un intervalle de 1,54 s / châssis.
- Pour le dosage de la saponine membrane induite des perturbations, la saponine 0,005% (Sigma) dans 2,5 mM de Ca 2 + Tyrode tampon a été perfusé par un système à écoulement gravitaire perfusion personnalisé assemblé 7. Le débit de perfusion est d'environ 1 ml / min et la pointe de perfusion doit être placé directement au-dessus de la cellule étant imagé.
4. Les résultats représentatifs:
Un film représentatif de la souris le tapis roulant peut être fait pendant le tournage. Le film va illustrer la capacité réduite de fonctionnement du MG53-/ - ont raison de dommages au muscle squelettique.
L'étendue des dégâts causés par le protocole de dommages des rayons UV-laser détaillées ci-dessus dépend de la capacité de réparation de la membrane de la fibre analysés. Cette capacité est affectée par le génotype de la souris à partir de laquelle la fibre a été isolé, les conditions extracellulaires, et toute modification de l'expression des protéines (transfection ou infection). Une fibre de type sauvage normal permettra légère à modérée d'entrée colorant (figure 2a). Fibres musculaires provenant du MG53-/ - ont une capacité de membrane de réparation compromise affichera entrée plus importante de colorant dans la fibre (Figure 2b).
Les résultats typiques pour la translocation montrent microélectrode blessure de MG53 contenant vesicles à l'endroit de la blessure. Figure 3a et 3b montrent GFP-MG53 myotubes C2C12 transfectées endommagé par l'insertion de la micropipette dans la membrane cellulaire. Dans la cellule avant que des dommages micropipette, GFP-MG53 est situé sur les deux membrane plasmique et le cytoplasme 3. Après la pénétration micropipette, GFP-MG53 vésicules contenant déplacé vers des sites dégâts (comme indiqué par une flèche). La figure 3c montre une GFP-MG53 transfectées C2C12 myoblastes traités avec 0,005% de la saponine, un détergent qui peut perméabiliser la membrane plasmique. Lors du traitement de saponine, GFP-MG53 transloqué du cytosol vers la membrane cellulaire.
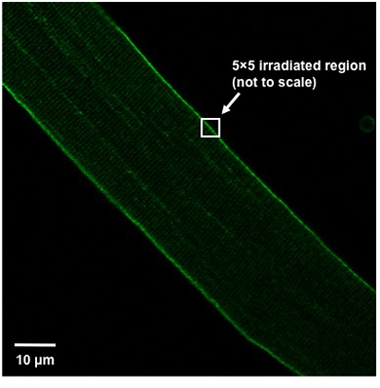
Weisleder, et al. Figure 1. L'alignement des fibres et de définition de région blessure. Une orientation correcte de la fibre musculaire isolée au sein du champ de vision et la définition de la région de blessures indiqué.
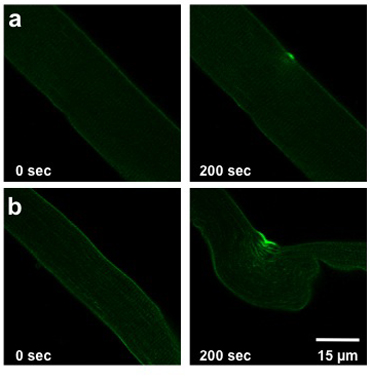
Weisleder, et al. Figure 2. Dommage laser UV de FDB fibre. Les images montrent des fibres avant de blessures (0 sec, à gauche) et à 200 sec après la lésion (à droite). Fibres d'une souris de type sauvage (a) montrent des blessures légères. Fibres de souris avec la réparation de la membrane compromise (b) permettre à plus de colorant pour entrer.
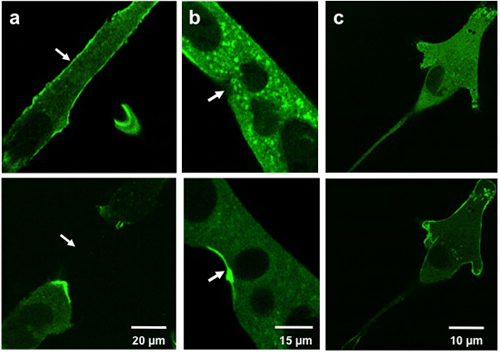
Weisleder, et al. Figure 3. Dommages de microélectrodes et de saponine à des cellules cultivées. Les images montrent myotubes C2C12 (a, b) et un myoblastes C2C12 (c) avant l'accident (en haut) et après la lésion (en bas). Cellules blessé avec une microélectrode (a, b) montrent MG53 translocation vers les sites des blessures (flèches). Les cellules traitées avec de la saponine (c) montrent MG53 translocation vers la membrane cellulaire.
Discussion
Le tapis roulant est une méthodologie utile à fournir une charge d'exercice pour les animaux traités. Comme une méthodologie pour mesurer la fonction musculaire ou la capacité d'endurance, il s'agit d'une approche notoirement bruyants qui est difficile à exécuter d'une manière reproductible 8. En général, les temps d'épuisement peut être utilisé comme un point final pour résoudre les différences majeures entre les groupes expérimentaux, comme ceux entre certaines lignées de souris knock-out et des souris de type sauvage 9. Les manipulations expérimentales qui produisent différence plus subtile, comme certains essais pharmaceutiques, ne peuvent pas résoudre les différences au-dessus du bruit associé à cette technique. Afin de maximiser la reproductibilité et la sensibilité de ces techniques, il est important de maintenir les conditions d'une session à de très près. L'heure de la journée, les animaux sont exercés, ainsi que les conditions chaudes période allant utilisées, sont des facteurs importants et devraient rester cohérentes d'un essai à.
Effets de déformation peuvent avoir un impact significatif sur la conception de protocoles de tapis roulant que certaines souches de souris peut fonctionner pendant beaucoup plus de temps sur le tapis roulant que les autres souches et réagissent différemment à un exercice d'endurance 10. En règle générale, beaucoup de souris sera capable d'exécuter 200-300 mètres au total dans une étude de l'épuisement avec une augmentation constante de la vitesse du tapis roulant (5 m / m vitesse initiale de 1 m / m ajoutée pour chaque minute après le démarrage). Pour un exercice d'endurance des souris peuvent être effectués entre 9 à 12 m / m pendant 30 minutes 2 ou 3 fois par semaine. Cependant, des études individuelles nécessitent habituellement une optimisation du protocole pour correspondre à des besoins individuels expérimental.
La procédure de dommages des rayons UV-laser a été montré pour être une méthode efficace pour mesurer la capacité de réparation de la membrane des fibres musculaires squelettiques 3,6,11. Une composante essentielle à la réussite de ces expériences est d'utiliser des fibres musculaires qui affichent une seule droite, l'aspect en forme de tige avec un motif régulier de stries et d'un sarcolemme lisse qui ne semble pas froissé. Si d'autres fibres musculaires sont sélectionnés endommager les membranes peuvent être déjà présents dans ces fibres et l'interprétation des résultats de ces expériences peuvent être compliquées. Il est aussi important que l'orientation de la fibre et la définition de la région irradiée être tel que défini dans la figure 1. Cette offre d'une blessure de la taille reproductibles, permettant ainsi la comparaison entre les fibres. Si la région définie de blessure se situe complètement dans la fibre, une blessure interne sera créée, plutôt que de perturber le sarcolemme. En outre, la valeur calculée pour AF / F 0 est très sensible à la région d'intérêt choisie pour la mesure de la fluorescence moyenne. Une zone d'environ 200μm 2, adjacente et y compris le site de la lésion, est appropriée. Contrairement à la région définie par une blessure, cette zone devrait se situer complètement à l'intérieur de la fibre. Si vous incluez un espace extérieur de la fibre, la région va augmenter entraînant vierge AF / F 0 en fibres avec une entrée de teinture peu tout en réduisant AF / F 0 en fibres avec un phénotype plus sévère. Cela diminue la sensibilité de l'essai, ce qui rend la comparaison entre les fibres plus difficile.
Pour le dosage de dommages micropipette, l'angle entre la micropipette et le plat à fond de verre devrait être d'environ 45 degrés afin de bien endommager la membrane cellulaire. Les cellules ont été choisis pour les dommages micropipette devrait être étroitement attaché au fond du plat et des cellules arrondies ne doit pas être utilisé car ils seront très probablement se détacher après micropipette piquer. Expériences permeabilzation saponine sont techniquement moins exigeant et relativement plus rapide pour effectuer des tests par rapport à micropipette pénétration. Cependant, il existe plusieurs limites à la saponine dommages, y compris celle d'une seule cellule peut être utilisé par plat, depuis la saponine se diffuse et des lésions d'autres cellules dans ce plat.
Déclarations de divulgation
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
|---|---|---|---|
| Tapis roulant rongeurs | Columbus Instruments Exer 3 / 6 ou équivalent | ||
| 70% d'éthanol | ISC Bioexpress | ||
| Des outils de dissection, y compris une pince fine pointe, des ciseaux à ressort | Instruments de précision du monde | ||
| 2 collagénase de type mg / ml, je | Sigma | ||
| Ca 2 + 0 Tyrode tampon (140 mM NaCl, 5 mM de KCl, 10 mM d'HEPES, 2 mM MgCl 2, pH 7,2, 290 mosm) | Sigma | ||
| 2,5 mM de Ca 2 + Tyrode tampon (NaCl 140 mM, 2,5 mM CaCl 2, 5 mM de KCl, 10 mM HEPES, MgCl2 2 mM, pH 7,2, 290 mosm) | Sigma | ||
| Température contrôlables agitateur orbital | Nouveau-Brunswick ou équivalent | ||
| Delta TPG vaisselle | Fisher Scientific | 1207133 | |
| LSM 510 microscope confocal avec un laser UV Enterprise 80 mW ou équivalent microscope confocal | Zeiss | ||
| FM1-43 ou FM4-64 colorants | Invitrogen | ||
| Borosilicate Capillaires Taille 0.8 à 1.0 X 100 mm | PYREX | N ° 9530-2 Partie | |
| Micropipette extracteur | Sutter Instruments | modèle P-97 | |
| 3 axes micromanipulateur | Narishige | MHW-3 | |
| Radiance 2100 microscope confocal à balayage laser ou un microscope équivalente | BioRad | MHW-3 | |
| La saponine | Sigma | 47036 |
Références
- Armstrong, R. B., Ogilvie, R. W., Schwane, J. A. Eccentric exercise-induced injury to rat skeletal muscle. J Appl Physiol. 54, 80-93 (1983).
- Hamer, P. W., McGeachie, J. M., Davies, M. J., Grounds, M. D. Evans Blue Dye as an in vivo marker of myofibre damage: optimising parameters for detecting initial myofibre membrane permeability. J Anat. 200, 69-79 (2002).
- Cai, C. MG53 nucleates assembly of cell membrane repair machinery. Nat Cell Biol. 11, 56-64 (2009).
- Cochilla, A. J., Angleson, J. K., Betz, W. J. Monitoring secretory membrane with FM1-43 fluorescence. Annu Rev Neurosci. 22, 1-10 (1999).
- McNeil, P. L., Miyake, K., Vogel, S. S. The endomembrane requirement for cell surface repair. Proc Natl Acad Sci U S A. 100, 4592-4597 (2003).
- Cai, C. Membrane repair defects in muscular dystrophy are linked to altered interaction between MG53, caveolin-3, and dysferlin. J Biol Chem. 284, 15894-15902 (2009).
- Wang, X. Cardioprotection of ischemia/reperfusion injury by cholesterol-dependent MG53-mediated membrane repair. Circ Res. 107, 76-83 (2010).
- Knab, A. M. Repeatability of exercise behaviors in mice. Physiol Behav. 98, 433-440 (2009).
- Zhao, X. Enhanced resistance to fatigue and altered calcium handling properties of sarcalumenin knockout mice. Physiol Genomics. 23, 72-78 (2005).
- Massett, M. P., Berk, B. C. Strain-dependent differences in responses to exercise training in inbred and hybrid mice. Am J Physiol Regul Integr Comp Physiol. 288, 1006-1013 (2005).
- Bansal, D. Defective membrane repair in dysferlin-deficient muscular dystrophy. Nature. 423, 168-172 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon