Method Article
Quantifier l'activité des Cis Éléments de la réglementation-dans la rétine de souris par électroporation explantation
Dans cet article
Résumé
Ce protocole décrit une méthode simple et peu coûteux afin de quantifier l'activité des éléments cis-régulateurs (par exemple, enhancer / promoteur) dans la vie des rétines de souris par électroporation explant. Analyse préparation de l'ADN, la dissection de la rétine, l'électroporation, la culture des explants rétiniens, et post-fixation et de quantification sont décrits.
Résumé
Les facteurs de transcription dans les réseaux de gènes cellulaires de contrôle du modèle spatio-temporelle et les niveaux d'expression de leurs gènes cibles en se liant aux éléments cis-régulateurs (CRE), courte (~ 300-600 pb) s'étend de l'ADN génomique qui peut rester en amont, en aval, ou dans les introns des gènes qu'ils contrôlent. CRES (ie, exhausteurs / promoteurs) se composent généralement de plusieurs clusters sites de liaison pour les activateurs de la transcription et de répresseurs 1-3. Ils servent d'intégrateurs logique de l'entrée de la transcription de donner une sortie unitaire dans la forme de l'activité du promoteur spatio-temporellement précis et quantitativement exacte. La plupart des études des mammifères cis-régulation à ce jour se sont appuyés sur la transgenèse de la souris comme un moyen de dosage de la fonction enhancer du CRE 4-5. Cette technique est fastidieuse, coûteuse et, à cause des effets de site d'insertion, en grande partie non quantitatives. D'autre part, les tests quantitatifs pour la CRE fonction de mammifères ont été développés dans les systèmes de culture de tissus (par exemple, deux tests luciférase), mais la pertinence in vivo de ces résultats est souvent incertaine.
L'électroporation offre une excellente alternative à la transgenèse souris traditionnelle en ce qu'elle permet à la fois l'évaluation spatio-temporelle et quantitative de l'activité cis-régulatrices dans les tissus vivants de mammifères. Cette technique a été particulièrement utile dans l'analyse de cis-régulation dans le système nerveux central, en particulier dans le cortex cérébral et la rétine 6-8. Alors que l'électroporation de souris de la rétine, à la fois in vivo et ex vivo, a été développé et largement décrites par Matsuda et Cepko 6-7,9, nous avons récemment développé une méthode simple pour quantifier l'activité des photorécepteurs spécifiques CRE de la souris électroporées rétines 10. Étant donné que la quantité d'ADN qui est introduit dans la rétine par électroporation peut varier d'une expérience à, il est nécessaire d'inclure «le contrôle de chargement 'un co-électroporation dans toutes les expériences. À cet égard, la technique est très similaire à l'essai à double luciférase utilisée pour quantifier l'activité du promoteur dans les cellules cultivées.
Lorsque dosant photorécepteur cis-régulatrices d'activité, l'électroporation est généralement effectuée sur des souris nouveau-nés (jour postnatal 0, P0) qui est le temps de la tige de production de pointe 11-12. Une fois les types de cellules rétiniennes deviennent post-mitotiques, l'électroporation est beaucoup moins efficace. Compte tenu du taux élevé de natalité tige dans souriceaux nouveau-nés et le fait que les tiges constituent plus de 70% des cellules dans la rétine de souris adultes, la majorité des cellules qui sont électroporation à P0 sont des tiges. Pour cette raison, les photorécepteurs tige sont le type le plus facile de cellules rétiniennes à l'étude par électroporation. La technique que nous décrivons ici est principalement utile pour quantifier l'activité de la CRE photorécepteur.
Protocole
1. Construction de la chambre d'électroporation
- Commander un microlame, BTX modèle 453 avec un écart de 3,2 mm (Harvard Apparatus # 45-0105) (figure 2A). Les rails de métal devrait être complètement scellé au fond de la diapositive.
- Utilisez un outil de Dremel pour couper une poignée off un rack microtube plastique. Coupez le manche en 5 petites pièces rectangulaires chacune avec les dimensions suivantes: 0.8cm longueur, 0,6 cm de hauteur, largeur 0.3cm (figure 2B). Ces morceaux de plastique réutilisables sont des entretoises qui sera utilisé pour mouler des puits individuels dans la chambre de microlame.
- Insérer les entretoises en plastique entre les rails métalliques de la microlame à intervalles réguliers. Les entretoises doivent être bien ajusté (Fig. 2C).
- Coupez l'extrémité hors une astuce P200 pipette, ajustement de la pointe d'une seringue de 3 ml et remplir la seringue avec le silicone d'aquarium de 100% caoutchouc. Combler les lacunes entre les entretoises en plastique avec du mastic. Soyez sûr de combler les lacunes de bas en haut afin qu'aucun des bulles se forment entre la prise d'étanchéité et de la base de la microlame.
- Placez une tige métallique au-dessus des entretoises en plastique et le fixer avec des clips liant, de sorte que les entretoises sont maintenus en place pendant le séchage du mastic (Fig. 2D-E). Laissez le mastic sec durant la nuit.
- Retirez les clips liant, tige métallique, et des entretoises en plastique (Fig. 2F). Utilisez une lame de scalpel pour nettoyer le mastic sur le haut des rails métalliques. Utiliser un microscope à dissection pour examiner les microlame et s'assurer qu'aucune des bulles sont présentes dans le bas des barrages de silicone. Enlevez tout film d'étanchéité qui peut s'être formé dans le puits de telle sorte que le métal nu est exposé à l'intérieur du puits. Remplir un puits avec de l'eau et assurez-vous que l'eau ne coule pas dans le puits adjacent (s). Répétez l'opération pour tous les puits.
- Le microlame fini s'inscrit dans le plat en plastique avec les poteaux en métal à côté de la fenêtre dans le côté de l'antenne (Fig. 2G); les électrodes seront éventuellement attachés à des poteaux métalliques.
2. Préparation de l'ADN
- Ajouter l'ADN plasmidique à un microtube 1.5ml sur la glace et amener le volume à 150μl d'eau distillée. Plusieurs espèces de plasmide peut être combinée pour la co-électroporation (par exemple, une construction expérimentale DsRed et un contrôle GFP). Lors du calcul de la quantité d'ADN d'ajouter dans le tube, gardez à l'esprit que le volume final de la partie aliquote d'ADN seront 60μl. Typiquement, chaque construction est utilisé à une concentration finale de 0.5μg/μl.
- Précipiter l'ADN en ajoutant 15μl d'acétate de sodium 3M (pH 5,2) et 450μl d'éthanol 100%. Inverser le tube du robinet ou plusieurs fois pour mélanger.
- Isoler l'ADN à 4 ° C, 13200 rpm, pendant 30 minutes. Laver le culot à l'éthanol 70%, puis la faire tourner à nouveau à 4 ° C, 13200 rpm, pendant 15 minutes. Sécher à l'air le culot jusqu'à ce semi-translucide, environ 7 minutes, puis remettre en suspension dans l'eau stérile 54μl. Ajouter 6μl stériles 10X PBS (pH 7,4) et mélanger.
3. La collecte des yeux
- Stériliser la chambre d'électroporation et tous les instruments avec de l'éthanol à 70%. Alors que la collecte et la dissection des yeux ne doivent pas être effectuées dans une hotte de culture de tissus, de désinfecter vos gants et de paillasse avec de l'éthanol et de tenter de maintenir des conditions stériles pendant toute la procédure.
- Préparer des boîtes de Pétri avec un milieu de dissection (1:1 de DMEM: F12, 100U/ml pénicilline, la streptomycine 100μg/ml, 0.29mg/ml L-glutamine, et l'insuline 5μg/ml): deux plats de 35mm chacune avec support 3ml et un plat de 60mm avec un milieu de 6ml. Cette étape doit être effectuée sous une hotte de culture de tissus.
- Désinfecter la tête et du cou d'un nouveau-né (jour postnatal 0) la souris chiot avec 70% d'éthanol. Vite décapiter avec des ciseaux et de transfert de la tête dans un plat stériles 100mm.
- Coupez le cuir chevelu avec de petits ciseaux à exposer les yeux. Utilisez une pince incurvée pour doucement scoop l'oeil de l'orbite, et le lieu de l'œil dans un plat contenant du milieu de 35mm de dissection. Il peut être utile pour enlever les yeux sous un microscope à dissection à faible puissance.
- Répétez les étapes 3.3 et 3.4 jusqu'à ce que tous les yeux ont été recueillis. Gardez les yeux dans le milieu de la dissection à la température ambiante tout en disséquant. Vous aurez besoin d'yeux 3-4 fois par partie aliquote d'ADN.
4. Dissection rétiniennes
- Utilisez l'éthanol à 70% pour désinfecter la fois une lame de rasoir et l'enveloppe d'une pipette de transfert en plastique stérile. Couper l'extrémité de la pipette hors de la lame afin qu'elle puisse aspirer un œil tout entier. Magasin de la pipette dans l'emballage en plastique lorsqu'il n'est pas utilisé.
- Transfert d'un oeil de l'antenne 35mm à 60mm le plat. Sous la loupe binoculaire à haute puissance, utilisez une pince fine pour retirer tout tissu, tels que les muscles oculomoteurs et de graisse, de la surface de l'œil. Ensuite, retirer le nerf optique en la pinçant descendre à la base.
- Afin d'isoler la rétine, percer un petit trou in la sclère au niveau du limbe. Insérer une broche de deux paires de forceps dans le trou (tangent à la surface de la rétine) et doucement déchirer la sclère / EPR. Chez les souris albinos, la sclérotique et RPE apparaissent relativement brillant pour le tissu de la rétine, qui est une couleur mate homogène gris. Chez les souris pigmentées, l'EPR est le noir. Laisser la lentille en place.
- Utilisez la pipette de transfert pour déplacer la rétine, disséqué dans le plat 35mm avec d'autres moyens.
- Répétez les étapes 04/02 au 04/04 jusqu'à ce que tous les yeux ont été disséqués.
- Stocker les rétines dans un incubateur à 37 ° C la culture de tissus jusqu'à ce que vous êtes prêt à électroporation.
5. Préparation pour l'électroporation
- Préparer les plats de 35mm de milieu. Pour chaque aliquote d'ADN à une électroporation, vous aurez besoin d'une boîte de milieu de dissection et une boîte de milieu de culture (milieu de dissection, plus 10% de FBS). Étiqueter les plats de façon appropriée.
- Utiliser une pipette stérile, P200 et du PBS 1X à laver les chambres dans le plat électroporation. Chaque chambre possède un volume de 60 100 pi. Laver chaque chambre à trois reprises.
- Remplissez les chambres avec les aliquotes d'ADN. Toute les chambres inutilisées doivent être remplis avec du PBS 1X 60μl. Brancher les électrodes à l'antenne électroporation.
- Utilisez les paramètres suivants sur la électroporateur: mode, BT, tension, 30V, longueur d'impulsion, 50 ms, le nombre d'impulsions, 5; intervalle, 950 ms; polarité, unipolaire.
6. L'électroporation
- Utilisez une pince fine pour saisir les rétines par la lentille et les transférer dans les chambres de l'électroporation. Chaque chambre peut accueillir jusqu'à 3-4 souris rétines (Fig. 3).
- Utilisez une pince pour aligner les rétines de telle sorte que l'objectif s'appuie contre la barre de métal attaché à l'électrode positive. Nettoyer la pince avec un Kimwipe après chaque transfert afin d'éviter le report de l'ADN d'une chambre à l'autre.
- Une fois tous les rétines sont alignés, appuyez sur "Start" sur la électroporateur. De minuscules bulles doivent se former sur la barre de métal attaché à l'électrode négative.
- Débrancher les électrodes et éteindre le électroporateur.
- Utilisez une pince pour déplacer doucement les rétines loin des murs de chambre.
- Utiliser une pipette de transfert stérile pour transférer les rétines des chambres dans les plats 35mm contenant du milieu de dissection.
- Laver chaque chambre stérile, à trois reprises avec du PBS 1X, puis rincer à l'eau stérile. Vaporiser plat avec de l'éthanol à 70%.
7. Placer rétines sur les filtres pour la culture
- Utiliser une pipette de transfert pour transférer les rétines dans les plats 35mm contenant un milieu de culture.
- Étiquette les puits d'une plaque de culture de 6 puits stériles et de remplir chaque puits avec un milieu de culture 3ml.
- Utilisez une pince stérile pour placer rondes Whatman filtres Nuclepore, côté brillant en haut, au sommet de la moyenne dans chaque puits.
- Sous un microscope à dissection, utiliser une pipette de transfert stérile pour transférer les rétines sur le filtre, lentille à l'envers. Si les terres rétine lentille de côté-up, le ramasser avec la pipette et de tenter de le placer à nouveau. Ne placez pas plus de 4 rétines sur un filtre, et s'assurer que les gouttelettes de milieu environnant chaque rétine restent séparés à partir des gouttelettes d'autres. Notez que nous la culture de la rétine avec l'objectif intacte, bien que d'autres protocoles appel pour le retrait de la lentille avant cette étape 9.
- Placer la plaque de culture dans un 37 ° C de culture de tissu incubateur (5% de CO 2) et pousser pour la quantité désirée de temps, généralement de huit jours. Dans notre expérience, en changeant le milieu est inutile durant la période de culture de huit jours, même si un changement de milieu peut être requis pour des périodes de culture plus longues.
8. Récolte et flatmounting fluorescentes explants rétiniens
- Remplacez le milieu de culture dans chaque puits avec du paraformaldéhyde 4% / PBS 1X. Si les rétines restent collées aux filtres, utilisez une pince pour retourner les filtres sur et retirez délicatement les rétines hors du filtre. Incuber dans paraformaldéhyde pendant 30 min. à température ambiante. Protéger les rétines de la lumière pour éviter le blanchiment de la fluorescence.
- Rincez les rétines deux fois pendant 10 minutes dans du PBS 1X.
- Utiliser une pipette jetable pour transférer les rétines sur une lame de verre dans une petite goutte de PBS. Sous un microscope à fluorescence de dissection, utiliser des forceps pour faire basculer les rétines de sorte qu'ils sont électroporées côté-up (à savoir, la lentille à l'envers).
- Placez le verre "pieds" fabriqués à partir de lamelles écrasées (morceaux de verre d'environ 1-2 mm de diamètre) dans les coins de la lame; ces pieds de prévenir l'aplatissement de la rétine. Placer une lamelle de verre intactes sur la lame afin qu'elle couvre les rétines et repose sur les pieds. Si nécessaire, utilisez une pipette pour ajouter plus de PBS entre la lame et la lamelle.
9. Imagerie et quantification de la fluorescence dans flatmount
- Utilisez unmicroscope composé fluorescent équipé d'une caméra monochrome à l'image de la rétine flatmounted à faible puissance (objectif 4X) dans les canaux rouge et vert. Tous les rétines doit être imagées avec le même temps d'exposition pour un canal donné fluorescents pour permettre la comparaison des intensités de fluorescence. Assurez-vous que les pixels ne sont pas saturées dans toute l'image, ou bien une quantification précise sera impossible. Exporter des images en niveaux de gris au format TIFF.
- Ouvrez l'image définie pour une rétine (c. .., canal rouge et verte du canal) au logiciel ImageJ ( http://rsbweb.nih.gov/ij/ ). Pour des raisons de ce tutoriel, le canal fluorescente verte (GFP des protéines) est la construction de contrôle qui est constante dans tous les rétines dans l'expérience. Le canal rouge fluorescent (protéine DsRed) est le concept expérimental qui varie pour chaque ensemble de rétines. Les images doivent être en niveaux de gris.
- En ImageJ, sélectionnez l'image de contrôle vert et spécifier un cercle d'intérêts avec un diamètre de 100 unités (Analyser / Outils / ROI gestionnaire / Plus / Spécifier). Dupliquez ce cercle (ROI manager / Ajouter) pour créer huit cercles total. Déplacez les cercles 1-5 pour sélectionner cinq régions qui sont uniformément électroporées, en évitant les bords extérieurs de la rétine et de la région sus-jacente de la lentille (figure 4A). En outre, sélectionner trois régions (cercles 6-8) en dehors de la rétine / objectif de mesurer la fluorescence de fond. Sélectionnez l'image rouge, décochez l'option "Afficher tous" boîte dans le ROI gestionnaire, et re-cocher la case. Tous les huit cercles devrait apparaître sur l'image rouge. Dé-sélectionnez tous les cercles de coordonnées dans le gestionnaire de ROI.
- Avec l'image sélectionnée rouges, enregistrer la valeur de pixel moyenne pour tous les cercles d'intérêt (ROI gestionnaire / Mesure); mesures 1-8 devrait apparaître, où 1-5 sont les mesures rouges rétine et 6-8 sont les mesures du fond rouge. Sélectionnez l'image verte et d'enregistrer la valeur de pixel moyenne; mesures 9-16 doivent apparaître, où les 9-13 sont les mesures vertes rétine et 14-16 sont les mesures du fond vert. Copiez les données de mesure dans Excel pour l'analyse (Fig. 5).
- Moyenne des trois mesures de fond dans les rouges et les canaux vert. Soustraire la moyenne fond rouge de chacune des cinq mesures rétiniennes dans le canal rouge, répétez l'opération pour le canal vert. Pour chaque région de la rétine d'intérêt, divisez-le fond soustrait mesure rouge par le fond-soustrait la mesure en vert afin de normaliser le niveau expérimental rouge sur le niveau de contrôle vert (Fig. 5).
- Déterminer l'écart moyen et standard de toutes les mesures normalisées pour une construction donnée DsRed (par exemple, 5 mesures par temps de la rétine 3 rétines séparées). Afin de comparer quantitativement les résultats de électroporations réalisées à des jours différents, comportent toujours un "standard" précipitations DsRed / GFP dans chaque ensemble électroporation. Valeurs d'expression relative travers les expériences peuvent être comparées en normalisant le niveau d'expression de cette «norme».
10. Les résultats représentatifs:
Un des résultats électroporation bon dans l'expression de la construction d'ADN (s) dans un quart-1 / 3 de la surface de la rétine (figure 4A). Depuis photorécepteurs tige en particulier, sont efficacement transduites, cette technique est idéale pour quantifier l'activité du promoteur spécifique des photorécepteurs (figure 4B). Nous avons déjà utilisé cette approche pour quantifier une gamme de variantes de promoteur de la Rho-tige spécifiques et Gnat1 locus 10. Nous avons trouvé qu'il est possible de quantifier l'activité du promoteur sur une près de 300 fois large.
La figure 5 est un échantillon de données à partir d'un simple rétine électroporé. Dans cet exemple particulier, l'expérimentation de construire pNrl (1.1kb)-DsRed a été mesurée dans le canal rouge et le contrôle de construire pNrl (3.2kb)-GFP a été mesurée dans le canal vert. Un ensemble complet de données pour la pNrl (1.1kb)-DsRed construire consisterait de 6-9 rétines mesuré de cette manière, et l'écart type serait calculé sur l'ensemble "DsRed normalisée à la GFP" valeurs. Si nous devions comparer le niveau d'expression de pNrl (1.1kb)-DsRed, par exemple, pNrl (0.8kb)-DsRed, alors les deux constructions devront être électroporation avec le contrôle GFP mêmes (par exemple, pNrl (3.2kb) - GFP) et imagée à la fois une même exposition. Il est possible de regrouper les données recueillies à des jours différents si une norme DsRed / GFP électroporation est effectuée sur chaque jour (par exemple, pNrl (3.2kb)-DsRed + pNrl (3.2kb)-GFP). Pour chaque construction expérimentale, le niveau normalisé DsRed serait ensuite normalisé à l'échelle normalisée DsRed de la «norme» (pNrl (3.2kb)-DsRed).
La technique que nous décrivons ici est principalement utile pour quantifier l'activité de la CRE 10,13 photorécepteur.Cell-type spécifique cis-régulatrices activité peut également être quantifiés en plus rares types de cellules rétiniennes telles que les cellules bipolaires 14, mais cela nécessite généralement que les zones d'intérêt à être quantifiés être sélectionnés dans des coupes verticales plutôt que dans les préparations flatmount. La même chose est vraie de la CRE qui conduisent son expression dans plusieurs types cellulaires tels que les photorécepteurs et les cellules bipolaires. Les procédures expérimentales sont par ailleurs similaires.
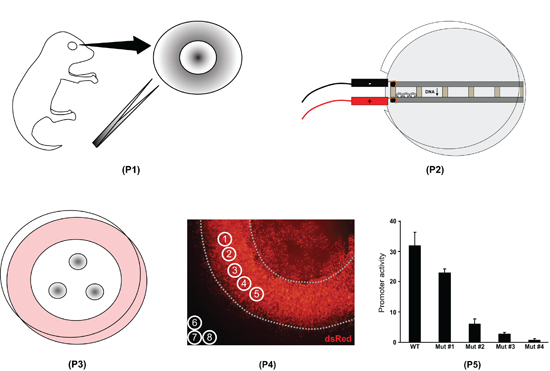
Figure 1. Vue d'ensemble de la procédure électroporation explant rétine. Premièrement, les yeux sont isolés de l'ensemble chiots jour postnatal souris 0 et les rétines sont disséqués (P1). Deuxièmement, les rétines sont placés dans des chambres remplies d'ADN et électroporés (P2). Troisièmement, les rétines sont placés sur des filtres et cultivées pendant huit jours (P3). Quatrièmement, les explants rétiniens sont fixes, montées sur des lames et imagée. Intensité de fluorescence est mesurée à l'aide du logiciel ImageJ (P4). Cinquièmement, les données ImageJ sont traitées dans un tableur afin de quantifier la différence dans l'activité de divers promoteurs (P5).

Figure 2. Construction de l'antenne électroporation. A) Chambre à partir microlame Unmodified Harvard Apparatus, BTX modèle 453 (numéro de catalogue 45-0105). B) Un outil Dremel est utilisé pour couper la poignée off un rack tube en plastique. La poignée est coupé en entretoises rectangulaires avec les dimensions suivantes: 0.8cm longueur, 0,6 cm de hauteur, 0.3cm de largeur. C) Les entretoises en plastique sont montés dans la chambre microlame à des intervalles égaux. Mastic Aquarium est injecté dans les interstices entre les entretoises (non représentée). D) Une barre de métal est placé sur les entretoises. E) Le bar et les entretoises sont serrés sur la diapositive avec des clips de liant pour maintenir tout en place comme le mastic sèche durant la nuit. F) Les entretoises sont enlevés et les puits sont testés pour s'assurer qu'ils sont étanches. G) La diapositive terminée s'inscrit dans le plat en plastique avec les barres de métal à côté de la fenêtre dans le côté du plat.

Figure 3. Diagramme de l'antenne électroporation avec rétines. Les chambres sont remplies avec des solutions d'ADN (jusqu'à cinq solutions différentes à la fois). Rétines sont placés dans les chambres et orienté de telle sorte que l'objectif est appuyé contre la barre métallique reliée à l'électrode positive; trois ou quatre rétines se tenir dans chacune des cinq chambres. Le courant électrique ne provoque pas les molécules d'ADN chargées négativement se déplacer dans les cellules rétiniennes.

Figure 4. A) la mesure de la rétine ImageJ niveaux de fluorescence en flatmount. Niveaux de gris des images flatmount dans la DsRed (expérimental) et GFP (contrôle) des canaux sont ouverts dans le logiciel ImageJ; noter que ces images ont été colorées à titre indicatif seulement. Cinq cercles de mesure (1 à 5) sont placées sur les régions de façon uniforme par électroporation, en évitant les bords et les lentilles (en pointillés). Trois cercles de mesure (6 à 8) sont placés en dehors de la rétine afin de déterminer les niveaux de fluorescence de fond. B) des images en coupe d'un explant électroporées rétinienne à haute puissance. L'explant a été fixé à 8 jours après leur naissance, dans 30% cryoprotégés sucrose/1X PBS pendant une nuit à 4 ° C, incorporé dans de l'OCT, et cryo-sectionné à 12 microns. La fluorescence des constructions pNrl (1.1kb)-DsRed et pNrl (3.2kb)-GFP sont exprimées dans les cellules photoréceptrices de la couche nucléaire externe (ONL). INL, couche nucléaire interne; GCL, couche des cellules ganglionnaires.

Figure 5. Traitement des données de fluorescence en utilisant Excel. À l'étape 1, la valeur moyenne pour chaque pixel cercle de mesure est copiée dans la feuille de calcul (les cellules B3 à B12, F3 à F5, H3-H5). Mesures # 1-5 sont les valeurs de la rétine et DsRed # 6-8 sont les valeurs de fond DsRed; mesures # 9-13 sont les valeurs de la rétine et la GFP # 14-16 sont les valeurs de fond GFP. Notez que la mesure # 1 et # 9 correspondent au cercle même mesure, comme le font les mesures # 2 et # 10, et ainsi de suite. Dans l'étape 2, la valeur de fond moyenne pour les chaînes de DsRed et GFP est calculé (cellules F6, H6). À l'étape 3, le fond est soustraite de la moyenne de chaque mesure rétiniennes (cellules C3-C12). À l'étape 4, chaque arrière-plan soustrait la mesure DsRed est normalisée à sa mesure correspondante GFP (cellules D3-D7).
Discussion
Électroporation explant est un moyen simple de quantifier l'activité cis-régulatrices dans la rétine de souris en développement. Comparé à cis-régulatrices analyse par transgénèse souris, l'électroporation est beaucoup moins cher, nécessitant souriceaux nouveau-nés que l'ADN, d'instruments de dissection, et l'électroporation / équipement de culture de tissus. Il est également beaucoup moins de temps de consommation: l'expérience on exige seulement quelques heures de temps de préparation, une période de culture d'environ huit jours, et quelques heures à la fin de l'expérience de l'imagerie et l'analyse des données. Électroporation explant est également supérieure à la culture cellulaire à base de cis-régulation réelle analyse puisque le tissu rétinien est utilisé. La rétine se développe tout à fait normalement dans les explants culture qu'elle forme trois couches distinctes cellulaire (couche externe nucléaire, couche intérieure nucléaire, et la couche de cellules ganglionnaires), mais ne parviennent pas à élaborer des photorécepteurs segments externes.
Un autre avantage est que l'électroporation explant est hautement reproductible. Les mêmes constructions électroporés dans les rétines différentes, voire des jours différents, se traduit généralement par les mêmes niveaux d'expression relative. En outre, depuis les plasmides par électroporation sont pensés pour être maintenu épisomique dans le noyau et ne sont pas incorporés dans les chromosomes, ils ne semblent pas être soumis aux mêmes effets site d'intégration qui perturbent cis-régulatrices analyse effectuée sur des souris transgéniques.
Électroporation explantation ne présentent plusieurs limites. D'abord, seules les cellules qui sont encore dans le cycle cellulaire peut être efficacement transduites par électroporation 15. Au P0, baguettes et autres plus tard-types de cellules rétiniennes (cellules bipolaires, cellules amacrines, M ller gliales) sont les principales populations de cellules ciblées par cette méthode. L'électroporation des cônes photorécepteurs par P0 électroporation a été rapporté 16, mais l'efficacité semble être faible. Une deuxième limitation est que la culture des explants-delà des résultats deux semaines dans la malformation progressive de la rétine et n'est donc pas recommandé. Si la quantification promoteur est tenu au timepoints tard, cependant, une électroporation in vivo dans 9 peuvent être effectuées, suivies par une dissection rétine au point de temps désiré, plat de montage de la rétine disséqué, et la quantification comme décrit dans la section 9. Une troisième limitation est que ce test n'est que modérément à haut débit. Contrairement à des analyses de culture à base de cellules qui peuvent tester des centaines de constructions en une seule expérience, la technique décrite dans ce protocole nécessite un minimum d'une rétine de souris entier par la construction. Ainsi, seule une dizaine de constructions de couple peut être raisonnablement électroporation dans une journée.
Une mise en garde supplémentaire à l'égard de la quantification de l'activité du promoteur en utilisant l'approche actuelle est qu'il ya un potentiel de «transpercement» de la fluorescence DsRed dans le canal de la GFP, en particulier lorsque les promoteurs dosant très forte. La raison de ceci est que le spectre d'émission de DsRed recouvre partiellement celle de la GFP. Pour contourner ce problème, les filtres d'émission optimisés devrait être utilisé que de minimiser le chevauchement spectral entre DsRed et GFP. Lorsque de tels ensembles de filtres optimisés ne sont pas disponibles, une autre solution possible serait d'utiliser une protéine fluorescente décalée vers le bleu (par exemple, BFP ou CFP) en lieu et place de la GFP.
Déclarations de divulgation
Remerciements
Les auteurs tiennent à remercier Karen Laurent pour son aide à la construction de la section décrivant la chambre d'électroporation.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| L'électroporation vaisselle, Microslide 453 | BTX Harvard Apparatus | 45-0105 | Voir la section 1 du protocole pour les modifications |
| 100% silicone caoutchouc aquarium de ciment | Perfecto fabrication | ||
| En rack microtube plastique | Fisher Scientific | 05-541 | Seule la poignée de porte sera utilisé |
| Dremel | Pour la coupe de la poignée hors du rack tube en plastique | ||
| DMEM | Gibco / Invitrogen | 11965 | |
| F12 | Gibco / Invitrogen | 11765 | |
| L-Glu/pen/strep | Gibco / Invitrogen | 10378-016 | La concentration 100X |
| Insuline | Sigma-Aldrich | I-6634 | Pour le stock de 1000X, resuspendre au 5mg/ml en 5mm HCl et filtre à stériliser |
| FBS | Gibco / Invitrogen | 26140-079 | |
| ECM 830 Square-ondes électroporateur | BTX Harvard Apparatus | ||
| Filtres Nuclepore | Whatman | 110606 | 25mm, 0,2 um |
| Incubateur de culture tissulaire | 37 ° C, 5% de CO 2 | ||
| Lamelles de verre # 1.5 | Fisher Scientific | 12-544E | 0.16mm d'épaisseur |
| Microscope composé fluorescent équipé d'une caméra | Caméra doit être monochromatique (par exemple, l'ORCA-ER caméra par Hamamatsu) | ||
| EGFP / DsRed ensemble de filtres pour microscope composé | Chroma Technology Corp | 86007 | Cette bleedthrough ensemble de filtres minimise entre le rouge et le vert chanenels |
| Logiciel ImageJ | NIH | http://rsbweb.nih.gov/ij/ |
Références
- Carroll, S. B., Grenier, J. K., Weatherbee, S. D. From DNA to diversity : molecular genetics and the evolution of animal design. , 2nd edn, Blackwell Pub. (2005).
- Davidson, E. H. Genomic regulatory systems : development and evolution. , Academic Press. (2001).
- Ptashne, M., Gann, A. Genes & signals. , Cold Spring Harbor Laboratory Press. (2002).
- Blow, M. J. ChIP-Seq identification of weakly conserved heart enhancers. Nat Genet. 42, 806-810 (2010).
- Visel, A. ChIP-seq accurately predicts tissue-specific activity of enhancers. Nature. 457, 854-858 (2009).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104, 1027-1032 (2007).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cereb Cortex. 19, 120-125 (2009).
- Matsuda, T., Cepko, C. L. Analysis of gene function in the retina. Methods Mol Biol. 423, 259-278 (2008).
- Lee, J., Myers, C. A., Williams, N., Abdelaziz, M., Corbo, J. C. Quantitative fine-tuning of photoreceptor cis-regulatory elements through affinity modulation of transcription factor binding sites. Gene Ther. 17, 1390-1399 (2010).
- Carter-Dawson, L. D., LaVail, M. M. Rods and cones in the mouse retina. II. Autoradiographic analysis of cell generation using tritiated thymidine. J Comp Neurol. 188, 263-272 (1979).
- Young, R. W. Cell differentiation in the retina of the mouse. Anat Rec. 212, 199-205 (1985).
- Corbo, J. C. CRX ChIP-seq reveals the cis-regulatory architecture of mouse photoreceptors. Genome Res. 20, 1512-1525 (2010).
- Kim, D. S., Matsuda, T., Cepko, C. L. A core paired-type and POU homeodomain-containing transcription factor program drives retinal bipolar cell gene expression. J Neurosci. 28, 7748-7764 (2008).
- Karra, D., Dahm, R. Transfection techniques for neuronal cells. J Neurosci. 30, 6171-6177 (2010).
- Onishi, A., Peng, G. H., Chen, S., Blackshaw, S. Pias3-dependent SUMOylation controls mammalian cone photoreceptor differentiation. Nat Neurosci. 13, 1059-1065 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon