Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une In Vitro Système d'étude dormance tumorale et le commutateur à la croissance métastatique
Dans cet article
Résumé
Une modification en 3-D in vitro du système est présenté dans lequel les caractéristiques de croissance de plusieurs lignées cellulaires tumorales dans la membrane basale reconstituée en corrélation avec le comportement en sommeil ou de prolifération de cellules tumorales dans un site métastatique secondaire In vivo.
Résumé
Récidive de cancer du sein, souvent suite à une longue période de latence dans laquelle il n'ya aucun signe de cancer et les métastases ne peuvent pas devenir cliniquement apparents que plusieurs années après l'enlèvement de la tumeur primaire et de la thérapie adjuvante. Une explication probable de ce phénomène est que les cellules tumorales ont ensemencé sites métastatiques, sont résistantes aux thérapies conventionnelles, et de rester en dormance pendant de longues périodes de temps 1-4.
L'existence de cellules cancéreuses dormantes sur les sites secondaires a été décrit précédemment comme quiescente cellules solitaires que ni prolifèrent, ni apoptose 5-7. De plus, ces cellules solitaires a été montré pour diffuser de la tumeur primaire à un stade précoce de 8-10 progression de la maladie et de résider en arrêt de croissance dans la moelle osseuse des patients, du sang et des ganglions lymphatiques 1,4,11. Par conséquent, la compréhension des mécanismes qui régulent la dormance ou le passage à un état prolifératif est essentielle pour la découverte de nouvelles cibles et des interventions pour prévenir la récidive de la maladie. Toutefois, démêler les mécanismes de régulation de l'interrupteur de la dormance tumorale à la croissance métastatique a été entravée par le manque de systèmes de modèles disponibles.
in vivo et ex systèmes modèle in vivo pour étudier la progression métastatique des cellules tumorales ont été décrits précédemment 1,12-14. Toutefois, ces systèmes n'ont pas fourni de modèle en temps réel et dans un aperçu haut débit de façon mécaniste en ce qui déclenche l'apparition de cellules tumorales dormantes solitaires à proliférer comme la maladie métastatique. Nous avons récemment développé un système in vitro en 3D pour modéliser les caractéristiques de croissance in vivo de cellules qui présentent soit dormants (D2.OR, MCF7, K7M2-AS.46) ou prolifératives (D2A1, MDA-MB-231, K7M2) le comportement métastatique in vivo. Nous avons démontré que les cellules tumorales qui présentent la dormance in vivo sur un site métastatique restent tranquilles quand elles sont cultivées dans un 3-dimension (3D) d'extrait de membrane basale (BME), tandis que les cellules hautement métastatiques in vivo facilement proliférer en culture 3D après variable, mais relativement courte périodes de repos. Surtout en utilisant la 3D dans le système modèle in vitro, nous avons démontré pour la première fois que la composition ECM joue un rôle important dans la régulation si les cellules tumorales dormantes va passer à un état prolifératif et ont confirmé dans des études in vivo 15-17. Ainsi, le système modèle décrit dans le présent rapport fournit une méthode in vitro de dormance tumorale et étudier le modèle de transition vers une croissance proliférative induite par le microenvironnement.
Protocole
1. L'entretien de culture cellulaire de dormance et métastatique des lignées cellulaires tumorales
- Cultivez dormants (D2OR / MCF7/K7M2-AS.46) et métastatique des cellules tumorales (D2A1 / MDA-MB-231 / K7M2) dans 10 des plaques de culture contenant du milieu cm Eagle modifié par Dulbecco (DMEM) élevés de glucose et 10% de sérum fœtal bovin ( FBS) et des antibiotiques. Une fois que les cellules atteignent 70-80% de confluence, procéder à des dosages suivants.
2. Test de prolifération cellulaire des cellules tumorales dormantes (repos) et métastatiques (prolifération) en culture dans un système 3D-BME
La culture de cellules dormantes / métastatique dans le système 3D
- Décongelez la croissance Cultrex facteur réduite Extrait de la membrane basale (BME) dans un réfrigérateur à 4 ° C une nuit avant d'effectuer le dosage. Notez le BME doivent être manipulés sur la glace en tout temps.
- Le lendemain, placer une plaque de 96 puits sur un plateau de glace à l'intérieur d'une hotte laminaire. Manteau chaque puits avec 50 100 pi de BME glacée en utilisant un distributeur avec une seringue. Assurez-vous qu'aucun des bulles se forment dans les puits. Placer la plaque de 96 puits enduits de BME dans un incubateur humidifié avec 5% de CO 2 à 37 ° C pendant 30 minutes.
- En attendant aspirer les médias à partir des cellules dormantes et ou métastatique des tumeurs (préparés à l'article 1). Rincer les plaques de culture avec 10 ml de phosphate saline tamponnée, de pH 7,4 (PBS). Aspirer le PBS et ajouter 2 ml de trypsine préchauffé à 37 ° C, pour les plaques de culture. Incuber les plaques dans une atmosphère humidifiée à 5% 2 à 37 ° C, pendant 5 min.
- Transfert des cellules dans un tube de 15 ml conique contenant 5ml de DMEM glucose supplémenté avec 10% de FCS et des antibiotiques et de compter les cellules.
- Isoler le nombre total de cellules à être cultivées dans une centrifugeuse de culture tissulaire à une vitesse de 1500g, à température ambiante pendant 5 min. Dans nos essais nous préparons 2X10 3 cellules / puits pour chaque lignée cellulaire ou un point de temps pour être examiné. Toutefois, cela peut varier selon les lignées cellulaires utilisées.
- Soigneusement aspirer le surnageant. Remarque, dans la plupart des cas, le culot n'est pas visible. Par conséquent, laisser un peu les médias. Appuyez sur le fond du tube 15ml conique avec vos doigts afin de s'assurer que la suspension des cellules individuelles est obtenue. Re-suspendre le culot avec du DMEM faible taux de glucose avec des antibiotiques supplémenté avec 2% de SVF BME + 2% (dosage de médias). 100 pi de la presse dosage doit être ajoutée pour tous les 3 2x10 cellules. Triturer les cellules de nombreuses fois avec une pipette de 5 ml pour s'assurer que seule une suspension cellulaire est maintenue.
- Assiette une 100 ul du mélange de cellules par puits sur le dessus de la plaque de 96 puits recouvert de BME. Pour l'évaluation de fond (dans la section 2.8) plaque dans 100 ul par puits de plus que les médias d'essai au-dessus des 96 plaque enduite ainsi BME. Incuber les plaques de culture 96 puits dans un incubateur humidifié à 5% de CO 2 à 37 ° C. Les cellules doivent être ré-alimentés tous les 4 jours avec les médias dosage.
Test de prolifération:
- Test de prolifération des cellules: ajouter aux puits au moment voulu des points 20 ul du titre Cellule 96 aqueux Un kit de dosage Solution Cellulaire prolifération. Incuber dans un humidifié à 5% de CO 2 incubateur à 37 ° C pendant 2h. Utiliser un dossier lecteur de plaque Elisa l'absorbance à 490nm. Pour l'évaluation et la soustraction de fond, ajouter 20 pi du titre Cellule 96 aqueux Un kit cellulaire Solution test de prolifération à des puits de pré enduits de BME et seulement superposées avec les médias dosage. Utiliser un dossier lecteur de plaque Elisa l'absorbance à 490 nm.
3. La coloration par immunofluorescence pour des molécules de signalisation cellulaire dans le sommeil (au repos) des cellules tumorales et / ou métastatiques (prolifération) des cellules tumorales
La culture de cellules dormantes / métastatique dans le système 3D pour la coloration immunofluorescence
* Le protocole suivant est une modification d'un protocole de culture 3D publié par Debnath J et al 18.
- Préparer BME comme décrit dans la section 2.1. Le jour suivant: place un système 8-chambre de lame de verre sur un plateau de glace à l'intérieur d'une hotte laminaire. Enrober chaque bien avec 50ul d'glacée BME utilisant un Pipetman 200 pl. Assurez-BME est répartie uniformément et sans bulles se forment dans les puits. Placer la lame 8 chambre de verre revêtu d'BME dans une atmosphère humidifiée à 5% 2 à 37 ° C pendant 20 min.
- Récolte des cellules dormantes et ou métastatique de la section 1 et se préparer à la culture comme décrit dans la section 2.3 à 2.4. Collecter le nombre total de cellules à cultiver dans un tube de 15 ml conique. Nous préparons 5 x10 3 cellules / puits pour chaque lignée cellulaire et le point de temps pour être examiné. Isoler les cellules dans une centrifugeuse de culture tissulaire à une vitesse de 1500g, à température ambiante pendant 5 min. Aspirer le surnageant avec précaution. Notez que le culot n'est pas visible; donc laisser derrière certains médias. Appuyez sur le fond du tube 15ml conique avec vos doigts pour s'assurer que seule une suspension cellulaire est obtenue.Re-suspendre le culot avec les médias dosage. 400μl des médias dosage doit être ajoutée pour tous les 3 5x10 cellules. Triturer les cellules de nombreuses fois avec une pipette de 5ml. Cette étape est très important de s'assurer que la suspension cellulaire unique est maintenu.
- 400μl Plaque du mélange de cellules par puits sur le dessus de chacune des 8 chambres enduits de BME. Incuber la culture système 8 chambres lame de verre dans un incubateur humidifié à 5% de CO 2 à 37 ° C. Les cellules doivent être ré-alimentés tous les 4 jours avec les médias dosage.
Immunofluorescence:
- Dans les points de temps souhaité, aspirer la couche supérieure de la presse et ajouter 200 ul du fixateur contenant du paraformaldéhyde à 4% (PFA), 5% de saccharose et 0,1% de Triton X-100 et incuber à température ambiante pendant 5 minutes. Aspirer le fixateur et ajouter 200 ul de 4% PFA contenant 5% de saccharose et incuber à température ambiante pendant 25 minutes.
- Aspirer le fixateur, ajouter 400 ul de tampon phosphate salin (PBS) à chaque puits. Incuber 10 minutes à température ambiante. Aspirer le PBS et ajouter 400 μ PBS contenant 0,05% de Tween 20 pendant 10 minutes à température ambiante.
- Bloquer les cellules fixées à température ambiante avec 200 ul d'âne soit 10% de sérum ou avec 3% de BSA pour 1 heure (une solution de blocage à utiliser doit être déterminée empiriquement pour chaque anticorps primaire).
- Aspirer la solution de blocage et ajouter 200 ul de l'anticorps primaire (dilution doit être déterminée empiriquement pour chaque anticorps primaire doit être utilisé). Diluer l'anticorps primaire dans le sérum d'âne de 10% si 10% de sérum d'âne a été utilisé pour bloquer ou de diluer l'anticorps primaire dans de la BSA 3% si 3% de solution de BSA de blocage a été utilisé. Incuber avec l'anticorps primaire nuit à 4 ° C.
- Aspirer l'anticorps, laver les puits avec 400μl de PBS pendant 15 minutes et répéter deux fois. Aspirer le PBS et ajouter 200 ul d'âne anti-IgG conjugué respectifs-à la rhodamine rouge (dilution doit être déterminée empiriquement), couvre la diapositive 8 de chambre avec du papier aluminium et laisser incuber pendant 1 heure à température ambiante.
- Laver les puits avec 400μl de PBS (3x15 minutes à chaque lavage). Aspirer le PBS. Monté avec Vectashield milieu de montage avec le DAPI. Diapositives à sec pendant 40 minutes à température ambiante dans l'obscurité. Les diapositives peuvent être conservés pendant 1 semaine à 4 ° C. Stocker les lames dans l'obscurité. Image diapositives par microscopie confocale.
4. Les résultats représentatifs:
Un exemple d'une analyse de la prolifération de la D2.0R et des cellules dormantes métastatique des tumeurs D2A1 dans la culture 3D est montré dans la figure 1A. Cellules dormantes sont D2.0R (au repos) à travers l'ensemble de la période expérimentale de 14 jours de culture alors que les cellules hautement métastatiques D2A1 restent dormantes seulement pour quatre à six jours, après quoi ils commencent à proliférer. Pendant la phase initiale dormantes, de nombreuses cellules restent solitaires dans la culture en 3-D (figure 1B; jour 4) alors que d'autres cellules non-proliférantes sous forme de sphéroïdes multicellulaires. La transition de D2A1 cellules à partir d'un sommeil à l'état prolifératif in 3-D de la culture (figure 1B; jour 12) est associée à des changements dramatiques dans la morphologie cellulaire. Par conséquent, ce test peut être utilisé pour tester ce facteur / s peuvent déclencher des cellules dormantes D2.0R de sortir de leur état de dormance et ce facteur / s peut empêcher les cellules D2A1 à la transition de leur état de dormance. Figure 2 est un exemple d'un agent prévenir D2A1 cellules à la transition de dormant à un état prolifératif. Comme l'illustre la figure 2, les traitements des D2A1 cellules avec un inhibiteur spécifique de la kinase chaîne légère de myosine (ML-7) maintenu D2A1 cellules dans un état de dormance.
Signalisation cellulaire dans les cellules dormantes et prolifèrent tumorales en culture dans le système 3D peut être étudiée par immunofluorescence pour des molécules de signalisation cellulaire. Comme l'illustre la figure 3 une augmentation significative de la phosphorylation de la myosine chaîne légère dans D2A1 cellules (coloration rouge) suivi par une réorganisation des filaments d'actine formant des fibres de stress d'actine (coloration verte) se produit pendant leur transition de la dormance (1-4 jours) pour prolifération (jour 7). Toutefois, en bloquant la lumière myosine chaîne de l'activité kinase dans les cellules par D2A1 shRNA ou médicament spécifique (ML-7) conserve D2A1 cellules dans un état de dormance et se traduit par une inhibition de la phosphorylation de la myosine chaîne légère et la F-actine organisation des fibres de stress (figure 4).
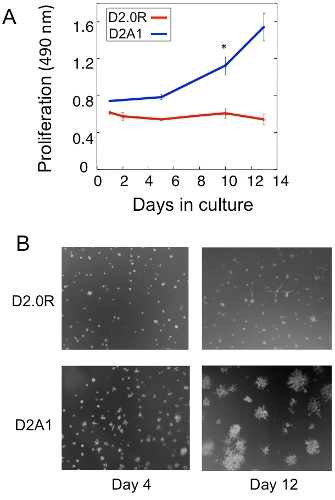
Figure 1. Modèle in vitro pour étudier solitaires de dormance des cellules tumorales et l'interrupteur à la croissance métastatique. A) La prolifération des D2.0R dormantes et métastatique D2A1 en 3-D BME Cultrex, n = 8 (moyenne ± SE). Les résultats représentatifs de trois expériences (* p ≤ 0,05). B) des images de microscopie et de Lumière de D2.0R D2A1 cellules cultivées en 3-D x20 Cultrex agrandissement BME.Figure modifiée à partir de Barkan et al 17.
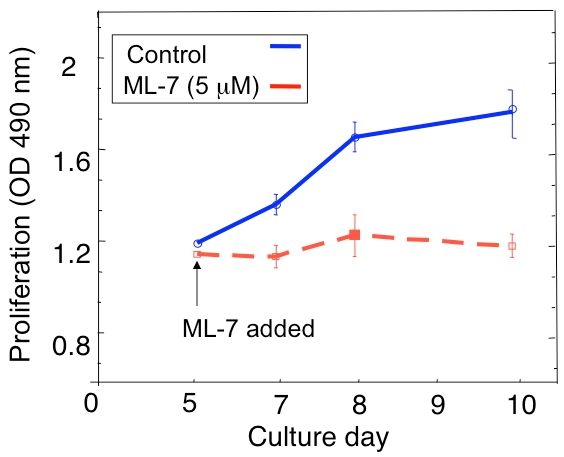
Figure 2. Prévenir l'interrupteur d'D2A1 cellules de dormance (quiescence) à la prolifération dans le système de culture en 3D par l'inhibition de kinase chaîne légère de myosine (MLCK). Évolution dans le temps des D2A1 prolifération cellulaire cultivée en 3-D BME Cultrex, n = 8 (moyenne ± SE). Les cellules ont été traitées (témoin), ou traités avec un inhibiteur spécifique de MLCK (ML-7, 5 uM) pendant 48 h sur commence 5 jours de culture. Figure modifiée à partir de Barkan et al 17.
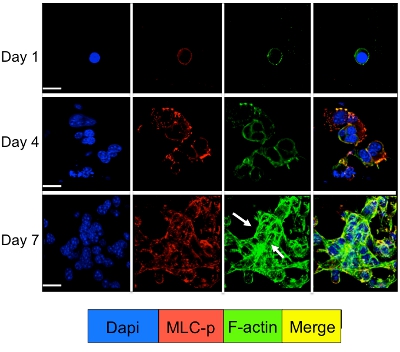
Figure 3. Phosphorylation chaîne légère de myosine suivi par F-actine au cours de réorganisation du commutateur d'D2A1 cellules de la dormance à la croissance proliférative. D2A1 cellules ont été cultivées en 3-D BME Cultrex le 8 lame de verre chambre. Les cellules ont été fixées et colorées avec du DAPI (bleu) pour la localisation nucléaire, phalloïdine (vert) pour le F-actine et avec un anticorps contre la forme phosphorylée de la chaîne légère de myosine (MLC-p) (rouge), comme indiqué à divers moments. Fusion de la F-actine, et MLC-p coloration (jaune). Expression du MLC-P a été augmenté au cours de la transition des cellules de la dormance D2A1 (jours1-4) à la croissance proliférative (jour 7) suivie de la formation de fibres d'actine stress (flèches). La microscopie confocale, grossissement x63. Blanc-bar est égal à 20 microns. Figure modifiée à partir de Barkan et al 17.
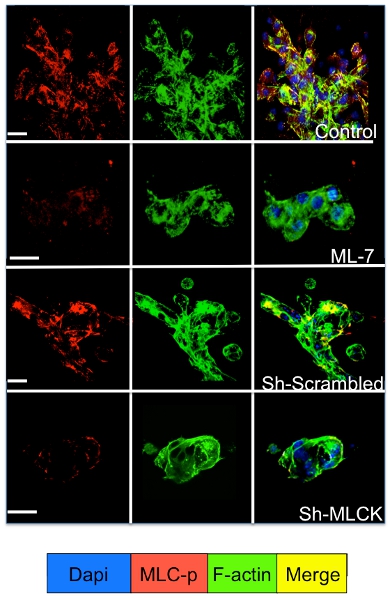
Figure 4. . Inhibition de kinase chaîne légère de myosine (MLCK) médiée F-actine formation des fibres de stress dans les cellules D2A1 D2A1 cellules ont été traitées (témoin), ou traités avec des inhibiteurs de MLCK (ML-7, 5 M), pour 48 h le jour de début de la culture 5, ou traités avec des œufs brouillés ou MLCK shRNA et colorées pour la forme phosphorylée de la chaîne légère de myosine (MLC-p) (rouge), F-actine (vert), et des noyaux (bleu). Fusion de la F-actine, et MLC-p coloration (jaune). La microscopie confocale, grossissement x63. Blanc-bar est égal à 20 microns.
Discussion
Les mécanismes sous-jacents qui maintiennent les cellules tumorales disséminées dans un état dormant ou le résultat de leur transition vers une croissance métastatique restent encore largement inconnus. Ce phénomène a été extrêmement difficile à étudier chez l'homme et de quelques 4,12 modèles précliniques ont été développées pour résoudre ce problème. Néanmoins, certains systèmes in vivo et ex vivo du modèle de dormance tumorale ont été caractérisées (examin?...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Cette recherche a été financée en partie par le Programme de recherche intra-muros de l'Institut national du cancer.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| DMEM glucose élevé | Invitrogen | 11965-118 | |
| DMEM faible taux de glucose | Invitrogen | 11885-092 | |
| Sérum fœtal bovin (FBS) | Invitrogen | 10091-148 | |
| Le facteur de croissance réduite en 3-D Extrait Cultrex membrane basale | Trevigen Inc | La concentration en protéines entre les 14-15mg/ml | |
| D2.0R et D2A1 lignées cellulaires | 5,19 | ||
| K7M2 et K7M2AS1.46 cellules | 20 | ||
| MCF-7 et MDA-MB-231 cellules de cancer du sein | ATCC | ||
| Un système de chambre de 8 lames de verre | (Lab-Tek, Thermo Scientific) | 177402 | |
| Cellule Titer 96 aqueux Une cellule Solution test de prolifération kit | Promega | G3580 | |
| Vectashield milieu de montage avec DAPI | Vector Laboratories Inc | H-1200 | |
| Normale du sérum d'âne | Jackson ImmunoResearch | 017-000-121 | |
| Lecteur de plaque ELISA | Bio-Tec | 490nm enregistrement | |
| Microscope confocal | Zeiss-LSM-510 | Grossissement x63 |
Références
- Aguirre-Ghiso, J. A. Models, mechanisms and clinical evidence for cancer dormancy. Nat Rev Cancer. 7, 834-846 (2007).
- Pantel, K., Woelfle, U. Micrometastasis in breast cancer and other solid tumors. J Biol Regul Homeost Agents. 18, 120-125 (2004).
- Naumov, G. N. Ineffectiveness of doxorubicin treatment on solitary dormant mammary carcinoma cells or late-developing metastases. Breast Cancer Res Treat. 82, 199-206 (2003).
- Klein, C. A. Framework models of tumor dormancy from patient-derived observations. Curr Opin Genet Dev. , (2010).
- Naumov, G. N. Persistence of solitary mammary carcinoma cells in a secondary site: a possible contributor to dormancy. Cancer Res. 62, 2162-2168 (2002).
- Townson, J. L., Chambers, A. F. Dormancy of solitary metastatic cells. Cell Cycle. 5, 1744-1750 (2006).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nat Rev Cancer. 2, 563-572 (2002).
- Pantel, K. Differential expression of proliferation-associated molecules in individual micrometastatic carcinoma cells. J Natl Cancer Inst. 85, 1419-1424 (1993).
- Demicheli, R. Tumour dormancy: findings and hypotheses from clinical research on breast cancer. Semin Cancer Biol. 11, 297-306 (2001).
- Braun, S. A pooled analysis of bone marrow micrometastasis in breast cancer. N Engl J Med. 353, 793-802 (2005).
- Pantel, K., Alix-Panabieres, C., Riethdorf, S. Cancer micrometastases. Nat Rev Clin Oncol. 6, 339-351 (2009).
- Goss, P. E., Chambers, A. F. Does tumour dormancy offer a therapeutic target. Nat Rev Cancer. 10, 871-877 (2010).
- Mendoza, A. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120, 2979-2988 (2010).
- Naumov, G. N. A model of human tumor dormancy: an angiogenic switch from the nonangiogenic phenotype. J Natl Cancer Inst. 98, 316-325 (2006).
- Barkan, D. Metastatic growth from dormant cells induced by a col-I-enriched fibrotic environment. Cancer Res. 70, 5706-5716 (2010).
- Barkan, D., Green, J. E., Chambers, A. F. Extracellular matrix: A gatekeeper in the transition from dormancy to metastatic growth. Eur J Cancer. , (2010).
- Barkan, D. Inhibition of metastatic outgrowth from single dormant tumor cells by targeting the cytoskeleton. Cancer Res. 68, 6241-6250 (2008).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30, 256-268 (2003).
- Morris, V. L. Mammary carcinoma cell lines of high and low metastatic potential differ not in extravasation but in subsequent migration and growth. Clin Exp Metastasis. 12, 357-367 (1994).
- Khanna, C. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 10, 182-186 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon