Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Tests biophysiques pour sonder les propriétés mécaniques du noyau cellulaire interphase: Application Strain Substrat et manipulation Microneedle
Dans cet article
Résumé
Nous présentons deux indépendantes, basées sur le microscope des outils pour mesurer les déformations induites nucléaire et du cytosquelette dans la seule, vivant des cellules adhérentes en réponse à l'application de déformation globale ou localisée. Ces techniques sont utilisées pour déterminer la rigidité nucléaire (ie, déformabilité) et de transmission de la force de sonde intracellulaire entre le noyau et le cytosquelette.
Résumé
Dans la plupart des cellules eucaryotes, le noyau est le plus grand organite et est généralement de 2 à 10 fois plus rigide que le cytosquelette entourant, par conséquent, les propriétés physiques du noyau contribuer de manière significative au comportement global biomécanique de cellules dans des conditions physiologiques et pathologiques. Par exemple, dans la migration des neutrophiles et des cellules de cancer envahissant, de la raideur nucléaire peut constituer un obstacle majeur au cours d'extravasation ou de passage dans des espaces étroits au sein des tissus. 1 D'autre part, le noyau des cellules dans les tissus mécaniquement actives comme les muscles nécessite suffisamment de soutien structurel à résister aux contraintes mécaniques répétitives. Fait important, le noyau est étroitement intégré dans l'architecture cellulaire, il est physiquement connecté au cytosquelette environnante, qui est une exigence essentielle pour le mouvement intracellulaire et le positionnement du noyau, par exemple, dans les cellules polarisées, les noyaux synaptiques au niveau des jonctions neuromusculaires, ou dans les cellules en migration. 2 Sans surprise, les mutations dans les protéines de l'enveloppe nucléaire tels que les lamines et nesprins, qui jouent un rôle crucial dans la détermination de la raideur nucléaire et nucléo-cytosquelette d'accouplement, il a été démontré récemment pour donner lieu à un certain nombre de maladies humaines, y compris d'Emery- Dreifuss dystrophie musculaire, myopathie des ceintures dystrophie musculaire et une cardiomyopathie dilatée. 3 Pour étudier la fonction des divers biophysique des protéines de l'enveloppe nucléaire et l'effet de mutations spécifiques, nous avons développé des méthodes expérimentales pour étudier les propriétés physiques du noyau en version simple, les cellules vivantes soumis à des perturbations mécaniques globales ou localisées. Mesure des déformations induites nucléaire en réponse à la demande substrat souche justement appliquée fournissent des informations importantes sur la déformabilité du noyau et permet une comparaison quantitative entre les différentes mutations ou des lignées cellulaires déficientes pour les protéines spécifiques de l'enveloppe nucléaire. Localisé application de souche du cytosquelette avec une micro-aiguille est utilisée pour compléter ce test et peuvent fournir des informations additionnelles sur la transmission intracellulaire vigueur entre le noyau et le cytosquelette. Etudier la mécanique nucléaire dans les cellules vivantes intactes préserve l'architecture normale intracellulaire et évite les artefacts potentiels qui peuvent survenir lorsque vous travaillez avec des noyaux isolés. Par ailleurs, l'application de contrainte substrat présente un bon modèle pour le stress physiologique expérimentés par des cellules dans les tissus musculaires ou autres (par exemple, cellules musculaires lisses vasculaires exposés à la souche du navire). Enfin, alors que ces outils ont été développés principalement pour étudier la mécanique nucléaire, ils peuvent également être appliquées pour étudier la fonction des protéines du cytosquelette et de signalisation mécanotransduction.
Protocole
1. L'application de contrainte Substrat
La mesure de la déformation nucléaire normalisée inclut la préparation de plats souche avec transparence, membranes en silicone élastique que la surface de culture de cellules, cellules plaquage sur la vaisselle, et d'acquérir des images des cellules, avant, pendant et après l'application de contrainte (uniaxial ou biaxial).
Préparation de plats membrane en silicone et l'adhérence des cellules
- Chaque plat souche se compose d'un sur-mesure récipient de plastique sans fond avec un diamètre de 3 "et un joint torique en plastique pour tenir une membrane de silicone, qui sert de substrat de culture cellulaire. Pour la préparation des plats souche, pince de 4" x 4 "morceau de membrane de silicone entre le joint torique et le plat. découpez soigneusement la membrane excès, rincer à l'eau déminéralisée, et autoclaver les plats souche.
- Marquer un point de référence dans le centre du fond de la membrane (à l'extérieur) avant le revêtement des membranes en silicone avec des molécules de la matrice extracellulaire (par exemple, la fibronectine). Ce point de repère aideront à identifier les mêmes cellules souches pendant les expériences. (Facultatif: Pour l'application de contrainte uniaxiale, deux bandes parallèles de scotch sont appliquées à travers le point de référence pour limiter la déformation de la membrane dans une seule dimension.)
- Pour assurer une fixation optimale des cellules, le manteau des membranes en silicone avec 3 pg / ml de fibronectine dilué dans 10 ml de PBS ou de toute protéines appropriées de la matrice extracellulaire. Couvrir le plat souche avec un plat en polystyrène de 10cm inversé, et incuber les plats pendant la nuit à 4 ° C.
- Le lendemain, rincez les membranes une fois avec tampon phosphate salin (PBS) pour éliminer un excès de protéines. Remplissez plat avec 10ml de milieu de croissance (Dulbecco Modified Eagles Medium (glycémie élevée) complété avec 10% de sérum de veau fœtal et 1% de pénicilline / streptomycine) et mis de côté.
- Fibroblastes embryonnaires de souris sont trypsinisées avec 0,05% de trypsine et ensemencées dans un milieu de croissance à environ 30% de confluence sur le plat de la membrane enduite de silicone et incuber pendant 24 - 48 heures dans des conditions de culture normale.
Expériences souche Substrat
- Mise en place du microscope pour des expériences. Les expériences sont réalisées sur un microscope inversé avec un appareil photo numérique adapté à la microscopie par fluorescence, contraste de phase ou DIC, en utilisant un objectif 60x et appropriée du logiciel d'acquisition d'image (par exemple, ou IPLab Metamorph). Un microscope droit n'est pas adapté à cette application. Le dispositif de déformation consiste en une plaque de base qui s'adapte sur la platine du microscope et titulaire d'un plateau cylindrique central qui sert à appliquer de contrainte à la section centrale de la membrane de silicone, une plaque mobile qui tient le plat souche et qui peut glisser de haut en bas sur le quatre broches orientation, ainsi que d'une plaque de poids de 5 lb à appliquer une charge.
- Afin de visualiser les noyaux, incuber les cellules souche dans le plat avec 1 ug / ml de Hoechst 33342 pendant 15 min à 37 ° C. Aspirer le moyen et le remplacer par 15 ml de phénol-rouge moyen de croissance libre (phénol-rouges sans modifié par Dulbecco Eagles Medium (glycémie élevée) avec 25 mM Hepes, complété avec 10% de sérum de veau fœtal et 1% de pénicilline / streptomycine). Vis le plat de contrainte dans la plaque de support plat. Soigneusement appliquer de la graisse (graisse Braycote vide 804) sur le périmètre de la partie inférieure de la membrane de silicone pour assurer glisse de la membrane le long de la centrale d'exposition. Veillez à garder la section centrale de la membrane claire.
- Placer la plaque de base sur la platine du microscope. Plaque de montage support plat soigneusement sur la plaque de base. Assurez-vous que dans la position initiale de repos, la membrane en silicone de l'antenne de contrainte repose en gros sur le plateau central.
- Premièrement, se concentrer sur le fond de la membrane de silicone et de trouver le point de référence central noir. Le point sera le point de départ pour toutes les acquisitions d'images et d'aides à localiser les mêmes cellules, pendant et après étirement. Nous utilisons un programme personnalisé écrit imagerie automatisée pour stocker les positions des cellules et de déplacer ces cellules pendant l'expérience, mais cela peut également être réalisé manuellement.
- A partir de la dot, régler la netteté de visualiser les cellules et le haut de la membrane de silicone. Repérez bien étalées cellules avec des noyaux central et d'acquérir un contraste de phase et une image de fluorescence de la centrale nucléaire Hoechst tache. L'image en contraste de phase devrait se concentrer sur les grandes lignes de cellules et la membrane de silicone, tandis que les images de fluorescence devrait se concentrer sur le plan central du noyau.
- Après l'acquisition des images de 5 à 15 cellules, revenir vers le point central. Appliquer lentement le poids à l'antenne de contrainte, ce qui entraîne l'application uniforme de contrainte au centre du plat. La souche substrat maximale appliquée est limitée par des entretoises en nylon placé sur les broches d'alignement vertical (broches de guidage).
- Focus sur le fond de la membrane de silicone et de localiser le point de référence de nouveau. A partir de ladot, relocaliser les mêmes cellules et encore acquérir un contraste de phase et une image de fluorescence des cellules et des noyaux à l'épreuve complète, en essayant de correspondre de près les plans focaux des images initiales. Ce processus ne doit pas dépasser 10 minutes pour éviter de remodelage actif et l'adaptation de la cellule au substrat tendues.
- Après toutes les images correspondantes ont été acquises, de déplacer la platine du microscope retour au point de départ. Retirer délicatement le poids de la plaque de support plat et permettent la membrane en silicone pour se détendre. Si nécessaire, poussez doucement le plat jusqu'à souche jusqu'à ce qu'il soit dans la position initiale. Puis d'acquérir des images à contraste de phase et de fluorescence des cellules de post-contrainte comme décrit ci-dessus pour les images souche.
Analyse
- Images des cellules et des noyaux marqués par fluorescence, avant, pendant et après l'application de contrainte sont analysés afin de calculer la contrainte normalisée nucléaire. Dans notre laboratoire, nous utilisons un script personnalisé écrit MATLAB pour l'analyse, mais plusieurs options alternatives sont disponibles. L'analyse est effectuée en trois étapes.
- Tout d'abord, pour calculer la souche substrat appliqué, les positions de 3 à 6 points de contrôle situés sur la membrane sont manuellement compensée entre les correspondants de pré-plein, et de post-contrainte des images. Le programme MATLAB calcule ensuite la souche membrane appliquée en comparant les positions de l'appariement des points de contrôle entre les images de pré-contrainte et plein de souche et aussi la contrainte résiduelle entre la souche de pré-et post-images souche. Dans le même temps, les points de contrôle sont utilisés pour enregistrer les paires d'images, ce qui aidera à détecter des cellules endommagées ou détacher (voir Figure 1).
- Dans une deuxième étape, les noyaux sont sélectionnés manuellement en utilisant un programme distinct de MATLAB qui calcule souche nucléaires pour chaque noyau individuel en adaptant la taille soit nucléaire ou marqueurs intranucléaires entre les correspondants de pré-plein, et de post-contrainte des images fluorescentes. Pour tenir compte de petites variations dans la souche membrane appliquée entre les différentes expériences, nous exprimons les résultats que la souche nucléaire normalisé, défini comme le rapport de la déformation nucléaires induites à la souche membrane appliquée qui est calculé pour chaque noyau. Les scripts MATLAB sont disponibles auprès du laboratoire Lammerding sur demande.
- Enfin, chaque noyau est validée, à l'exclusion des mesures à partir des cellules qui se détachent ou être endommagé lors de l'application de contrainte (figure 1).
2. Dosage de la manipulation Microneedle
Préparation des plats, des cellules adhérentes, et micro-aiguilles
- Incuber 35 mm de verre plats en bas de culture cellulaire avec une faible concentration de fibronectine (0.5ug/ml) à la Saline de Hank saline tamponnée (HBSS) ou toutes les protéines de la matrice extracellulaire adaptés pendant 2 heures à 37 ° C. Lavez la vaisselle avec HBSS deux fois et ajouter 2 ml de milieu de croissance pour le plat avant de passer à l'étape suivante.
- Fibroblastes embryonnaires de souris sont trypsinisées avec 0,05% de trypsine et ensemencées dans 2 ml milieu de croissance ensemencées à 7,5 x 10 4 cellules / ml sur la vaisselle fibronectine revêtement à fond de verre. Remettre les cellules dans un incubateur pendant la nuit. Remettre les cellules dans un incubateur pendant la nuit. Il faut optimiser le nombre de cellules pour obtenir seule, adhérent, non confluentes cellules pour d'autres types cellulaires.
- Tirez sur le micro-aiguilles, fait de borosilicate capillaires, à la pointe des diamètres de environ 1 à 3 microns avec un extracteur commerciales pipette (par exemple, Sutter Instrument Company).
Expérience de manipulation Microneedle
- Le lendemain, incuber les cellules avec Mitotracker mitochondriale tache (600 uM; Invitrogen) et Hoechst 33342 colorant nucléaire (1 pg / ml) ajouté à un milieu de croissance pendant 30 minutes dans un incubateur à 37 ° C.
- Laver les cellules une fois dans HBSS pendant 5 minutes à température ambiante, puis ajouter le phénol-rouge moyen de croissance libre aux cellules pour l'imagerie.
- Acquérir une image de la cellule unique sans la micro-aiguille insérée dans le cytosquelette en contraste de phase, une image fluorescente du Hoechst 33342 images colorant fluorescent et un des mitochondries tache, avec un objectif 60x (0,70 NA, Plan-Achromat) sur une inversée microscope avec une caméra charge-coupled device numérique.
- L'utilisation d'un micromanipulateur (par exemple, InjectMan NI 2, Eppendorf), insérer délicatement la micro-aiguille dans le cytoplasme d'une cellule à une distance fixe (typiquement 5 um) loin de la périphérie du noyau et de prendre une image à contraste de phase, une image fluorescente du Hoechst 33342 tache et une image de fluorescence de la tache mitochondriale. Pour cette application, il permet de contrôler le micromanipulateur par un ordinateur, par exemple, Windows HyperTerminal, pour parvenir à des procédures de micromanipulation cohérente.
- Déplacer le micro-aiguille, une distance spécifique (généralement 10 ou 20 mm) vers la périphérie de la cellule à 1 um / s tout en recueillir des images à contraste de phase et de fluorescence de chaque 10secondes. Comme la micro-aiguille est en mouvement à une distance spécifique vers la périphérie cellulaire. Avec les paramètres choisis, comme la micro-aiguille est en mouvement à une distance spécifique vers la périphérie de la cellule, cela correspondra à 2-3 cadres pendant le processus de manipulation.
- Enfin l'acquisition d'images supplémentaires après la micro-aiguille est retirée de la cytosquelette.
Analyse
- Cartes de déplacement sont calculés en utilisant un script personnalisé écrit MATLAB basée sur le suivi des caractéristiques marquées par fluorescence du noyau et le cytoplasme. (Le script MATLAB est disponible à partir du laboratoire de Lammerding sur demande). Le programme utilise une corrélation croisée normalisée algorithme entre les régions petite image (environ 10 um x 10 um en taille et espacés de 5 um d'intervalle) dans les trames d'image ultérieures. Pour chaque centre de la région, le déplacement dans les directions x et y. directions sont calculés comme le décalage entre l'emplacement d'origine et le poste nouvellement identifiées et affichées comme un vecteur de déplacement et également stockées sous forme de valeurs numériques. A partir des cartes de déplacement, les déplacements en moyenne dans les régions prédéfinies peuvent être calculés. Notez que les déplacements du cytosquelette sont basées sur le canal de fluorescence des marqueurs du cytosquelette (par exemple, Mitotracker mitochondriale tache), tandis que les déplacements nucléaires sont calculées à partir du canal de fluorescence correspondant au signal de Hoechst 33342. Pour notre application, nous avons l'habitude d'examiner les régions suivantes: (i) la souche du cytosquelette au site d'application de contrainte, à savoir le site d'insertion microaiguille, (ii) la souche nucléaire dans une région à l'intérieur du noyau vers le site d'application de contrainte, (iii) nucléaire contrainte dans une région nucléaire en dehors du site d'application, et (iv) la souche du cytosquelette dans une région cytoplasmique à travers le noyau. En outre, on peut aussi mesurer directement l'élongation nucléaire de contraste de phase ou Hoechst 33342 séquences d'images de fluorescence. Dans ce cas, appliquée souche nucléaire est calculé en divisant l'allongement nucléaire (DL = L - L 0) par la longueur initiale L 0, où L est la longueur finale du noyau à la fin de l'application de contrainte et L 0 est le longueur initiale du noyau. Pour les cellules intactes avec une nucléo-cytosquelette d'accouplement, le noyau sera allongé vers le site d'application de contrainte. En revanche, dans les cellules où nucléo-cytosquelette couplage est perturbé, c'est à dire, les forces sont transmises de manière moins efficace entre le cytosquelette et le noyau, le noyau est prévu d'allonger significativement moins dans la direction du site d'application de contrainte. Ainsi, une diminution des déformations nucléaires en réponse à la demande du cytosquelette contrainte implique un découplage (partiel) entre le noyau et du cytosquelette.
3. Les résultats représentatifs:
L'application de contrainte Substrat
Nous avons acquis des images avant, pendant et après l'application de contrainte à des fibroblastes embryonnaires de souris à partir hétérozygotes et homozygotes lamine A / C-déficiente (LMNA + / - et LMNA - / -) et de type sauvage (LMNA + / +) les souris et ultérieurement calculé la souche normalisée nucléaires pour chaque cellule. Après analyse, les noyaux sont validées et que les cellules sont endommagées ou rétracter lors de l'application de contrainte sont exclues de l'analyse. La figure 1A montre des noyaux de trois cellules qui sont valables, alors que la figure 1B représente les cellules qui devraient être exclus de l'analyse. Normalisé des données souche nucléaires sont mises en commun par au moins trois expériences indépendantes (chacune contenant des mesures à partir des noyaux ~ 5-10) et comparée avec une autre cellule ou de groupes de traitement par l'analyse statistique. Augmentation de souche normalisée nucléaire indique la rigidité réduite nucléaire, comme on le voit dans les cellules avec une expression réduite des protéines de l'enveloppe nucléaire lamine A / C (figure 2).
Dosage de la manipulation Microneedle
Pour le dosage de la manipulation microaiguille, nous imagé déplacements nucléaire et du cytosquelette lors de l'application déformation localisée du cytosquelette. Les cellules qui sont endommagés ou détachés sont exclus de l'analyse. Pour l'analyse, nous mesurons l'ampleur des mouvements nucléaires et du cytosquelette vers le site d'application des forces simples, des cellules adhérentes. Par exemple, dans la figure 3, nous suivons mitochondrial (marqueur pour le cytosquelette) déplacements avant et après déformation du cytosquelette et puis tracer les déplacements en tant que vecteurs. Chaque vecteur représente le déplacement calculé comme le décalage entre l'emplacement d'origine et le poste nouvellement identifiés. Les régions à faible intensité de l'image ou la texture insuffisante (par exemple, les régions en dehors de la cellule) sont exclus de l'analyse. Les déplacements du cytosquelette et nucléaires sont ensuite quantifiés dans certains secteurs à des distances croissantes du site d'application de contrainte (figure 4, les zones correspondant à la couleur boxes dans l'encadré). Dans les fibroblastes embryonnaires de souris avec des intacte nucléo-cytosquelette d'accouplement, les forces sont transmises par les cellules entières, ce qui entraîne des déformations induites nucléaire et du cytosquelette qui lentement dissiper loin du site d'application de contrainte (figure 4). En revanche, les fibroblastes avec perturbée nucléo-cytosquelette d'accouplement (ou modifié l'organisation du cytosquelette) l'affichage des déplacements localisés près du site d'application, comme le montre la figure 4 et que peu de déformations induites plus loin. Comparables d'application de contrainte du cytosquelette au site d'insertion microaiguille (boîte orange) est observée pour les deux fibroblastes de contrôle (mCherry seul) et les fibroblastes avec une perturbation du cytosquelette nucléo-raccord (DN KASH). Toutefois, induit des déplacements nucléaire et du cytosquelette (bleu, jaune, et les boîtes rouges) à d'autres régions ont été significativement plus faible dans les fibroblastes avec perturbé nucléo-cytosquelette d'accouplement (DN KASH) que dans les cellules de contrôle (mCherry seule) (figure 4). Ainsi, la diminution des déplacements du cytosquelette et nucléaires en dehors du site d'application souche, indique que la transmission vigueur entre le cytosquelette et le noyau a été perturbé.
Surtout, nous avons également validé que les mitochondries sont adaptés marqueur du cytosquelette, en effectuant des manipulations micro-aiguille sur les fibroblastes embryonnaires de souris transfectées avec GFP ou mCherry actine et GFP-vimentine et marqué par fluorescence avec Mitotracker vert ou rouge. Cartes de déplacement du cytosquelette ont été calculés de façon indépendante à partir du signal de fluorescence de la mitochondrie et le cytosquelette d'actine ou de la vimentine. Le déplacement absolue moyenne a été calculée pour quatre régions du cytosquelette à des distances croissantes loin du site d'application de contrainte. Les valeurs de pente et de R-carré ont été calculés à partir de la régression linéaire entre les mesures obtenues à partir des mitochondries et de l'actine ou la vimentine, respectivement. Pour l'actine, la pente était de 0,99 et la valeur R2 de 0,986; pour la vimentine, la pente est de 1,04 et la valeur R2 était 0,971, confirmant que les déplacements mitochondriale servir d'indicateurs fiables pour les déformations du cytosquelette.
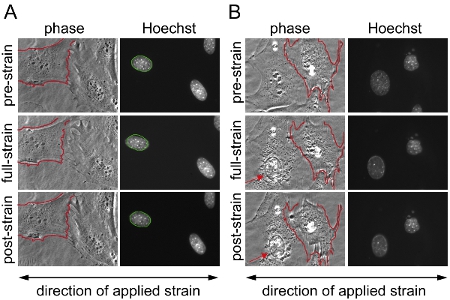
Figure 1. L'application de contrainte sur le substrat fibroblastes embryonnaires de souris (MEF). Fibroblastes embryonnaires de souris réparties sur deux zones distinctes sur la membrane de silicium ont été imagées avec un contraste de phase et la microscopie par fluorescence, avant, pendant et après l'application de la déformation uniaxiale de 20%. (A) Exemple d'une expérience réussie avec des noyaux provenant de cellules valables qui ont survécu à l'application de contrainte sans aucun dommage ou de détachement et de (B) par exemple des cellules qui se rétractent / partiellement détachée lors de l'application de contrainte; des résultats à partir des cellules représentées en (B) sont exclus de l'analyse. En (B), la cellule sur le côté gauche montre des signes de dommages nucléaires du cytosquelette et de l'effondrement (flèche), tandis que la cellule sur le côté droit se détache partiellement et se rétracte lors de l'application de contrainte. Cela peut être une indication de l'application de contrainte excessive. Pour une meilleure comparaison, dans (A) et (B) à la frontière de l'une des membranes cellulaires non étirée est souligné en rouge et superposés sur la même cellule pendant et après l'application de contrainte. Dans (A) de la frontière du noyau étiré est décrite dans le vert et superposées sur le même noyau, pendant et après l'application de contrainte.
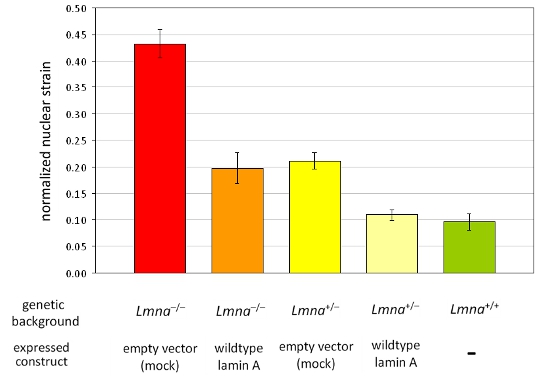
Figure 2. Analyse de la déformation nucléaire normalisée dans un panel de différentes lignées de cellules MEF MEF de l'LMNA -. / - Et LMNA + / - fond génétique ectopique exprimant soit un vecteur vide ou de type sauvage lamine A ont été analysés. En comparaison à partir de MEFs sœurs de type sauvage (LMNA + / +), la perte de la lamine A résultats / expression C de la rigidité nucléaire a diminué qui peut être entièrement restauré par la réintroduction de type sauvage lamine A. Notamment, réduit la raideur nucléaire se traduit par augmentation des valeurs de déformation nucléaire normalisée. Les barres d'erreur représentent les erreurs standard.

Figure 3. Dosage de la manipulation Microneedle pour mesurer la transmission intracellulaire vigueur. Contraste de phase (A, B) et de fluorescence (C, D) des images d'un fibroblaste étiquetés avec colorant nucléaire (bleu) et mitochondrial Mitotracker tache (en vert). Un micro-aiguille a été insérée dans le cytosquelette à une distance définie par le noyau (A et C) et ensuite déplacé vers la périphérie de la cellule (B, D). Déplacements du cytosquelette et nucléaires ont été quantifiées par le noyau marqué par fluorescence de suivi et les mitochondries en utilisant une mesure écrite algorithme de corrélation croisée. Plan de déplacement (E) de la finale du cytosquelette (vert) déformations calculées à partir de séries d'images de fluorescence; longueur de flèche est magnifié par 2x pour une meilleure visibilité. Barres d'échelle, 10 um.
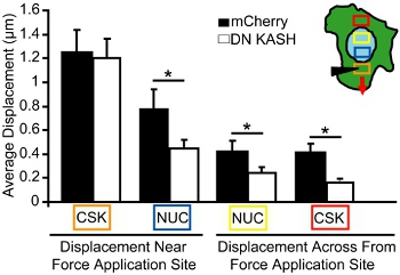
Figure 4. Analyse de la transmission intracellulaire vigueur lors de la manipulation microaiguille. Induite déplacements du cytosquelette et nucléaires lors de la manipulation microaiguilles, mesurée dans les domaines correspondant aux cases colorées (en médaillon en A). La boîte orange est le site d'application de contrainte. Malgré l'application souche semblable dans le cytosquelette (boîte orange), induit des déplacements nucléaire et du cytosquelette (bleu, jaune, et les cases rouges) ont été significativement plus faible dans les fibroblastes embryonnaires de souris qu'avec un perturbé nucléo-cytosquelette d'accouplement (DN KASH) par rapport au contrôle ( mCherry seul) des cellules.
Discussion
Dosage de souche Substrat
L'application souche a été utilisée avec succès par nous et d'autres groupes pour étudier les déformations induites nucléaire dans des cellules soumises à des contraintes mécaniques et à enquêter sur la contribution des protéines spécifiques de l'enveloppe nucléaire à la rigidité nucléaires. 4-8 L'avantage de cette technique est qu'elle sondes propriétés mécaniques noyaux de vie dans leur environnement cellulaire et du...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été soutenu par le National Institutes of Health (R01 et R01 HL082792 NS059348) et le Brigham and Women Award de l'Hôpital de cardiologie Leadership Group.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de réactif | Société | Numéro de catalogue | |
| La fibronectine | Millipore | FC010 | |
| Mitotracker Rouge FM et FM Vert | Invitrogen | M22425 et M-7514 | |
| Hoechst 33342 | Invitrogen | H3570 | |
| Hank Saline saline tamponnée | Invitrogen | 14185 | |
| Phénol libre, DMEM | Invitrogen | 21063 | |
| Sérum fœtal bovin | Aleken Biologicals | FBSS500 | |
| Pénicilline / streptomycine | Sigma | P0781-100ML | |
| Verre borosilicate avec filament | Instrument Sutter | BF100-78-10 | |
| Gloss / Brillant feuilles de silicone non renforcé, 0,005 " | Spécialité Manufacturing Inc | ||
| Phosphate de Dulbecco saline tamponnée | Invitrogen | 14200 | |
| 35 mm plats en verre à fond la culture (FluoroDish) | World Precision Instruments, Inc | FD35-100 | |
| Graisser Braycote vide 804 | Fournitures Spi | 05133A-AB |
Références
- Friedl, P., Wolf, K., Lammerding, J. Nuclear mechanics during cell migration. Curr Opin Cell Biol. 23, 55-64 (2011).
- Mejat, A., Misteli, T. LINC complexes in health and disease. Nucleus. 1, 40-52 (2010).
- Worman, H. J., Fong, L. G., Muchir, A., Young, S. G. Laminopathies and the long strange trip from basic cell biology to therapy. J Clin Invest. 119, 1825-1836 (2009).
- Caille, N., Tardy, Y., Meister, J. J. Assessment of strain field in endothelial cells subjected to uniaxial deformation of their substrate. Ann Biomed Eng. 26, 409-416 (1998).
- Lammerding, J. Lamins A and C but not lamin B1 regulate nuclear mechanics. J Biol Chem. 281, 25768-25780 (2006).
- Lammerding, J. Abnormal nuclear shape and impaired mechanotransduction in emerin-deficient cells. J Cell Biol. 170, 781-791 (2005).
- Lammerding, J. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Verstraeten, V. L., Ji, J. Y., Cummings, K. S., Lee, R. T., Lammerding, J. Increased mechanosensitivity and nuclear stiffness in Hutchinson-Gilford progeria cells: effects of farnesyltransferase inhibitors. Aging Cell. 7, 383-393 (2008).
- Brooks, S. V., Zerba, E., Faulkner, J. A. Injury to muscle fibres after single stretches of passive and maximally stimulated muscles in mice. J Physiol. 488, 459-469 (1995).
- Maniotis, A. J., Chen, C. S., Ingber, D. E. Demonstration of mechanical connections between integrins, cytoskeletal filaments, and nucleoplasm that stabilize nuclear structure. Proc Natl Acad Sci. 94, 849-854 (1997).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon