Method Article
Microarrays polymères pour la découverte à haut débit des biomatériaux
Dans cet article
Résumé
Une description de la formation d'un micro-réseau de polymère en utilisant une technique de photopolymérisation sur la puce. La caractérisation à haut débit de surface en utilisant la microscopie à force atomique, des mesures de contact avec l'eau d'angle, rayons X et spectroscopie de photoélectrons temps de vol des ions secondaires spectrométrie de masse et un dosage de la fixation des cellules est également décrit.
Résumé
De mélange est une opération unitaire qui combine deux ou plusieurs composants en un mélange homogène. Ce travail consiste à mélanger deux liquides visqueux flux à l'aide d'un mélangeur statique en ligne. Le mélangeur est un dispositif split-and-recombinent qui emploie un écoulement de cisaillement et d'extension pour augmenter le contact interfacial entre les composants. Un prototype split-et-recombinent (SAR) mélangeur a été construit en alignant une série de minces découpés au laser en poly (méthacrylate de méthyle) (PMMA) plaques maintenu en place dans un tuyau en PVC. Mélange dans ce dispositif est illustré sur la photographie de la figure. 1. Le colorant rouge est ajouté à une partie du fluide d'essai et utilisé en tant que composant mineur étant mélangés dans la majeure (non teint) composant. À l'entrée du mélangeur, la couche de fluide injecté traceur est divisée en deux couches à mesure qu'il s'écoule à travers la section de mélange. Sur chaque section de mélange ultérieur, le nombre de couches horizontales est dupliqué. En fin de compte, le seul flux de colorant est dispersé uniformément throughout la section transversale du dispositif.
À l'aide d'un fluide non-newtonien de test de Carbopol 0,2% et un fluide traceur dopée de composition semblable, dans l'unité de mélange est visualisé en utilisant l'imagerie par résonance magnétique (IRM). L'IRM est une sonde très puissant expérimentale de chimie moléculaire et de l'environnement physique ainsi que la structure de l'échantillon sur les échelles de longueur de quelques microns à quelques centimètres. Cette sensibilité a donné lieu à une large application de ces techniques pour caractériser les propriétés physiques, chimiques et / ou biologiques des matériaux allant de l'homme à des aliments à des milieux poreux 1, 2. L'équipement et les conditions utilisées ici sont adaptés pour des liquides contenant des quantités substantielles d'imagerie de RMN 1 H mobiles tels que l'eau ordinaire et des liquides organiques, y compris les huiles. Traditionnellement IRM a utilisé des super aimants supraconducteurs qui ne sont pas adapté aux environnements industriels et non transférables au sein d'un laboratoire (Fig. 2). Les progrès récents in aimant la technologie ont permis la construction de grands volumes aimants industriellement compatibles appropriés pour le déroulement des processus d'imagerie. Ici, l'IRM permet concentrations de composants spatialement résolues à différents emplacements axiaux pendant le processus de mélange. Ce document de travail en temps réel le mélange des fluides très visqueux par distributive mélange avec une demande de produits de soins personnels.
Protocole
1. Préparation de faible encrassement de fond
- Peser 2 g de poly (méthacrylate d'hydroxyéthyle) (pHEMA) (Sigma - culture de cellules testées) dans un tube à centrifugation de 50 ml. Dissoudre dans 50 ml de 95% (v / v) d'éthanol dans l'eau. Cela prend généralement 24 heures de sonication.
- Dip-couche à fonction époxy lame de verre (Genetix) avec la solution de pHEMA. Les groupes époxy va rapidement former des liaisons covalentes avec le revêtement pHEMA. Trempage est réalisé en maintenant la lame de verre avec une pince et tremper la lame dans la solution. Typiquement 5 mm de la lame est laissée non revêtue, qui est utile pour orienter la lame et peut aussi agir comme un contrôle positif en tant que surface d'adhérence. La lame est ensuite retirée de la solution pHEMA sur une période de 1 s, renversé et mis à sécher dans une position presque horizontale pendant 10 min avant de passer à un support.
- Les diapositives pHEMA enrobés sont ensuite laissés dans des conditions atmosphériques pendant 1 semaine pour permettre l'évaporation complète de til solvant.
2. Préparation d'une solution de monomère
- Peser 120 mg du photoamorceur 2,2-diméthoxy-2-phénylacétophénone et ajouter à 3 ml de diméthylformamide (DMF) à préparer une solution photoinitiateur 4% (p / v). Le mieux est fraîche avant chaque tirage, de sorte que la masse et le volume de la solution faite peut varier en fonction de la quantité de solution photo-initiateur est nécessaire. La solution est stable jusqu'à un mois.
- Solutions de monomères sont effectuées par addition de 1 partie de la solution de photoinitiateur 3 parties du monomère pur. Ce résultat est obtenu par pipetage 5 pi de solution de photo-initiateur et 15 pl de monomère dans une plaque de 384 sources bien. Un volume total de 20 ul est idéal pour la formation de taches. La hausse des volumes désirez plus de buvard avant taches uniformes peuvent être produites. De plus petits volumes peuvent entraîner chargement incomplet de la broche.
- Cette méthode est limitée à l'utilisation d'acrylate / méthacrylate de monomères qui sont solubles dans le DMF en virtue de celles-ci étant les seules combinaisons qui ont été explorées; acrylamides et autres solvants sont susceptibles de se prêter à l'impression. Pour atteindre la concentration du monomère proposé (75% p / p) de monomères liquides sont également nécessaires, mais des concentrations plus faibles de monomère peut être utilisé pour les monomères solides (la concentration du monomère réduit ne semble pas altérer les chimie de surface du polymère résultant Cependant, il est probable que la température de transition vitreuse et le poids moléculaire est modifiée). Monomères hautement volatils sont également difficiles à utiliser en raison de l'évaporation rapide de monomère avant l'étape de durcissement UV lorsque la polymérisation. En fonction du nombre de solutions de monomères une course peut durer aussi longtemps que 6 heures et à la fin des monomères terme volatiles sont évaporés à partir de la plaque de source. L'utilisation de monomères volatils peut être réalisée par refroidissement de la phase d'impression et en utilisant seulement petits tirages.
- À l'exception de quelques monomères hautement hydrophilestels que le poly (éthylène glycol), l'acrylate de la dissolution des points de polymère résultantes dans des tampons aqueux n'a pas été observé, par conséquent, l'utilisation d'un monomère de réticulation n'est pas requis, mais n'est pas exclue.
3. Polymère microarray formation
La procédure typique pour un polymère microarray formation est représenté schématiquement sur la figure 1.
- Formation puces à ADN est obtenu en utilisant un robot de contact (Biodot) à l'aide d'une platine XYZ (Figure 2). Broches fendues de 220 um de diamètre sont utilisés (ARRAYIT 96B). Toutes les broches doivent être nettoyés par ultrasons dans du dichlorométhane pendant 10 minutes avant le tirage et même le porte-broches doivent aussi être nettoyés.
- Les repères sont chargées dans le support, le séchage et lames de matrice sont chargés, puis toute la chambre est remplie d'argon pour réduire la teneur en oxygène en dessous de 2000 ppm, qui est suffisamment basse pour éviter la trempe des radicaux de polymérisation par l'oxygène. L'humidité est maintenue end situe entre 30-40%. Y compris l'humidité permet de pHEMA permettant de gonfler le polymère formé à s'interpénétrer la couche pHEMA et devenir physiquement piégé à la surface 2.
- Le tirage est commencé. Chaque cycle se compose de:
- Chargement de l'échantillon de plaque de source. Les broches sont descendus dans les solutions à une vitesse de 25 mm / s, qui s'est tenue dans la solution pendant 2,5 s puis retirée à une vitesse de 25 mm / s (figure 2).
- Les repères doivent être effacés avant l'impression pour éliminer la solution de monomère à partir de l'extérieur de la broche. Par la suite de livraison monomère se produit à partir de la partie de la broche de piquants de réaliser la formation de points uniforme. La séquence buvard utilisé se compose de 33 contacts avec une lame de verre propre. Pour les quatre premières positions du nombre de contacts est de 10, 5, 4 et 3 respectivement. Les quatre prochaines positions 2 contacts sont établis et dans les 3 dernières positions 1 contact est établi. Temps de contact total pour chaque contact est de 10 ms et une approche et une vitesse de retrait est de 175mm / s. En ce moment, les taches formées doivent avoir une forme cohérente et géométrie. Un échec à ce stade indique broches impurs ou de contaminants dans la poussière des solutions de monomères.
- Les solutions de monomères sont ensuite imprimés sur les lames de verre recouvertes pHEMA (figure 2). Un contact est établi par spot à un mouvement de broche 175 mm / s et le temps de contact de 10 ms, ce qui en fonction de la viscosité et de tension superficielle de la solution de monomère donne un diamètre de spot moyenne de 400 um. Généralement de 3 tableaux répétés sont imprimées sur chaque lame de verre et un total de 10 diapositives sont imprimés sur un seul passage. Cela équivaut à 30 points par cycle.
- Les broches sont lavées dans du DMF. 2,5 L de DMF fraîche est prévu pour l'exécution de lavage. Pins sont lavés dans un bain de flux avec agitation.
- En même temps que le lavage, les lames fraîchement imprimées sont irradiées avec une onde courte UV (365 nm) de source à une densité de 30 mV / cm 2 pendant la durée de la période de lavage d'une durée de 30 s.
- Après avoir toutes les solutions de monomères sont imprimés les tableaux sont irradiés par UV (365 nm) pour 10 minutes supplémentaires.
- Les tableaux fraîchement imprimés sont conservés à basse pression (<50 mTorr) pendant 1 semaine pour éliminer le monomère non polymérisé et de solvant.
4. Haut débit caractérisation de surface (SCHT)
Un schéma général des techniques SCHT est illustré à la figure 3. Au centre de la automatisé, à haut débit approche est l'alignement de la puce avec l'appareil de polymère caractérisation. Dans tous les cas, cela est réalisé en utilisant une caméra qui donne une vue d'en haut du tableau. Initialement, le tableau est mis en rotation pour aligner avec le mouvement XY de la scène. Un point de corner du tableau se trouve alors désigné et les coordonnées précises. La position de chaque point de polymère peut ensuite être prédite en utilisant les dimensions de la matrice.
- Angle de contact de l'eau (WCA) des mesures
- AOC mesures sont prises en utilisant la méthode de la goutte posée sur unautomatisé Krüss DSA 100 instrument. Une goutte d'eau unique avec un volume d'environ 400 pL est distribuée en utilisant une tête d'impression piézo-chassée sur chaque point de polymère. Le diamètre d'un point de polymère est typiquement 300 pm et le diamètre de base de la goutte d'eau sur le lieu de polymère est de 100 um, par conséquent, une seule mesure peut être obtenue par spot polymère.
- Un étage XY permet le positionnement automatique de chaque point de polymère sous la tête d'impression 7. Ceci est réalisé à l'aide d'une caméra placée au-dessus de l'échantillon qui donne une vue de dessus de la matrice. Au départ, la position de la caméra doit être ajustée pour aligner la distribution de la goutte d'eau au centre de la vue de la caméra, puis le tableau peut être aligné sur la tête d'impression.
- Une caméra à grande vitesse enregistre le profil latéral de la gouttelette après avoir heurté la surface et ensuite l'évaporation. Le châssis qui capte l'impact initial de goutte est utilisé pour mesurer l'angle de contact. Un cercle est monté sur le profi baissele et l'angle de contact par la suite déterminé.
- Temps de vol secondaire Ion Mass Spectrometry (ToF-SIMS)
- Échantillon est chargé sur scène. Il s'agit d'abord aligner la scène avec Al feuille propre, ce qui contribue à compensation de charge, puis en maintenant la lame en place par l'utilisation d'onglets à vis en métal.
- Platine porte-échantillon est placé dans la chambre de transfert de l'ToF-SIMS et on laisse la pompe jusqu'à ce que 1,6 x 10 -6 mbar. L'échantillon est ensuite transféré à la chambre d'analyse principale, qui présente généralement une pression de vide de 1,0 x 10 -8 mbar.
- ToF-SIMS mesures sont réalisées à l'aide d'un instrument ION-ToF IV fonctionne avec un monoisotopique Bi 3 + source d'ions primaires fonctionnant à 25 kV en mode "groupé". Un pulsée 1 faisceau d'ions primaires pA est balayée sur la zone d'analyse, à la fois positifs et négatifs des ions secondaires collectées à partir d'un domaine de 100 × 100 um de chaque spot polymère dans la puce de 10 secdeuxième temps d'acquisition. Masses d'ions ont été déterminées en utilisant une résolution temps-de-vol analyseur permettant l'affectation précise de la masse. La résolution en masse typique (à m / z 41) était légèrement supérieur à 6000. Électrons de faible énergie (20 eV) ont été utilisés pour compenser la charge de surface causés par le faisceau d'ions chargés positivement primaire sur les surfaces isolantes 8.
- Microscopie à force atomique (AFM)
- Une étape importante AFM avec un étage automatisé est nécessaire pour l'analyse des réseaux sur la lame de verre. Un microscope d'encombrement ou ICON est idéal à cet effet.
- L'échantillon est placé sur la scène et de la scène est hébergé au coin supérieur droit du tableau.
- La position du coin gauche inférieur de la matrice se trouve, ce qui permet à la position de tous les autres spots à interpoler.
- Une liste de position est générée et introduite dans la fonction d'auto-échantillonnage du logiciel.
- Mesures AFM sont prises en utilisant un instrument Nanoscope 3000A en tapant mode. Conseils de silicium avec une fréquence de résonance de l'ordre de 300 kHz et une force constante de 40 N / m sont utilisés (Tap300Al, Capteurs budgétaires). Um 5x5 régions du polymère sont mesurés 9.
- La moyenne quadratique (RMS) rugosité est mesurée à travers cette région pour chaque image à l'aide du logiciel SPIP traitement par lots. Chaque image est d'abord aplatie avant les mesures de rugosité.
- Toutes les images demandent une visite manuel pour identifier artéfacts d'imagerie qui peuvent avoir besoin d'être retiré de mesures de rugosité. Au cours de cette étape d'images peuvent également être classés selon les caractéristiques de surface communes 9.
- X spectroscopie de photoélectrons (XPS)
- Coulisse de puces est fixée à une barre de l'échantillon en utilisant un ruban adhésif double face et ensuite chargé dans la chambre de mesure d'un instrument Kratos Axis Ultra XPS.
- Entrer dans la chambre de mesure et d'attendre jusqu'à ce qu'il atteigne une pression inférieure à 10 -8 Torr.
- Le fonctionnement appropriéparamètres, comme un monochromateur source de rayons X (Al, 1486,6 eV), et le potentiel d'anode de courant (10 kV et 15 mA), la taille de l'ouverture (110μm), l'énergie passe (80 eV pour le balayage de large et 20 eV pour le balayage à haute résolution) sont sélectionné. La source de rayons X est focalisé au moyen de deux coins opposés de la puce à ADN et l'optimisation du signal de l'oxygène à partir de l'échantillon. Les positions x et y de points individuels est alors déterminé et enregistré comme une liste de positions.
- Un diagramme programme est écrit, puis exécutez pour l'acquisition de données, y compris les analyses de large et scans haute résolution pour des éléments spécifiques.
- La spectroscopie Raman
- Spectres Raman sont prises pour chaque tache polymère à l'aide d'un microscope Raman LabRAM HR (Horiba Jobin Yvon). Initialement, le signal Raman est calibré à l'aide d'une plaquette de silicium et le décalage Raman de Si à 520,7 cm -1.
- L'échantillon est ensuite placé sur la scène et la focalisation du laser (longueur d'onde = 523 nm) est ajustée afin de maximiser le CH décalage Ramanà 2950 cm -1.
- La position du centre de la tache en haut à gauche sur la puce à ADN est ensuite fixé en tant qu'origine et un plan de la puce est configurée en utilisant la fonction de réseau sur le logiciel LabRAM HR.
- 10 spectres sont acquis de façon cumulative pour chaque échantillon avec un temps d'irradiation de 0,5 s.
5. Essai bactérien
Le tableau peut être exposé à de multiples dosages biologiques y compris l'attachement et la prolifération des cellules souches, d'autres types de cellules et de bactéries 3,10,4. Nous décrivons ici un essai de fixation des bactéries, ce qui est schématisé dans la figure 4.
- Une souche bactérienne transformée avec le plasmide GFP exprimée est cultivée pendant une nuit à 37 ° C dans 10 ml de milieu LB dans un tube Falcon de 50 ml sous agitation à 200 rpm.
- La DO 600 de la culture bactérienne est mesurée et suffisantes culture d'une nuit est inoculé dans 15 ml de RPMI-1640 définis à entraînerdans une finale DO 600 de 0,01.
- Les tableaux sont prélavés dans l'eau distillée stérile pendant 10 minutes pour éliminer les composants solubles dans les tableaux (monomère non polymérisé, oligomères et solvant)
- Diapositives de tableaux lavés sont placés dans une boîte de Petri propre et stérilisée aux UV pendant 10 min.
- Un diaporama avec l'ensemble est placé dans une boîte de Pétri et 15 ml de la inoculés IPMB-1640 est ajouté. Parallèlement une autre diapositive est placée dans une boîte de Pétri et incubés avec des non-innoculatd RPMI-1640 en tant que contrôle.
- Les lames sont incubées à 37 ° C pendant 72 heures sous agitation à 60 rpm.
- Les lames sont lavées deux fois avec 15 ml de PBS stérile.
- Les lames sont lavées deux fois avec 15 ml d'eau distillée stérile.
- Les lames sont séchées à l'air.
- Les lames sont imagées par un chargeur automatique GenePix 4200AL Scanner (Molecular Devices, États-Unis) avec un laser d'excitation de 488 nm et bleu standard filtre d'émission (510-560nm). Un représentant polymère autofluorescence image estreprésenté sur la figure 2. Cela devrait être fait dès que possible pour éviter la dégradation de la GFP. Si ce n'est pas possible, les cellules doivent subir une fixation. En outre, l'inclusion de contrôles positifs appropriés avec une réponse connue bactérienne est impératif d'être en mesure de normaliser les résultats et permettre des expériences menées sur des jours différents pour être quantitativement comparables. L'intensité de fluorescence totale de points de polymère est acquise au moyen GenePix Pro 6 (Molecular Devices, États-Unis). Ceci est fait pour les deux lames incubées avec des bactéries et des médias seulement. À trouver la fluorescence due à la croissance de bactéries sur la fluorescence de la commande de support est soustraite de la fluorescence mesurée sur la lame à incuber avec des bactéries.
- Les diapositives peuvent aussi être colorées par 20 pM SYTO17 colorant d'acide nucléique (Invitrogen, Royaume-Uni) à température ambiante pendant 30 minutes et imagée en utilisant un objectif Carl Zeiss LSM 700 microscope à balayage laser avec ZEN 2009 logiciels d'imagerie (Carl Zeiss, Allemagne). La couverture des bactériessur la surface est déterminée en utilisant l'image ouverte de source J 1.44 du logiciel (National Institute of Health, États-Unis).
6. Les résultats représentatifs
Les conditions d'impression ont été optimisés pour l'impression des puces polymères hautes qualité. L'humidité doit être maintenue entre 30-40%. Le délaminage des points de polymère en milieu aqueux a été observée fréquemment pour les tableaux imprimés à une humidité inférieure à 30%, ce qui suggère que cette humidité est insuffisante pour faire gonfler la couche pHEMA et permettre le piégeage physique du polymère sur le substrat. L'humidité peut être encore augmentée de modifier le diamètre des points de polymère, mais cela dépend de la chimie monomère. Par exemple, lorsque des volumes égaux de solution de polymérisation ont été imprimés et que l'humidité est passée de 40 à 80% le diamètre du spot diminué de 430 um à 370 um pour un monomère contenant un groupement hydrophile glycol d'éthylène volume tout égal pour un monomer contenant une structure aliphatique hydrophobe de carbone du cycle du diamètre du spot est passé de 290 um à 350 um (Figure 5).
Le degré de polymérisation peut être contrôlée en utilisant une spectroscopie Raman pour mesurer le C = C décalage Raman qui est détectée à 1640 cm -1, qui devrait être normalisée par le décalage Raman C = O à 1720 cm -1. Les spectres Raman a été mesurée pour les taches de polymères polymérisés pour l'exposition aux UV varié (Figure 6). Le C = C: C = rapport O diminué l'exposition aux UV est passée de 0 à 50 s, après quoi aucune nouvelle diminution de la C = C: C = O ratio a été observée avec une irradiation UV supplémentaire (figure 6). Spectres Raman ont également été mesurées pour les points de polymère polymérisé au niveau varié O 2 et la figure 7A C = C décalage Raman a été observé que la teneur en O 2 a été diminuée à 2000 ppm, mais sans réduction supplémentaire a été observé pour un niveau au-dessous de O 2 présente ( ). La spectroscopie Raman a également démontré la capacité de l'extraction sous vide step pour éliminer le monomère non polymérisé. Préalablement à l'extraction sous vide C = shift Raman C était plus élevé pour le polymère polymérisé à 3300 ppm par rapport à 2000 ppm (figure 7A), cependant, après extraction sous vide de la hauteur du décalage Raman est indiscernable (figure 7B), ce qui suggère tout monomère non polymérisé a été éliminée au cours de l'étape d'extraction sous vide. Pour résumer, les conditions de polymérisation comprennent un taux d'humidité de 30-40%, l'exposition aux UV supérieure à 50 s à une teneur en O 2 en dessous de 2000 ppm, avec une étape d'extraction sous vide après l'impression pendant 7 jours.
Après l'extraction d'impression et vide le succès de la polymérisation des points de polymère peut être évaluée par microscopie optique simple d'identifier et de morphologies anormales place. En règle générale, les taches devraient apparaître circulaire et uniforme, comme le montre la figure 8 sur la gauche. La cause probable d'un changement dans la géométrie est une cheville endommagée ou sale. Pour un petit nombre de combinaisons de monomères nous avons observé des taches difformes, par exemple d'un emplacement central avec un satellite de petites taches, illustré à la figure 8 sur la droite, ou une forme oeuf sur le plat où il ya une place centrale au-dessus du grand flatter place. Cela peut être causé par séparation de phase avant l'impression en raison de différences dans la tension viscosité, hydrophilie, la volatilité ou de la surface des monomères et suggère que la combinaison de monomères n'est pas compatible avec ce format. Cartographie chimique supplémentaire des points de polymère par des techniques telles que ToF-SIMS est également une étape importante de la qualité et de contrôle parfois nécessaire de déterminer la distribution de solutions chimiques des matériaux »à travers les taches et le tableau. Cette technique permet d'identifier épandage excessif de certains matériaux ne sont pas visibles au microscope optique et d'identifier séparation de phase dans les points de polymère individuelles.

Figure 1. Schéma illustrant les différentes étapes de la formation d'un poLymer place.
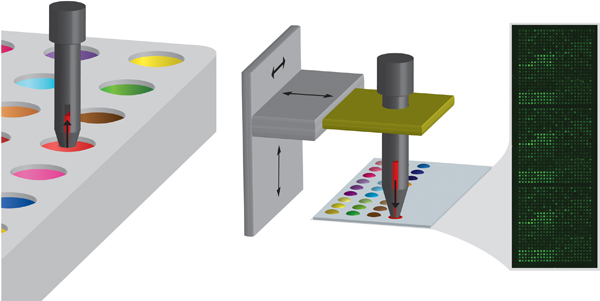
Figure 2. Schéma de la méthode d'impression comportant un premier axe de chargement de la broche avec le monomère dans une plaque de source, puis le dépôt du monomère sur un substrat par mise en contact. La broche est commandée par un bras de robot XYZ. L'encart montre une image typique de l'autofluorescence d'un tableau après la production.

Figure 3. Schéma de mettre en évidence les techniques associées à HTSC et également des essais biologiques appliquées à l'étude des puces polymères.

Figure 4. Schéma de l'essai de fixation des bactéries.
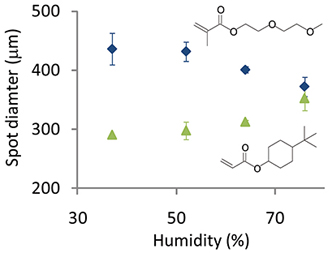
Figure 5. Pdiamètre de la tache imprimée à l'humidité olymer varié pour deux monomères différents: 4-tert-butylcyclohexyle et d'acrylate de di (éthylène glycol) le méthacrylate de l'éther éthylique.
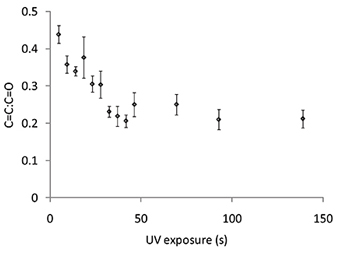
La figure 6. Rapport de l'intensité Raman de la liaison C = C à décalage Raman à 1640 cm -1 et le C = O de décalage Raman à 1720 cm -1 à partir de points de polymère d'acrylate de 4-tert-butylcyclohexyle ayant varié exposition aux UV. Les barres d'erreur égale à un écart type (n = 3).
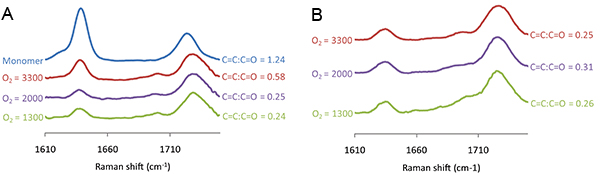
La figure 7. Les spectres Raman mesurés pour points de polymère d'acrylate de 4-tert-butylcyclohexyle imprimé à divers niveaux 2 O, indiqué à la gauche de chaque spectre, (A) et avant (B) après extraction sous vide. Le rapport de l'intensité Raman de la liaison C = C à décalage Raman à 1640 cm -1 et le C = O de décalage Raman à 1720 cm -1 est affiché à droite de chaque spectre.

Figure 8. Une image de microscopie à la lumière des points de polymère deux. Le point sur la gauche montre une tache bien formée, tandis que la tache sur la droite est un exemple d'un spot contenant une distribution très inégale de monomère. La barre d'échelle est de 500 um.
Discussion
Puces polymères ont été utilisés avec succès pour la découverte de nouveaux matériaux par des centaines de dépistage du roman de polymère dans un essai biologique et l'identification des «hit» des matériaux qui peuvent ensuite être étendus aux dispositifs utiles. Dans ce cas, la caractérisation de la surface décrit peut être utilisé à la suite de l'essai biologique et exclusivement sur le «hit» des matières à étudier ces matières de façon plus détaillée. Cette stratégie peut être intéressante si HTSC n'est pas disponible à l'expérimentateur utilisant cette approche. Cependant, pour tirer pleinement parti des puces polymères d'étudier les interactions biologiques et matérielles toute la gamme des centaines de matériaux devrait être analysé avant essais biologiques en utilisant des méthodologies SCHT, qui peuvent ensuite être utilisés pour observer généraux structure-fonction des tendances.
Contacter l'impression repose sur la tige métallique glissant vers le haut et vers le bas librement sur le support d'axe. Propreté de support de broches et la broche est primordial est de veiller à printing se produit avec succès et devraient être rigoureusement menées. Avant de commencer une impression exécuter le mouvement approprié de la broche dans le support broche peut être testé en effectuant une marche à sec, sans monomères présents. L'étape de nettoyage devrait se poursuivre jusqu'à ce que le mouvement de broche est réalisé de manière reproductible.
Beaucoup de réflexion doit aller dans la conception du mélange de monomères. Afin de produire facilement une bibliothèque combinatoire de polymères, des centaines de copolymères sont formés en mélangeant quelques monomères à différents rapports. En règle générale, nous produisons 576 bibliothèques membres car cela forme un 24 x 24 tableau, ce qui est adapté à la géométrie d'une lame de verre. Afin de produire une bibliothèque combinatoire qui explore l'espace le plus combinatoire de la méthode la plus simple consiste à mélanger 24 monomères par paires à un ratio de 2:1. Alternativement, l'inclusion des gradients de composition dans le tableau sont utiles pour permettre les observations des tendances, ce qui permet des compositions de monomères optimales à determined. A titre d'exemple de ce 22 monomères peuvent être utilisés en tant que premier composant dans un mélange de co-monomère qui est dilué avec de 1 séquentiellement des composants 6 secondes. Si 5 dilutions sont utilisées, par exemple en mélangeant les premier et second composants à des rapports de 90:10, 75:25, 50:50, 25:75 et 10:90, cela se traduirait par 488 solutions de copolymères uniques. Pour porter le total à 576, reproduit des homopolymères des monomères utilisés peuvent être introduits, ce qui est souvent un échantillon de référence important. 576 solutions de monomère devrait être distribué dans 2 384 plaques à puits. Pour la programmation du robot, il est plus facile d'avoir deux plaques identiques en termes de la position des monomères, par conséquent, les solutions de monomères doit être réparti de manière égale entre les deux plaques.
Une quantité importante de temps peut être sauvé dans la préparation des plaques de source par l'utilisation de pipettes multicanaux, et la conception des plaques de source doit être déterminée afin d'exploiter l'utilisation des pipettes multicanaux.
Pour atteindre HTSC automatisée des tableaux de la position au comptant doit être correctement aligné avec l'appareil de caractérisation. Typiquement, la hauteur d'une matrice d'acrylate est 500-1000 um et le diamètre de spot de polymère est de 300 um. La plupart des stades XY ont une résolution inférieure à 10 um, ainsi la tolérance est correcte pour l'appareil de caractérisation de surface à accéder de manière fiable les positions de réseau une fois que les dimensions correctes ont été saisies dans le logiciel de positionnement de l'échantillon. La limitation du positionnement automatisé est en fait l'impression exacte de la matrice. Pour garantir une impression précise qu'il est important pour empêcher le mouvement du substrat sur la phase d'impression, soit par aspiration sous vide ou pinces à ressort avec des dimensions de diapositives appropriées (à noter que la fois un américain et la taille de l'UE lame standard existent).
ToF-SIMS est une technique extrêmement surface sensible qui observera toute contamination des échantillons. Ainsi, plus grand soin doit être prispour éviter le contact avec la surface. Les échantillons doivent être manipulés, mais la surface de contact avec intérêt non, avec des gants propres (de préférence en polyéthylène) et avec des pincettes fraîchement nettoyées. En général, nous laver avec du chloroforme et de l'hexane. Stockage des échantillons avant les mesures se fait mieux dans un porte-échantillon qui contient les diapositives de l'autre, par exemple l'. 5 ou 20 porte-lame porte-lame
Les tableaux sont conçus spécifiquement pour être compatible avec de nombreux formats de tests biologiques et des affichages, c'est le substrat utilisé est une lame de microscope idéal pour les scanners à fluorescence et microscopes légers. Cela signifie que le format est bien adapté à l'exploration de nombreux matériaux biologiques des interactions. En outre, le format permet à des centaines de matériaux à être projeté en parallèle. Cela permet à de nombreux matériaux plus à être projeté que les méthodes conventionnelles de chimie où chaque nouveau matériau est un dépistage individuel. L'accroissement des possibilités de matériel biologique interactions permettents pour l'élucidation des mécanismes des interactions de surface biologiques, ainsi que de trouver le meilleur matériau pour une application donnée.
Déclarations de divulgation
Nous n'avons rien à déclarer.
Remerciements
Le financement par le Wellcome Trust est aimablement reconnu (numéro de licence 085245/Z/08/Z). La nanotechnologie Nottingham et Nanoscience Centre est aimablement reconnu pour donner accès au système de Raman et de l'Agence de développement de East Midlands pour le financement de cet équipement.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif / équipement | Entreprise | Catalogue / Numéro de modèle | |
| Diapositives époxy | Genetix | K2652 | |
| Contactez-imprimante | Biodot | XYZ3060 Plate-forme | |
| Tige métallique | ARRAYIT | 946MP6B | |
| ToF-SIMS instrument | ION-TOF | ||
| Instrument XPS | Kratos | ||
| WCA appareil | Krüss | DSA 100 | |
| AFM | Bruker | Icône de dimension | |
| RPMI-1640 milieux de culture cellulaire | Sigma-Aldrich | R0883 | |
| SYTO17 | Invitrogen | S-7579 |
Références
- Hook, A. L., Anderson, D. G., Langer, R., Williams, P., Davies, M. C., Alexander, M. R. High throughput methods applied in biomaterial development and discovery. Biomaterials. 31, 187-198 (2010).
- Anderson, D. G., Levenberg, S., Langer, R. Nanoliter-scale synthesis of arrayed biomaterials and application to human embryonic stem cells. Nature Biotechnology. 22, 863-866 (2004).
- Mei, Y., Saha, K., Bogatyrev, S. R., Yang, J., Hook, A. L., Kalcioglu, Z. I., Cho, S. W., Mitalipova, M., Pyzocha, N., Rojas, F., Van Vliet, K. J., Davies, M. C., Alexander, M. R., Langer, R., Jaenisch, R., Anderson, D. G. Combinatorial development of biomaterials for clonal growth of human pluripotent stem cells. Nature Materials. 9, 768-778 (2010).
- Pernagallo, S., Wu, M., Gallagher, M. P., Bradley, M. Colonising new frontiers-microarrays reveal biofilm modulating polymers. Journal of Materials Chemistry. 21, 96-101 (2011).
- Yang, J., Mei, Y., Hook, A. L., Taylor, M., Urquhart, A. J., Bogatyrev, S. R., Langer, R., Anderson, D. G., Davies, M. C., Alexander, M. R. Polymer surface functionalities that control human embryoid body cell adhesion revealed by high throughput surface characterization of combinatorial material microarrays. Biomaterials. 31, 8827-8838 (2010).
- Urquhart, A. J., Anderson, D. G., Taylor, M., Alexander, M. R., Langer, R., Davies, M. C. High throughput surface characterisation of a combinatorial material library. Advanced Materials. 19, 2486-2491 (2007).
- Taylor, M., Urquhart, A. J., Zelzer, M., Davies, M. C., Alexander, M. R. Picoliter water contact angle measurement on polymers. Langmuir. 23, 6875-6878 (2007).
- Urquhart, A. J., Taylor, M., Anderson, D. G., Langer, R., Davies, M. C., Alexander, M. R. TOF-SIMS analysis of a 576 micropatterned copolymer array to reveal surface moieties that control wettability. Analytical Chemistry. 80, 135-142 (2008).
- Hook, A. L., Yang, J., Chen, X., Roberts, C. J., Mei, Y., Anderson, D. G., Langer, R., Alexander, M. R., Davies, M. C. Acrylate polymers with hydro-responsive topography. Soft Matter. 7, 7194-9197 (2011).
- Pernagallo, S., Unciti-Broceta, A., Diaz-Mochon, J. J., Bradley, M. Deciphering cellular morphology and biocompatibility using polymer microarrays. Biomedical Materials. 3, (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon