Method Article
Une méthode mise à jour EPA 1623 qui utilise tangentielle débit à fibres creuses d'ultrafiltration et de chaleur étapes de dissociation pour la détection de voie d'eau
Dans cet article
Résumé
Ce protocole décrit l'utilisation d'un flux de fibres creuses système d'ultrafiltration tangentielle concentration de l'échantillon et une dissociation de chaleur étapes alternatives pour la détection de aqueuse Cryptosporidium Et Giardia Espèces en utilisant la méthode EPA 1623.
Résumé
Espèces Cryptosporidium et Giardia sont deux des plus répandus des protozoaires qui causent des épidémies d'origine hydrique diarrhéiques dans le monde. Afin de mieux caractériser la prévalence de ces agents pathogènes, la méthode EPA 1623 a été élaboré et utilisé pour surveiller les niveaux de ces organismes dans l'eau potable aux États-Unis fournit 12. Procédé comporte trois parties principales, la première est la concentration de l'échantillon dans lequel au moins 10 litres d'eau de surface brute est filtrée. Les organismes et les débris piégés sont ensuite élue du filtre et centrifugé pour concentrer davantage l'échantillon. La deuxième partie de la méthode utilise une procédure de séparation immunomagnétique où l'échantillon d'eau concentrée est appliquée à des billes immunomagnétiques qui se lient spécifiquement aux oocystes de Cryptosporidium et des kystes de Giardia permettant l'élimination spécifique des parasites des débris concentré. Ces kystes (oo) sont ensuite détachés des billes magnétiques par un procé dissociation acidecédure. La dernière partie de la méthode est la coloration par immunofluorescence et le dénombrement où (oo) kystes sont appliqués à une diapositive, taché, et énuméré par microscopie.
Méthode 1623 a quatre cotés systèmes concentration de l'échantillon pour capturer les oocystes de Cryptosporidium et des kystes de Giardia dans l'eau: filtres Envirochek (Pall Corporation, Ann Arbor, MI), les filtres Envirochek HT (Pall Corporation), les filtres Filta-Max (IDEXX, Westbrook, MA), ou centrifugation à flux continu (Haemonetics, Braintree, MA). Toutefois, le Cryptosporidium et Giardia recouvrements kystes et d'oocystes) ont beaucoup varié en fonction de la matrice des sources d'eau et les filtres utilisés 1,14. Un nouveau flux tangentiel à fibres creuses d'ultrafiltration (HFUF) système a récemment été montré pour être plus efficace et plus robuste à la récupération des oocystes de Cryptosporidium et les kystes de Giardia à partir de matrices d'eau différents, d'ailleurs, il est moins coûteux que l'option autre capsule de filtres et peut se concentrer de multiples pathogènes simultanément 1-3,5-8,10,11. En outre, des études antérieures par Hill et ses collègues ont démontré que le HFUF considérablement amélioré Cryptosporidium recouvrements des oocystes lors directement comparés avec les filtres HT Envirochek 4. D'autres modifications aux méthodes actuelles ont également été signalés à améliorer les performances des méthodes. Remplacement de la procédure de dissociation acide avec la chaleur de dissociation a été montré pour être plus efficace pour séparer Cryptosporidium des billes magnétiques dans certaines matrices 9,13.
Ce protocole décrit une méthode de modification de 1623 qui utilise le système de filtration HFUF nouvelle étape avec la chaleur de dissociation. L'utilisation de HFUF avec cette méthode modifiée est une alternative moins chère à l'APE actuels options Méthode de filtration 1623 et offre plus de souplesse en permettant la concentration des organismes multiples.
Protocole
1. Tangentielle procédure d'ultrafiltration à fibres creuses
- Préparation des tampons et des solutions:
Solution d'élution (1 L):
Pour 1 litre d'eau de qualité réactif ajouter 0,1 g de sodium polyphosphate, 0,1 ml de Tween-80 et 0,01 ml Y-30 antimousse. - Préparer ensemble filtre (Figure 1) dans une enceinte de sécurité biologique:
- Insérez Masterflex I / P 73 tubes de laboratoire à travers une Masterflex I / P tête de la pompe de Facile-Charge reliée à un Masterflex I / P lecteur brushless de précision.
- Fixez le tuyau à un 0-60 psi, manomètre glycérine-remplie équipée d'une branche du TNP connecteur en T en amont de la tête de pompe avec une pince à vis, et à un PEHD connecteur en T en aval de la tête de pompe.
- Monter la bouteille rétentat en ajustant un Nalgene 53-B de remplissage / purge bouchon avec Masterflex L / S 15 tubes de laboratoire et un connecteur en T et en le fixant à un 1 L Nalgene devoir bouteille en polypropylène lourde.
- Monter Masterflex L / S 24 W tubevec une pince de serrage (2 pince de serrage) et connectez-le à partir de la bouteille rétentat au HDPE T-connecteur.
- Branchez le Masterflex L / S 24 tubes de laboratoire à partir de la jauge de pression à l'Asahi Kasei Rexeed 25S à haut flux de dialyseur avec une pince à vis, et de le dialyseur à la bouteille rétentat. Utilisez-mesure adaptateurs DIN conçus pour accueillir tube ¼ ID "pour connecter le tuyau à la ultrafiltre à fibres creuses.
- Monter Masterflex L / S 24 tubes de laboratoire avec une pince pincée (1 pince de serrage) et le connecter à une pipette en plastique de 10 ml avec le bouchon pointe et le coton enlevé pour agir en tant que la ligne de l'absorption de l'échantillon et puis fixez le tuyau à la HDPE T- Connecteur.
- Monter une extrémité du tube Masterflex laboratoire L/S-36 avec une rampe de serrage et raccorder le tuyau au port situé à proximité de l'effluent l'extrémité de sortie du filtre. Placer l'autre extrémité dans le conteneur de déchets.
- Ajouter 0,01% (p / v) polyphosphate de sodium à l'échantillon L 10 de l'eau et mélanger pendant 3 min.
- Fermer 2 pince de serrageet retirez le capuchon de l'évent de la bouteille rétentat. Tous les autres pinces devraient être ouverts.
- Réglez le sens de la pompe pour déplacer le fluide de la T-connecteur à la jauge de pression (à droite à la figure ci-dessous à gauche 1). Réglez la vitesse de la pompe à 25% de la vitesse maximale et tourner sur la pompe.
- Lorsque la bouteille est rétentat 2/3 pleine, pince de serrage ouvert 2 et de remplacer rapidement le capuchon d'évent à la bouteille rétentat. Vérifiez toutes les conduites et les raccords pour s'assurer qu'il n'y a pas de fuites.
- Lentement augmenter la vitesse de la pompe au débit de filtration désirée (environ 1,5 L / min), en vérifiant s'il ya des fuites. Utilisation d'un cylindre gradué et un compteur minuterie ou d'écoulement, vérifier le taux filtrat de l'eau sortant de la ligne d'effluent (bleu L / S 36 tube dans la figure 1). Les bulles d'air peuvent se forment généralement à l'extrémité de sortie du filtre qui rend difficile de parvenir à une pression stable et le taux de filtration. Cette erreur est corrigée par le pincement de la ligne de l'effluent à la main pour un moment. Cette actionsera généralement coaxial la bulle d'air à l'orifice de filtrat et pour sortir via la ligne d'effluent. Répéter au besoin, en gardant à l'esprit que les bulles d'air de pois de taille sont souvent inévitables.
- Surveiller le processus de filtration. Mesurer et enregistrer la pression et le débit de filtration en fonction des besoins. La pression ne doit jamais dépasser 20 psi. Il est recommandé que le taux de filtration ne doit pas dépasser 2,0 L / min. Il est important que le volume d'eau dans la bouteille rétentat être surveillés afin de s'assurer qu'il ne se jette. Il est normal que le volume pour augmenter ou diminuer légèrement. Si le volume d'eau dans la bouteille tombe en dessous de rétentat tiers pleine, puis retirez le capuchon de l'évent et une pincée de près de serrage 2 sur la ligne bouteille rétentat. Apportez le volume de retour à environ 2/3 plein, d'ouvrir la pince et remettre rapidement le capuchon de l'évent, assurant une bonne étanchéité. Si le volume de la bouteille rétentat tombe rapidement et en continu, puis d'assurer la couvercle de la bouteille rétentat est serré et le capuchon de l'évent est bien en place, et que le tubing est toujours en contact avec l'échantillon d'eau. Si ces questions ne se produisent pas, alors il est probable que le joint dans le couvercle de la bouteille rétentat est mauvaise et doit être remplacé.
- Lorsque le récipient contenant l'échantillon est vide, pince de serrage immédiatement fermer 1, de réduire la vitesse de la pompe à 20% de son maximum, retirez le capuchon de l'évent de la bouteille rétentat et fermer la pince rampe.
- Réglez le volume de l'échantillon dans la bouteille rétentat à environ 200 ml en serrant ou desserrant la pince rampe. Après le volume est d'environ 200 ml, serrer le collier rampe d'accès pour les étapes d'élution (1.11 à 1.12).
- Ajouter 500 ml de solution d'élution à l'échantillon contenant et rincer l'intérieur du récipient. Placer la pipette 10 ml connectée à la ligne absorption échantillon dans le conteneur qui contient la solution d'élution. Veiller à ce que la pince bretelle est fermée. Pincée ouvrir la bride 1 et pincée près borne 2 momentanément pour élaborer la solution d'élution.
- Après le 500 ml de solution d'élution est établi, À proximité pincer pince 1 et pince de serrage ouvert 2. Laisser la solution d'élution de circuler pendant 5 minutes avec une vitesse de la pompe de 20% de sa valeur maximale.
- Réglez le volume de l'échantillon dans la bouteille rétentat à environ 100 ml en serrant ou desserrant la pince bretelle sur la ligne des effluents. Serrer la pince rampe et permettre à l'échantillon de circuler pendant 1 minute. Éviter de tirer de l'air dans la tubulure en assurant le volume de l'échantillon dans la bouteille de rétentat est suffisamment élevée pour couvrir la L / S 15 tube qui pénètre dans la bouteille de rétentat.
- Inverser le sens de la pompe qui force l'échantillon dans la bouteille de rétentat. Laisser la pompe fonctionner en marche arrière pendant 20 secondes, soit un total de ~ 225 ml dans le flacon de rétentat. Arrêter la pompe.
- Retirez le Masterflex I / P 73 tube de la tête de pompe et débrancher le manomètre. Déconnecter le Masterflex L / S 24 tube sortant de la fibre creuse ultrafiltre. Tenez le tube dessus de la bouteille rétentat pour forcer tout échantillon restant dans lerétentat bouteille.
- Débrancher tous les tuyaux de la bouteille et de remplacer le bouchon du réservoir avec un bouchon non-évacuation.
- Passez à la procédure IMS / IFA avec la ~ 225 ml rétentat.
2. Procédé de séparation immunomagnétique
- Préparation des tampons et des solutions:
- Autoriser les tampons figurant dans les Dynabeads: kit combo Cryptosporidium / Giardia atteindre la température ambiante.
- SL-1X tampon A: Ajouter 1 ml de 10X SL-tampon A à 9 ml d'eau de qualité réactif.
- Transférer le ~ 225 ml de liquide de la bouteille à un rétentat marqué 250 ml tube à centrifuger conique. Rincer la bouteille rétentat deux fois avec 10 ml d'eau réactif, et ajouter les rinçages au tube à centrifuger conique. Centrifuger la suspension à 1500 xg pendant 15 min à 4 ° C sans frein.
- Soin aspirer le surnageant de l'interface air-eau à 5 ml au-dessus du culot emballés pour tous les 0,5 ml de volume de culot (aspirer soit à une5 ml ci-dessus un volume de 1,3 ml à granulés, et aspirer à 5 ml pour une pastille de 0,5 ml ou moins).
- Bien resuspendre le culot dans le surnageant par vortex et / ou d'une pipette de mélange. Transférer chaque volume de 5 ml du liquide à l'côtés plats Dynal L10 tube contenant 1 ml chacune 10X SL-tampon A et 10X SL-tampon B. rinçage du tube conique deux fois avec 2,5 ml d'eau à réactif et ajouter le liquide de rinçage à le tube L10, portant le volume total dans le tube de ml L10 à 12, y compris les tampons.
- Ajouter 100 ul chacun de bien mélangés resuspendues Dynabeads anti-Cryptosporidium et anti-Giardia dans le tube L10. Tourner le tube L10 à 18 tours par minute pendant 1 heure à température ambiante sur une table de mixage des rotateurs.
- Placer le côté plat du tube L10 contre l'aimant MPC-6 et le rock doucement la main le tube de bout en bout, à 180 ° pendant 2 minutes.
- Garder le tube L10 dans l'aimant MPC-6 avec le côté aimant en place, décanter le surnageant loin de la perle / (oo) kystes complexes boue à l'aimant. Retirer le tube L10 de l'aimant et ajoutez 0,5 ml de 1X SL-tampon A dans le tube. Transférer la suspension en utilisant deux rinçages supplémentaires de 0,5 ml de 1X SL-tampon A dans un microtube de 1,5 ml qui s'est tenue à la MPC-S de l'aimant dans la position verticale.
- Agitez doucement le tube dans le MPC-S aimant 180 ° pendant 1 minute. Avec l'aimant en place, aspirer le surnageant en utilisant une pipette Pasteur dirigée vers le bas du tube de microcentrifugation.
- Ajouter 1 ml de 1X PBS à la face avant du tube de microcentrifugation, retirer l'aimant et le tube basculer légèrement jusqu'à ce que les billes sont remises en suspension. Remplacer l'aimant dans la position verticale et balancer doucement le tube à 180 ° pendant 1 minute. Aspirer le PBS rinçage, sans perturber le culot perles, en utilisant une pipette Pasteur pour enlever autant de débris que possible.
- Retirer l'aimant et ajouter 50 ul d'eau réactif à l'arrière du tube de microcentrifugation. Vortex du tube à pleine vitesse pendant 50 secondes,incuber le tube à 80 ° C pendant 10 minutes suivi par un vortex 30 secondes. Remplacer l'aimant dans le MPC-S dans la position inclinée, la liaison des perles à l'aimant et en laissant les kystes oocystes) dans le liquide. Appliquer la suspension du kyste (oo) à une diapositive SingleSpot bien.
- Répéter l'étape 2,10, en appliquant le liquide à l'même puits contenant la première dissociation. Placer la lame sur une diapositive 37 ° C plus chaud pendant 1 heure pour sécher la suspension à la diapositive ainsi.
3. La coloration et examen
- Préparation des tampons et des solutions:
Solution de travail DAPI: Ajouter 25 ul de la solution mère DAPI (2 mg / ml dans le méthanol) à 25 ml de PBS 1X. Les stocks en magasin et des solutions de travail entre 1 ° C et 10 ° C dans l'obscurité. - Appliquer 50 ul de méthanol à la diapositive bien et laissez-la sécher à température ambiante.
- Ajouter 50 ul de la solution DAPI de travail à la diapositive puits et incuber pendant 2 minutes à température ambiante.
- Utilisez un Kimwipe pour absorber le DAPI à partir du puits. Appliquer 50 pi de EasyStain. Incuber à 35 ° C pendant 30 minutes.
- Mèche la tache avec le bien avec un Kimwipe, puis ajouter lentement 300 pi de tampon de fixation à froid EasyStain, ce qui lui permet de circuler sur le bord bien. Incuber pendant 2 minutes à température ambiante.
- Utilisez un Kimwipe pour absorber la mémoire tampon du puits et verser 10 ul de milieu de montage EasyStain.
- Appliquer soigneusement une lamelle, enlever toutes les bulles qui se produisent. Sceller la lamelle avec du vernis à ongles transparent.
- Numérisation de la diapositive entière en utilisant le filtre FITC, au grossissement total de 200X, pour ovoïdes ou sphériques vert pomme objets fluorescents qui ressemblent à un oocyste ou kyste. Examinez tous les objets avec le filtre DAPI à un grossissement total de 1000X, puis avec DIC, également à un grossissement total de 1000X. Notez la taille à l'aide d'un micromètre oculaire calibré et les caractéristiques morphologiques.
- Documenter les résultats.
Note: Complément informationinformations sur la procédure d'origine peut être trouvée dans le Décembre 2005 Version de la méthode EPA 1623 12. La procédure d'ultrafiltration à flux tangentiel à fibres creuses décrit est utilisé à la place de la section 12.0 de la méthode EPA 1623. La dissociation de la chaleur modifie l'article 13.3.3 de la méthode EPA 1623. Le procédé décrit également une PBS supplémentaire de rinçage au cours du processus IMS qui peut être inséré dans le Décembre 2005 version de méthode 1623, après l'article 13.3.2.16. La liste complète des consommables, des réactifs et du matériel utilisés pour la méthode EPA 1623, y compris ces modifications est répertorié dans la liste d'équipement.
4. Les résultats représentatifs
Oocystes de Cryptosporidium et des kystes de Giardia récupérés par le biais des procédés de filtration et de séparation immunomagnétique sont détectés par l'analyse microscopique. Au grossissement total de 200X, chaque organisme présentant un motif de coloration typique, la taille et la forme comme le montre la figure 2 devrait être en outre fait observer à l'aide immersion dans l'huile à un grossissement total de 1000X. Cela permettra pour la mesure et l'identification des caractéristiques qui définissent soit typiques ou atypiques caractéristiques qui régissent à l'identification du positif. Cryptosporidium est un ovoïde à objet sphérique de 4 à 6 m de diamètre qui présente brillante vert pomme de fluorescence FITC avec des bords brillamment mis en évidence (figure 3A ). Avec DAPI UV, un oocyste se présentent l'une des catégories suivantes: la lumière caractéristique de coloration bleue interne avec une jante vert et pas noyaux distincts (DAPI négative), coloration au bleu intense interne, ou jusqu'à quatre formes distinctes, bleu ciel noyaux (DAPI positif - la figure 3B). Les caractéristiques atypiques englobent les écarts de couleur, de structure ou de fluorescence DAPI (par exemple, un trop grand nombre noyaux colorés, rouge fluorescent structures internes). Si l'objet fluorescent a satisfait aux critères pour FITC typique et coloration au DAPI, il est examiné en utilisant con interférence différentiellecontraste (DIC). L'objet est examinée pour atypiques externes ou internes caractéristiques morphologiques comme ornementation paroi cellulaire, ou un ou deux noyaux grande remplissage de la cellule. Si les structures atypiques ne sont pas respectées, l'objet est enregistré dans le nombre total IFA et classés comme une structure vide amorphe ou de un à quatre sporozoïtes présents (figure 3C). De même, Giardia objets similaires sont examinés en ce qui concerne la coloration FITC et DAPI ainsi que les caractéristiques DIC, comme axonèmes, les organismes de la médiane, et les noyaux des kystes de Giardia sont ronds à ovoïdes objets brillants vert-pomme, 8 - 18. Um de long par 5 - 15 um de largeur avec des bords brillamment mis en évidence (figure 3D). Avec DAPI UV, le kyste de Giardia exposera DAPI-négative coloration, ou DAPI-positifs caractéristiques (figure 3E). L'objet fluorescent est examiné par DIC pour les fonctionnalités typiques et atypiques de la même manière que celle décrite pour Cryptosporidium.Si les caractéristiques atypiques ne sont pas respectées, l'objet est enregistré dans le nombre total IFA et catégorisés comme étant vide structure amorphe contenant, ou avec un ou plusieurs types de structures internes actuelles (Figure 3F).
Tout organisme que l'on observe d'avoir des caractéristiques atypiques ne doit pas être compté comme un kyste (oo). L'analyse microscopique des échantillons de l'environnement peut être difficile car il ya des organismes qui peuvent l'auto-fluorescence ou une réaction croisée avec le FITC-conjugué anti-Cryptosporidium et / ou anti-Giardia anticorps 1. Il est recommandé que l'analyste se familiariser avec les microbes aquatiques et des dizaines d'examen de diapositives d'acquérir une expérience identifier Cryptosporidium et Giardia. Au moins trois (oo) kystes sur la lame de contrôle coloration positive devrait être caractérisé avant chaque session à la loupe.
Échantillons de contrôle de qualité peuvent être dopés avec (oo) kystes pour déterminer la rec pour centOvery pour chaque protozoaire en utilisant le calcul:
(Oo) pourcentage de récupération kyste = ((Nombre d'échantillons QC - Compter à partir de l'échantillon non dopé) / Spike) x 100.
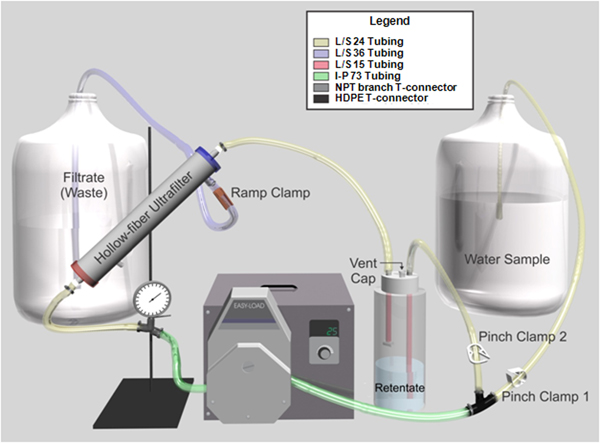
Figure 1. Représentation graphique du système d'ultrafiltration à flux tangentiel à fibres creuses. Le tube est un code de couleur à l'aide est l'assemblage du système.
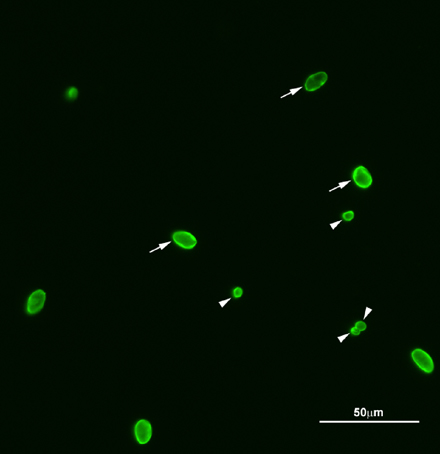
Figure 2. Représentant l'image de fluorescence de Cryptosporidium et Giardia (oo) kystes. Oocystes de Cryptosporidium et des kystes de Giardia ont été colorées avec des anticorps anti-FITC Cryptosporidium / Giardia anticorps. Flèches, Giardia kystes; pointes de flèches, des oocystes de Cryptosporidium. Un total de quatre oocystes de Cryptosporidium et des kystes de Giardia six ont été trouvés dans le plan focal. Les échantillons observateursed sous 200X grossissement.

. Figure 3 Représentant des images microscopiques des oocystes de Cryptosporidium et des kystes Giaridia utilisées pour la caractérisation des oocystes de Cryptosporidium (A - C).. Brillant vert-pomme de fluorescence FITC d'objets sphériques de 4 à 6 m de diamètre avec des bords brillamment mis en évidence (A) contenant jusqu'à quatre formes distinctes, bleu ciel noyaux au DAPI (B) et un à quatre sporozoïtes (s) par des oocystes (C). Les kystes de Giardia (D - F). Brillant vert pomme FITC fluorescence de ronde à des objets ovoïdes 8 - 18 pm de long par 5 à 15 um de largeur avec des bords brillamment mis en évidence (D) contenant jusqu'à quatre noyaux bleu ciel DAPI (E) et avec un ou plusieurs structure interne discernable tels en tant que noyaux (N), le corps médian (M) et ou axonèmes (A) (F). Les flèches blanches, brillantes de pomme verte fluorescence de coloration des oocystes de Cryptosporidium et Giardia kystes walls; pointes de flèches blanches, DAPI noyaux positifs. Les échantillons observés à la loupe 1000X.
Discussion
Tangentielle débit à fibres creuses d'ultrafiltration est une technique alternative et efficace pour la concentration initiale des oocystes de Cryptosporidium et des kystes de Giardia dans l'eau. Fibres creuses d'ultrafiltration est moins cher que les filtres traditionnels. Depuis il a la capacité de se concentrer des oocystes de Cryptosporidium et des kystes de Giardia à partir d'une variété de matrices d'eau différents, il est une alternative utile aux techniques de filtration actuelles utilisées pour la méthode EPA 1623. Comme avec la plupart des autres méthodes de filtration, d'ultrafiltration à fibres creuses est sujette à l'encrassement des échantillons très turbides. Eau à haute pression qui découlerait de l'encrassement du filtre, c'est pourquoi il est recommandé de surveiller la pression pendant la course de filtration. En plus de oocystes de Cryptosporidium et des kystes de Giardia, fibres creuses d'ultrafiltration a été montré qu'il était capable de se concentrer les bactéries et les virus 1-3,5,8. Fibres creuses d'ultrafiltration outlined dans cette méthode peut être utilisée pour concentrer des organismes multiples dans un seul échantillon. Il est à noter que l'obtention d'un volume final compris entre 200 et 250 ml est l'étape finale critique dans la procédure de concentration, afin que les étapes de centrifugation supplémentaires, qui peuvent entraîner une perte de kyste (oo), sont évités (étape 2.2). Cependant, ce qui permet le volume dans la bouteille d'abandonner trop faible peut avoir des effets défavorables sur les recouvrements car il ne sera pas un volume suffisant de liquide de forcer tous les oocystes ou des kystes dans la bouteille rétentat. Par conséquent, il est recommandé de maintenir un volume final compris entre 200 et 250 ml.
La chaleur de dissociation est une alternative à l'étape de dissociation acide dans la méthode 1623. Cette autre étape a été montré pour améliorer la récupération des oocystes de Cryptosporidium et de réduire la variation méthode lorsqu'il est isolé de la rivière soit ou 9 eau à réactif. Une comparaison côte à côte de l'acide et la chaleur de dissociation démontré que les méthodes utilisant la chaleur pour dissociationte les organismes des billes immunomagnétiques produit des recouvrements plus élevés pour les deux moyennes Cryptosporidium et Giardia. En outre, la précision des recouvrements Cryptosporidium et Giardia était meilleure dans les échantillons traités à la chaleur de dissociation par rapport à la dissociation acide 9.
L'incorporation de HFUF que l'étape de concentration permet une plus grande souplesse en offrant la possibilité de se concentrer de multiples organismes. En outre, il est une alternative moins coûteuse à la méthode de filtration options actuelles de 1623.
Déclarations de divulgation
L'Agence américaine de protection de l'environnement à travers son Bureau de la recherche et le développement en collaboration avec l'Office des eaux souterraines et le Centre de l'eau potable d'assistance technique financé la recherche décrite ici. Tous les travaux ont été soutenus sur le site de l'EPA des États-Unis, Cincinnati, Ohio. Bien que les informations décrites dans cet article a été financé en tout ou en partie par l'Agence américaine de protection de l'environnement sous contrat (contrat EP-C-06-031) à Shaw de l'environnement et de l'Infrastructure, Inc, il ne reflète pas nécessairement les vues de la Agence et aucune approbation officielle doit être déduite. Il a été soumis à examen de l'Agence et approuvé pour publication.
Remerciements
Nous tenons à remercier Ann Grimm et Michael Zimmerman, pour examen critique de ce manuscrit et Doug Hamilton pour son soutien technique.
matériels
| Name | Company | Catalog Number | Comments |
| Equipement / Réactif | Vendeur | Catalogue # | |
| Asahi Kasei Rexeed 25 S / R humides à fibres creuses ultrafiltres | Composez médicale | REXEED25S / R | |
| I / P 73 (Masterflex R-3603), ou équivalent | Cole Parmer | EW-06408-73 | |
| L / S 24 (Masterflex platinum), ou équivalent | Cole Parmer | EW-96410-24 | |
| L / S 15 (Masterflex platinum), ou équivalent | Cole Parmer | EW-96410-15 | |
| L / S 36 (Masterflex platinum), ou équivalent | Cole Parmer | EW-96410-36 | |
| I / P Entraînement Brushless de précision | Cole Parmer | EW-77410-10 | |
| I / P Chef Facile pompe de charge | Cole Parmer | EW-77601-10 | |
| Noir PEHD Tee, 1/4 "x 3/8" x 3/8 " | Plastiques US | 62064 | |
| Masterflex connecteur en T L / S 15-25 | Cole Parmer | Ex.-30613-12 | |
| Nalgene lourde bouteille pp L 1 | Cole Parmer | EW-06257-10 | |
| 10 ml Pipettes | Fisher Scientific | 13-678-11C | |
| Nalgene remplissage / purge bouchon pour 1/4 "tube, 53B | Cole Parmer | EW-06258-10 | |
| Manomètre | Cole Parmer | A-680-46-10 | |
| Raccord droit, NPT (F), 1/4 " | Cole Parmer | EW-06469-18 | |
| TNP branches de tés, pp naturelle | Cole Parmer | A-30610-75 | |
| Attaches de pincement, 1/2 " | Cole Parmer | EW-06833-00 | |
| Custom ajustement adaptateurs DIN | Moulé Products Corp | MPC-855NS.250 | |
| Anneau support | Fisher Scientific | 14-670b | |
| Pinces support annulaire | Fisher Scientific | 05-769-6Q | |
| Keck rampe de serrage, 14mm | Cole Parmer | EW-06835-10 | |
| Polyphosphate de sodium | Sigma-Aldrich | 305553 | |
| Thiosulfate de sodium pentahydraté | Sigma-Aldrich | 72050 | |
| Antimousse Y-30 émulsion | Sigma-Aldrich | A5758 | |
| Tween-80 | Sigma-Aldrich | P1754 | |
| 10 L cubitainer pliable en polyéthylène haute densité | VWR | IR314-0025 | |
| Centrifuger porte-bouteilles | Fisher Scientific | 05-663-103 | |
| 250 ml tubes à centrifuger coniques | Corning | 430776 | |
| Entonnoir jetable | Cole Parmer | U 6122-10 | |
| Pissette | Cole Parmer | U-06252-40 | |
| Centrifuger | Beckman Coulter | Allegra X-15R | |
| Rotor swing-out | Beckman Coulter | ARIES SX4750 | |
| Centrifuger adaptateurs baquets pour les tubes de 250 ml coniques | Beckman Coulter | 349849 | |
| 200 ul de gros calibre des pointes de pipette | Fisher Scientific | 02-707-134 | |
| VacuShield filtre | Gelman | 629-4402 | |
| 5 pipettes ml | Fisher Scientific | 13-678-11D | |
| Dynabeads: Cryptosporidium / Giardia combo kit | JeDexx | 73002 | |
| Tubes de 50 ml à centrifuger coniques | Faucon | 352098 | |
| Dynal L10 plats tubes face | IDEXX | 74003 | |
| Minuteur | VWR | 23609-202 | |
| Dynal MPC-6 aimant | IDEXX | 12002D | |
| 1 ml Pipettes | VWR | 53283-700 | |
| 1,5 ml à faible adhérence microtubes | Fisher Scientific | 02-681-320 | |
| 1000 pipette ul & conseils barrière correspondantes | Gilson | P1000/DF1000ST | |
| 100 pipette ul & conseils barrière correspondantes | Gilson | P100/DF100ST | |
| 9 pouces pipettes Pasteur | VWR | 14672-412 | |
| Dynal MPC-S aimant | IDEXX | 12020D | |
| Vortex | VWR | 14216-188 | |
| Mélangeur rotateurs Dynabeads | IDEXX | 94701 | |
| Bloc thermique | Fisher Scientific | 11-718-2 | |
| Perles Armure de laboratoire | Lab Armure | 42370-750 | |
| Thermomètre digital | Fisher Scientific | 15-077-60 | |
| Phosphate-tampon salin 1X pH 7,4 (PBS 1X) | Sigma | P4417 | |
| Diapositives seul endroit | IDEXX | 30201 | |
| Couverture de verre | Corning | 287018 | |
| EasyStain kit directe | BTF | - | |
| 10 pipette ul & conseils barrière correspondantes | Gilson | P10 & DF10ST | |
| 4 ', 6'-Diamidino-2-phényl-indole dichlorhydrate (DAPI) | Sigma | D9542 | |
| Vernis à ongles | Fisher Scientific | S30697 | |
| Le méthanol | Fisher Scientific | L6815 | |
| Kimwipes | Kimberly Clark | 34155 | |
| Incubateur | Boekel scientifique | 133000 | |
| glisser plus chaud | Fisher Scientific | 11-474-521 | |
| Huile à immersion, type A ND = 1,515 | Nikon | MXA20234 | |
| Nikon 90i microscope avec des capacités de DIC | Nikon | MBA 77000 | |
| Plan d'APO objectif 100x | Nikon | MRD01901 | |
| Planifiez Achro 20X | Nikon | MRL00202 | |
| Filtre FITC | Nikon | 96302 | |
| DAPI filtre | Nikon | 96301 | |
| X-Cite illuminateur de fluorescence | Nikon | 87540 | |
| Papier pour lentilles | Nikon | 76997 | |
| Biohazard sac jetable | Fisher Scientific | 01-829D | |
| Biohazard récipient pour objets tranchants | Fisher Scientific | 14-827-117 | |
| Peroxyde d'hydrogène à 3% | VWR | BDH3540-2 | |
| Javellisant | Fisher Scientific | 1952030 | |
| Wypall | Kimberly Clark | 34790 |
Références
- DiGiorgio, C. L., Gonzalez, D. A., Huitt, C. C. Cryptosporidium and Giardia recoveries in natural waters by using Environmental Protection Agency Method 1623. Appl. Environ. Microbiol. 68, 5952(2002).
- Hill, V. R., Kahler, A. M., Jothikumar, N., Johnson, T. B., Hahn, D., Cromeans, T. L. Multistate evaluation of an ultrafiltration-based procedure for simultaneous recovery of enteric microbes in 100-liter tap water samples. Appl. Environ. Microbiol. 73, 4218-4225 (2007).
- Hill, V. R., Polaczyk, A. L., Hahn, D., Narayanan, J., Cromeans, T. L., Roberts, J. M., Amburgey, J. E. Development of a rapid method for simultaneous recovery of diverse microbes in drinking water by ultrafiltration with sodium polyphosphate and surfactants. Appl. Environ. Microbiol. 71, 6878-6884 (2005).
- Hill, V. R., Polaczyk, A. L., Kahler, A. M., Cromeans, T. L., Hahn, D., Amburgey, J. E. Comparison of hollow-fiber ultrafiltration to the USEPA VIRADEL technique and USEPA method 1623. J. Environ. Qual. 38, 822-825 (2009).
- Holowecky, P. M., James, R. R., Lorch, D. P., Straka, S. E., Lindquist, H. D. Evaluation of ultrafiltration cartridges for a water sampling apparatus. J. Appl. Microbiol. 106, 738-7347 (2009).
- Lindquist, H. D., Harris, S., Lucas, S., Hartzel, M., Riner, D., Rochele, P., Deleon, R. Using ultrafiltration to concentrate and detect Bacillus anthracis, Bacillus atrophaeus subspecies globigii, and Cryptosporidium parvum in 100-liter water samples. J. Microbiol. Methods. 70, 484-492 (2007).
- Polaczyk, A. L., Roberts, J. M., Hill, V. R. Evaluation of 1MDS electropositive microfilters for simultaneous recovery of multiple microbe classes from tap water. J. Microbiol. Methods. 68, 260-266 (2007).
- Rhodes, E. R., Hamilton, D. W., See, M. J., Wymer, L. Evaluation of hollow-fiber ultrafiltration primary concentration of pathogens and secondary concentration of viruses from. 176, 38-45 (2011).
- Shaw, N. J., Villegas, L. F., Eldred, B. J., Gaynor, D. H., Warden, P. S., Pepich, B. V. Modification to EPA Method 1623 to address a unique seasonal matrix effect encountered in some U.S. source waters. J. Microbiol. Methods. 75, 445-448 (2008).
- Simmons, O. D. 3rd, Sobsey, M. D., Heaney, C. D., Schaefer, F. W. 3rd, Francy, D. S. Concentration and detection of Cryptosporidium oocysts in surface water samples by method 1622 using ultrafiltration and capsule filtration. Appl. Environ. Microbiol. 67, 1123-1127 (2001).
- Sobsey, M. D., Glass, J. S. Influence of water quality on enteric virus concentration by microporous filter methods. Appl. Environ. Microbiol. 47, 956-9560 (1984).
- USEPA. Method 1623: Cryptosporidium and Giardia in Water by Filtration/IMS/FA. Office of Water. 815-R-05-002, EPA. (2005).
- Ware, M. W., Wymer, L., Lindquist, H. D., Schaefer, F. W. 3rd Evaluation of an alternative IMS dissociation procedure for use with Method 1622: detection of Cryptosporidium in water. J. Microbiol. Methods. 55, 575-583 (2003).
- Zuckerman, U., Tzipori, S. Portable continuous flow centrifugation and method 1623 for monitoring of waterborne protozoa from large volumes of various water matrices. J. Appl. Microbiol. 100, 1220-1227 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon