Method Article
En synthèse in vitro de la maternelle, de l'espacement de longue fibreux et segmentaire collagène Espacement long
Dans cet article
Résumé
Des procédures simples et reproductibles sont décrits pour la fabrication de collagène trois ensembles structurellement distinctes à partir d'un type commun disponible dans le commerce monomère collagène I. Type natif, fibreux espacement long ou segmentaire collagène espacement de temps peut être construit en faisant varier les conditions dans lesquelles les 300 nm de long et 1,4 nm de diamètre bâtiment monomère bloc est exposé.
Résumé
Fibrilles de collagène sont présentes dans la matrice extracellulaire de tissus animaux pour fournir des échafaudages de construction et de résistance mécanique. Ces fibrilles de collagène natif ont une périodicité caractéristique des bandes de ~ 67 nm et sont formés in vivo à travers l'ensemble hiérarchique des monomères de collagène de type I, qui sont 300 nm et une longueur de 1,4 nm de diamètre. In vitro, en faisant varier les conditions dans lesquelles l' blocs de construction monomères sont exposés, allant des structures uniques dans des échelles de longueur allant jusqu'à 50 microns peuvent être construits, y compris non seulement les fibrilles de type indigène, mais aussi l'espacement fibreux longue et segmentaire collagène espacement longtemps. Ici, nous présentons les procédures pour former les trois structures différentes de collagène à partir d'un monomère collagène disponible dans le commerce commun. En utilisant les protocoles que nous et d'autres ont publié dans le passé pour faire de ces trois types conduisent généralement à des mélanges de structures. En particulier, les fibrilles non bagués étaient généralement found lors de collagène natif, et des fibrilles indigènes étaient souvent présents lors de collagène fibreux espacement longtemps. Ces nouvelles procédures ont l'avantage de produire du collagène de type désiré fibrilles presque exclusivement. La formation des structures désirées est vérifiée par imagerie à l'aide d'un microscope à force atomique.
Introduction
Le collagène est une classe de protéines structurelles qui ont une structure en triple hélice formée de trois chaînes polypeptidiques. Ces monomères triple hélice encore monter d'une manière hiérarchique pour former des structures plus en plus grands. Il existe au moins 28 types de collagène génétiquement différents qui ont été identifiés 1. Ensemble, collagènes représentent 30% des protéines totales chez les animaux, avec la comptabilité de type I forme prédominante pour un maximum de 90% de tous les 2 protéines de collagène. Collagène de type I se trouve que les structures fibrillous dans la peau, des ligaments, des tendons et des os. Microscope à force atomique (AFM) et microscopie électronique (EM) des images de type I fibres de collagène natif en général montrent des bandes avec une période caractéristique de ~ 67 nm (souvent appelé D-banding) 3-5.
Type I monomère collagène est une hétérotrimère triple hélice constituée de deux α1 identiques (I) et une chaîne α2 (I) de la chaîne, chaque plus d'unmille acides aminés de long. Elle est longue et mince avec des dimensions de 300 nm de longueur et 1,4 nm de diamètre. Type I monomère collagène peut être facilement obtenu en décomposant naturellement formées structures d'ordre supérieur 6. Nous 7 et de nombreux autres 8-10 ont montré que ces blocs de construction monomères solubles peuvent alors être utilisées pour reconstituer D-bandes fibrilles in vitro (figure 1).
En plus des fibrilles de collagène natif, deux autres structures du collagène ordre supérieur ont été trouvés pour former in vitro en utilisant le bloc de monomère même bâtiment. Les deux structures sont fibreuses espacement long (FLS) et segmentaire espacement long (SLS) collagène (figure 1). FLS collagène est une construction fibrillous comme le collagène natif, mais est caractérisée par une plus grande périodicité des bandes de collagène natif 11. In vitro, le collagène FLS se forme lorsque le monomère collagène est combiné avec α1-acide glycoprotéine 12. FLS collagène a été observée in vivo, ainsi, bien que rarement 13. SLS collagène est décrit comme cristallites parce que les monomères sont alignés dans le registre comme dans un réseau cristallin 14. SLS collagène se forme lorsque le monomère collagène est combiné avec l'adénosine triphosphate (ATP) 15. Naturelle de collagène SLS a été observée dans le milieu de culture des fibroblastes mais pas dans les échantillons de tissus extraits, probablement en raison de sa petite taille et l'absence de distinguer les caractéristiques topographiques 16.
L'objectif de cette revue est de présenter des procédures détaillées pour la fabrication de fibrilles de collagène naturel que FLS et de collagène ainsi SLS que même les chercheurs les plus inexpérimentés peuvent se reproduire. En utilisant des matériaux de pointe disponibles dans le commerce à partir, nous avons essayé de rendre les protocoles aussi simples que possible et toujours les faire travailler de manière fiable. Nous détaillons également comment utiliser un AFM pour caractériser la structure du collagène différentes qui sont faites. Ce travail sera bénéfique pour les chercheurs qui veulent étudier un ou plusieurs de ces structures supérieures de collagène de commande et / ou les utiliser comme précurseurs dans d'autres applications, mais ne disposent pas actuellement de l'expertise ou tout simplement ne veulent pas travailler avec des échantillons de tissus.
Protocole
REMARQUE: L'eau utilisée dans tous les protocoles a une résistivité> 18 MΩ.cm.
1. Les fibrilles de collagène natif
- Combinez 6 pl d'eau, 20 ul de 200 mM Na 2 HPO 4 ajusté à pH 7 avec HCl et 10 pl de 400 mM de KCl dans un tube de centrifugeuse et mélanger.
- Ajouter 4 pl de collagène monomère (~ 3 mg / ml dans du HCl 0,01 N) à la microtube et mélanger. La solution doit être limpide et incolore.
- Placer le tube de centrifugeuse contenant le mélange réactionnel dans un bloc de chauffage qui a été pré-chauffée à 37 ° C et laissé pendant 3 à 4 heures. À ce stade, la solution doit être légèrement trouble et contiennent principalement des fibrilles de collagène natif.
2. Le collagène fibreux Espacement long
- Dialyser 1 ml de collagène monomère (~ 3 mg / ml dans 0,01 N HCl) en utilisant 12-14 kDa MWCO membrane contre 400 ml d'eau, en changeant l'eau quatre fois sur une période de 24 heures à la température ambiante. Le collag dialysemonomère en qui n'est pas utilisé tout de suite peut être conservé à 4 ° C pour une utilisation ultérieure.
- Mélanger 20 ul d'eau, 20 pi de 3 mg / ml α1-glycoprotéine acide dans l'eau et 20 ul de collagène monomère dialyse dans un tube de centrifugeuse. La solution doit être limpide et incolore.
- Laisser le microtube contenant le mélange réactionnel à température ambiante pendant 30 min. À ce stade, la solution devrait être nuageux et contient des fibrilles de collagène principalement des services en français.
3. Segmentaire collagène Espacement long
- Mélanger 67 ul d'eau, 60 pl de 100 mM de glycine-HCl à pH 3,3 et 40 ul de 10 mg / ml d'ATP dans l'eau dans un tube de centrifugeuse et mélanger.
- Ajouter 33 ul de collagène monomère (~ 3 mg / ml dans du HCl 0,01 N) à la microtube et mélanger. La solution doit être limpide et incolore.
- Laissez le microtube contenant le mélange réactionnel à la température ambiante pendant 2 heures. À ce stade, la solution apparaîtra toujours clair, mais devraitcontiennent du collagène essentiellement SLS.
4. Caractérisation AFM
- Cliver la surface d'un morceau de mica lié à un substrat AFM en recouvrant la surface de mica avec un morceau de ruban adhésif, puis enlèvement par pelage. Vérifiez que le ruban après pour confirmer que toute une couche de mica a été coupé afin de réduire les irrégularités de la surface et de veiller à ce que l'ancien échantillon est retiré si le mica est réutilisé.
- Appliquer 20 ul de la solution de fibrilles de collagène au substrat de mica fraîchement clivé. Laissez-le pendant 5 min.
- Doucement rincer solution de fibrilles de collagène avec de l'eau. Il est conseillé de ne pas appliquer l'eau directement sur le centre du substrat de mica, mais au niveau du bord et à lui permettre de s'écouler à travers l'échantillon.
- Sécher la surface sous un léger courant d'azote gazeux. Il est conseillé de diriger le jet sur le bord et non au centre du substrat de mica.
- Sous un microscope optique à un grossissement de 200 ×,les échantillons de collagène natif et FLS devrait montrer des amas de fibrilles. Collagène SLS ne sera pas visible.
- Les caractéristiques uniques des trois structures du collagène différentes sont observables par l'AFM. En règle générale, nous fibrilles de collagène natif d'image avec un AFM en mode contact intermittent avec silicium sondes AFM, tandis que FLS et de collagène SLS fibrilles nous avons généralement l'image d'un AFM en mode contact à l'aide de nitrure de silicium sondes AFM. Nous faisons cela parce que de temps et de coût. Silicon sondes AFM sont en général plus forte que les sondes AFM en nitrure de silicium, qui les rendent particulièrement utile pour l'imagerie la plus étroite structure de tarification de fibrilles de collagène natif. Toutefois, le silicium sondes AFM sont beaucoup plus sujettes à la contamination par des échantillons de collagène que les sondes AFM en nitrure de silicium et le besoin de remplacer fréquemment. Par conséquent, nous nous réservons l'utilisation de sondes AFM en silicium pour la plupart des fibrilles de collagène natif d'imagerie où la résolution est une nécessité plus grande et nous fonctionnons en mode contact intermittent à prolong leur durée de vie utile.
Nous recommandons une première tranche de 100 × 100 um 2 Recherche qui devrait montrer au moins quelques constructions de collagène années. A partir de là, le zoom pour numériser des tailles de 10 × 10 um 2, puis 2 × 2 um 2 à observer la périodicité des bandes de collagène natif et FLS, ou les traits plus fins d'un collagène SLS. C'est aussi une bonne idée de vérifier au moins deux autres régions sur l'échantillon de collagène pour vérifier que les analyses initiales sont représentatifs.
Résultats
Le collagène natif
Le mélange réactionnel de ~ 0,3 collagène monomère mg / ml dans du phosphate 100 mM et 100 mM de KCl à pH 7 à gauche à 37 ° C pendant 3-4 heures permettra d'obtenir une solution contenant des fibrilles de collagène de type natif avec claire ~ 67 nm D-bandes, sans fibrilles non bagués.
Sous un microscope optique à un grossissement de 200 ×, des touffes de plusieurs fibrilles peuvent normalement être vu sur le substrat de mica en particulier lorsqu'il est vu par contraste d'interférence différentiel (DIC) Microscopie (figure 2). Dans un échantillon typique, de 100 × 100 um aléatoire 2 Recherche par AFM se montrent habituellement au moins un peu de fibrilles qui sont microns 5-50 longues (figures 3a-c). Individuelle, séparées par des fibrilles de collagène peut être facilement identifié à ce stade. Avec un 512 × 512 pixels balayage de l'image 2, le zoom dans une taille de 10 × 10 um balayage 2 montre que tous les fibrilles sont bagués (figures 3d-f ). Afin de mesurer avec précision la périodicité des bandes, il est préférable de zoomer sur une 2 × 2 format de numérisation um 2 (figures 3g-i).
Cerclage périodicité peut être déterminée simplement en mesurant la moyenne et la distance longitudinale entre plusieurs pics ou vallées. Par ailleurs, si le logiciel AFM permet, une transformation de Fourier unidimensionnelle transformer le long d'une section longitudinale peut également être utilisé. Figure 4 montre une image AFM d'une hauteur de fibrilles et un correspondant en coupe longitudinale.
FLS collagène
Le mélange réactionnel de 1 mg / ml μ1-glycoprotéine acide et ~ 1 monomère collagène mg / ml dans l'eau laissée à température ambiante pendant 30 min donnera une solution de fibrilles de collagène FLS.
Des amas de fibrilles, similaires à ce qui est observé dans le cas du collagène natif, on peut facilement voir sur le substrat de mica sous un microscope optique à 200 m ×agnification. Dans un échantillon typique, un échantillon aléatoire de 100 × 100 um 2 Recherche par AFM se montrent habituellement au moins un peu de fibrilles. Avec un 512 × 512 pixels 2 Taille balayage de l'image, la périodicité des bandes peut être mesurée par un zoom sur un 10 × 10 um 2 Recherche (figure 5a) ou plus précisément avec une 5c 2 × 2 um 2 Recherche (figure 5b). Figure montre une coupe longitudinale d'une fibrille de FLS.
SLS collagène
Le mélange réactionnel de 2 mg / ml ATP et ~ 0,5 mg / ml de collagène monomère dans 100 mM de glycine-HCl à pH 3,3 tampon laissé à température ambiante pendant 2 h va donner une solution de collagène SLS.
En règle générale, les cristallites SLS ne sera pas visible au microscope optique. Un AFM est nécessaire pour confirmer la présence de cristallites SLS. Dans un échantillon typique, un échantillon aléatoire de 100 × 100 um 2 Recherche par AFM se montrent habituellement un grand nombrepoints. Zoomer dans un 10 × 10 um 2 Recherche se montrent habituellement plusieurs cristallites SLS (Figure 6a). Et un 2 × 2 um 2 Recherche (figure 6b) montre la structure fine d'un cristallite SLS.
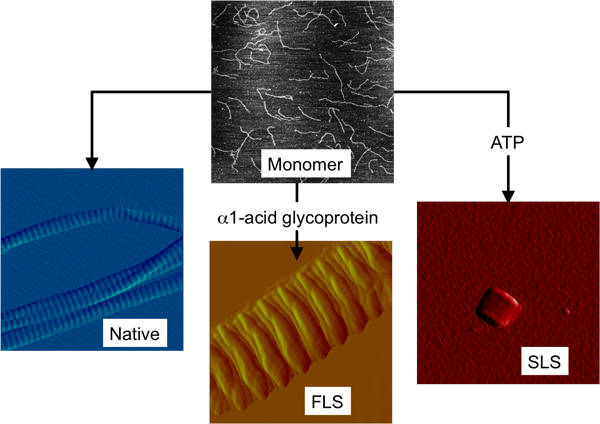
Figure 1. Les trois formes de structure différente de fibrilles de collagène que l'on peut former in vitro à partir de monomères de collagène. Images AFM montrant monomère collagène et les trois plus élevés structures du collagène ordre tout à l'échelle même taille (2 × 2 um 2).
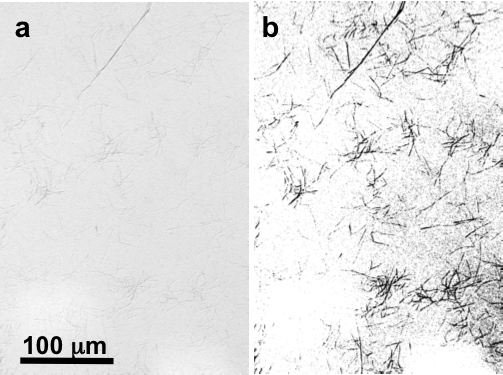
Figure 2. D'image numérique à ~ 200 grossissement au microscope optique DIC de fibrilles de collagène natif de mica (a) intact et (b) à seuil et aiguisée to mettre en évidence des fibrilles.

Figure 3. Images AFM de fibrilles de collagène natif sur le mica. Intermittents en mode de contact AFM images d'amplitude sont présentés.

Figure 4. (A) 0,5 × 1 um 2 Mode de contact intermittent hauteur AFM image (échelle verticale = 100 nm) et (b) en coupe longitudinale d'une fibrille collagène natif.

Figure 5. Images AFM de fibrilles de collagène FLS sur le mica. (A) 10 × 10 um 2 contact mode image déviation AFM, (b) 2 × 2 um 2 contact mode image déviation AFM et (c) longitudinalecoupe d'une fibrille collagène FLS.

Figure 6. Images AFM de collagène SLS sur le mica. Intermittents en mode de contact AFM images d'amplitude sont présentés.
Discussion
Purifié monomère collagène est stable à un pH faible et la température et la formation de fibrilles de collagène natif consiste essentiellement à élever le pH et la température de la solution de monomère de collagène. Procédures pour la reconstitution des fibrilles de collagène bandes de monomères existent depuis plus de 50 ans. La procédure que notre laboratoire utilisés dans nos premières études avec le collagène il ya 15 ans 7 est basée sur les procédures résumées par Chapman et ses collègues en 1986 10. Les conditions de formation de fibrilles de collagène dans ce travail plus tôt étaient de 0,18 mg / ml de monomère de collagène dans Na 2 HPO 4 / KH 2 PO 4 (I = 0,2, pH 7,4) à 34 ° C. L'inconvénient de cette et d'autres procédures que nous avons essayé, c'est qu'il ya toujours des fibrilles formées bagués aux côtés des fibrilles souhaitées bandes. Les nouvelles conditions sont ~ 0,3 mg / ml de collagène dans un monomère phosphate 100 mM et 100 mM de KCl à pH 7 à gauche à 37 ° C pendant 3-4 h. La procéduredure décrite ici diffère dans chaque aspect de la procédure antérieure pour faire des fibrilles de collagène natif. Mais le plus notable, nous avons doublé la force ionique en augmentant la concentration du tampon et en ajoutant 100 mM de KCl. L'augmentation de la force ionique résultats en formation plus cohérente des fibrilles de collagène exclusivement baguées.
D'après notre expérience, les seules fois que cette procédure n'a pas donné de collagène de type natif, c'est quand la solution de monomère collagène était passé date recommandée par le fabricant d'utilisation. Lorsque cela se produit, ce qui est observé varie de moins de fibrilles qui sont tous bagués à des fibrilles encore beaucoup observés, mais surtout sans bague. Notez que le collagène monomère a expiré ne peuvent encore souvent être utilisé avec succès pour la fabrication du collagène natif, mais quand il tombe en panne, monomère de nouveau collagène doit absolument être acheté.
FLS a d'abord été identifié par Highberger et al. 17 dans les préparations de collagène crédité Orekhovich et coll. 18. D'autres études conduit Highberger et Schmitt à conclure qu'il était glycoprotéine α1-acide qui favorise la formation de FLS 12. Nous avons par la suite en mesure de reproduire la procédure de mise collagène FLS en combinant monomère collagène disponible dans le commerce et α1-glycoprotéine acide à pH bas et lentement pour permettre le pH à augmenter de dialyse du mélange à l'eau pendant 24 heures 11. Nous présentons maintenant une modification de cette procédure par la dialyse du monomère collagène contre l'eau d'abord et tout simplement en le combinant avec α1-glycoprotéine acide dans l'eau pour former le collagène FLS. Les conditions de FLS collagène montage décrites ici sont beaucoup moins de temps. Le monomère collagène doit encore être pré-dialyse contre l'eau, mais il peut être fait en vrac, puis conservés à 4 ° C de façon stable jusqu'à ce qu'il soit utilisé. Cela donne nouvelle procédure FLS principalement fibrilles de collagène bandes.
D'après notre expérience, α1-glycoprotéine acideprotéine avec une faible teneur en protéines et de l'eau combinée, ainsi que par la teneur en sucre plus élevée inférence, est essentielle pour réussir à faire fibrilles FLS. En général, nous vérifier auprès du fabricant que le lot glycoprotéine α1-acide que nous utilisons a une teneur en protéines combiné% et de l'eau de 82 ou moins. Et comme la procédure pour la synthèse du collagène natif, monomère collagène qui est trop vieux peut également entraîner l'échec à produire du collagène FLS. En outre, la pureté de l'eau utilisée pour la dialyse est essentiel dans cette procédure. Par exemple, la dialyse de monomère collagène contre, même ~ 8 MΩ.cm plutôt que de l'eau> 18 résultats MΩ.cm dans une solution de collagène qui ne sera pas former le collagène FLS.
Parmi les trois types de fibrilles de collagène, la plus facile à faire est le collagène SLS. La première préparation de SLS a été décrit par Schmitt et ses collègues 15. Nous avons publié une adaptation de cette procédure il ya 12 ans pour la fabrication de collagène à l'aide SLS coll disponible dans le commerceagen 14. La procédure entraîne simplement la combinaison de 2 mg / ml ATP et 0,5 mg / ml de collagène monomère à 0,05% (v / v) d'acide acétique à pH 3,5 et en laissant le mélange à température ambiante pendant une nuit.
Dans notre expérience, l'aspect critique de l'ensemble SLS qui doit être contrôlé est le pH de la solution réactionnelle. SLS assemblés dans des conditions plus basiques (pH ~ 3.6-3.9) se traduit par des amas de cristallites agrégés. Des conditions plus acides (pH ~ 2.9 à 3.2) se traduit par plus minces, plus cristallites séparés que ceux assemblés dans les conditions idéales de pH 3.3 à 3.5. PH de réaction en dehors de cette plage (<2,8 et> 4) ne rapportent aucun collagène SLS. Dans le passé, on a ajusté le pH du mélange réactionnel par addition d'acide acétique. Pour simplifier la procédure encore plus loin, dans ce manuscrit, nous avons introduit un tampon glycine-HCl pour contrôler le pH.
Les trois structures différentes de collagène formés à partir des protocoles décrits ci-dessus ont un caractèrecaractéristiques réalistes qui ne peut être perçue que par des instruments capables d'une résolution nanométrique. Le collagène natif et FLS sont caractérisées par des bandes périodicités de ~ 67 nm et ~ 270 nm. La dimension la plus longue de collagène SLS est juste ~ 360 nm. Nous avons décrit précisément comment nous utilisons un AFM pour caractériser les trois structures du collagène différents. Cependant, toute exploitation AFM en contact ou en mode contact intermittent avec une sonde AFM ayant un rayon <10 nm devrait également être en mesure à l'image de ces structures de collagène. En outre, la microscopie électronique peut être et a été utilisée pour caractériser ces structures de collagène 19.
Le principal avantage de ces procédures est qu'elles produisent principalement du collagène souhaité construire. La seule autre forme de collagène qui se trouve dans ces réactions est le monomère de départ, ce qui est souvent visible en arrière-plan des images AFM. Dans le cas de collagène natif et FLS, ils peuvent être facilement séparé de la majeure partie du déraimonomère DECT par centrifugation répétée et le lavage de la maternelle résultant ou FLS collagène granulés avec de l'eau.
Nous avons présenté des procédures simples et fiables pour faire des indigènes, FLS et de collagène SLS grâce aux fonctionnalités avancées, disponibles dans le commerce des matières premières. Le monomère collagène utilisé dans l'ensemble de ces procédures est disponible dans le commerce sous une forme purifiée. α1-glycoprotéine acide et l'ATP sont également tous deux disponibles dans le commerce.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous tenons à remercier tous les nombreux passées de premier cycle, les étudiants diplômés et postdoctoraux qui ont contribué de leur temps et d'efforts à l'étude de la fibrogenèse collagène dans notre laboratoire. En sciences naturelles et en génie du Canada a toujours fourni des fonds pour nos études de collagène.
matériels
| Name | Company | Catalog Number | Comments |
| Matériel / réactif | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| Monomère de type collagène I (~ 3 mg / ml dans du HCl 0,01 N) | Inamed Avancée Biomatrix | 5409 5005-B | Lot 1261443 (2,9 mg / ml, pH 2,1) Lot 1629346 (3,2 mg / ml, pH 2,1) Lot 6006 (3,2 mg / ml, pH 2,1) |
| ATP | Biochimiques de recherche internationaux | A-141 | Lot FBJ-1194A |
| α1-glycoprotéine acide à partir de plasma bovin | Sigma-Aldrich | G3643 | Lot 051K7440 (89,8%) Lot 011K7410 (82%) Lot 065K7405 (71,2%) Lot 063K7495 (71,9%) Lot 117K7535 (75,9%) (Teneur en eau des protéines +) |
| a1-acide glycoprotein de plasma humain | Sigma-Aldrich | G9885 | Lot 128H7606 (70,9%) Lot 049K7565V (68%) (Teneur en eau des protéines +) |
| mica | Ted Pella | 53 | |
| Pointprobe - Silicon SPM-Sensor | Nanomonde | NHC | Silicon AFM sonde que nous utilisons pour le mode contact intermittent |
| Conseils Nanoprobe Veeco | Veeco (Maintenant Bruker sondes AFM) | NP-S | Le nitrure de silicium AFM sonde que nous utilisons pour le mode de contact |
Références
- Kadler, K. E., Baldock, C., Bella, J., Boot-Handford, R. P. Collagen at a glance. J. Cell Sci. 120, 1955-1958 (2007).
- Abraham, L. C., Zuena, E., Perez-Ramirez, B., Kaplan, D. L. Guide to Collagen Characterization for Bio Studies. J. Biomed. Mat. Res. 87B, 264-285 (2008).
- Baselt, D. R., Revel, J. -. P., Baldeschwieler, J. D. Subfibrillar Structure of Type I Collagen Observed by Atomic Force Microscopy. Biophys. J. 65, 2644-2655 (1993).
- Petruska, J. A., Hodge, A. J. A Subunit Model for Tropocollagen Macromolecule. Proc. Natl. Acad. Sci. U.S.A. 51, 871-876 (1964).
- Smith, J. W. Molecular Pattern in Native Collagen. Nature. 219, 157-158 (1968).
- Gross, J., Highberger, J. H., Schmitt, F. O. Extract of collagen from connective tissue by neutral salt solutions. PNAS. 41, 1-7 (1955).
- Gale, M., Pollanen, M. S., Markiewicz, P., Goh, M. C. Sequential assembly of collagen revealed by atomic force microscopy. Biophys. J. 68, 2124-2128 (1995).
- Wood, G. C., Keech, M. K. The formation of fibrils from collagen solutions. Biochem. J. 75, 588-597 (1960).
- Williams, B. R., Gelman, R. A., Poppke, D. C., Piez, K. A. Collagen Fibril formation. J. Biol. Chem. 253, 6578-6585 (1978).
- Holmes, D. F., Capaldi, M. J., Chapman, J. A. Reconstitution of collagen fibrils in vitro; the assembly process depends on the initiating procedure. Int. J. Biol. Macromol. 8, 161-166 (1986).
- Paige, M. F., Rainey, J. K., Goh, M. C. Fibrous long spacing collagen ultrastructure elucidated by atomic force microscopy. Biophysical Journal. 74, 3211-3216 (1998).
- Highberger, J. H., Gross, J., Schmitt, F. O. The interaction of mucoprotein with soluble collagen; an electron microscope study. PNAS. 37, 286-291 (1951).
- Ghadially, F. N. . Ultrastructural pathology of the cell and matrix. , (1988).
- Paige, M. F., Goh, M. C. Ultrastructure and assembly of segmental long spacing collagen studied by atomic force microscopy. Micron. 74, 355-361 (2001).
- Schmitt, F. O., Gross, J., Highberger, J. H. A new particle type in certain connective tissue extracts. PNAS. 39, 459-470 (1953).
- Bruns, R. R., Hulmes, D. J. S., Therrien, S. F., Gross, J. Procollagen segment-long-spacing crystallites: their role in collagen fibrillogenesis. PNAS. 76, 313-317 (1979).
- Highberger, J. H., Gross, J., Schmitt, F. O. Electron microscope observations of certain fibrous structures obtained from connective tissue extracts. JACS. 72, 3321-3322 (1950).
- Orekhovich, V. N., Tustanovsky, A. A., Orekhovich, K. D., Plotnikova, N. E. O prokollagene kohzi. Biokhimiya. 13, 55-60 (1948).
- Lin, A. C., Goh, M. C. Investigating the ultrastructure of fibrous long spacing collagen by parallel atomic force and transmission electron microscopy. Proteins. 49, 378-384 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon