Method Article
Imagerie et de reconstruction 3D de structures vasculaires cérébraux embryonnaires poisson zèbre
Dans cet article
Résumé
Imagerie du développement vasculaire cérébral chez le poisson zèbre larvaire est décrite. Techniques pour faciliter l'imagerie 3D et modifier le développement vasculaire cérébral en utilisant des traitements chimiques sont également fournis.
Résumé
Poisson zèbre constituent un outil puissant pour étudier la biologie du développement et de la pathologie in vivo. La petite taille et de la transparence relative des embryons de poisson zèbre les rendent particulièrement utiles pour l'examen visuel des procédés tels que le cœur et le développement vasculaire. Dans plusieurs études récentes Poisson-zèbre transgénique qui exprime l'EGFP dans les cellules endothéliales vasculaires ont été utilisés pour analyser l'image et des réseaux vasculaires complexes dans le cerveau et de la rétine, en utilisant la microscopie confocale. Les descriptions sont fournies à préparer, traiter et l'image embryons de poisson zèbre qui expriment la protéine fluorescente verte (EGFP), puis de générer des rendus 3D complets du système vasculaire cérébral. Protocoles comprennent le traitement des embryons, l'imagerie confocale, et les protocoles de fixation qui préservent la fluorescence de l'EGFP. En outre, des conseils utiles sur l'obtention d'images de haute qualité des structures vasculaires cérébraux, tels que l'élimination de l'œil sans endommager les tissus nerveux à proximité sont fournies. Les pièges à éviteravec l'imagerie confocale sont discutés, ainsi que les mesures nécessaires pour générer des reconstructions 3D à partir de piles d'images confocale en utilisant librement les logiciels open source.
Introduction
Poisson zèbre fournir un système puissant pour étudier la biologie du développement, et la relative transparence de leurs embryons se prête à des études fondées sur l'imagerie 1. Le poisson zèbre a été utilisé comme un modèle pour le développement des vertébrés pendant des décennies. Téléostéens, y compris le poisson-zèbre, ont un système vasculaire vertébré simplifiée qui n'a pas homologue raisonnable chez les invertébrés. Le sang est pompé à partir de la chambre antérieure d'un coeur à deux chambres par des branchies, où il est oxygéné. Le sang des branchies converge à l'aorte dorsale et passe à travers les artères qui se ramifient en vaisseaux plus petits et plus petits, éventuellement capillaires profonds dans des tissus d'organes. De capillaires oxygène est libéré et le dioxyde de carbone est absorbé. Du côté veineux de capillaires flux sanguin dans les veines plus en plus grandes et est finalement aspiré dans la chambre postérieure du cœur, où le cycle se répète.
Un poisson zèbre adulte peut pondre plus de 200 œufs à la fois, et once fécondé, ils développent rapidement 2. Après une journée de l'axe du corps est bien développé, y compris les muscles ce contrat et se déplacent à l'intérieur de l'embryon la membrane chorionique. De 2-7 jours après la fécondation (DPF) la plupart des systèmes de l'organisme à développer, y compris les yeux et un système nerveux central qui peuvent coordonner nageant vers la nourriture ou à l'écart de la lumière vive. Jusqu'à sept embryons de dpf sont suffisamment petites pour permettre la visualisation par microscopie. Les lignées transgéniques qui expriment des protéines fluorescentes peuvent être imagées par microscopie confocale ou fluorescence. Imagerie confocale peut être couplé avec un logiciel open-source 3 pour créer des rendus 3D de structures vasculaires complets dans embryons de poissons zèbres qui offrent un point de vue des systèmes de biologie du développement vasculaire. Études concernés par des changements dans la complexité vasculaire et cérébro-vasculaire bénéficieront de ce protocole, car elle permet une analyse au niveau des systèmes de réseaux vasculaires 4,5. Une compilation des méthodes et des ressources sont de fournird pour permettre l'adoption simple et de ces techniques pour les études qui nécessitent l'imagerie des structures vasculaires chez le poisson zèbre embryonnaire. Le rapport coût-efficacité de poisson zèbre comme modèle animal est de combiner les technologies émergentes d'imagerie pour fournir de nouvelles plates-formes permettant d'évaluer les effets angiogéniques de voies moléculaires dans le développement des vertébrés et de l'homéostasie.
Protocole
1. Poisson zèbre élevage, Embryon génération, et le traitement
- Effectuer les protocoles de poisson zèbre suivants sous la direction d'un soin des animaux et l'utilisation comité institutionnel (IACUC) et dans les directives de protection des animaux du NIH ou d'autres organes / directives réglementaires.
- Souches de poisson zèbre qui expriment des protéines fluorescentes dans des tissus spécifiques, les cellules ou d'organes sont disponibles auprès du Centre de ressources international poisson zèbre (ZIRC). Par exemple, Tg (kdr: EGPF) S843 exprimer EGFP dans les cellules endothéliales vasculaires 6, qui peuvent être utilisés pour produire des structures vasculaires 3D complètes, comme indiqué dans ce protocole. D'autres lignes de poisson zèbre transgénique sont disponibles à partir ZIRC.
- Maison de poisson zèbre adulte dans un système d'aquaculture approprié qui surveille le pH, la salinité, la température, l'oxygène dissous, la lumière, et d'autres facteurs environnementaux 7. Le poisson zèbre montré ici ont été logés dans un système Aquaneering Inc. (San Diego, CA) à 28,5 ° C avec une lig 14 heuresht/10 heures cycle d'obscurité. Nourrir le poisson zèbre adulte une alimentation équilibrée de la crevette de saumure et la BDNI 4/6 poisson alimentaire (Brine Shrimp Direct, Ogden, Utah).
- Le mâle adulte et le poisson zèbre femme en âge de reproduction devraient être hébergés séparément pour augmenter l'accouplement.
- Stimuler la ponte et la fécondation en plaçant les femelles (2-4) et les hommes (4-6) ensemble dans un récipient d'accouplement qui a un fond de maille avec des trous assez grands pour que les oeufs tombent à travers, mais trop petit pour les adultes de poisson zèbre à passer . Mettre en place des accouplements la veille; les œufs sont pondus près de l'aube, généralement tout le cycle de lumière de jour augmente lentement en intensité (l'aube). Vérifier la liste des oeufs au fond du récipient d'accouplement toutes les 15-30 minutes.
- Ramassez les œufs à l'aide d'une passoire et propre avec un tampon E3 (5 mM de NaCl, KCl 0,17, 0,33 mM de CaCl2 0,33 mM MgSO 4). Transférer les œufs à 100 plaques de culture mm remplis de tampon E3 et magasin dans un incubateur à 28 ° C.
- Pour étudier les produits chimiques qui modifient cerebrovascular ramification ajouter concentrations chimiques désirées. Par exemple neovasular ramification peut être induite par un inhibiteur γ-sécrétase (GSI IX/DAPT/N- [N-(3,5-Difluorophenacetyl-L-alanyl)]-S-ester phenylglycinet-butyl) solubilisé dans du DMSO 4, en commençant 24 heures après la fécondation (HPF). À ce moment-points embryons sont encore dans le chorion, et de nombreux produits chimiques peuvent traverser 8. Si une condition de traitement a neuronaux ou moteur effets qui peuvent nuire à la capacité des embryons de se libérer du chorion, alors embryons doivent être dé-chorionated entre 24 et 48 HPF, qui peut être fait soit avec une pince de pronase 2. Embryons figurant dans les images fournies ont été dechorionated en saisissant doucement le chorion avec deux pinces acérées et déchirer ouvert.
- Si nécessaire / on le souhaite, la formation de pigment peut être inhibée par l'ajout de 0,003% de N-phénylthiourée (PTU) à la mémoire tampon E3 à 24 hpf.
2. Imagerie confocale de cérébrovasculaire Structres en fixe embryons de poisson zèbre
- Sacrifier des embryons dans 250 mg / L Tricaine méthanesulfonate, puis les fixer par immersion dans de 2 - 4% de paraformaldéhyde pendant une nuit à 4 ° C. Conteneurs avec des embryons fluorescents doivent être enveloppés dans du papier. Une fois fixée, les embryons doivent être conservés dans du PBS à 4 ° C jusqu'à imagée - EGFP intensité de fluorescence devient moins résolu après environ une semaine, mais la morphologie (vu dans le domaine lumineux) est conservée beaucoup plus longtemps.
- Préparer pour monter l'embryon en retirant d'abord un œil à l'aide d'une aiguille de tungstène aiguisées. Couper autour du tissu conjonctif de l'œil d'abord, puis couper les muscles, et enfin couper le nerf optique pour déplacer l'œil. (Remarque: Si l'imagerie supprimer deux côtés on veut les deux yeux.)
- Une fois l'œil est enlevé, monter l'embryon sur une lamelle en utilisant une baisse de 3% de méthylcellulose. Orienter l'embryon ainsi que le côté avec l'œil enlevé est confrontée à la lamelle et est aussi proche de la vitre que possible. Couvrir l'ensemble embryon méthyllcellulose pour éviter la dessiccation pendant la formation d'image.
- L'image de l'embryon monté immédiatement en utilisant un microscope confocal inversé équipé d'un objectif de haute qualité 20x Plan Apo (ouverture numérique = 0,75 ou mieux). Cette configuration est préférable à un microscope non-inversée qui exigerait l'embryon en sandwich entre deux plans de verre, et en appuyant sur l'embryon contre la vitre supérieure.
- Recueillir tranches optiques dans une um incréments l'aide d'un réglage d'ouverture moyenne ou grande. Les grandes étapes de 2,5 um peuvent également être utilisés, mais il peut être plus difficile de déterminer l'ordre spatial de petits objets. Petites ouvertures produisent des détails plus précis, mais les analyses plus nécessaires peuvent blanchir EGFP et aussi de limiter la profondeur de l'imagerie dans l'embryon qui peut être atteint. Un microscope confocal permet une imagerie à mi-chemin à travers un embryon.
- Si l'imagerie du poisson entier, enlever les deux yeux au début (voir la note à l'étape 3.2), tourner l'embryon après Imaging un côté et répétez les étapes 2.3 à 2.5 pour le côté opposé.
3. Reconstruction 3D de poisson zèbre embryonnaire Cerebrovasculature
- Utilisez la distribution Fidji 3 de l'open source ImageJ (http://fiji.sc), qui est optimisé pour les rendus 3D, gratuit et compatible avec PC, Mac et Linux.
- Importation piles confocale à Fidji en allant à Plug-ins> LOCI> BioFormats Importateur 9, puis sélectionnez le fichier confocale, par exemple name.ids pour piles Nikon (figure 2A). Sélectionnez Afficher pile avec le mode HyperStack, Couleur: gris, consultez l'échelle automatique, consultez canaux divisés.
- Ces sélections ouvrir quatre panneaux de canaux séparés; pour EGFP seul sera nécessaire, habituellement le troisième vers le bas. Fermez les trois autres panneaux (rouge, bleu et alpha) laissant l'image 16 bits avec un nom long suivi par C = 1 (figure 2A).
- Régler le seuil de balayage si l'image en utilisant le défilement tab le long du fond pour trouver une tranche qui a la région ou de la structure d'intérêt, puis aller à Image> Réglages> Seuil (figure 2C).
- Dans le panneau qui s'affiche, faites glisser la barre du haut (niveau de noir) vers la gauche de sorte que la structure peut être bien vu sur fond, et laisser la lame de fond (niveau de blanc) où il est (figure 2D). Sélectionnez B & W, sélectionnez fond foncé. Ne sélectionnez pas de seuil de calculer pour chaque image moins que d'autres ajustements sont nécessaires pour chaque tranche, sélectionnez fond noir. Ce processus crée une nouvelle image 8 bits.
- AVERTISSEMENT: Seuil ne peut être annulée ou enregistré dans ImageJ, si la pile confocale devra être rechargé à chaque fois qu'un changement est nécessaire. Notez les numéros et essayer différents réglages jusqu'à ce que le résultat escompté est atteint.
- Aller au Plug-ins> 3D Viewer> Seuil 0, rééchantillonnage facteur 1 (meilleur) ou 2 (bien), désactivez les cases rouges et bleu pour faire une sortie 3D vert - sinon il will produire un rendu blanc - sélectionnez Appliquer (non automatique) (figure 2E).
- Tourner, tourner et agrandir l'image 3D à l'aide de la souris et des commandes clavier (figure 2F).
- Enregistrer des images fixes à n'importe quel moment en utilisant l'option de capture dans le menu. La taille de la boîte de l'image sur l'écran dicte dimensions en pixels de l'image produites si une image haute résolution est désirée marque la grande boîte en faisant glisser le coin inférieur droit.
- Créer un film filature 3D en sélectionnant Affichage> Enregistrer une rotation de 360 ° (figure 2G). Rotation par défaut à 2 degrés par étape, mais il peut être modifié à 5 degrés par exemple, ce qui créera des tailles de fichiers beaucoup plus petits, mais peuvent ajouter saccades de l'animation.
- Enregistrez le fichier dans l'un des nombreux formats disponibles pour les visionner plus tard avec les lecteurs multimédias, les télécharger sur Internet, ou à l'aide de présentations PowerPoint. Le lecteur multimédia open source, VLC ( http :/ / www.videolan.org / vlc / index.html), est gratuit et gère ces vidéos très bien.
Résultats
Reconstruction 3D de structures vasculaires fournit une perspective globale et visuellement intéressant de développement du poisson zèbre. Figures 1 et 2 montrent que les méthodes qu'ils généralement effectuées. Figure 3 montre plusieurs angles de structures vasculaires dans une 6 dpf embryon de poisson zèbre qui a exprimé EGFP dans les cellules endothéliales. Avec une couleur verte ou blanche solide, il peut être difficile d'apprécier l'intensité du signal; pseudo-coloration fournir intensité de l'image à partir d'une consultation table et permet une meilleure perception de la profondeur où les structures se chevauchent. Un exemple d'une image en 3D de pseudo-couleur de la vascularisation dans un 6 dpf poisson zèbre est fourni à la figure 4. Fluorescence imagerie d'embryons vivants peut être utilisé pour étudier des caractéristiques physiologiques qui comprennent l'œil et le mouvement du corps, et l'activité cardiaque. Figures 3 et 4 montrer des résultats représentatifs obtenus avec ces méthodes, en utilisant la ligne de poisson zèbre transgénique décrit. résolution d'imagerie dépend des caractéristiques du microscope, mais la luminosité du signal EGFP est suffisante pour une bonne qualité d'image avec la plupart des systèmes commerciaux. La reconstruction et le rendu des représentations 3D est cohérente et options dans ce logiciel open-source offrent toujours de bons résultats.
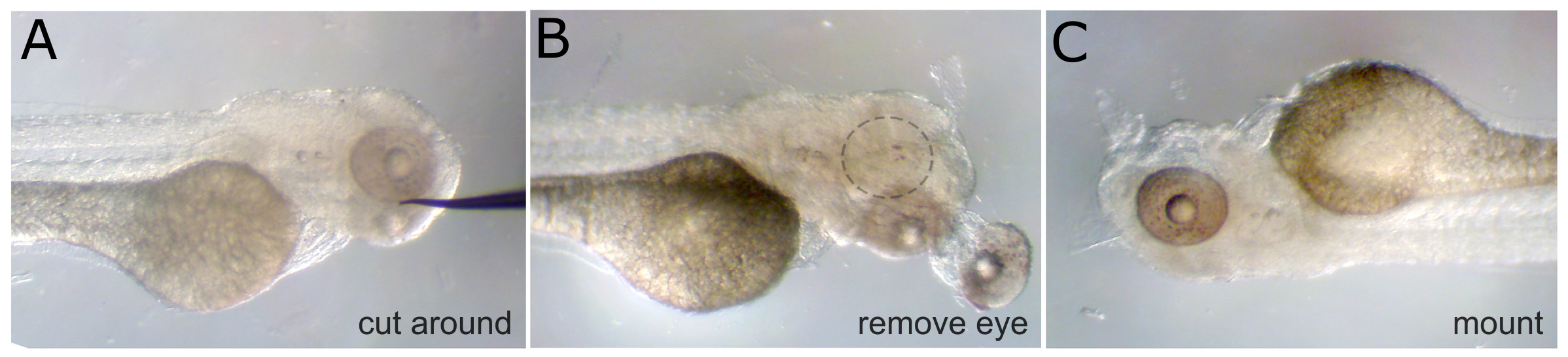
Figure 1. Élimination des yeux. A) fixe 3 dpf embryon avec un besoin de tungstène placé à côté de l'œil. Tissu est coupé autour de l'oeil de cette position. B) L'œil est tombe et les muscles oculaires sous-jacents et du nerf optique sont coupés. L'orbite vide est indiqué avec le cercle en pointillés. C) Le même embryon est retourné et monté avec méthyl-cellulose, à l'œil intact vers le haut. hres.jpg "target =" _blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
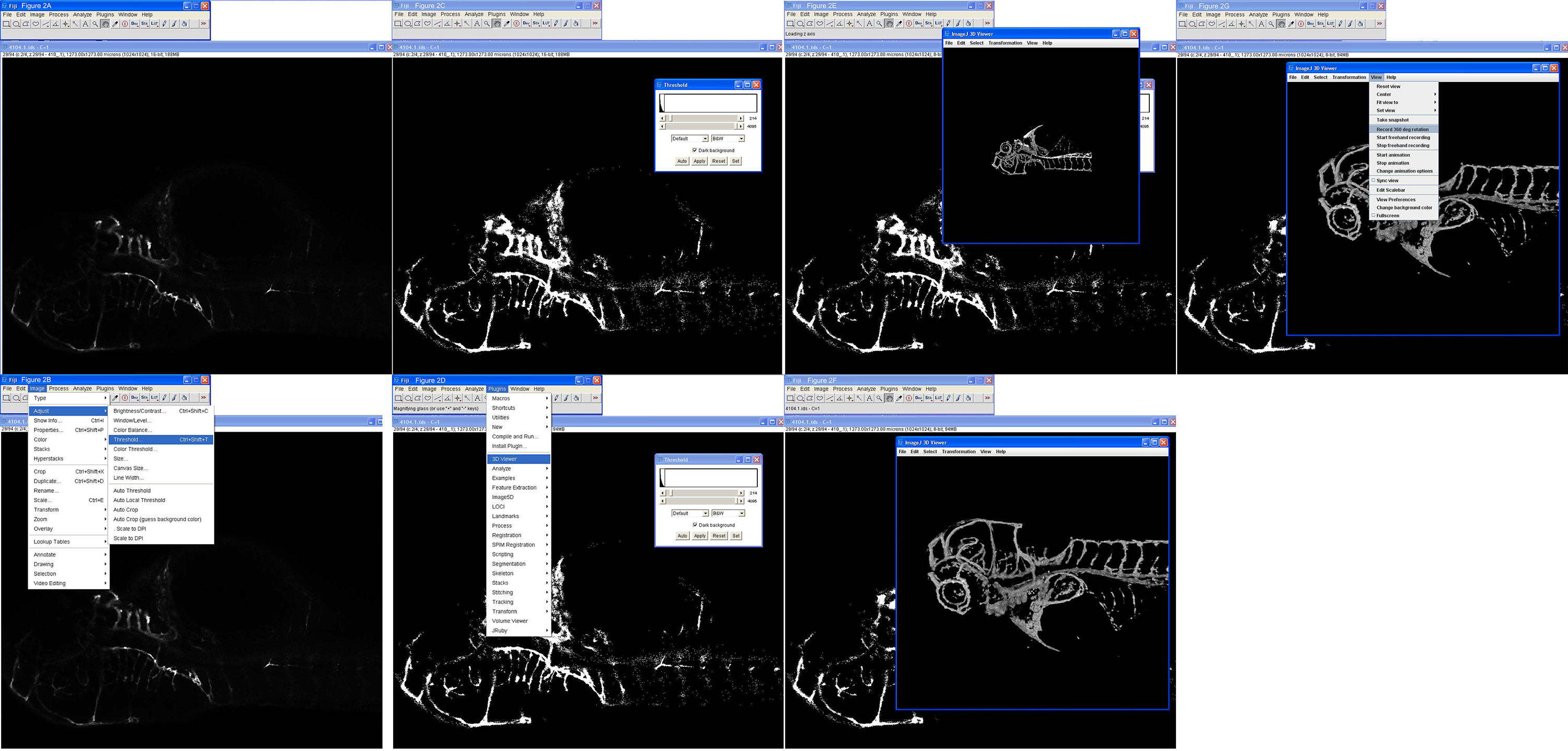
Figure 2. Étape par étape de la reconstruction en 3D d'une pile d'images confocale. A) Ouvrir le fichier (4104.1.ids) chargé dans Fidji utilisant Plug-ins> LOCI> BIOFORMAT pour sélectionner. B) Après avoir trouvé une tranche de la zone d'intérêt, le réglage de seuil est choisi comme indiqué. C) Le seuil est ajusté à 214 en utilisant le haut curseur et appliquer est sélectionné. spectateur D) 3D est appelé comme indiqué. E) La reconstruction 3D est représenté d'un poisson zèbre à l'œil intact, pour l'orientation. F) L'image a été agrandie et rotation. G) Un film de rotation de 360 degrés est faite comme indiqué. res.jpg "target =" _blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
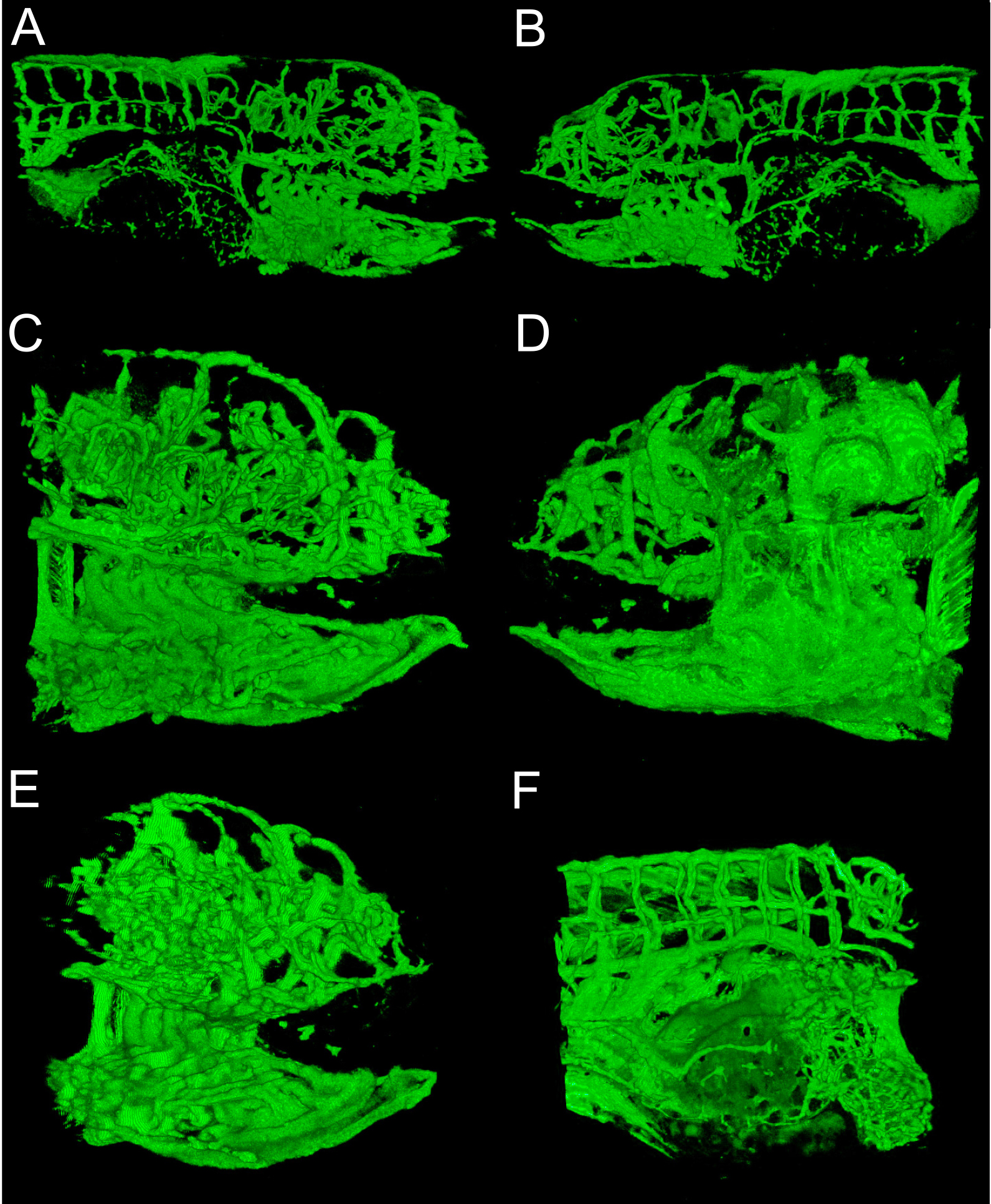
Figure 3. Perspectives de reconstruction 3D. A) point de vue médiale de 6 dpf embryon imagé avec objectif 10x, la bouche est sur la droite, et non pas à l'intérieur de la bouche branchies. B) latérale de la même embryon, la note nageoire est une boucle au milieu. C) même embryon imagé avec 20x objectif, perspective interne, la résolution des branchies de la note. D) perspective latérale de 20x imagerie objective. La nageoire est sur le bord droit de l'écran. E) vue antéro-médial de 20x imagerie objective, les branchies des notes à l'intérieur de la bouche. F) L'abdomen de la même embryon imagé avec un objectif 20x, tête vers la droite. Remarque vasculaire sur le sac jaune en bas à droite.jove.com/files/ftp_upload/50417/50417fig3highres.jpg "target =" _blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
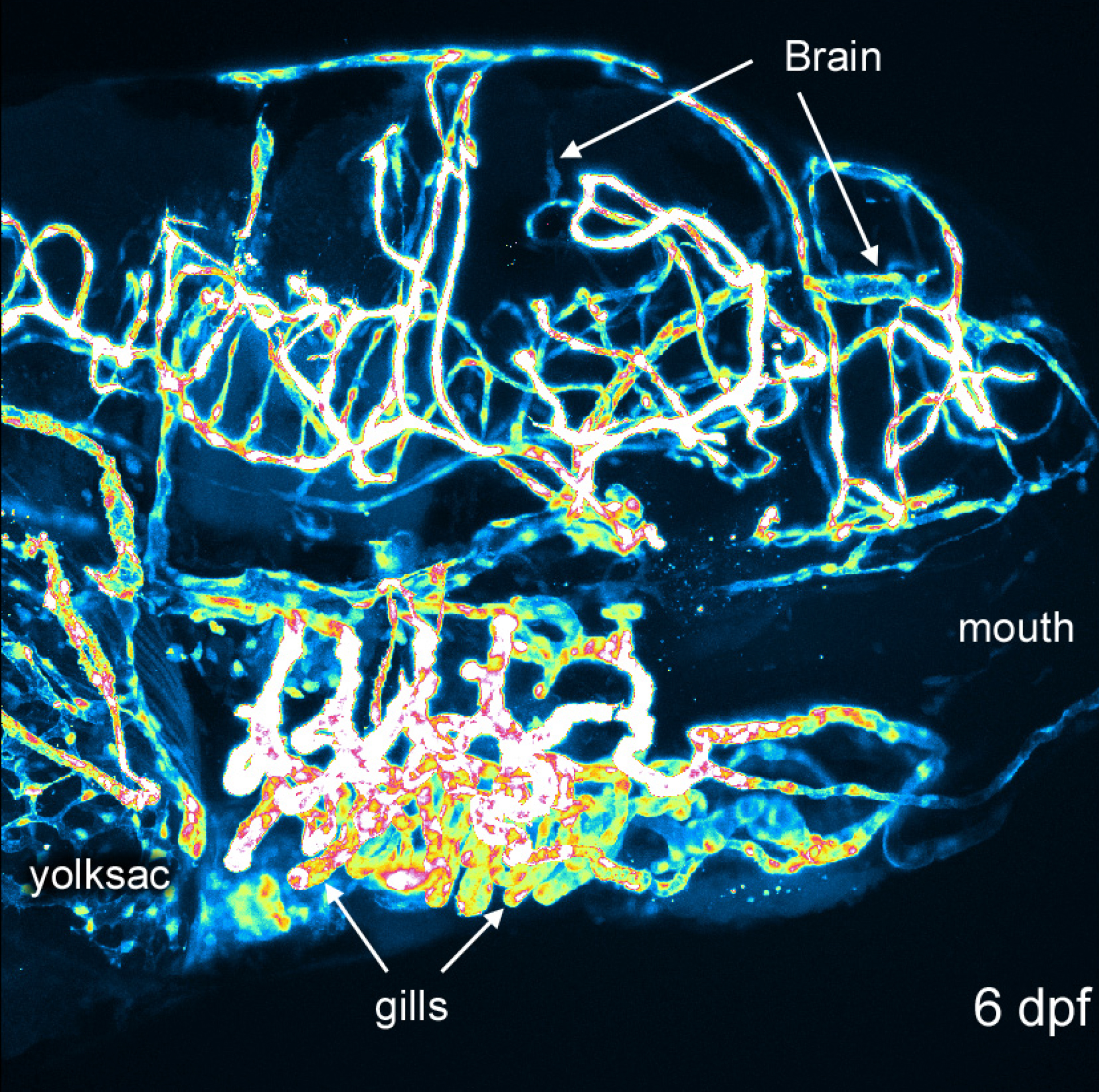
Figure 4. Différences d'intensité dans 6 dpf embryon. Image d'une reconstruction de 6 dpf utilisant un pseudo-consultation-table pour l'intensité du signal. Bouche, le cerveau, les branchies et sac de jaune sont marqués pour orientation. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
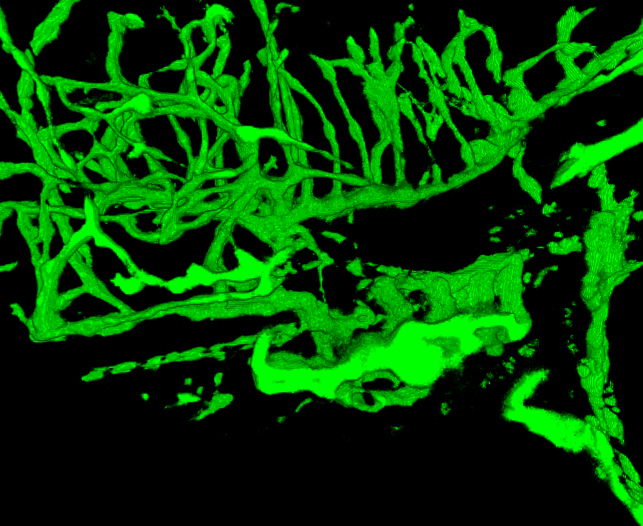
Figure 5. Film du système vasculaire reconstruit dans un poisson-zèbre 4 dpf. Le poisson a été imagée à 2,5 um. Les images ont étéà partir de l'imagerie de la moitié de l'embryon. Comparer les structures vasculaires avec des structures dans un poisson zèbre GSI-traitée prévus dans la figure 6. Notez la densité plus faible des vaisseaux sanguins dans la tête et plus grandes branchies. (Voir le "Zfish_spin.avi" fichier supplémentaire sous Téléchargements)
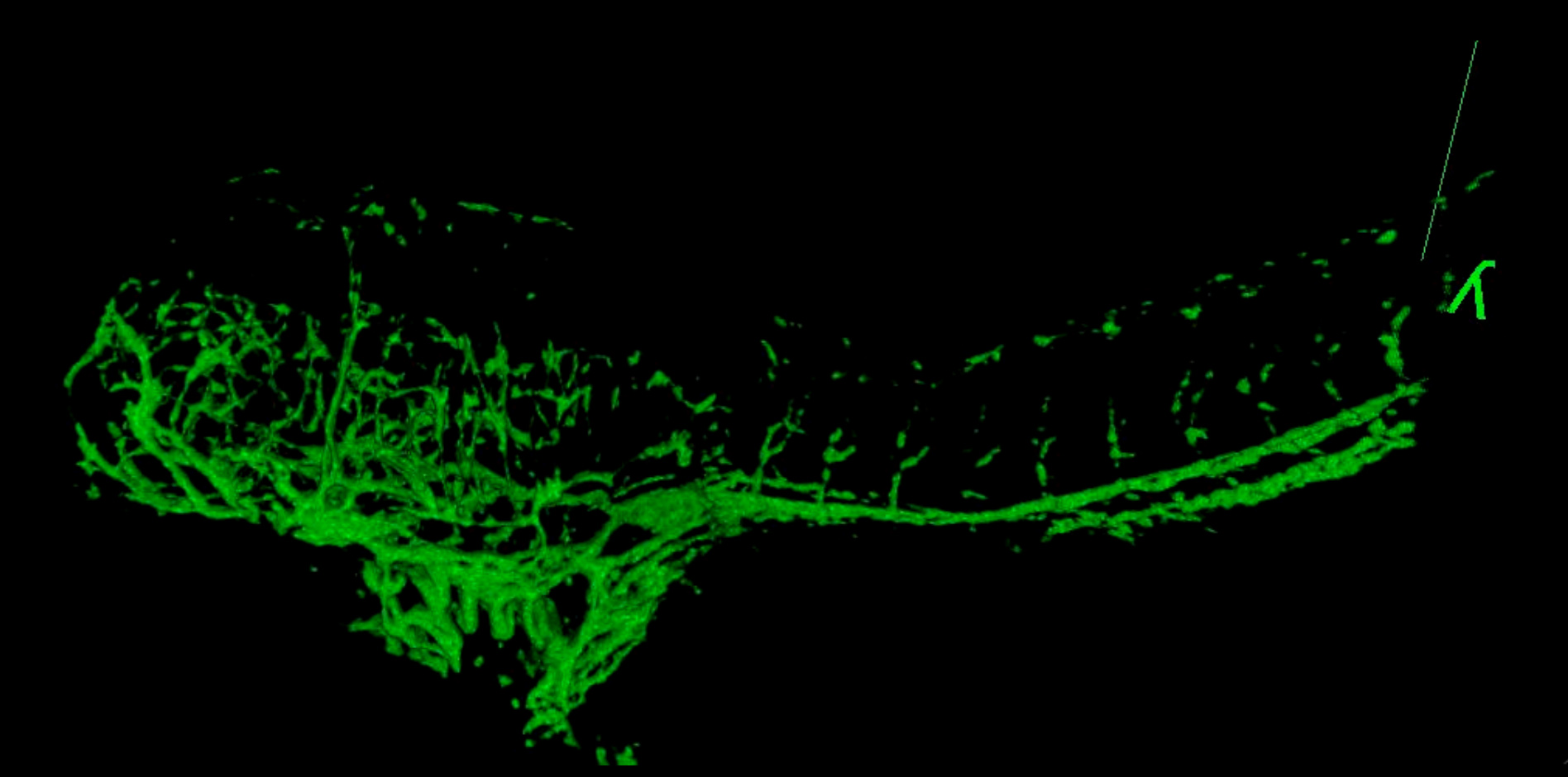
Figure 6. 3D Movie du système vasculaire dans un embryon GSI-traitée à 4 dpf. Le poisson a été imagée à 2,5 um par de latéral à la ligne médiane. Comparer structures vasculaires avec le contrôle 4 dpf poissons montre la figure 5. L'dos voûté et une plus petite taille sont typiques dans les embryons traités avec ce produit chimique. (Voir le «GSI-treated_4dpf_fish.avi" fichier supplémentaire sous Téléchargements)
Discussion
Les méthodes décrites ici constituent une base pour les études visuelles du système vasculaire dans le développement du poisson zèbre. Spécimens vivants peuvent être utilisés pour évaluer les paramètres physiologiques tels que la fréquence cardiaque et du volume systolique cardiaque, tandis que les échantillons fixes peuvent être utilisés pour l'imagerie confocale à haute résolution. Drosophile et C. elegans pour permettre l'imagerie du corps entier, mais le poisson zèbre sont des vertébrés et de fournir un modèle utile pour les tissus de vertébrés, y compris un système vasculaire endothelial cell-doublé. Ces études peuvent intégrer lignées transgéniques d'importantes ressources génomiques et de la communauté de recherche du poisson zèbre. Reconstruction 3D et le rendu des images confocales de poisson zèbre embryonnaire, tel que décrit ici, permettre une approche de biologie des systèmes à ramification vasculaire et la densité des vaisseaux sanguins qui n'est pas possible avec des modèles animaux plus grands tels que les rats et les souris. En outre, comme le poisson-zèbre amniotes développer dans un environnement modifiables (tampon E3), où l'on peut facilement ajouter cHIMIE qui inhibent les enzymes spécifiques ou d'autres processus qui affectent le développement vasculaire. La concentration et le calendrier de livraison des produits chimiques peuvent être modifiés, permettant le chercheur de conditions de traitement pour affiner.
1. Modifications et dépannage
Toute modification de ce système peuvent intégrer des lignées transgéniques de poisson zèbre qui expriment des protéines fluorescentes EGFP ou autres dans une variété de modèles spécifiques de 10 tissus, organes ou région. En outre, l'analyse des changements néovasculaire de la rétine de poisson zèbre a été récemment publié 5. Problèmes avec la pigmentation dans les embryons de poisson zèbre âgés et les adultes peuvent être compensées par croisement avec des lignées transgéniques qui ne produisent pas de pigments à l'échelle ou pigmentaire rétinien. Problèmes avec la fluorescence diminuée entraînent généralement des conditions de fixation inappropriés. Paraformaldéhyde (4%) pour un jour est optimale, mais fixateurs forts, tels que le glutaraldéhyde, tétroxyde d'osmium ou de l'alcool, peutdétruire la fluorescence de l'EGFP. Après fixation, les embryons doivent être conservés dans du PBS à 4 ° C et toujours protégés des rayons du soleil.
2. Limites de cette technique
La qualité et la résolution de rendus 3D produites avec ce protocole dépendent de la qualité des images générées. Pénétration de la lumière à travers ces embryons est limitée par rapport au plan sagittal médian à l'aide d'un microscope confocal standard. Cet aspect de l'imagerie limite la profondeur de l'imagerie dans les embryons âgés et les adultes, mais les systèmes de microscopie multi-photons les plus avancées pour l'imagerie permet à de plus grandes profondeurs.
3. Importance par rapport aux méthodes existantes
Ce protocole prévoit une approche de l'analyse des réseaux de vaisseaux sanguins au niveau des systèmes qui peuvent intégrer un animal entier. Représentations antérieures de ces données sont souvent appuyés sur des séries d'images disposées ensemble, mais le rendu 3D offre une meilleure résolution de la relation spatialetionships impliqués.
4. Applications futures
Nouveaux développements dans l'imagerie et le traitement des tissus fourniront de nombreuses nouvelles applications pour ces méthodes qui peuvent inclure faire embryons plus âgés ou adultes transparent 11-14. Transparence accrue permettra d'accroître considérablement la pénétration des tissus par des lasers confocale et multi-photons. En outre, comme la vitesse de caméras et des tubes photomultiplicateurs à augmenter rapidement, il peut être possible de produire des rendus 3D de poissons, en temps réel, fournissant une 4 ème dimension de l'analyse.
5. Étapes critiques
Une étape cruciale dans ce protocole est la préparation pour l'imagerie, qui comprend la fixation correcte. L'imagerie doit être fait dès que possible après la fixation des objectifs de haute qualité qui ont les meilleures ouvertures numériques disponibles. Résolution dépend du système d'imagerie utilisé, les systèmes afin de haute qualité sont généralement mieux. Génération des rendus 3D beaucoup de mémoirepour les nouveaux, de sorte que les ordinateurs haut de gamme avec une grande quantité de mémoire et de bons processeurs graphiques sont recommandées.
Le système de la biologie visuelle décrite ici a été optimisé pour le poisson-zèbre transgénique qui exprime l'EGFP dans les cellules endothéliales vasculaires, bien que ces procédés peuvent être adaptés à des embryons transgéniques qui expriment la GFP, ou d'autres protéines fluorescentes, dans des populations de neurones, les muscles, les glandes ou un nombre quelconque de d'autres cellules. Le principal avantage de travailler avec ce système est la possibilité d'étudier ce qui se passe dans tout l'embryon à tout moment pendant cette période de développement, chez les animaux fixes et / ou en direct.
Déclarations de divulgation
Il n'y a rien à divulguer.
Remerciements
Les auteurs remercient les membres passés et présents de nos laboratoires qui ont aidé à développer ces techniques. Un financement partiel prévu pour DE par une subvention de l'Institut de la Californie pour la médecine régénérative / CIRM (RN1-00538).
matériels
| Name | Company | Catalog Number | Comments |
| N – Phenylthiourea | Alfa Aesar, catalog #41972 | 0.2 M in E3 buffer, kept at 4 °C | |
| E3 buffer | Sigma | 5 mM NaCl, 0.17 mM KCl, 0.33 mM CaCl2, 0.33 mM MgSO4 | |
| Confocal microscope | Nikon | D-EclipseC1 on a Nikon TE-2000U | |
| Glass bottom dishes | Mat-Tek | ||
| GSI IX/DAPT | N-[N-(3,5-Difluorophenacetyl-L-alanyl)]-S-phenylglycinet-butyl ester EMD Biosciences | ||
| 24 well plates | Becton-Dickinson, cat# 351147 | BD Falcon | |
| Transfer pipettes | VWR, cat #414004-001 | VWR disposable transfer pipettes | |
| Methyl-cellulose | Alfa Aesar, cat#43146 | 3% in E3 buffer | |
| NRD 4/6 Fish food | Brine Shrimp Direct | Dried | |
| Brine shrimp | Brine Shrimp Direct | Live | |
| Tungsten wire | Small Parts # TW-016-60 | 0.016” OD | |
| Tricaine | VWR # 101107-950 | Tricaine methanesulfonate 250 mg/L in E3 buffer |
Références
- Staudt, D., Stainier, D. Uncovering the molecular and cellular mechanisms of heart development using the zebrafish. Annu Rev Genet. 46, 397-418 (2012).
- Westerfield, M. The Zebrafish Book. , University of Oregon Press. (2007).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Cameron, D. J., et al. Alzheimer's-related peptide amyloid-β plays a conserved role in angiogenesis. PLoS ONE. 7, (2012).
- Cunvong, K., Huffmire, D., Ethell, D. W., Cameron, D. J. Amyloid-β increases capillary bed density in the adult zebrafish retina. Invest Ophthalmol Vis Sci. 54, 1516-1521 (2013).
- Jin, S. W., Beis, D., Mitchell, T., Chen, J. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132, 5199-5209 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture. 269, 1-20 (2007).
- Hagedorn, M., Kleinhans, F. W., Artemov, D., Pilatus, U. Characterization of a major permeability barrier in the zebrafish embryo. Biol Reprod. 59, 1240-1250 (1998).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC Bioinformatics. 11, 274(2010).
- Opitz, R., et al. Transgenic zebrafish illuminate the dynamics of thyroid morphogenesis and its relationship to cardiovascular development. Dev Biol. 372, 203-216 (2012).
- Gleave, J. A., et al. Neuroanatomical phenotyping of the mouse brain with three-dimensional autofluorescence imaging. Physiol Genomics. 44, 778-785 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497, 332-337 (2013).
- Markaki, Y., Smeets, D., Cremer, M., Schermelleh, L. Fluorescence in situ hybridization applications for super-resolution 3D structured illumination microscopy. Methods Mol Biol. 950, 43-64 (2013).
- Walter, T. J., Sparks, E. E., Huppert, S. S. 3-dimensional resin casting and imaging of mouse portal vein or intrahepatic bile duct system. J Vis Exp. 68, e4272(2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon