Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Issu l'évolution temporelle du glutamate Dégagement avec une analyse de déconvolution des courants de Transporteur ASTROCYTIQUES
Dans cet article
Résumé
Nous décrivons une méthode analytique pour estimer la durée de vie de glutamate au niveau des membranes astrocytes à partir d'enregistrements électrophysiologiques des courants de transporteur du glutamate dans les astrocytes.
Résumé
La plus forte densité de transporteurs du glutamate dans le cerveau se trouve dans les astrocytes. Le glutamate en couple de transporteurs le mouvement du glutamate à travers la membrane avec le co-transport de Na + et 3 1 H + et le contre-transport de K + 1. Le courant stoechiométrique généré par le processus de transport peut être contrôlée au moyen d'enregistrements de patch-clamp de cellules entières provenant astrocytes. L'évolution dans le temps du courant enregistré est façonné par l'évolution temporelle du profil de concentration de glutamate qui astrocytes sont exposées, la cinétique de transporteurs du glutamate, et les propriétés des membranes passives électrotoniques astrocytiques. Nous décrivons ici les méthodes expérimentales et analytiques qui peuvent être utilisés pour enregistrer les courants de transporteur du glutamate dans les astrocytes et isoler le cours du temps de jeu glutamate de tous les autres facteurs qui façonnent la forme d'onde des courants de transporteurs astrocytaires. Les méthodes décrites ici peuvent être utilisées pour estimer la durée de vie of flash-Uncaged et synaptiquement-glutamate libéré à membranes astrocytaires dans n'importe quelle région du système nerveux central pendant la santé et la maladie.
Introduction
Les astrocytes sont l'un des types cellulaires les plus abondants dans le cerveau avec une morphologie en forme d'étoile et des protubérances membranaires fines qui s'étendent tout au long de la neuropile et atteignent voisins contacts synaptiques 1,2. La membrane de la cellule Les astrocytes de forte densité est emballé avec des molécules d'transporteur du glutamate 3. Dans les conditions physiologiques, transporteurs du glutamate se lient rapidement glutamate sur le côté extracellulaire de la membrane et le transférer dans le cytoplasme de la cellule. Ce faisant, les transporteurs maintiennent bas la concentration basale de glutamate dans l'espace extracellulaire 4. Transporteurs du glutamate dans les processus astrocytaires fins adjacents à excitateurs synapses sont idéalement positionnés pour lier glutamate libéré lors d'événements synaptiques comme il diffuse loin de la fente synaptique. Ce faisant, les transporteurs limitent également les retombées glutamate vers et péri-régions extra-synaptiques et sur synapses voisines, ce qui réduit la dispersion spatiale du signal d'excitations dans le cerveau de 5 à 7.
Transport du glutamate est un processus électrogénique stoechiométrique couplé au mouvement de 3 Na + et H + 1 le long de leur gradient électrochimique et à la contre-transport de K + 1 8. Transport du glutamate est associée (mais pas stœchiométriquement couplé à) une conductance anionique perméable à la SCN - (thiocyanate)> NO 3 - (nitrate) ≈ ClO 4 - (perchlorate)> I -> Br -> Cl -> F -, pas de CH 3 SO 3 - (méthane sulfonate) et C 6 H 11 O 7 - (gluconate) 9-11. Les deux courants (stoechiométrique ou non stoechiométrique) peuvent être enregistrées par l'obtention d'enregistrements de patch-clamp de cellules entières de astrocytes, identifiés visuellement sous un éclairage Dodt ou infra-rouge contraste d'interférence différentiel (IR-DIC) dans acute tranches de cerveau 12. La composante stoechiométrique du courant associé au transport du glutamate à travers la membrane peut être isolé en utilisant CH 3 SO 3 -, ou 11 C 6 H o 7 - solutions intracellulaires base et peut être provoquée par le glutamate flash-uncaging sur les astrocytes 13,14, ou en activant la libération de glutamate à partir de synapses voisines, soit électriquement ou 12 avec une commande de optogenetic ciblée.
L'évolution temporelle de la composante stoechiométrique du courant transporteur est façonnée par la vie du profil de concentration du glutamate au niveau des membranes astrocytaires (c.-garde au glutamate), la cinétique de transporteurs du glutamate, les propriétés des membranes passives des astrocytes, et au cours de stimulations synaptiques, par le synchronicité de la libération de glutamate dans les synapses activées 13. Nous décrivons ici en détail: (1) une appr expérimentaleOach d'isoler la composante stoechiométrique des courants de transporteur du glutamate à partir d'enregistrements de patch-clamp de cellules entières de astrocytes en utilisant la souris coupes d'hippocampe aigus comme exemple la préparation expérimentale, (2) une approche analytique pour dériver le cours du temps de jeu glutamate à partir de ces enregistrements 13, 14. Ces méthodes peuvent être utilisées pour enregistrer et analyser les courants de transporteur du glutamate de astrocytes dans n'importe quelle région du système nerveux central.
Protocole
1. Slice Préparation
- Préparer 500 ml tranchage solution / de stockage contenant (en mM): 119 NaCl, 2,5 KCl, 0,5 CaCl2, 1,3 MgSO4 · 7H 2 O, 4 MgCl2, 26,2 NaHCO3, une NaH 2 PO 4, et 22, du glucose, 320 mOsm, pH 7,4
- Utilisez un bécher de 250 ml pour préparer une chambre submersion pour les tranches, remplissez-le avec 200 ml de tranchage solution / de stockage, le réchauffer dans un bain d'eau à 34 ° C et la bulle avec 95% d'O 2, 5% de CO 2.
- Maintenir la solution restante de tranchage / de stockage dans une bouteille en verre à 4 ° C.
- Utilisez un adhésif cyanoacrylate pour attacher un petit bloc d'agar (6%, établi en ACSF) sur le porte-échantillon vibratome et stocker à 4 ° C.
- 30 minutes avant de commencer le tranchage, de placer le flacon en verre contenant la solution de stockage / tranchage dans un seau rempli de glace et de la bulle avec 95% de O 2, 5% de CO 2.
Note: la vitesse et la précision sont primordiales pour les étapes de dissection décrites ci-dessous.
- Anesthésier la souris (P14-21, C57BL / 6) avec halothane / isoflurane (isoflurane a été signalé pour améliorer l'absorption du glutamate astrocytaire 15), décapiter, et plonger la tête dans un bécher de 50 ml contenant une solution oxygénée, froid tranchage / stockage.
- Effectuez la dissection du cerveau sur un sac de glace enveloppé avec du papier absorbant et conservés à -20 ° C.
- L'utilisation d'un scalpel pour faire une incision dans la peau sagittal médian sur la face dorsale de la tête, à partir de la frontale de l'extrémité caudale, et exposer le crâne.
- Placer la lame de cisaillement inférieure d'une petite paire de ciseaux chirurgicaux dans le trou occipital et de faire deux découpes, vers la gauche et sur le côté droit (45 °).
- Couper le crâne long de la ligne sagittale médiane, à partir de la caudale à l'extrémité frontale.
- Retirez le cerveau avec une spatule et le tremper dans oxygéné, froid tranchage / stockage solutisur.
- Avec un scalpel, faire cinq coupes à: (1) éliminer les bulbes olfactifs et le cortex frontal, (2) supprimer le cervelet; (3) éliminer la gauche et (4) lobes temporal droit; (5) séparer les deux hémisphères du cerveau avec une coupe sagittal médian.
- Tamponnez les deux parties du cerveau avec du papier absorbant pour éliminer tout excès de solution.
- Coller la surface latérale de chaque section de cerveau à la plaque de base vibratome froid: la face dorsale du cerveau doit être tournée vers la lame vibratome; la face ventrale du cerveau doit être en contact avec le bloc de l'agar, de la lame vibratome.
Remarque: pour obtenir des tranches de très haute qualité, il est important que les deux parties du cerveau sont solidement collés à la plaque de base vibratome. Pour ce faire, utilisez une colle cyanoacrylate qui n'est pas trop liquide et qui ne sèche pas trop vite. - Fixez la plaque de base vibratome à la chambre de dissection, réglez le e trancheickness à 250 um et d'ajuster la largeur de la course de la lame. Procéder à trancher.
Remarque: si tout est correctement orienté, la vibratome faut couper des tranches à partir de la parasagittales dorsale vers la face ventrale et du médial vers le côté latéral du cerveau. - Une fois la lame a traversé le cortex et l'hippocampe, utiliser un scalpel pour couper le cortex / hippocampe du cerveau moyen et placer chaque tranche dans la chambre de submersion à 34 ° C.
- Jeter le premier couple de tranches. En règle générale, 12 tranches (250 um d'épaisseur) peuvent être obtenus à partir d'un cerveau P14-21 souris.
- Gardez les tranches à 34 ° C pendant 30 minutes et laisser refroidir à température ambiante pendant 30 min avant de les utiliser pour les enregistrements électrophysiologiques.
2. Identification et enregistrements astrocytes
- Préparer une solution contenant interne (en mm): 120 KCH 3 SO 3, 10 EGTA, 20 HEPES, 2 MgATP, 0,2 NaGTP,5 QX-314Br et 5 NaCl, 290 mOsm, pH 7,2.
- Préparer une solution extracellulaire d'enregistrement contenant (en mM): 119 NaCl, 2,5 KCl, 2,5 CaCl2, 1,3 MgSO4 · 7H 2 O, 1 MgCl2, 26,2 NaHCO3, une NaHPO 4, et 22, du glucose, à 300 mOsm, pH 7,4 , saturé avec 95% d'O 2, 5% de CO 2.
- Ajouter les médicaments suivants à la solution d'enregistrement extracellulaire, pour bloquer l'activation des Glua, Glun, mGluRII, mGluRIII, GABA A, GABA B, et les récepteurs d'adénosine A1 (en pM): 10 2,3-dioxo-6-nitro-1, 2,3,4-tétrahydrobenzo [ƒ] quinoxaline-7-sulfonamide disodium (NBQX), 10 (RS) -3 - (2-carboxypiperazin-4-yl)-propyl-1-phosphonique (CPP), (2S )-2-amino-2-[(1S, 2S)-2-carboxycycloprop-1-yl] -3 - (xanth-9-yl) propanoïque disodium (LY341495), 100 (R, S)-α- méthylsérine-O-phosphate (PAD), 100 picrotoxine, 5 3 - [[(3,4-dichlorophényl) méthyl] amino] propyl]-diéthoxyméthyl) phosphinique (CGP52432), une8-cyclopentyl-1 ,3-dipropylxanthine (DPCPX).
- Régler la température de la solution extracellulaire dans la chambre d'enregistrement; températures typiques se situent entre 34 - 36 ° C.
- Préparer électrodes de patch-clamp de verre borosilicate capillaires (R ≈ 2,5 MQ) à l'aide d'un double étage, verre micro-pipette extracteur.
- Prenez l'une des tranches et le placer dans la chambre d'enregistrement. Maintenez le bouton enfoncé avec une harpe métallique réalisé avec un fil de platine et cordes en nylon.
- Inspecter visuellement les tranches de moins de Dodt éclairage ou IR-DIC. Les astrocytes peuvent être identifiés par leur corps à petites cellules (Ø = 10 um) et le noyau de premier plan (Figure 1).
- Pour stimulations synaptiques, placer une électrode en acier inoxydable bipolaire, ~ 100 um loin de l'astrocyte que vous envisagez de patch.
- Patcher l'astrocyte et briser dans la configuration cellule entière en appliquant une aspiration très doux.
Note: Les astrocytes ont généralement faible resistanc d'entréee (~ 10 MQ), le potentiel de membrane au repos hyperpolarisé (~ -90 mV), et aucune activité de tir. Les astrocytes sont conservés à son potentiel de membrane au repos au cours des expériences en mode voltage-clamp (ie le courant de maintien doit indiquer 0 Pa). Avant chaque stimulation, une étape d'hyperpolarisation 10 ms tension (-3 mV) est utilisé pour surveiller la série et la résistance d'entrée de l'astrocyte. - Jeter les enregistrements si les changements de résistance série> 20% ou si le potentiel de membrane de l'astrocyte devient dépolarisée. Le potentiel de la membrane de l'astrocyte peut être directement mesurée par la commutation de voltage-clamp à mode de courant-clamp. En variante, alors que dans le mode voltage-clamp, le potentiel de la membrane peut être contrôlée en lisant la valeur du potentiel de maintien qui aboutit à 0 Pa courant de maintien.
- Si stimulations synaptiques sont employées, alternent stimuli simples et jumelés (par exemple 100 ms d'intervalle), toutes les 10 - 20 sec.
- Pour expérim de photolyse UVents, connectez une lampe Xe uncaging au port épifluorescence du microscope et d'ajouter le composé en cage à la solution extracellulaire. courants de Transporteur de ~ 100 pA amplitude peuvent être obtenus lorsque le flash-uncaging 100 um MNI-L-glutamate dans le champ de vision (Ø = 662,5 um lorsque vous utilisez un objectif 40X 14). Stimulations alternent avec le chemin de lumière ouvert et bloqué, tous les 10 - 20 sec.
- Évoquer les transitoires de glutamate et d'enregistrer les courants de transporteur dans les conditions de contrôle et en présence d'une concentration sous-saturante de l'antagoniste D, L-thréo-β-Benzyloxyaspartic acide transporteur du glutamate à large spectre (TBOA; 10 pM) pour réduire l'amplitude du courant de transporteur à au moins 30% de sa valeur de commande (voir articles 4, 5) ou en présence d'une forte concentration de TBOA (50 - 100 um) pour bloquer les courants de transporteurs complètement et isoler le soutenue K +-courant (voir section 3) .
3. PharmacIsolation gique de la K soutenue + courant
- Enregistrer les courants astrocytaires dans des conditions de contrôle et en présence d'une concentration élevée, saturant de TBOA (50 - 100 pM).
- Moyenne au moins 20 balayages en TBOA (50 - 100 um).
- Monter les traces moyennes obtenues en 3.2 avec la fonction:
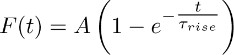
Remarque: Le composant TBOA insensible (celui qui est enregistré en présence de TBOA (50 - 100 pm)) représente le soutenue K +-courant. Son évolution dans le temps est approchée par la fonction mono-exponentielle décrit ci-dessus. - Répétez cette forme à travers différents astrocytes et d'en tirer une valeur moyenne de Τ hausse (c'est à dire le temps de montée moyenne du K + soutenue à long terme (voir section 5)).
4. Jeconsolation de la portion facilitée des courants Transporter synaptiquement-Activated (fSTCs)
- Moyenne au moins 20 balayages obtenus avec stimulations paires, dans des conditions de contrôle et TBOA (10 M) (Figure 2a gauche).
- Moyenne un nombre identique de balayages obtenus avec stimulations simples, dans des conditions de contrôle et TBOA (10 M) (Figure 2a milieu).
- Comparer l'amplitude de la réponse du courant moyen de l'étape de tension de -3 mV dans les quatre traces moyennées (impulsion de commande unique, le contrôle apparié-impulsions, TBOA seule impulsion, couplé TBOA-impulsions).
- Si l'amplitude de la réponse actuelle est la même dans les quatre traces, passez à l'étape 4.7.
- Si l'amplitude de la réponse moyenne actuelle est différente dans l'une des quatre traces, vérifier que toutes les traces individuelles étaient appropriés pour être inclus dans la moyenne.
- Si l'amplitude du courant moyen est différente dans l'une des quatre traces, mais dans l'traces individuelles sont adaptées pour être inclus dans la moyenne, de vérifier que, dans chaque trace de la taille des écailles FSTC linéairement avec la taille de la réponse du courant à l'étape de la tension d'essai. Si tel est le cas, à l'échelle l'ensemble des traces par rapport à l'autre de sorte que les réponses actuelles à l'étape de la tension d'essai sont tous égaux en amplitude.
Note: Dans les conditions d'enregistrement décrite ici (ie intracellulaire CH 3 SO 3 - ou C 6 H 11 O 7 -), stimulations synaptiques des axones excitateurs génèrent des courants astrocytiques avec formes d'onde complexes constitués d'un courant stoechiométrique intérieur transitoire augmentation rapide et une lente -en hausse, soutenue intérieur K +-courant reflétant K + rééquilibrage dans l'espace extracellulaire après l'action propagation potentielle le long des axones voisins. Il est essentiel de supprimer ce soutenue K +-courant, comme tout courant résiduel qui conduirait à unesurestimer la durée de vie du glutamate. - Soustraire la trace moyenne obtenue avec stimulations simples à partir de la trace moyenne obtenue avec stimulations appariés (Figure droit 2a). Cette étape permet d'isoler le stoechiométrique et soutenue K +-courant évoquée par le second stimulus.
- Déplacer la trace moyenne obtenue avec stimulations simples par un intervalle de temps qui correspond à l'intervalle entre les impulsions utilisée pour fournir jumelé-impulsions (soit 100 msec) (Figure 2b).
- Soustraire la décalés dans le temps réponse moyen obtenu avec stimulations simples à partir de la moyenne des réponses à la deuxième stimulus obtenu en 4.7 (figure 2c). Cette étape d'isoler la partie du courant de facilité de transporteur évoquée par le second stimulus (le FSTC).
- Dans la plupart des cas, l'étape précédente supprime entièrement le K + soutenue courant. Si c'est le cas, l'isolement de la FSTC est terminée et vous pouvez Procéed avec l'analyse de déconvolution et d'en tirer le cours du temps de jeu à partir de glutamate astrocytes. Dans certains cas, cependant, un petit K soutenue + courant est toujours présent (figure 2d) et une analyse plus approfondie est nécessaire (voir section 5).
Note: N'oubliez pas que l'analyse décrite dans 4.7 à 4.10 doit être effectuée sur les traces de moyennes obtenues dans des conditions de contrôle et TBOA (10 M).
5. Soustraction de la résiduelle zdustained K +-courant de fSTCs
- Mesurer l'amplitude du K + soutenue courant restant après l'exécution de l'analyse décrite dans la section 4.
- L'échelle de l'amplitude de la fonction mono-exponentielle décrit au point 3.3 de l'amplitude de la valeur résiduelle soutenue K +-courant mesuré à 5.1 (figure 2d gauche et au centre). Pour ce faire, dans l'équation 3.3, définissez le terme A est égal à l'amplitude de l'soutenue K +-courant moiasured en 5.1 et le terme Τ hausse égale à la valeur moyenne de Τ hausse estimée à 3,4.
- Soustraire la fonction mono-exponentielle résultant de la FSTC et soutenue K +-courant obtenu à 4,10 (figure 2d droite). Cette étape effectue l'isolement de la FSTC.
6. Isolation des courants de Transporteur Flash activé (CDD)
- Moyenne au moins 20 balayages obtenus avec le trajet de la lumière ouverte, dans des conditions de contrôle et TBOA (10 M).
- Moyen d'un nombre identique de balayages obtenue avec le trajet de la lumière fermée, dans des conditions de contrôle et dans TBOA (10 pM).
- Comparer l'amplitude de la réponse du courant à l'étape de tension de -3 mV dans les quatre traces moyennées (impulsion de commande unique, le contrôle apparié-impulsions, TBOA seule impulsion, couplé TBOA-impulsions).
- Si l'amplitude de la réponse en courant est la même dans toutes les quatre traces, passer à l'étape 6.7.
- Si l'amplitude de la réponse moyenne actuelle est différente dans l'une des quatre traces, vérifier que toutes les traces individuelles étaient appropriés pour être inclus dans la moyenne.
- Si l'amplitude du courant moyen est différente dans l'une des quatre traces, mais toutes les traces individuelles sont appropriés pour être inclus dans la moyenne, de vérifier que, dans chaque trace de la trajectoire de la lumière ouvrir la taille de la balance FTC linéairement avec la taille de la réponse du courant à l'étape de la tension d'essai. Si tel est le cas, à l'échelle l'ensemble des traces par rapport à l'autre de sorte que les réponses actuelles à l'étape de la tension d'essai sont tous égaux en amplitude.
Remarque: dans les conditions d'enregistrement décrite ici (ie intracellulaire CH 3 SO 3 - ou C 6 H 11 O 7 -), les stimuli Flash génèrent des courants astrocytiques composés uniquement de l'augmentation rapide transitoire stoechiométrique courant entrant. - Soustraire la trace moyenne obtenue avec le pat la lumièreh bloqué à partir de la trace moyenne obtenue avec le trajet de la lumière ouverte. Cette étape permet de supprimer l'artefact de stimulation et d'isoler les CDD.
Note: l'analyse décrite au point 6.7 doit être effectuée sur les traces moyennes obtenues dans des conditions de contrôle et TBOA (10 M).
7. analyse de déconvolution
- Ajuster le courant transporteur (FSTC ou FTC) a enregistré dans des conditions de contrôle (Figure 3a gauche) et dans TBOA (10 M) (Figure 3a droite) et isolé comme décrit dans les sections 4-6, avec la fonction multi-exponentielle:

- Créer une fonction croissante qui se désintègre instantanément mono-exponentielle en fonction de la fonction:
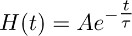
etqui décrit le mieux la phase de décomposition du courant transporteur enregistré dans TBOA (10 M) (Figure 3b).
Remarque: la fonction décrite au point 7.2 (ie H (t)) représente l'évolution temporelle de la clairance de glutamate astrocytes en présence de TBOA (10 M). - Déconvolutionner la fonction mono-exponentielle obtenue en 7.2 (Figure 3b et 3c milieu) de l'ajustement du cours de transporteur enregistré dans TBOA (10 M) obtenue en 7.1 (Figure 3a droit, c gauche).
Note: déconvolution est une opération mathématique inclus dans de nombreux progiciels d'analyse comme (par exemple Matlab, Python). En IgorPro, le code de programmation que nous utilisons généralement pour effectuer ce genre d'analyse, l'opération de déconvolution peut être calculée efficacement que décrit ci-dessous, à l'aide discrète de Fourier rapide transforme. Tout d'abord, utiliser l'opération FFT pour calculer le discrete rapide de transformée de Fourier de la fonction mono-exponentielle obtenue en 7.2 et de l'ajustement du courant de transporteur enregistrée dans TBOA obtenu en 7.1. Ensuite, utiliser l'opération IFFT pour calculer la transformée de Fourier rapide discrète inverse du rapport des deux fonctions de FFT. La fonction I entraînant (t) peut être décrit comme suit: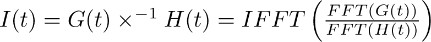
L'étape décrite au point 7.3 permet à dériver le filtrage du courant transporteur dans TBOA (10 pM) (figure 3c droite). Le filtre représente les facteurs de distorsion qui transforment la vie de glutamate au niveau des membranes astrocytaires dans le courant du transporteur isolé dans les sections 4-6 (ie le FSTC ou FTC). - Déconvolutionner le filtre (Figure 3c droite, figure 3d milieu) de l'ajustement du courant transporteur dans des conditions de contrôle (Figure 3a à gauche, figure 3d gauche).
Remarque: cette étape permet de dériver le cours du temps de jeu à partir de glutamate astrocytes dans des conditions de contrôle (Figure 3d droite). L'hypothèse sous-jacente à cette étape de déconvolution est que le profil temporel du filtre reste inchangée dans des conditions de contrôle et TBOA (10 M). - Pour obtenir une estimation quantitative de l'évolution globale du temps de jeu glutamate, calculer le centre de gravité () de la forme d'onde obtenue à l'étape 7.4. Cela se fait en calculant que:
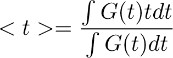
où G (t) est la forme d'onde obtenue à l'étape 7.1. Dans l'équation décrite ci-dessus, le terme t correspond à la fenêtre de temps pendant lequel l'intégrale est calculée.
Remarque: lorsque la méthode a été créé, a été calculée sur des fenêtres de temps qui ont été laissés sans contrainte 13. Cette approche peut être utilisée tant que la fenêtre d'intégration est réglé pour être plus large que la durée de la clairance du glutamate et les désintégrations de forme d'onde de dégagement complètement revenue à la ligne de base. Si ce n'est pas le cas, cependant, cette méthode d'estimation rencontre certaines limites. Par exemple, si le signal de dégagement ne se dégrade pas exactement retour à l'état initial, puis augmente avec la largeur de la fenêtre d'intégration. Pour éviter toute source potentielle d'imprécision de l'estimation de , nous calculons maintenant au-dessus d'une fenêtre de temps correspondant à 10% du pic du courant transporteur, avant et après son apparition 14. Cette dernière approche améliore la cohérence avec laquelle est mesurée à travers les cellules. Cela est très pratique en particulier lorsque l'on analyse les petits effets des traitements pharmacologiques sur l'évolution dans le temps de dédouanement.
Résultats
Le succès de l'approche analytique décrite ici dépend de façon critique sur l'obtention des enregistrements électrophysiologiques haute qualité des courants de transporteur de astrocytes dans n'importe quelle région du système nerveux central. Dans des coupes d'hippocampe de souris aiguës, les astrocytes peuvent être facilement identifiés sous Dodt éclairage ou IR-DIC en raison de leur corps à petites cellules (Ø = 10 um) et le noyau de premier plan (Figure 1). Leur morphol...
Discussion
Nous décrivons ici une approche expérimentale pour obtenir des enregistrements électrophysiologiques des astrocytes, un protocole d'analyse pour isoler les courants de transporteur du glutamate dans les astrocytes et une méthode mathématique pour calculer le cours du temps de jeu glutamate à partir des courants de transporteurs astrocytaires.
Le succès de l'analyse repose sur la capacité à obtenir des enregistrements de patch clamp haute qualité à partir des astrocytes et ...
Déclarations de divulgation
Les auteurs déclarent aucun conflit d'intérêt.
Remerciements
Ce travail a été financé par l'Institut national des troubles neurologiques et du programme de recherche intra-muros Course (NS002986). AS a écrit le manuscrit et mis en œuvre l'analyse de déconvolution. JSD développé la version initiale de l'analyse de déconvolution et commenté le texte.
matériels
| Name | Company | Catalog Number | Comments |
| CGP52432 | Tocris | 1246 | |
| (R,S)-CPP | Tocris | 173 | |
| DPCPX | Tocris | 439 | |
| LY341495 disodium salt | Tocris | 4062 | |
| MSOP | Tocris | 803 | |
| NBQX disodium salt | Tocris | 1044 | |
| D,L-TBOA | Tocis | 1223 | |
| Picrotoxin | Sigma | P1675 | |
| MNI-L-glutamate | Tocris | 1490 | |
| Alexa 594 | Life Technologies | A10438 | Optional |
| Matrix electrodes | Frederick Haer Company | MX21AES(JD3) | |
| Borosilicate glass capillaries | World Precision Instruments | PG10165-4 | |
| Dual-stage glass micro-pipette puller | Narishige | PC-10 | |
| Loctite 404 instant adhesive | Ted Pella | 46551 | |
| Xe lamp | Rapp OptoElectronic | FlashMic | |
| Igor Pro 6 | Wavemetrics |
Références
- Ventura, R., Harris, K. M. Three-dimensional relationships between hippocampal synapses and astrocytes. J. Neurosci. 19, 6897-6906 (1999).
- Witcher, M. R., Kirov, S. A., Harris, K. M. Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus. Glia. 55, 13-23 (2007).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Herman, M. A., Jahr, C. E. Extracellular glutamate concentration in hippocampal slice. J. Neurosci. 27, 9736-9741 (2007).
- Arnth-Jensen, N., Jabaudon, D., Scanziani, M. Cooperation between independent hippocampal synapses is controlled by glutamate uptake. Nat. Neurosci. 5, 325-331 (2002).
- Barbour, B. An evaluation of synapse independence. J. Neurosci. 21, 7969-7984 (2001).
- Rusakov, D. A., Kullmann, D. M. Extrasynaptic glutamate diffusion in the hippocampus: ultrastructural constraints, uptake, and receptor activation. J. Neurosci. 18, 3158-3170 (1998).
- Zerangue, N., Kavanaugh, M. P. Flux coupling in a neuronal glutamate transporter. Nature. 383, 634-637 (1038).
- Eliasof, S., Jahr, C. E. Retinal glial cell glutamate transporter is coupled to an anionic conductance. Proc. Natl. Acad. Sci. U.S.A. 93, 4153-4158 (1996).
- Wadiche, J. I., Amara, S. G., Kavanaugh, M. P. Ion fluxes associated with excitatory amino acid transport. Neuron. 15, 721-728 (1995).
- Wadiche, J. I., Kavanaugh, M. P. Macroscopic and microscopic properties of a cloned glutamate transporter/chloride channel. J. Neurosci. 18, 7650-7661 (1998).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. J. Neurosci. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H. Neuronal transporters regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. J. Neurosci. 29, 14581-14595 (2009).
- Zuo, Z. Isoflurane enhances glutamate uptake via glutamate transporters in rat glial cells. Neuroreport. 12, 1077-1080 (2001).
- Barbour, B., Brew, H., Attwell, D. Electrogenic uptake of glutamate and aspartate into glial cells isolated from the salamander (Ambystoma) retina. J. Physiol. 436, 169-193 (1991).
- Bergles, D. E., Tzingounis, A. V., Jahr, C. E. Comparison of coupled and uncoupled currents during glutamate uptake by GLT-1 transporters. J. Neurosci. 22, 10153-10162 (2002).
- Diamond, J. S., Jahr, C. E. Synaptically released glutamate does not overwhelm transporters on hippocampal astrocytes during high-frequency stimulation. J. Neurophysiol. 83, 2835-2843 (2000).
- Benediktsson, A. M., et al. Neuronal activity regulates glutamate transporter dynamics in developing astrocytes. Glia. 60, 175-188 (2012).
- Hires, S. A., Zhu, Y., Tsien, R. Y. Optical measurement of synaptic glutamate spillover and reuptake by linker optimized glutamate-sensitive fluorescent reporters. Proc. Natl. Acad. Sci. U.S.A. 105, 4411-4416 (2008).
- Scimemi, A., Meabon, J., Woltjer, R. L., Sullivan, J. M., Diamond, J. S., Cook, D. G. Amyloidβ1-42 slows clearance of synaptically-released glutamate by mislocalizing astrocytic GLT-1. J. Neurosci. 33, 5312-5318 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon