Method Article
Profilage des matières triacylglycéride à Bat tégumentaire lipides par chromatographie sur couche mince préparative et MALDI-TOF spectrométrie de masse
Dans cet article
Résumé
Tégument des mammifères contient des lipides solvant extractible qui peuvent fournir des compositions chimiques caractéristiques de chaque espèce. Cet article présente une méthode de routine pour la séparation de larges classes de lipides isolés à partir de tissus tégumentaires en utilisant la chromatographie en couche mince et détermination du profil de triacylglycéride par désorption / ionisation laser à temps de vol par spectrométrie de masse assistée par matrice.
Résumé
Le tégument de mammifère comprend des glandes sébacées qui sécrètent une substance huileuse à la surface de la peau. La production de sébum est une partie du système immunitaire inné qui est protectrice contre les microbes pathogènes. La production de sébum anormale et la composition chimique sont également un symptôme clinique de maladies spécifiques de la peau. Le sébum contient un mélange complexe de lipides, y compris les triacylglycérides, ce qui est spécifique à l'espèce. Les propriétés chimiques présentées par les grandes classes de lipides diverses gênent la détermination spécifique de la composition du sébum. Techniques d'analyse des lipides exigent généralement des dérivations chimiques qui sont échantillon frais de préparation augmentation de main-d'œuvre et. Cet article décrit comment extraire les lipides de tégument de mammifère, de larges classes de lipides séparées par chromatographie sur couche mince, et le profil le contenu de triacylglycéride par désorption laser assistée par matrice / ionisation temps de vol spectrométrie de masse. Cette méthode robuste permet une détermination directedes profils de triacylglycéride entre les espèces et les individus, et il peut être aisément appliqué à n'importe quel groupe taxonomique des mammifères.
Introduction
Tissus tégumentaires mammifères comprennent l'épiderme, les structures kératiniques (par exemple, des cheveux et ongles) et les glandes exocrines. Glandes exocrines de type sébacé sont associées à des follicules pileux, qui sont collectivement désignés comme l'unité pilo-sébacée 1. Les glandes sébacées libérer un exsudat huileux sur la surface de la peau appelée sébum. Le sébum est composé en grande partie de glycérolipides (par exemple triacylglycérides [tags]), acyles gras libres (AGL), les esters de stérol / cire, et le squalène. La composition chimique du sébum est spécifique à l'espèce 2. En plus de faire partie du système immunitaire inné et fourniture de la fonction antimicrobienne 3, lipides sébacés affectent les processus physiologiques importants, y compris la perte par évaporation de l'eau par la peau 4, l'intégrité cellulaire et la régulation des gènes 5, et la drogue absorption 6. Les compositions de lipides sébacés peuvent également servir de marqueurs de maladies. Ratios modifiés et les montants des sébacée bclasses de lipides de la route sont les signes cliniques de maladies telles que l'acné vulgaire 7, 8 pellicules, la dermatite séborrhéique 8, 9 astéatose, entre autres 10. tissus épidermiques et cheveux comprennent des profils variables contenant des stérols et dérivés, TAG, FFA, les céramides, les phospholipides, et d'autres composants lipidiques mineures. Étant donné que les lipides tégumentaire peuvent fonctionner dans des processus pathologiques, la détermination des différences dans la composition chimique des TAGs entre les individus sains et malades peut être utile pour le diagnostic clinique de la maladie.
Les lipides sont généralement définis comme étant des composés organiques insolubles dans l'eau avec des substituants soit non polaire ou non polaire polaires 11. structures lipidiques peuvent être des chaînes longues d'hydrocarbures oxygénés, des alcanes (y compris les esters de cire, des acides gras libres, des alcools, des cétones et des aldéhydes) ou des structures cycliques complexes tels que le cholestérol 12. Il ya huit principales classes de lipides sur la base de la structure (AGL, glycerolipids [GL], glycérophospholipides [GP], sphingolipides [SP], stérols lipides [ST], lipides prénol [PR], saccharolipids [sl], et polykétides [PK]), qui présentent un large éventail de propriétés chimiques en fonction de la classe 13. En raison de la grande variation dans les propriétés chimiques des classes de lipides, de profil direct sans dérivation avant de molécules lipidiques est souhaitée. Un procédé émergent dans la recherche de lipides est la chromatographie en couche mince (TLC) en combinaison avec désorption laser assistée par matrice / spectrométrie de ionisation à temps de vol de masse (MALDI-TOF MS) 14.
MALDI-TOF MS est largement utilisé dans la recherche pour identifier des protéines de protéomique et de les associer à des séquences spécifiques d'acides aminés en raison de la très grande précision peptide de masse d'ions générés «empreintes» de protéines digérées à la trypsine 15. MALDI-TOF MS peut également être utilisé pour le profil d'autres classes de biomolécules, y compris les lipides tels que TAG 16-18. MALDI nécessite l'utilisation d'une matrice, typquement un composé organique qui contient des structures double liaison aromatiques et conjugués. Les molécules de la matrice servent à transférer doucement l'énergie du laser pour les analytes, de promouvoir le transfert de protons, et de produire des ions à charge unique en phase gazeuse de 19 à 21. Les ions sont soumis à un champ de haute tension sous vide poussé et accélérés dans un analyseur de masse TOF où les ions sont ensuite séparés par des différences dans les vitesses qui sont proportionnels à leurs rapports masse sur charge. Même de très grosses biomolécules peuvent être ionisées avec peu de fragmentation, la production d'espèces moléculaires d'ions à charge unique pour l'analyse du spectre simplifié. La capacité à analyser les molécules lipidiques directement sans dérivation avant a favorisé l'adoption immédiate de MALDI-TOF MS dans la recherche lipidomiques 18.
Cet article présente une méthode de routine pour isoler et analyser les lipides tégumentaire de la chevelure, les sécrétions sébacées et plagiopatagium de la chauve-souris rouge de l'Est (Lasiurus borealis). Il est utilisé pour déterminer les variations interspécifiques de chauves-souris lipides tégumentaire d'élucider le processus de la maladie du syndrome du nez blanc (WNS) 22. WNS est une maladie fongique des chauves-souris et est causée par les espèces nouvellement décrites psychrophiles Geomyces destructans 23-25. WNS a causé la mort de plus de 5 millions de chauves-souris nord-américaines de la grotte et menace de l'extinction des espèces de chauves-souris vulnérables, avec des impacts économiques potentiels de milliards de dollars de dommages à l'industrie agricole 26,27. Pour étudier les étapes de G. destructans infection, les lipides ont été extraits à partir des tissus pour les cheveux et les ailes de chauve-souris rouges de l'Est et séparés en de larges classes de lipides par chromatographie sur couche mince afin d'isoler la fraction de DAT pour une analyse ultérieure par MALDI-TOF MS. TAG contiennent de courtes chaînes acyle et sont facilement détectés par MALDI-TOF MS avec peu d'interférences de matrice.
Protocole
ATTENTION: Obtenir à l'avance tous les permis provinciaux et fédéraux nécessaires pour la manipulation, le transport, le stockage et les chauves-souris. Les approbations doivent être obtenues auprès de votre soin des animaux et l'utilisation comité institutionnel, ainsi que de votre comité de biosécurité institutionnel. Si les chauves-souris vivantes (ou les tissus du système nerveux) doivent être traitées, les préposés aux animaux doivent être vaccinés contre la rage. Les chauves-souris utilisées dans la présente étude ont été recueillies à partir de la forêt nationale de Ozark Saint-François, AR, durant l'été 2010 selon les méthodes classiques (comité institutionnel de biosécurité approbation N ° de Arkansas State University 135349-1) 28.
Une. Traitement de tissus et extraction des lipides
- Nettoyez tous les instruments avec du méthanol avant et entre la collecte des tissus de différents individus. Couper les cheveux (environ 1,0 g) de la peau avec des ciseaux et les mettre dans un flacon Erlenmeyer de 125. Sébum échantillon de la surface de l'aile en frottant la peau avec 4 - 6 boules de coton imbibé de chloroforme: Solvant de methanol (C: M, 03:02 v / v), et de placer ceux-ci dans un ballon séparé.
- Extraire le tissu avec 10 ml de C: M (02:01 v / v) contenant 0,5% d'hydroxytoluène butylé (BHT) pour empêcher l'oxydation 29. N'utilisez que des solvants HPLC de qualité.
- Après 2 heures, ajouter environ 0,5 g de sulfate anhydre de chaque flacon, mélanger brièvement, et de recueillir le solvant par filtration sur papier filtre.
- Répétez les étapes deux fois 1.2 et 1.3. Une fois avec un mélange 1:1 C: et M successivement avec 01:02 C: M. Piscine filtrats ensemble.
- On évapore les filtrats groupés sous un courant de N2, déterminer le poids à sec, et on dissout le résidu dans de lipide 03:02 C: M (avec 0,5% de BHT) à une concentration de 10 mg / ml. échantillon de magasin dans des flacons de verre à -20 ° C. Il est généralement préférable d'analyser les échantillons dans un mois après le prélèvement de l'échantillon et de minimiser les cycles de gel-dégel.
2. Lipidique Séparation par préparative Chromatographie en couche mince
- Préparez à l'avance solvant lavé 1,5 ml microcetubes ntrifuge par remplissage avec 03:02 C: M, rinçage à l'acétone et séchage à l'air. Ceci est fait pour éliminer les plastifiants qui peuvent interférer avec l'analyse de masse plus tard de spectrométrie. Stocker des tubes échantillons dans un récipient exempt de poussière et manipuler ces tubes uniquement avec des gants pour éviter la contamination des huiles de la peau.
- Activer la plaque de CCM d'abord pré-développer avec 3:02 C: M. Ajouter suffisamment de solvant à la chambre TLC à une profondeur de 1 cm, puis placer la plaque dans la chambre (près avec couvercle en verre) et laisser le solvant jusqu'au complètement au dessus de la plaque. Cette opération prend environ 45 min.
- Retirer la plaque et la sécher dans une hotte jusqu'à ce que le solvant s'évapore (environ 15 min), puis mettre dans un four pendant au moins 10 min à 120 ° C. Placez une marque de crayon en haut de la plaque pour maintenir l'orientation lorsque les échantillons sont appliqués. Placez un trait de crayon droite, à 1,5 cm du bord inférieur de la plaque, pour marquer la ligne de base où l'échantillon et les normes seront placés.
- Préparer chambre TLC en coupant unemorceau de papier filtre assez grand pour recouvrir les deux parois courtes et une paroi longue. Placer le filtre papier doublure dans la chambre. Il sera entièrement mouillé lorsque le solvant est ajouté à la chambre.
- Préparer 100 ml de la phase mobile de solvant, qui est de l'hexane: éther diéthylique: acide acétique (H: E: A; 80:20:2 v / v / v). Verser le solvant dans la chambre pour donner une profondeur d'environ 1 cm. Couvrir avec le couvercle en verre, en utilisant un joint d'étanchéité à la graisse de silicone le long de l'arête supérieure de la chambre. Laisser la chambre s'équilibrer pendant la nuit avant de l'utiliser.
- Appliquer l'échantillon à la main la plaque préparée avec un tube capillaire ou une pipette en une série continue d'environ 1,5 cm à partir d'un bord de 1,5 cm à l'autre bord. Un applicateur automatique d'échantillons est préféré car il va charger l'échantillon dans une série de plus homogène. Utiliser les voies extérieures de la plaque CCM de repérer environ 20 pi de mélange stérol, FFA, TAG, et les normes d'esters de stérols (utilisation à 10 mg / ml; mélanges préfabriqués peuvent être obtenus).
- Placer la plaque CCM chargé dansla chambre équilibrée, fermer avec le couvercle, et de développer la plaque jusqu'à ce que le solvant fonctionne sur le bord supérieur. Cette opération prend environ 45 min avec la phase mobile est décrit ici. Retirer la plaque de la chambre et de permettre au solvant de s'évaporer à partir de l'excès de la plaque dans une hotte de laboratoire pendant environ 1 min.
- Pulvériser avec 0,05% de rhodamine 6G à 95% d'éthanol. Visualiser les bandes lipidiques sous une lampe à ultraviolet de longueur d'onde longue. Marque avec un crayon, la position de f de R pour les bandes fluorescentes résolus dans l'échantillon et les normes. Un dossier photographique peut être prise à ce stade.
- Identifier la bande correspondant à la norme de TAG et le retirer de la plaque par grattage de la silice avec une spatule sur un grand morceau de papier cristal peser papier. Transfert silice à un solvant lavé microtube de 1,5 ml.
- Ajouter 1,0 ml de 3:2 C: M solvant pour le tube de prélèvement, de traitement par ultrasons pendant 1 min, boulettes de la silice par centrifugation, puis transférer le solvant dans un nouveau tube pré-pesée. Répétez ee étape précédente, mettre en commun les filtrats, et évaporer le solvant sous un courant de N 2.
- Rangez le résidu séché contenant des balises sous N2 dans l'obscurité à 4 ° C tandis que les échantillons de tissus supplémentaires sont séparés par CCM. Rhodamine 6G est présente dans les échantillons, mais elle est insoluble dans l'hexane et on élimine au cours de dissolution de l'échantillon, immédiatement avant l'analyse MS.
3. TAG analyse par MALDI-TOF MS
- Préparer une nouvelle α-cyano-4-hydroxy-cinnamique (CHCA) solution de matrice par dissolution de 10 mg dans 1 ml CHCA solvant (49,5% d'éthanol, 49,5% d'acétonitrile et 1% de TFA aqueux à 0,1%).
- Préparer hormone adrenocarticotropic (ACTH; 18-39 pince, 2465,1989 Da) pour la résolution de l'instrument et des tests de sensibilité en mélangeant 1 ul d'ACTH (1 mg / ml) avec 39,5 pi d'acide trifluoroacétique à 0,1% (TFA) pour obtenir un 10 pmol / solution stock. Ceci peut être stocké à -20 ° C pour une utilisation ultérieure.
- Préparer un nouveau travail ACTH solution (1 pmol / ul) en prenant 1 pl de l'/ ul solution stock de 10 pmol, mélange avec 9 pi 0,1% de TFA, puis le mélange (1:1) avec 10 pi de la solution de matrice CHCA pour obtenir un fmole 500 / concentration ul.
- Préparer les normes TAG à 10 mg / ml dans 03:02 C: M pour l'étalonnage de l'instrument MALDI (par exemple tricaprine [470,361 Da], tricapryline [554,455 Da], trilaurine [638,549 Da], tripalmitine [722,642 Da], tripalmitolein [800,689 Da] , trimyristine [806,736 Da], trioléine [884,783 Da], tri-11-eicosenoin [968,877 Da], et trierucin [1,052,971 Da]).
- Préparer trioléine à 10 mg / ml dans C: 03:02 M pour un étalonnage standard de TAG externe lock-masse.
- Dissoudre les échantillons d'étiquette mémorisées dans l'hexane à une solution à 10 mg / ml.
- Préparer un 0,5 M (77,06 mg/1.0 ml) de solution mère d'acide 2,5-dihydroxybenzoïque (DHB) avec 90% de méthanol à utiliser comme échantillon et la matrice standard. Préparer aussi une solution à 1,0 M (2.0 g/50.0 ml) de NaOH. Couvrez le tube avec une solution de DHB utilisant de l'aluminium foi l abri de la lumière.
- Mix (dans des tubes pré-lavés) 10,0 pi matrice DHB, 10,0 ul d'échantillon ou standard, et M NaOH 5,0 pi 1.0. Mélanger et centrifuger brièvement le tube pour porter le mélange à la partie inférieure.
- Coin 1,0 pi de la norme, échantillon, ou de l'ACTH sur une plaque cible MALDI en acier inoxydable et le placer dans un dessiccateur à sec. Placer la plaque cible dans l'appareil d'acquisition de données.
- Effectuer MALDI-TOF MS analyse en mode réflectron positif. Tune et étalonner l'instrument tel que décrit par le fabricant de l'instrument selon la ACTH et des solutions standard de TAG.
- Acquérir des spectres pour chaque échantillon repéré sur la plaque cible (compatible avec les spécifications de l'instrument, les paramètres de ce travail étaient de 5 cadence de tir laser Hz, ~ 100 tirs par point pour obtenir un spectre moyen). Après lissage et en soustrayant le fond de spectres MALDI, pics processus d'ions manuellement avec le moteur de recherche en ligne LIPID MAPS (/ Tools / ms / glycerolipids_batch "target =" _blank "> www.lipidmaps.org / outils / ms / glycerolipids_batch).
- Copiez et collez la liste des spectres dans la liste des ions précurseurs et boîte d'intensité. Limiter la recherche à la composition d'acyle désiré. Identifiez TAG par la masse / charge (m / z) des rapports de ions présents dans le spectre pour chaque échantillon. Si l'ester méthylique d'acide gras (FAME) les pourcentages sont disponibles à partir de l'analyse GC / MS distinct, ajouter ces données pour obtenir les probabilités d'étiquettes présentes.
INSTRUMENT: Le spectromètre de masse utilisé dans cette étude est une des eaux MALDI Micro MX (équipé d'un nm 20 Hz N 2 laser 337). MALDI l'instrument de tout fabricant avec la capacité de mode de réflectron positif peut être utilisé. Les paramètres généraux sont tension d'impulsion, 2000 V; réflectron, 5200 V, la source, 15 000 V, avec l'acquisition de données en utilisant un logiciel MassLynx (v. 4.0). Ces conditions d'exploitation offrent une résolution de masse supérieure à 12 000.
Résultats
La méthode d'extraction pour isoler des lipides totaux à partir du tissu décrit par Folch 30 est une procédure simple, qui est adapté ici. Après extraction de tissu et l'évaporation du solvant, les lipides apparaissent souvent comme un film jaunâtre. La couleur jaune est la plus probable à partir de contaminants de protéines, qui peuvent être éliminés en effectuant une extraction liquide-liquide. Ce traitement de l'échantillon supplémentaire n'est pas nécessaire dans cette procédure parce CCM préparative sépare la fraction de TAG de ces contaminants. L'addition de sulfate de sodium anhydre frais, à tous les étages de filtrage permet de réduire la contamination de l'eau qui affecte des déterminations précises de poids de lipides.
Analyse des lipides tégumentaire des mammifères par CCM preparative avec H: E: A comme phase mobile sera généralement résoudre quatre bandes distinctes correspondant à (à partir de l'origine) des stérols, des acides gras libres, les étiquettes, et les esters de stérols / esters de cire / squalène (Figure 1). À l'occasion lors de l'utilisation analytiquecal haute performance (HP) avec la CCM H: E: Une phase mobile, les esters de stérols, les esters cireux, et le squalène se séparera et apparaissent comme trois bandes distinctes. Dans les conditions utilisées dans la présente étude, les esters de stérol / cireux ne sont pas séparés. Si ces bandes sont d'un intérêt, la phase mobile peut être commuté dans l'isooctane et d'éther éthylique (95:5 v / v), et la plaque de CCMHP peut être analysé par densitométrie à balayage. D'autres facteurs peuvent causer une mauvaise séparation. Ceux-ci sont généralement éliminées en plaçant le papier filtre dans la chambre, l'application de graisse pour un joint étanche sur le couvercle, la chambre d'équilibrage pendant une nuit, et le maintien de CCM chambres propres, afin d'obtenir des séparations et des données de qualité TLC cohérente.
Les spectres de masse MALDI-TOF représentant obtenu pour TAG isolés à partir de la chauve-souris rouge de l'Est sont présentés dans les figures 2 et 3. Ces spectres contiennent des pics ioniques TAG dans la plage entre la masse m / z de 850 à 910, qui est typique pour les TAGs isolées de mammifère non aquatiques. L'addition de NaOH 1,0 M favorise une seule charge des ions Na + qui sont plus stables que les ions H +. En plus de la stabilité, l'absence de H + et K + ions augmente la facilité d'analyse de spectre. Le m / z 850-910 ion pics correspondent à 16h00, 18h00, 18h01, 18h02 et groupements FA étant les constituants acyle dominantes dans les tags (tableau 1). Possibles fragments FA de TAG peuvent être initialement déterminé par le total des ions m / z présents dans spectres MS MALDI-TOF, et les différences entre les espèces et les individus déduites. Toutefois, si les rapports de contenu spécifiques acyle sont nécessaires, MS / MS ou chromatographie en phase gazeuse (GC / MS) doivent être utilisés. De plus amples informations sur les ratios d'acyle peut être déduite par l'observation des pics dans la région des diacylglycérides du spectre (figure 4). Diacylglycérides sont produites à partir de la fragmentation de TAG dans la source MALDI et peuvent être trouvés dans le m / z 590-650 région. fragmentation de TAG peut être augmentée paren omettant l'addition de NaOH 1,0 M 16. Le tissu de l'aile de chauve-souris rouge de l'Est se caractérise par un pic dominant à m / z 879,7 et tissu de cheveux avec un pic dominant à m / z 881,8 (Figure 2 et 3 respectivement). Pics à m / z 907,8, 879,7, 855,7 et (POP, OPP) sont à peu près même intensité (~ 50%) dans les tissus de cheveux avec le pic à 853,7 être d'environ 40%.
| Composition | Composition élémentaire | Masse observée |
| TAG Na + | TAG Na + | |
| SSO | C 57 H 108 O 6 | 911,8 |
| OOS, LSS | C 57 H 106 O 6 | 909.8 |
| OOO, LNSS, LSO | C 57 H104 O 6 | 907,8 |
| LOO, LLS | C 57 H 102 O 6 | 905,8 |
| LLO, OOLn | C 57 H 100 O 6 | 903.7 |
| LLL | C 57 H 98 O 6 | 901,7 |
| LLLn | C 57 H 96 O 6 | 899,7 |
| LLnLn | C 57 H 94 O 6 | 897,7 |
| Lnlnln | C 57 H 92 O 6 | 895,7 |
| OSP | C 55 H 104 O 6 | 883,8 |
| LSP, POO, Sopo | C 55 H 102 O 6 | 881,8 |
| LOP, LNSP, OPLS | C 55 H 100 O 6 | 879,7 |
| LLP, LNOP, Lopo | C 55 H 98 O 6 | 877,7 |
| LnLP, LLPo, LnOPo | C 55 H 96 O 6 | 875,7 |
| LnLnP, LnLPo | C 55 H 94 O 6 | 873,7 |
| LnLnPo | C 55 H 92 O 6 | 871,7 |
| PPS | C 53 H 102 O 6 | 857,8 |
| POP, OPP | C 53 H 100 O 6 | 855,7 |
| MOO, PPL, Popos, Popo | C 53 H 98 O 6 | 853,7 |
| PPLN, avec une belle piscine, Popoo, Myoo | C 53 H 96 O 6 | 851,7 |
| LLM, LnOM | C 53 H 94 O 6 | 849,7 |
| PPP, ALSS | C 51 H 98 O 6 | 829,7 |
| PppO, osla | C 51 H 96 O 6 | 827.7 |
| PPoPo, PMyO | C 51 H 94 O 6 | 825,7 |
| LnLnLa | C 51 H 86 O 6 | 817,6 |
| MMS, claque, PPM | C 49 H 94 O 6 | 801,7 |
| SLaPo, PPOM, PPMy | C 49 H 92 O 6 | 799,7 |
| PoPoM, OOCa | C 49 H 90 O 6 | 797,7 |
| MMP | C 47 H 90 O 6 | 773,7 |
| MMPo, Ocap | C 47 H 88 O6 | 771.7 |
| OCaPo | C 47 H 86 O 6 | 769,6 |
| MMM, PPCA, PMLA | C 45 H 86 O 6 | 745.6 |
| PoPCa, PoMLa | C 45 H 84 O 6 | 743.6 |
| Popoca | C 45 H 82 O 6 | 741,6 |
| LaLaP, MMLA, MCAP | C 43 H 82 O 6 | 717,6 |
| LaLaPo | C 43 H 80 O 6 | 715,6 |
| OO | C 39 H 72 O 5 | 643,5 |
| OL | C 39 H 70 O 5 | 641,5 |
| LL | C 39 H 68 O 5 | 639,5 |
| SP | C 37 H 72 O 5 | 619,5 |
| OP | C 37 H 70 O 5 | 617,5 |
| LP | C 37 H 68 O 5 | 615,5 |
Tableau 1. Composition des acides gras, la composition élémentaire et isotopique de masse de produits d'addition sodiated de triacylglycérides et diacylglycérides. Ln = acide linolénique (18h03), L = acide linoléique (18:2), O = acide oléique (18:1), S = l'acide stéarique (18h00), P = acide palmitique (16h00), Po = acide palmitoléique (16:1), M = acide myristique (14h00), Ma = myristoleïque (14:01) La = laurique acide (12h00), Ca = acide caprique (10h00).
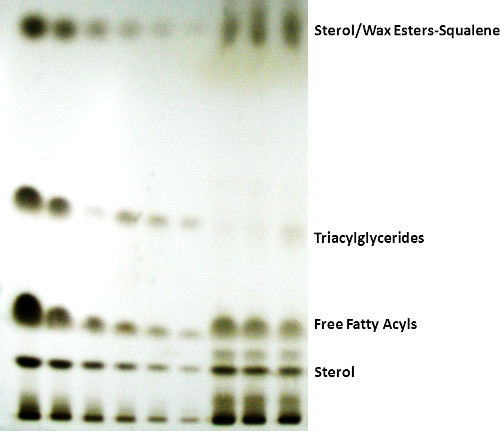
Figure 1. Chromatogramme sur couche mince de séparation de large classe de lipides par un mélange hexane: éther diéthylique: acide acétique(80:20:2 v / v / v) comme phase mobile. L'bande entre FFA stérol et n'a pas été identifiée par une norme, mais peut être un alcool gras ou une cire diester.
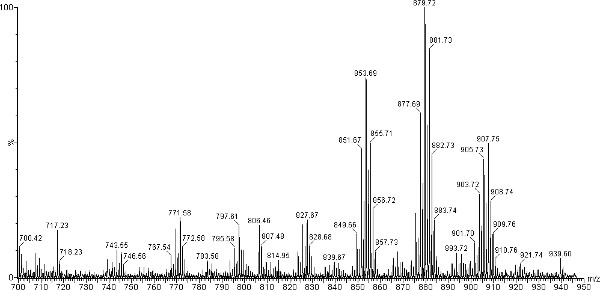
Figure 2. Région de TAG élargi de MALDI-TOF spectre de masse de TAG sodiated. (M / z 700 à 950) de chauve-souris rouge de l'Est (L. borealis) de tissu de l'aile pics identifiés à m / z 853,7 (MOO, PPL, Popos, Popo) et m / z 879,7 (LOP, LNSP, OPLS). Cliquez ici pour agrandir la figure .
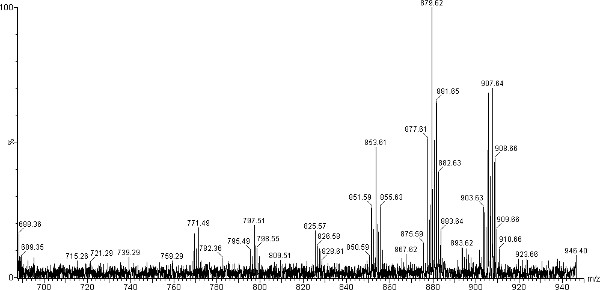
Figure 3. Région de TAG élargi de MALDI-TOF spectre de masse de TAG sodiated (m / z 700 à 950) de chauve-souris rouge de l'Est (L. borealis) des tissus de cheveux.Pics identifiés à m / z 905,8 (LOO, LLS) et m / z 907,8 (OOO, LNSS, LSO). Cliquez ici pour agrandir la figure .
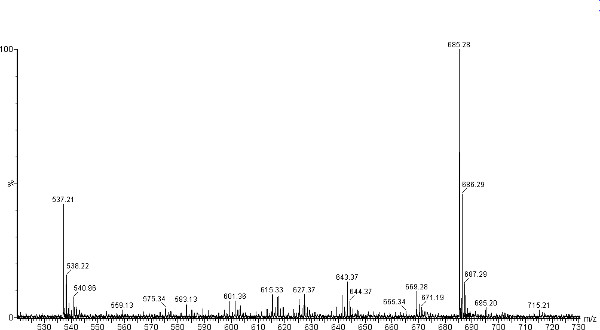
Figure 4. Région DAG de MALDI-TOF spectre de masse de fragments de DAG sodiated (m / z 530 à 730). Des tissus de chauve-souris rouge de l'Est (L. borealis) de l'aile pics identifiés à m / z 643,5 (OO) et m / z 615,5 (LP) . Cliquez ici pour agrandir la figure .
Discussion
Cet article présente une méthode simple et robuste pour séparer les grandes classes de lipides isolés à partir de tégument mammifère par CCM préparative et la détermination des profils de TAG par MALDI-TOF MS, sans dérivation de temps des molécules lipidiques. Les étapes essentielles de la production de spectres de la qualité de TAG avec MALDI-TOF MS comprennent: 1) l'extraction réussie du composé à la contamination ou oxydation minimale; 2) séparation suffisante et l'isolement par chromatographie, et 3) de haute résolution et une précision de masse par MALDI-TOF MS.
Ce document illustre la méthode par extraction et la séparation de la fraction lipidique neutre du plagiopatagium de la chauve-souris rouge de l'Est pour obtenir des profils MS TAG. Bien que la présente étude a utilisé une espèce de chauve-souris (Mammalia: Chiroptera), ces méthodes peuvent être étendues à étudier lipides tégumentaires de toutes les espèces de mammifères. Bat tégument se caractérise par une prédominance de cholestérol, avec des quantités plus faibles de TAG, FFA, squalene, et stérol / esters de cire. Ratios sébum lipidiques dans battes diffèrent des humains en ce que le squalène est présent en faibles quantités (par opposition à un maximum de 16% chez l'homme), tandis que le cholestérol se produit dans des proportions plus importantes (1-7% dans l'homme, mais de 26 à 62% en chauves-souris) 22 , 31. Cheveux humains contiennent environ 3% TAG, tandis que les ratios jusqu'à 28% se trouvent dans les cheveux de chauve-souris rouge de l'Est. L'extraction des échantillons lipidiques des chauves-souris est similaire pour d'autres espèces. Bien que dans la présente étude des boules de coton imbibé de solvant sont utilisés pour enlever le sébum, on peut également inverser un tube ou flacon échantillon contenant un solvant sur la surface des multiples temps de tégument. Produits spécialisés de bande fournissent également d'autres moyens pour extraire les lipides de surface 32. Une partie essentielle d'une bonne extraction des lipides est de minimiser la contamination par les huiles de la peau. Ceci est facilement réalisé en gardant une bouteille squeeze avec du méthanol et de pulvérisation toute la verrerie et les ustensiles, ustensiles essuyant avec un tissu entre tous les échantillons et portant des gants d'examen. Oxydation oacyles polyinsaturés f est empêchée par l'addition de BHT, et il doit être utilisé quelle que soit la température des échantillons sont stockés à.
analyse des biomolécules nécessite généralement une étape chromatographique à séparer les molécules d'intérêt de contaminants. TLC est utilisé dans le présent procédé, ce qui évite les exigences d'instrumentation pour gaz ou Chromatographie en phase liquide et nécessite moins d'expérience technique pour obtenir des résultats fiables et reproductibles. En fonction de la classe de lipides d'intérêt, de nombreux différentes phases mobiles peuvent être incorporés. En outre, l'utilisation de plaques HPTLC et densitométrie à balayage peut être utilisée pour obtenir des résultats quantitatifs. Bien que les variations de méthodes TLC sont trop nombreux pour les énumérer ici, certaines phases mobiles couramment utilisés dans les lipides CCM comprennent le chloroforme: méthanol: eau pour la séparation des phospholipides et des glycolipides ou iso-octane: l'éther éthylique pour la séparation des lipides non polaires 28. En termes de séparation mots-clés à d'autres classes de lipides, le H: E: Une sortesystème lvent fonctionne de manière cohérente et fournit des résultats comparables.
Un autre avantage de l'utilisation TLC est que les bandes d'intérêt peuvent être profilées rapidement en utilisant MALDI-TOF MS, sans dérivatisation préalable des analytes. Dans cette étude, la silice est retirée de la plaque de CCM, et l'analyte est élué de celle-ci par sonification dans un solvant et centrifugation subséquente à séparer l'adsorbant et l'évaporation du solvant d'élution. En variante, la matrice peut être appliquée directement sur des bandes d'analytes séparés sur des plaques de CCM et ensuite analysés directement par MALDI-TOF MS 33. Profilage succès par MALDI-TOF MS ne repose sur la préparation d'échantillon suffisante et la compétence de l'opérateur avec réglage et l'étalonnage de l'instrument. L'instrument doit être étalonné tous les jours avec les normes couvrant la gamme de poids moléculaire approprié pour les molécules d'intérêt. La sensibilité et la résolution appropriée (par exemple ≥ 10 000) de l'équipement devraient également être ConfirméD par jour par l'ACTH.
Les constituants lipidiques sébacées présentes à la surface du tégument mammifères peuvent jouer un rôle dans la colonisation par des bactéries pathogènes fongiques /. Par conséquent la connaissance de la composition chimique des espèces et des individus peut fournir des indices sur les processus de maladies humaines et animales. Différences intraspécifiques chez les personnes saines et malades peuvent représenter des signes cliniques qui aident à la détection de la maladie et le diagnostic. De plus, si des composés spécifiques qui inhibent la croissance microbienne sont présents, ceux-ci peuvent être identifiés pour une utilisation dans le traitement des maladies et la prévention.
Déclarations de divulgation
Les auteurs déclarent aucun intérêt financier concurrents.
Remerciements
Assistance a été fournie par Scott Treece, Katelyn Arter, Jeremy Ragsdell, Tony Lamarck James, Amy Fischer, Hannah Blair, et Cheyenne Gerdes lors de l'élaboration de méthodes de laboratoire. Nous tenons à remercier le Laboratoire Medina-Bolivar (Luis H. Nopo-Olazabal, Arkansas Biosciences Institute) de l'aide pour TLC densitométrie à balayage. MALDI-TOF MS utilisé pour ce projet a été fourni par la NSF EPSCoR, RII: Initiative ASSET Arkansas P3 Center (EPS-0701890) à l'Institut des biosciences de l'Arkansas. Le financement a été assuré par un des États-Unis Pêches et Wildlife Service / Arkansas State Wildlife Grant, la Société nationale de spéléologie et le Center for American Bat recherche et la conservation du Nord à l'Indiana State University.
matériels
| Name | Company | Catalog Number | Comments |
| Butylated Hydroxytoluene | MP Biomedicals, LLC | 101162 | www.mpbio.com |
| TLC Flexible Plates | Whatman | 4410-222 | www.whatman.com |
| ACTH | Sigma-Aldrich Chem. Co. | A8346-5X1VL | www.sigmaaldrich.com |
| Triolein | Sigma-Aldrich Chem. Co. | 44895-U | |
| TLC Lipid Standard | TLC 18-1 | www.nu-chekprep.com | |
| MALDI TAG Standard | Nu-Check Prep., Inc. | NIH Code 53B | |
| MALDI TAG Standard | Sigma-Aldrich Chem. Co. | 17810-1AMP-S | |
| Glass Vials with Teflon Cap | U.S. National Scientific Co. | B7800-2 | www.nationalscientific.com/ |
| DHB | Sigma-Aldrich Chem. Co. | 50862-1G-F | |
| CHCA | Sigma-Aldrich Chem. Co. | C8982-10X10 mg | |
| Sebutape | CuDerm | S100 |
Références
- Pappas, A., Anthonavage, M., Gordon, J. S. Metabolic fate and selective utilization of major FAs in human sebaceous gland. Journal of Investigative Dermatology. 118 (1), 164-171 (2002).
- Nicolaides, N., Hwei, H. C., Rice, G. R. The skin surface lipids of man compared with those of eighteen species of animals. Journal of Investigative Dermatology. 51 (2), 83-89 (1968).
- Desbois, A. P., Smith, V. J. Antibacterial free fatty acids: activities, mechanisms of action and biotechnological potential. Applied Microbiology and Biotechnology. 85 (6), 1629-1642 (2010).
- Munoz-Garcia, A., Williams, J. B. Cutaneous water loss and lipids of the stratum corneum in Dusky Antbirds, a lowland tropical bird. Condor. 109 (1), 59-66 (2007).
- Catala, A. The function of very long chain polyunsaturated fatty acids in the pineal gland. Biochimica et Biophysica Acta. 1801, 95-99 (2010).
- Stahl, J., Niedorf, F., Kietzmann, M. Characterization of epidermal lipid composition and skin morphology of animal skin ex vivo. European Journal of Pharmacology. 72 (2), 310-316 (2009).
- Picardo, M., Ottaviani, M., Camera, E., Mastrofrancesco, A. Sebaceous gland lipids. Dermato-Endocrinology. 1 (2), 68-71 (2009).
- Ro, B. I., Dawson, T. L. The role of sebaceous gland activity and scalp microfloral metabolism in the etiology of seborrheic dermatitis and dandruff. Journal of Investigative Dermatology. 10, 194-197 (2005).
- Davoudi, S. M., Sadr, B., et al. Comparative study of skin sebum and elasticity level in patients with sulfur mustard-induced dermatitis and healthy controls. Skin Research and Technology. 16 (2), 237-242 (2010).
- Zampeli, V. A., Makrantonaki, E., Tzellos, T., Zouboulis, C. C. New pharmaceutical concepts for sebaceous gland diseases: implementing today's pre-clinical data into tomorrow's daily clinical practice. Current Pharmaceutical Biotechnology. 13 (10), 1898-1913 (2012).
- Horton, H. R., Moran, L. A., et al. . Principles of Biochemistry. , (1993).
- Fahy, E., Subramaniam, S., et al. A comprehensive classification system for lipids. European Journal of Lipid Science and Technology. 107 (5), 337-364 (2005).
- Fahy, E., Subramaniam, S., et al. Update of the LIPID MAPS comprehensive classification system for lipids. Journal of Lipid Research. 50 (5), S9-S14 (2009).
- Fuchs, B., Süß, R., Nimptsch, A., Schiller, J. MALDI-TOF-MS directly combined with TLC: A review of the current state. Chromotagraphia. 69, S95-S105 (2009).
- Savary, B. J., Vasu, P., Lorence, A. . Recombinant Gene Expression, Reviews and Protocols. , (2011).
- Gidden, J., Liyanage, R., Durham, B., Lay, J. O. Reducing fragmentation observed in the matrix-assisted laser desorption/ionization time-of-flight mass spectrometric analysis of triacylglycerols in vegetable oils. Rapid Communications in Mass Spectrometry. 21, 1951-1957 (2007).
- Fuchs, B., Schiller, J. Application of MALDI-TOF mass spectrometry in lipidomics. European Journal of Lipid Science and Technology. 111 (1), 83-98 (2009).
- Fuchs, B., Sϋβ, R., Schiller, J. An update of MALDI-TOF mass spectrometry in lipid research. Progress in Lipid Research. 49 (4), 450-475 (2010).
- Karas, M., Bachmann, D., Hillenkamp, F. Influence of the wavelength in high-irradiance ultraviolet laser desorption mass spectrometry of organic molecules. Analytical Chemistry. 57 (14), 2935-2939 (1985).
- Hillenkamp, F., Karas, M., Holtkamp, D., Klusener, P. Energy deposition in ultraviolet laser desorption mass spectrometry of biomolecules. International Journal of Mass Spectrometry and Ion Processes. 69 (3), 265-276 (1986).
- Knochenmuss, R., Cole, R. B. . Electrospray and MALDI Mass Spectrometry: Fundamentals, Instrumentation, Practicalities, and Biological Applications. , 149-262 (2010).
- Pannkuk, E. L., Gilmore, D., Savary, B. J., Risch, T. S. Triacylglyceride (TAG) profiles of integumentary lipids isolated from three bat species determined by matrix-assisted laser desorption - ionization time-of-flight mass spectrometry (MALDI - TOF MS). Canadian Journal of Zoology. 90 (9), 1117-1127 (2012).
- Blehert, D., Hicks, A. C., et al. Bat white-nose syndrome: An emerging fungal pathogen. Science. 323 (5911), 227-228 (2009).
- Gargas, A., Trest, M. T., et al. Geomyces destructans sp. nov. associated with bat white-nose syndrome. Mycotaxon. 108, 147-154 (2009).
- Lorch, J. M., Meteyer, C. U., et al. Experimental infection of bats with Geomyces destructans causes white-nose syndrome. Nature. 480 (7377), 376-378 (2011).
- Frick, W. F., Pollock, J. F., et al. An emerging disease causes regional population collapse of a common North American bat species. Science. 329 (5992), 679-682 (2010).
- Boyles, J. G., Cryan, P. M., McCracken, G. F., Kunz, T. H. The economic importance of bats in agriculture. Science. 332 (6025), 41-42 (2011).
- Sikes, R. S., Gannon, W. L., et al. Guidelines of the American Society of Mammalogists on the use of wild mammals in research. Journal of Mammalogy. 92 (1), 235-253 (2011).
- Law, S., Wertz, P. W., Swartzendruber, D. C., Squier, C. A. Regional variation in content, composition, and organization of porcine epithelial barrier lipids revealed by thin layer chromatography and transmission electron microscopy. Archives of Oral Biology. 40 (12), 1085-1091 (1995).
- Folch, J., Lees, M., Sloane Stanley, G. H. A simple method for the isolation and purification of total lipids from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- Nicolaides, N. Skin lipids: Their biochemical uniqueness. Science. 186 (4158), 19-24 (1974).
- Camera, E., Ludovici, M., et al. Comprehensive analysis of the major lipid classes in sebum by rapid resolution high-performance liquid chromatography and electrospray mass spectrometry. Journal of Lipid Research. 51, 3377-3388 (2011).
- Fuchs, B., Süß, R., et al. Lipid analysis by thin-layer chromatography- A review of the current state. Journal of Chromatography A. 1218 (19), 2754-2774 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon