Method Article
Injection intra-lymphatique de particules de polymère biodégradables
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les ganglions lymphatiques sont les tissus immunologiques qui orchestrent la réponse immunitaire et constituent une cible critique pour les vaccins. Des biomatériaux ont été utilisés pour mieux cibler les ganglions lymphatiques et contrôler l’administration d’antigènes ou d’adjuvants. Cet article décrit une technique combinant ces idées pour injecter des particules de polymère biocompatibles dans les ganglions lymphatiques.
Résumé
La génération de la réponse immunitaire adaptative repose sur le drainage efficace ou le trafic de l’antigène aux ganglions lymphatiques pour le traitement et la présentation de ces molécules étrangères aux lymphocytes T et B. Les ganglions lymphatiques sont ainsi devenus des cibles critiques pour les nouveaux vaccins et immunothérapies. Une stratégie récente pour cibler ces tissus est l’injection directe des ganglions lymphatiques des composants solubles du vaccin, et les essais cliniques impliquant cette technique ont été prometteurs. Plusieurs stratégies de biomatériaux ont également été étudiées pour améliorer le ciblage des ganglions lymphatiques, par exemple, en accordant la taille des particules pour un drainage optimal des particules vaccinales de biomatériaux. Dans cet article, nous présentons une nouvelle méthode qui combine l’injection directe des ganglions lymphatiques avec des particules de polymère biodégradables qui peuvent être chargées d’antigène, d’adjuvant ou d’autres composants vaccinaux. Dans ce procédé, les microparticules polymères ou nanoparticules sont synthétisées par un protocole d’émulsion double modifié intégrant des stabilisants lipidiques. Les propriétés des particules(p. ex. taille, charge de la cargaison) sont confirmées par diffraction laser et microscopie fluorescente, respectivement. Les ganglions lymphatiques de souris sont ensuite identifiés par l’injection périphérique d’un colorant traceur non toxique qui permet la visualisation du site d’injection cible et le dépôt ultérieur de particules de polymère dans les ganglions lymphatiques. Cette technique permet un contrôle direct des doses et des combinaisons de biomatériaux et de composants vaccinaux administrés aux ganglions lymphatiques et pourrait être mise au point dans le développement de nouveaux vaccins à base de biomatériaux.
Introduction
Les ganglions lymphatiques (LN) sont les centres de commandement du système immunitaire. À ce site immunologique, les cellules présentatrices d’antigènes amorcent les lymphocytes naïfs contre les antigènes étrangers spécifiques pour activer les réponses immunitaires cellulaires et humorales. Les LN sont ainsi devenus une cible attrayante pour l’administration de vaccins et d’immunothérapies. Malheureusement, la plupart des stratégies vaccinales entraînent une administration inefficace et transitoire d’antigènes et d’adjuvants au tissu lymphoïde1. Les approches qui améliorent le ciblage et la rétention des composants du vaccin dans les IAA pourraient donc avoir un impact significatif sur la puissance et l’efficacité des nouveaux vaccins.
Une stratégie pour contourner le défi du ciblage des LN qui a démontré un grand intérêt pour les nouveaux essais cliniques est l’injection directe, intra-LN (i.LN.)2-4. Ces essais ont utilisé des conseils échographiques pour administrer des vaccins aux LN en tant que simple procédure ambulatoire. Par rapport aux voies d’injection périphériques traditionnelles, cette approche a permis d’épargner considérablement la dose et d’améliorer l’efficacité dans des contextes thérapeutiques, y compris les allergies et le cancer2-4. Ces études ont utilisé l’injection i.LN. de vaccins solubles(c’est-à-dire sans biomatériaux) qui ont été rapidement nettoyés par drainage lymphatique. Par conséquent, des injections multiples- ou des cycles d’injections multiples- ont été administrés pour réaliser ces effets thérapeutiques impressionnants. Une meilleure rétention dans le LN pourrait améliorer l’interaction entre l’antigène et/ou l’adjuvant et les cellules immunitaires, améliorant davantage la puissance de l’amorçage des cellules immunitaires. Ce potentiel est soutenu par des études récentes qui montrent que la cinétique de l’antigène et de l’administration adjuvante joue un rôle essentiel dans la détermination de la réponse immunitaire spécifique générée5-7. De plus, la localisation et la réduction au minimum des doses de médicaments et de vaccins pourraient réduire ou éliminer les effets systémiques, comme l’inflammation chronique.
Les biomatériaux ont fait l’objet d’études approfondies pour améliorer la puissance et l’efficacité des vaccins1,8,9. L’encapsulation ou l’adsorption sur les supports de biomatériaux peut protéger physiquement la cargaison de la dégradation et surmonter les limites de solubilité. Une autre caractéristique notable des transporteurs de biomatériaux, tels que les microparticules ou nanoparticules polymères, est la capacité de cocharger plusieurs classes de cargaison et, par la suite, de libérer ces cargaisons à intervalles contrôlés. Cependant, une limitation importante qui continue d’entraver les vaccins contre les biomatériaux et les immunothérapies in vivo est le ciblage inefficace des cellules immunitaires et le trafic limité vers les ganglions lymphatiques. Par exemple, l’injection périphérique de vaccins contre les biomatériaux par des voies conventionnelles(par exemple intradermiques, intramusculaires) présente généralement un mauvais ciblage du LN, avec jusqu’à 99% du matériel injecté restant au site d’injection4,10. Plus récemment, la taille des porteurs de vaccins biomatériaux a été réglée pour améliorer le trafic préférentiel ou le drainage de ces vaccins vers les LN par le flux interstitiel8,10. Ces progrès ont permis d’améliorer les réponses immunitaires cellulaires et humorales, soulignant l’importance de cibler et d’ingénierie l’environnement du LN pour de nouveaux vaccins.
Cet article présente un protocole de vaccination qui combine des particules de polymère stabilisées aux lipides et l’administration d’i.LN. pour générer des dépôts de vaccins à libération contrôlée5,11. S’appuyant sur des études récentes utilisant des techniques chirurgicales pour i.LN. chez la souris6,7,12,13, nous avons développé une stratégie rapide et non surgicale pour l’injection de vaccins biomatériaux chez les petits animaux5. La combinaison de l’administration i.LN. avec des porteurs de vaccins biomatériaux a puissamment amélioré la réponse des lymphocytes T CD8 dans les 7 jours suivant une seule injection de dépôts de vaccins à libération contrôlée5. Une réponse humorale forte(c.-à-d. titres d’anticorps) a été également générée ; ces deux améliorations étaient liées à une rétention accrue des composants du vaccin dans les ganglions lymphatiques qui était médiée par la libération contrôlée des porteurs de biomatériaux. Fait intéressant, la taille des particules vaccinales a modifié le devenir de ces matériaux une fois dans les LN: les particules à l’échelle nanométrique ont montré une absorption directe accrue par les cellules, tandis que les microparticules plus grosses sont restées dans l’environnement LN extracellulaire et ont libéré une cargaison(par exemple adjuvant) qui a été absorbée par l’antigène résident du LN présentant des cellules5. Ces données suggèrent deux voies qui pourraient être exploitées pour de nouveaux vaccins en contrôlant la taille des biomatériaux injectés i.LN.
Dans cet article, les particules polymères biodégradables stabilisées en lipides (micro- et nano-échelle) sont synthétisées à l’aide d’une stratégie de double émulsion modifiée5,11. Les propriétés des particules sont caractérisées par la diffraction laser et la microscopie. Ces particules sont ensuite injectées directement dans les LN inguinaux identifiés nonchirurgicalement à l’aide d’un colorant traceur commun et non toxique14. L’analyse post-injection des LN par histologie ou cytométrie de flux peut être utilisée pour vérifier la distribution des particules dans l’environnement LN, ainsi que pour surveiller l’absorption cellulaire et la rétention des particules au fil du temps. Pour les protocoles détaillant le traitement histologique et la cytométrie en flux, les lecteurs sont renvoyés aux articles récents de JoVE et aux rapports de revue15-22. Les résultats typiques démontrent le ciblage local de ces dépôts par LN qui pourraient être exploités pour obtenir des réponses immunitaires puissantes et efficaces ou pour adapter l’immunité aux agents pathogènes cibles.
Protocole
Toutes les études sur les animaux dans ce protocole ont été réalisées conformément aux directives fédérales, étatiques et locales, et en utilisant des protocoles examinés et approuvés par le Comité institutionnel de soins et d’utilisation des animaux (IACUC) de l’Université du Maryland.
1. Synthèse de microparticules et de nanoparticules stabilisées en lipides
- Dans un flacon en verre de 7 ml, combiner les lipides DOPC, DSPE-PEG et DOTAP à un rapport molaire de 60:20:20 pour préparer un mélange lipidique maître.
- Pour synthétiser un seul échantillon : Transférer respectivement 242,9 μl, 287,4 μl et 71,9 μl de DOPC, DSPE-PEG et DOTAP dans le flacon à l’aide de pipettes sérologiques en verre de 2 ml.
- Pour synthétiser plusieurs échantillons : Multipliez chaque volume lipidique ci-dessus par le nombre d’échantillons et combinez-les en un seul flacon, puis transférez des aliquotes égales de ce mélange lipidique dans des flacons correspondant à chaque échantillon à préparer.
- Sécher les lipides sous un doux flux d’azote gazeux pendant 10 min, ou les placer dans un four à vide pendant la nuit.
- Dans un seul flacon en verre vide de 20 ml, dissoudre 80 mg de PLGA dans 5 ml de dichlorométhane pour chaque échantillon de particules afin de générer une solution mère de polymère à 16 mg/ml.
- Ajouter 5 ml de solution polymère au(s) flacon(s) contenant les lipides, le capuchon et le vortex séchés pendant 30 secondes.
- Pour synthétiser des microparticules :
- Commencez à soniquer la phase organique contenant le polymère, les lipides et d’autres cargaisons insolubles dans l’eau sur la glace à 12 W à l’aide d’un sonicateur.
- Créer l’émulsion eau dans huile (p/o) à l’aide d’une pipette pour ajouter 500 μl deH2O distillé, ouH2O contenant 1 mg de peptide, de protéines ou d’autre cargaison soluble dans l’eau.
- Continuez à soniquer pendant 30 secondes à 12 W sur la glace, en berçant doucement le flacon de haut en bas et d’un côté à l’autre autour de la pointe du sonicateur pour assurer une émulsification complète.
- Créer l’émulsion eau-dans-huile-dans-eau (p/o/p) en versant l’émulsion p/o dans 40 ml deH2O dans un bécher de 150 ml.
- Homogénéiser pendant 3 min à 16 000 tr/min à l’aide d’un homogénéisateur numérique.
- Ajouter une barre d’agitation magnétique, transférer le bécher sur une plaque d’agitation et laisser l’émulsion p/s/p remuer pendant la nuit pour éliminer l’excès de solvant.
- Pour synthétiser des nanoparticules :
- Commencer à soniquer la phase organique contenant le polymère, les lipides et d’autres cargaisons insolubles dans l’eau sur la glace à 14 W.
- Créez l’émulsion w/o à l’aide d’une pipette pour ajouter 500 μl deH2O distillé, ouH2O contenant 1 mg de peptide, de protéines ou d’autres cargaisons solubles dans l’eau.
- Continuer à soniquer pendant 30 sec à 14 W sur la glace.
- Créer l’émulsion p/o/p en versant l’émulsion p/o à 40 ml deH2O dans un bécher de 150 ml et en soniquetant pendant 5 min à 16 W sur de la glace. Basculez doucement le flacon de haut en bas et d’un côté à l’autre autour de la pointe du sonicateur pour assurer une émulsification complète.
- Ajouter une barre d’agitation magnétique, transférer le ballon sur une plaque d’agitation et laisser l’émulsion p/s/p remuer pendant une nuit pour éliminer l’excès de solvant.
- Le lendemain matin, lavez et collectez les particules:
- Verser l’émulsion à travers une passoire de cellule à mailles de nylon de 40 μm dans un tube conique de 50 ml.
- Particules centrifuges pendant 5 min à 5 000 x g pour les microparticules ou 5 min à 24 000 x g pour les nanoparticules.
- Décantant le surnageant et lavage des particules par remise en suspension dans 1 ml deH2O.
- Transférer les particules en suspension dans un tube de microcentrifugation de 1,5 ml.
- Centrifuger pendant 5 min à 5 000 x g pour les microparticules ou 5 min à 24 500 x g pour les nanoparticules.
- Laver les particules deux fois de plus en enlevant le surnageant, en les ressuscitant dans 1 mlH2O,et en centrifugant comme à l’étape 1.6.5. Après le lavage, suspendre les particules dans 1 mlH2O pour une utilisation immédiate, ou lyophiliser pour un stockage prolongé.
2. Mesure du rendement de synthèse
- Pré-pondez un flacon en verre vide de 20 ml. Ajouter 100 μl de suspension de particules au flacon pré-pesé après avoir pipeté de haut en bas avec une micropipette à mélanger.
- Lyophiliser les particules ou sécher sous un doux jet d’azote.
- Peser le flacon contenant le polymère séché. Déterminer le rendement en particules dans le flacon en soustrayant le poids d’origine du flacon de la masse du flacon contenant les particules séchées.
- Déterminer le rendement global des particules en multipliant la masse de particules dans le flacon par le facteur de dilution. Pour déterminer le rendement en pourcentage, divisez la masse de particules par la masse d’entrée théorique maximale et multipliez par 100 %.
3. Détermination de la taille des particules
- Nettoyez la cellule de fraction de verre de style cuvette fournie en la remplissant d’eau désionisée et en essuyant avec un écouvillon à bout de coton. Transférer 10 ml deH2Odistillé dans la cellule de faction nettoyée, ajouter une micro-barre d’agitation magnétique et charger la cellule de fraction dans le support cellulaire de l’analyseur de granulométrie.
- Ajustez la vitesse d’agitation magnétique dans l’analyseur de particules pour obtenir un mélange complet dans la cellule de fraction et fermez la porte du compartiment.
- Alignez les lasers sur la cellule de fraction à l’aide de l’interface du logiciel de l’instrument.
- Utilisez l’interface du logiciel de l’instrument pour enregistrer une lecture de ligne de base avec la cellule de fraction ne contenant que duH2Odistillé.
- Pipettez la suspension de particules d’origine de haut en bas avec une micropipette à mélanger.
- Pipetter 10 μl de suspension de particules (généralement environ 0,5 mg) dans la cellule de fraction. Assurez-vous que le volume d’échantillon de particules ajouté à la cellule est suffisant pour générer l’intensité du signal dans la plage appropriée, comme indiqué sur l’interface du logiciel de l’instrument. La masse réelle de particules requise dépend du rendement en pourcentage et des propriétés optiques de l’échantillon de particules.
- Fermez la porte du compartiment de l’analyseur de granulométrie et mesurez la taille des particules à l’aide d’un indice de réfraction de 1,60 pour le PLGA.
- Utilisez l’interface logicielle pour calculer le diamètre des particules à l’aide d’un nombre.
4. Visualisation des particules
- Pipette suspension de particules de haut en bas avec micropipette à mélanger. Diluer la suspension de particules à 1 mg/ml dans de l’eau désionisée.
- Préparez une lame de microscope en ajoutant 3 μl de suspension de particules diluées et en montant une lame de couverture à un angle de 45 ° pour éviter la formation de bulles. Placez la lame sur l’étage du microscope et l’image à l’aide des ensembles de filtres appropriés pour chaque cargaison fluorescente.
5. Préparation de souris pour i.LN. injection
- Préparer une solution de colorant traceur:
- Préparer une solution à 0,1 % (p/v) de colorant traceur en dissolvant 10 mg de poudre de colorant avec 10 ml de H2O distillé.
- Stériliser la solution de colorant dans un flacon en verre à l’aide d’un filtre à seringue de 0,2 μm.
- Un jour avant l’injection, anesthésier la souris à l’aide d’isoflurane selon un protocole animal approuvé par l’IACUC. Pour évaluer la profondeur de l’anesthésie, effectuez un test réflexe de pincement des pincements et surveillez la fréquence respiratoire pour assurer une fréquence respiratoire d’environ 100 à 140 respirations par minute.
- Rasez les cheveux à la base de la queue et du quartier arrière à l’aide de tondeuses pendant que la souris est anesthésiée. Retirez les poils de la face ventrale de l’animal et latéralement autour de la face dorsale juste au-dessus de l’articulation de la jambe postérieure (hanche).
- Injecter un colorant traceur.
- Pour chaque injection de colorant, utilisez une micropipette pour transférer 10 μl de solution de colorant dans un tube de microcentrifugation et aspirez la totalité des 10 μl dans une aiguille 31G fixée à une seringue de 1 ml.
- Injecter 10 μl de solution de colorant par voie sous-cutanée de chaque côté de la base de la queue où les cheveux ont été coupés, rechargeant entre les injections.
- Enlevez les poils restants en appliquant une crème dépilatoire douce via des cotons-tiges. Assurez-vous d’enrober la zone entre la cuisse postérieure et l’abdomen.
- Laisser la crème dépilatoire incuber sur la peau pendant 3 min. Après l’incubation, main gantée humide avecH2Ochaud et frottez doucement la crème dépilatoire dans la peau.
- Retirez immédiatement la crème dépilatoire en mouillant la main gantée avec H2O chaud et en frottant la base de la queue et le quartier arrière. Répétez jusqu’à ce que l’excès dépilatoire soit enlevé, en vous assurant de garder la main mouillée pour éviter l’irritation.
- Retirez l’épilation résiduelle de la souris en mouillant un chiffon doux ou une serviette en papier avec H2Ochaud et en un seul mouvement, en essuyant la partie inférieure de la souris. Évitez un mouvement de frottement pour éviter l’abrasion ou les dommages à la peau de la souris.
- Laissez la souris récupérer sous une lampe chauffante et revenez à la tenue.
6. i.LN. Injection de particules
- Le lendemain, anesthésiez la souris à l’aide d’isoflurane conformément à un protocole animal approuvé par l’IACUC.
- Examinez la souris pour confirmer le drainage du colorant traceur dans chaque ganglion lymphatique inguinal. Le ganglion lymphatique doit être visible sous la forme d’une tache sombre près de la cuisse postérieure et de l’abdomen.
- Préparer une solution injectable de particules:
- Ressusciter les particules dansH2O distillé à la concentration d’injection désirée. Pour chaque injection, utilisez une micropipette pour transférer 10 μl de solution de particules dans un tube de microcentrifugation.
- Aspirer la totalité des 10 μl dans une aiguille à insuline 31G fixée à une seringue de 1 ml.
- Injecter la dose de particules:
- Après avoir visualisé le LN, serrez la peau autour du LN à l’aide du pouce, de l’index et du majeur pour tirer la peau et permettre le placement contrôlé du volume d’injection.
- Approchez le LN avec l’aiguille à un angle de 90° par rapport à la peau et pénétrez dans la peau au-dessus du LN teint jusqu’à une profondeur de 1 mm.
- Injectez lentement tout le volume. Pendant l’injection, observez le volume du LN à travers la peau pour confirmer l’injection par l’élargissement visible du LN.
- Laissez la souris récupérer sous une lampe chauffante et revenez à la tenue ou effectuez des tests supplémentaires.
Pour les techniques d’analyse pertinentes(par exemple, histologie, cytométrie en flux), voir les articles JoVE 265, 1743 et 3054 et les protocoles actuels en immunologie,chapitres 5 et 2115-22.
Résultats
Les résultats attendus pour les protocoles présentés dans ce manuscrit peuvent être divisés en trois catégories : la synthèse de particules, la préparation animale et l’injection de particules.
La figure 1 illustre la synthèse et la caractérisation de particules polymères biodégradables, stabilisées par des lipides amphiphiles. Les résultats du protocole de synthèse par évaporation émulsion/solvant(figure 1A)peuvent être évalués qualitativement par inspection visuelle des émulsions finales générées; les lots de particules doivent être des émulsions homogènes et stables à l’aspect opaque. Les complications comprennent des émulsions qui crèment ou floculent, souvent en raison d’un stockage inapproprié des stabilisants lipidiques. Pour éviter cette instabilité, les lipides doivent être conservés à -80 °C à l’état déshydraté ou dans un flacon scellé purgé avec de l’azote. L’évaluation quantitative de la synthèse des particules peut être effectuée à l’aide de la diffraction laser ou de la diffusion dynamique de la lumière pour analyser la distribution de la taille(Figure 1B). Les résultats attendus comprennent des tailles de particules monomodales étroitement réparties, indiquant une population uniforme de particules. Les paramètres de synthèse décrits dans ce manuscrit génèrent des distributions moyennes centrées sur environ 100 nm ou 3 μm pour les nanoparticules et les microparticules, respectivement. Une évaluation qualitative plus poussée de la synthèse des particules peut être réalisée en modifiant le protocole ci-dessus pour incorporer plusieurs classes de cargaison fluorescente. Sur la figure 1C,des images de microscopie de microparticules chargées d’un peptide fluorescent (FITC, vert), d’un colorant lipophile (DiD, rouge), et d’une image de superposition (jaune) confirment la création de particules dans la gamme de taille souhaitée et l’encapsulation de peptide dans le volume de la particule.
Les deux premiers panneaux de la figure 2 résument les résultats attendus de la préparation des animaux pour la stratégie d’injection i.LN. décrite dans le présent document. La méthodologie consiste à marquer les LN inguinaux par injection périphérique d’un traceur non toxique afin d’identifier l’emplacement de l’injection ultérieure de particules i.LN. (figure 2A)5. Comme nous l’avons mentionné, le drainage du colorant traceur après injection sous-cutanée à la base de la queue permettra la visualisation des LN inguinaux (Figure 2B)5. L’ingestion de crèmes dépilatoires approuvées peut présenter des dangers pour les souris. Ainsi, il faut prendre soin d’enlever soigneusement toute la crème appliquée, en accordant une attention particulière aux pattes et à la face ventrale des souris. L’épilation doit être enlevée à l’aide d’un chiffon humide et doux ou d’une serviette en papier humide dans un seul mouvement lisse. Évitez de frotter pour enlever la crème, car cela peut entraîner des abrasions sur la peau exposée des souris.
La confirmation du local de la livraison au LN inguinal peut être évaluée par l’observation ou l’histologie. Le volume LN peut être surveillé visuellement pendant l’injection comme un indicateur de l’injection réussie. Les résultats attendus comprennent une distribution efficace de la cargaison dans toute la structure du LN, sans fuite importante vers les tissus ou les cellules adjacents. De plus, comme le liquide injecté déplace/dilue le traceur dans le LN, la concentration/coloration du colorant devrait devenir moins intense après l’injection. L’observation du tissu devrait indiquer un LN intact, mais agrandi dû à l’injection liquide. Les défis potentiels incluent l’injection trop rapidement ou l’absence du LN, qui peuvent tous deux causer l’élution du volume dans le tissu sous-cutané environnant. Ces résultats indésirables peuvent être confirmés par l’autopsie ou l’histologie, où la suspension de particules sera observée se propageant aux cellules et aux tissus éloignés des nœuds ciblés pour l’injection. En revanche, un résultat attendu serait l’identification d’un LN inguinal agrandi en raison du confinement des particules dans la structure LN. Le traitement histologique des LN excisés peut confirmer définitivement la livraison de la cargaison au tissu lymphoïde, comme le montrent les figures 2C et 2D. Notez que les particules de la figure 2 incorporent une cargaison fluorescente pour permettre la visualisation de la cargaison pendant l’injection, ainsi que pendant le traitement histologique et la microscopie fluorescente.
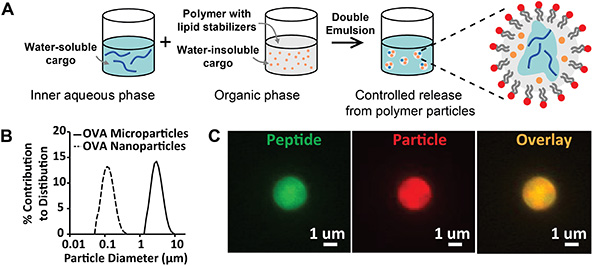
Figure 1. Synthèse et caractérisation des particules stabilisées lipidiques. A) Schéma de schéma décrivant la synthèse de particules stabilisées en lipides préparées par évaporation émulsion/solvant. B) Distributions granuriques des microparticules (ligne continue, diamètre = 2,8 μm) et des nanoparticules (ligne pointillée, diamètre = 113 nm). C) Images de microscopie fluorescente de particules chargées d’un peptide marqué par fluorescence et d’un colorant à particules fluorescentes. Étiquettes: peptide (vert) et particule (rouge). Cliquez ici pour agrandir l’image.

Figure 2. i.LN. Injection and Distribution of Biodegradable Particles within LN. A)Méthodologie pour l’injection i.LN. B) Visualisation des LN chez une souris à travers la peau (image supérieure) et après l’autopsie (image inférieure)5. C) Coloration histologique d’un LN confirmant le dépôt et la distribution de microparticules polymères marqués par fluorescence (particules, vertes; Lymphocytes T, rouges; Cellules B, bleu). D) Nanoparticules marqués par fluorescence (50 nm, image de gauche) et microparticules (6 μm, image de droite) dans les LN 24 heures après injection. Cliquez ici pour agrandir l’image.
Discussion
La technique décrite dans ce protocole permet l’administration contrôlée des vaccins aux LN et aux cellules présentatrices d’antigène ln-résidentes. La cargaison encapsulée de biomatériaux peut être localisée dans le réseau local, ce qui permet de manipuler les doses d’un ou de plusieurs types de cargaisons livrées au microenvironnement du réseau local. Il a été démontré que la localisation et la libération contrôlée des particules de polymère génèrent une puissante réponse immunitaire cellulaire et humorale à des doses significativement plus faibles que les approches conventionnelles. De plus, grâce à la manipulation de la taille du support de biomatériaux, le mode primaire de traitement cellulaire peut être modulé entre l’absorption directe de nanoparticules ou la libération de cargaison extracellulaire à partir de microparticules plus grandes5. Ces résultats établissent la faisabilité de l’administration de biomatériaux i.LN. en tant que plate-forme pour l’administration de vaccins thérapeutiques.
La synthèse de particules PLGA par émulsion/évaporation de solvant a été largement utilisée dans les applications d’administration de médicaments23,24. Ainsi, les défis potentiels associés à cette technique sont principalement liés à l’identification et au dépôt réussis des vaccins dans le site cible du nouveau-n°c. Bien que l’utilisation du colorant traceur facilite la visualisation des LN inguinaux ciblés, la taille et la profondeur de la cible sous la peau sont petites. Ainsi, les auteurs recommandent d’allouer du temps et des souris pour pratiquer la préparation et les injections de souris. Pendant la préparation de l’animal(c’est-à-dire le rasage et l’application d’un dépilatoire), il faut veiller à ne pas couper les souris sur la face ventrale de l’animal où l’angle de la jambe avec l’abdomen rend la peau plus sujette aux blessures causées par les tondeuses. De plus, tous les dépilatoires doivent être enlevés avec de l’eau tiède pour empêcher les animaux d’ingérer la crème pendant le comportement normal de toilettage. Pour pratiquer les injections de LN, une concentration plus élevée de colorant traceur peut être administrée et les animaux de pratique peuvent être euthanasiés, puis injectés plusieurs fois. Après l’injection, les souris peuvent être nécropsiées et la taille des LN provenant d’animaux injectés peut être comparée à celle d’un LN témoin non injecté. Une limitation de cette technique est la limite physique du volume d’injection qui peut être chargé dans la structure LN. Notre protocole suggère un volume d’injection de 10 μl chez la souris, bien que d’autres études aient rapporté des volumes d’injection plus importants au moins aussi élevés que 20 μl.13 Cependant, l’administration directe de vaccins par injection i.LN. permet une réduction spectaculaire de la dose, de sorte que la fonction de ces vaccins ne devrait généralement pas être limitée par des contraintes de volume.
Comme nous l’avons mentionné, la modification de la propriété physique des particules(c.-à-d. la taille) est un mécanisme efficace pour modifier la voie ou les résultats induits par les biomatériaux et les cargaisons encapsulées dans le tissu LN. Le protocole d’évaporation émulsion/solvant peut facilement être modifié pour modifier les propriétés physiques ou chimiques telles que la charge ou la fonctionnalité de surface, et le taux de biodégradation/libération de la cargaison23,24. Par exemple, la cinétique de libération peut être réglée par des compositions polymères alternatives, et la fonction de surface peut être modifiée à l’aide de compositions lipidiques modifiées ou de poly(alcool vinylique). La cargaison chargée en particules peut être facilement manipulée pour contenir différents antigènes ou adjuvants pour les agents pathogènes cibles. L’avantage de cette approche est obtenu grâce à la combinaison de la livraison i.LN. avec la mainlevée locale et contrôlée de la cargaison à partir de biomatériaux. Cette synergie établit une plate-forme qui peut être exploitée pour générer efficacement des réponses immunitaires adaptatives à l’aide de doses infimes et avec des effets secondaires non spécifiques / systémiques réduits.
Déclarations de divulgation
Les coûts de production et les frais d’accès pour ces articles ont été partiellement parrainés par HORIBA, Ltd.
Remerciements
Ce travail a été financé en partie par la fondation PhRMA et un prix de recherche et d’érudition de l’Université du Maryland, College Park. Nous remercions le Professeur Darrell Irvine pour son soutien aux travaux initiaux menés dans le cadre de l’achèvement de « l’ingénieriein situ du microenvironnement ganglionnaire par injection intranodale de particules polymères libérant des adjuvants ». 5
matériels
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375 | 10 mg/ml stock in chloroform |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[amino(polyethylene glycol)-2000] ammonium salt (DSPE-PEG) | Avanti Polar Lipids | 880128 | 10 mg/ml stock in chloroform |
| 1,2-Dioleoyl-3-trimethylammonium-propane chloride salt (DOTAP) | Avanti Polar Lipids | 890890 | 10 mg/ml stock in chloroform |
| Polylactic-co-glycolic acid (PLGA) | Sigma-Aldrich | P2191 | Lactide:Glycolide (50:50). MW 30,000-60,000 |
| Dichloromethane (DCM) | VWR | BDH1113 | |
| Isoflurane | Vetone | 502017 | |
| Nair | Nair | ||
| Evans blue tracer dye | VWR | AAA16774-09 | |
| U-100 BD Ultra-Fine Short Insulin Syringes, 31 G 5/16 in needle | VWR | BD328418 | |
| Single-Use Needles, BD Medical, 21 G, 1.5 in needle | VWR | BD305167 | |
| Syringes with BD Luer-Lok Tip, BD Medical, 1 ml | VWR | BD309628 | |
| Falcon Cell Strainers, Sterile, Corning, 40 µm | VWR | 21008-949 | |
| Vybrant DiD Cell-Labeling Solution | Invitrogen | V-22887 | |
| Fluoresbrite YG Microspheres 6.00 µm | Polysciences | 17149 | |
| Fluoresbrite YG Microspheres 0.05 µm | Polysciences | 17156 | |
| Ovalbumin, Purified | Worthington Biochemical | LS003056 | |
| Qsonica Sonicator Ultrasonic Processor Q125 | Qsonica | Q125 | 1/8 in diameter microtip probe |
| Ultra-Turrax T 25 digital homogenizer | IKA | YO-04739-22 | 10 G dispersing element |
| Fluorescent Microscope | Olympus | IX-83 | |
| Laser Diffraction Particle Size Distribution Analyzer | Horiba | LA-950 | Including provided cuvette-style glass fraction cell |
| Professional 8685 Peanut Classic Clippers | Wahl |
Références
- Swartz, M. A., Hirosue, S., Hubbell, J. A. Engineering Approaches to Immunotherapy. Sci. Transl. Med. 4, (2012).
- Adamina, M., et al. Intranodal immunization with a vaccinia virus encoding multiple antigenic epitopes and costimulatory molecules in metastatic melanoma. Mol. Ther. 18, 651-659 (2010).
- Ribas, A., et al. Intra-Lymph Node Prime-Boost Vaccination against Melan A and Tyrosinase for the Treatment of Metastatic Melanoma: Results of a Phase 1. Clinical Trial. Clin. Cancer Res. 17, 2987-2996 (2011).
- Senti, G., et al. Intralymphatic allergen administration renders specific immunotherapy faster and safer: a randomized controlled trial. Proc. Natl. Acad. Sci. U.S.A. 105, 17908-17912 (2008).
- Jewell, C. M., Lopez, S. C. B., Irvine, D. J. In situ engineering of the lymph node microenvironment via intranodal injection of adjuvant-releasing polymer particles. Proc. Natl. Acad. Sci. U.S.A. 108, 15745-15750 (2011).
- Johansen, P., et al. Antigen kinetics determines immune reactivity. Proc. Natl. Acad. Sci. U.S.A. 105, 5189-5194 (2008).
- Randolph, G. J., Angeli, V., Swartz, M. A. Dendritic-cell trafficking to lymph nodes through lymphatic vessels. Nat. Rev. Immunol. 5, 617-628 (2005).
- Irvine, D. J., Jewell, C. M. Ch. 132. Comprehensive Biomaterials. Ducheyne, P., et al. , (2011).
- Moon, J. J., Huang, B., Irvine, D. J. Engineering Nano- and Microparticles to Tune Immunity. Adv. Mater. 24, 3724-3746 (2012).
- Reddy, S. T., et al. Exploiting lymphatic transport and complement activation in nanoparticle vaccines. Tissue Eng. Part A. 14, 734-735 (2008).
- Bershteyn, A., et al. Polymer-supported lipid shells, onions, and flowers. Soft Matter. 4, 1787-1791 (2008).
- Johansen, P., et al. Direct intralymphatic injection of peptide vaccines enhances immunogenicity. Eur. J. Immunol. 35, 568-574 (2005).
- Mohanan, D., et al. Administration routes affect the quality of immune responses: A cross-sectional evaluation of particulate antigen-delivery systems. J. Controlled Release. 147, 342-349 (2010).
- Harrell, M. I., Iritani, B. M., Ruddell, A. Lymph node mapping in the mouse. J. Immunol. Methods. 332, 170-174 (2008).
- He, H., Courtney, A. N., Wieder, E., Sastry, K. J. Multicolor Flow Cytometry Analyses of Cellular Immune Response in Rhesus Macaques. J. Vis. Exp. , 1743(2010).
- Matheu, M. P., Parker, I., Cahalan, M. D. Dissection and 2-Photon Imaging of Peripheral Lymph Nodes in Mice. J. Vis. Exp. e265. , 265(2007).
- Salmon, H., et al. Ex vivo Imaging of T Cells in Murine Lymph Node Slices with Widefield and Confocal Microscopes. J. Vis. Exp. , 3054(2011).
- Donaldson, J. G. in Current Protocols in Immunology: Immunofluorescence Staining. , John Wiley & Sons, Inc. (2001).
- Hofman, F. in Current Protocols in Immunology: Immunohistochemistry. , John Wiley & Sons, Inc. (2001).
- Holmes, K., Lantz, L. M., Fowlkes, B. J., Schmid, I., Giorgi, J. V. in Current Protocols in Immunology: Preparation of Cells and Reagents for Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Overview of Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Analysis of Flow Cytometry Data. , John Wiley & Sons, Inc. (2001).
- Anderson, J. M., Shive, M. S. Biodegradation and biocompatibility of PLA and PLGA microspheres. Adv. Drug Deliv. Rev. 28, 5-24 (1997).
- Danhier, F., et al. PLGA-based nanoparticles: an overview of biomedical applications. J. Controlled Release. 161, 505-522 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon