Method Article
Cathétérisme de l'artère carotide et Veine jugulaire faire pour effectuer des mesures hémodynamiques, Infusions et prélèvement sanguin dans un modèle de rat Conscients
Dans cet article
Résumé
Vascular accesses to measure hemodynamics, provide fluids and perform blood sampling are important to any small animal model study. We present a technique for implanting catheters into the carotid artery and the common jugular vein in an anesthetized rat for connecting to a system to perform monitoring, infusions and sampling.
Résumé
Le succès d'un petit modèle animal pour étudier les maladies graves est, en partie, tributaire de la capacité du modèle de simuler la condition humaine. Inoculation intra-trachéale d'une quantité connue de bactéries a été utilisée avec succès pour reproduire la pathogenèse de la pneumonie qui se développe ensuite dans la septicémie. Surveillance des paramètres hémodynamiques et fournir un traitement clinique standard y compris perfusion d'antibiotiques, de fluides et de médicaments pour maintenir la pression artérielle est essentiel pour simuler les soins de soutien de routine dans ce modèle, mais de le faire exige à la fois artérielle et veineuse accès vasculaire. La vidéo détaille la technique chirurgicale pour implanter l'artère carotide et cathéters de veine jugulaire communes dans un rat anesthésié. Après une période de récupération de 72 heures, les animaux sont anesthésiés de nouveau et reliées à une installation d'attache pivotant et fixé au boîtier de rongeur qui relie les cathéters implantés dans le système de surveillance hémodynamique. Cette configuration permet la libre circulation de larat au cours de l'étude tandis que les pressions de surveillance continue, la perfusion de liquides et de médicaments (antibiotiques, des vasopresseurs) et en effectuant un prélèvement de sang.
Introduction
Cathétérisme artériel et veineux de rats a longtemps été utilisé dans la recherche de laboratoire. 1, 2 cathétérisme peut être utilisé pour la surveillance des paramètres hémodynamiques y compris systolique, diastolique et la pression artérielle moyenne (PAM), la fréquence cardiaque (FC) et la pression veineuse centrale (CVP) 3,4. En outre, ces cathéters permettent l'infusion de traitements standard ou thérapies potentielles ainsi que le prélèvement de sang pour analyser davantage le mécanisme sous-jacent d'une maladie ou d'un traitement. Par conséquent, avoir accès vasculaire dans un petit modèle animal est essentielle pour l'étude de mesures de performance clinique et les effets du traitement.
Pour étudier les causes sous-jacentes de maladies graves, il est important d'abord de développer un modèle pour simuler la condition humaine. Inoculation intra-trachéale d'une quantité connue de bactéries a été utilisée avec succès pour reproduire la pathogenèse de la pneumonie, une infection pulmonaire sévère qui se développe ensuite dans la septicémie.3, 5 Suivi des mesures hémodynamiques et fournir un traitement clinique standard est essentiel pour simuler les soins de soutien de routine. Traitement clinique standard comprend perfusion d'antibiotiques qui aide à effacer l'infection sous-jacente et l'administration de liquides et de vasopresseurs, deux thérapies employées chez les patients septiques pour maintenir la pression sanguine. 5-7 l'accès vasculaire, en particulier l'implantation de cathéters de brevets est particulièrement important lorsque nous étudions thérapies expérimentales pour la septicémie.
Pendant de nombreuses années, la capacité d'administrer un traitement clinique standard pour les rongeurs a été limitée par la disponibilité des matériaux avec les propriétés nécessaires pour la construction de cathéters implantables et la capacité de la technologie d'infusion de fournir de petits volumes précision dans le temps. En outre, la capacité de déclencher une perfusion en réponse à la surveillance continue d'une mesure hémodynamique spécifique permet une position constante et reproductiblemodèle ard de traitement lors de l'utilisation plus grande des tailles d'échantillon typique de études sur les rongeurs. 8, 9 Ces limitations technologiques dans les matériaux et le matériel de précision ont été surmontés mais de fournir simultanément des thérapies de routine tout en surveillant les paramètres hémodynamiques, à la fois artérielle et l'accès vasculaire veineuse doivent être disponibles.
La vidéo détaille la technique chirurgicale pour implanter l'artère carotide et cathéters de veine jugulaire communes dans un rat anesthésié. Après une période de récupération de 72 heures, les animaux sont anesthésiés de nouveau et reliées à une installation d'attache pivotant et fixé au boîtier de rongeur utilisé pour connecter les cathéters implantés dans le système de surveillance hémodynamique. Pendant l'étude, le système permet une perfusion de fluide à base de part et délivrer un volume donné, à un certain débit de perfusion ou d'un système automatisé qui fournit un débit de perfusion en fonction de la pression artérielle moyenne détectée afin de maintenir une plage de pression donnée. Système de perfusion de fluideutilise seringue programmable pompes qui interface avec sorties numériques du système d'acquisition de données et sont contrôlés par le logiciel de surveillance du MAP. L'installation d'attache pivotant et permet la libre circulation du rat au cours de l'étude, tout en surveillant la pression, la perfusion des fluides et des vasopresseurs, et en effectuant un prélèvement de sang sans avoir à manipuler les animaux. Surveillance simultanée de jusqu'à 12 animaux instrumentés avec deux cathéters chacun (dans notre configuration) avec le matériel extensible à surveiller 24 animaux instrumentés permet une grande souplesse pour étudier plusieurs groupes stratifiés dans chaque expérience.
Cette procédure de cathétérisme peut être bénéfique aux installations de recherche qui utilisent des modèles de rongeurs similaires nécessitant un accès vasculaire pour la surveillance, l'échantillonnage et le traitement pour un maximum de 11 jours. Si le centre de recherche compte tenu de cette procédure a de l'expérience avec des rongeurs et une structure de soutien adéquate pour maintenir ces animaux puis developing ces compétences peuvent fournir une économie significative des coûts, réduisant le coût total par rat cathétérisé de plus de 180 $ à moins de 50 $ (incluant rat naïf, composants du cathéter et les coûts techniques) et accroître la flexibilité de planification (rats naïfs sont facilement disponibles vs calendrier de livraison de l'entreprise des rats implantés). Le succès de cette procédure dépend des compétences de la personne effectuant les cathétérismes. Les animaux de formation requis pour devenir compétent dans cette procédure a varié de 20 à 40 rats avec un taux de perméabilité du cathéter résultant de> 90%.
Protocole
Les procédures décrites ci-dessous ont été réalisées dans le cadre d'un protocole approuvé par le soin et l'utilisation des animaux Comité du Centre clinique des Instituts nationaux de la santé.
1. Préparation pour l'intervention
- Gaz stériliser les cathéters et les instruments.
2. Préparer les cathéters
- Rincer les cathéters avec le glycérol héparine (250 UI d'héparine / ml de glycérol 1) pour assurer la perméabilité et éviter les fuites. Brancher extrémité du cathéter avec un bouchon métallique (20 ga, 15 mm) pour retenir glycérol hépariné.
3. Préparer aseptique Workstation
- Utilisez 70% d'alcool pour pulvériser les postes de travail et instruments plateaux. Utilisez un champ stérile pour couvrir les instruments exploitation table et plateaux et place des instruments sur le plateau.
4. Préparer rats pour la chirurgie
- Lieu rat individuellement dans une chambre Lucite et exposer à un anesthésique; isoflurane (3-5%) mélangeed avec de l'oxygène jusqu'à inconscient. Retirer rat de la chambre et de se raser la fourrure des zones antérieures et postérieures du cou. Appliquer du lubrifiant onguent pour les yeux.
5. cathéter Implantation
- Placez rat anesthésié (confirmé par pincement de l'orteil) sur une table chirurgicale chauffée en position ventrale; placer son nez dans le cône de nez pour maintenir l'anesthésie avec respiration spontanée (isoflurane; 3,5%). Frottez doucement la zone chirurgicale 3 fois utilisation de Betadine et 70% d'alcool en alternance. Faire une incision de 0,5 cm de la peau de la ligne médiane entre les omoplates en utilisant une paire de ciseaux chirurgicaux.
- Repositionner rat dans la position dorsale; freiner doucement les jambes de chaque côté de la table à l'aide de bandes de caoutchouc; maintenir l'anesthésie. Placez deux laminés gaze de 4x4 stérile sous le cou pour hyperextension légèrement pour une meilleure exposition. Faire un col droit de l'incision de la peau ventrale de 2 cm de la ligne médiane du cou au niveau de la clavicule au moyen d'un scalpel.
6. DroitVeine jugulaire cathétérisme
- L'utilisation d'un hémostatique, disséquer carrément la veine jugulaire droite, séparer salivaires et les tissus lymphatiques de visualiser et d'isoler une section de 5 mm du navire. En utilisant une suture de soie 4-0, placer un lien lâche sur les deux extrémités crânienne et caudale de la cuve afin de maximiser l'exposition de la cuve. Utilisation d'un ciseau chirurgical micro faire une incision assez grand pour passer le cathéter, conformément à la cuve entre les deux ligatures et attacher la ligature autour du vaisseau crânien.
- Insérer le cathéter dans le vaisseau veineux vers le coeur à l'aide du micro crochet et une pince de dissection et de faire avancer le cathéter jusqu'à ce que tout le segment PU 3F est dans le récipient. Utiliser les ligatures aux extrémités crânienne et caudale pour fixer le cathéter dans le récipient.
7. artère carotide gauche de cathétérisme
- L'utilisation d'un hémostatique, disséquer le muscle omo-hyoïdien carrément longitudinalement pour exposer l'artère carotide gauche et isolate une section de 5 mm de la cuve. Assurer le nerf vague (de couleur blanche) est complètement séparée de l'artère. Prenez soin de ne pas déchiqueter ou rompre le nerf.
- Utilisation 4-0 suture de soie, placer une cravate lâche sur l'extrémité caudale du navire, attacher l'extrémité crânienne de la cuve et placer une pince bulldog caudale dessus de la suture pour arrêter l'écoulement de sang après l'incision. En utilisant une paire de ciseaux chirurgicaux micro, faire une incision, assez grand pour passer le cathéter, en ligne avec le navire entre les deux ligatures. Insérez le cathéter artériel vers le cœur avec l'aide du micro crochet de dissection et une pince.
- Utilisez un porte-aiguille lisse sans serrure pour maintenir la partie du cathéter intérieur de la cuve étanche avant de retirer la pince bulldog. Avancer le cathéter avec une paire de pinces lors du desserrage porte-aiguille lentement jusqu'à ce que la totalité du segment de PU 2F cathéter est dans le vaisseau. Attachez la ligature caudale lâche autour du cathéter et du navire pour garantir, mais pas si tight à occlure, le cathéter.
8. Utilisation d'un hémostatique droite, Tunnel à 5 cm Tube de retour sous-cutanée derrière l'oreille et à travers l'incision entre les omoplates. Extérioriser les cathéters à travers le tube et retirer le tube.
9. Fermez l'incision ventrale avec trois acier inoxydable Clips blessure, et l'incision dorsale avec 4-0 sutures en soie pour sécuriser les cathéters extériorisés en place.
10. Moniteur post-chirurgicale et soins
- Après cathétérisme, mettre fin à l'anesthésie et de récupérer le rat en décubitus latéral dans une cage avec une literie de cellulose. Respecter les rats à des intervalles de 2 h pendant au moins 4 heures ou jusqu'à ce que ne montrant aucun signe de douleur, puis une fois par jour. Donnez kétoprofène [5 mg / kg, injection sous-cutanée (SQ)] poster immédiatement la procédure et toutes les 12 heures si le rat montre des signes de douleur ou de détresse. Dans notre expérience, pas de rats ont exigé une analgésie supplémentaire pour la douleur suite à l 'initiativel injection. Caractéristiques observées qui susciter contrepartie de doses supplémentaires de l'analgésie comprennent, mais sans s'y limiter; une posture anormale; augmentation / diminution de la fréquence respiratoire, unthrifty / non damées, infection / inflammation du site d'incision, écoulement oculaire, horripilation ("pelage pointes"), la réduction de l'activité en réponse à des stimuli auditifs ou tactiles.
NOTE: Les rats récupérés pendant 72 heures qui gagnent> 10 g de poids pré-cathétérisme seront recrutés dans l'étude.
11. Raccordement au système hémodynamique
- Après la reprise, se inscrire rats sains (gain de poids> 10g) dans l'étude. Passer rats chambre Lucite et anesthésier comme décrit précédemment.
- Placez champ stérile sur la table chirurgicale avec hémostatique stérile, pince micro, 1 ml seringues à aiguille émoussée attachés.
NOTE: Les conseils de la pince hémostatique devraient être recouverts de caoutchouc pour éviter d'endommager le cathéter. Passer sur un rat anesthésié chirurgicaletable à la position ventrale et le lieu nez dans le cône de nez pour maintenir l'anesthésie (3-5%) avec la respiration spontanée. - Clamp cathéters artériels et veineux en utilisant une paire de pinces hémostatiques caoutchouc plafonné juste en dessous les broches de métal. Utiliser une paire de pinces pour retirer la broche métallique à l'extrémité du cathéter et fixer une seringue de 1 ml rempli de solution saline à l'héparine avec une aiguille émoussée joint. À son tour, retirer les pinces hémostatiques et de retirer 0,1 ml pour assurer les cathéters sont patentes.
- Re-serrer les cathéters, retirer l'aiguille et fixez cette fin à un cathéter plus (pré-rincée avec de l'héparine solution saline) qui est relié à un pivot et attaché sur le dessus de la cage de boîte à chaussures. Connectez ces cathéters aux transducteurs d'acquisition de données et l'enregistrement, l'échantillonnage, ou perfusion.
REMARQUE: Tous les cathéters sont protégées par des conduits de ressort hélicoïdal assez longtemps pour permettre gamme complète de mouvement d'un animal dans leur cage. - Après connexion du cathéter, anesthésie et finrécupérer les animaux en position sternale dans une cage avec une literie de cellulose. Pour maintenir la perméabilité artérielle du cathéter, rincer manuellement les lignes avec 0,05 ml d'héparine solution saline (50 UI / ml) toutes les 1 h pour 24 h, ce qui coïncide avec les évaluations régulières des animaux.
12. Prélèvement de sang, surveillance de la pression et de l'administration des médicaments
- Fixez la seringue vide robinet relié à cathéter artériel et de retirer 0,6 ml ras ligne. Fixez échantillon seringue, prélever des échantillons, et retourner le 0,6 ml ras ligne suivie par 0,7 ml héparine chasse d'une solution saline.
- Utiliser les données matérielles et logicielles acquisition pour mesurer et enregistrer le PAM et le rythme cardiaque en continu.
- Connectez le système de délivrance de médicaments automatisé (ADDS) au cathéter veineux.
REMARQUE: ADDS ajuste le débit de perfusion de vasopresseur (dose élevée, faible, ou 0) basée sur la carte détectée à des pressions maintenues dans la fourchette physiologique normale.
Résultats
Les variations de la pression vasculaire sont transmis à travers les cathéters remplis de fluide (figure 1) et converties en signaux électriques représentées par les formes d'onde hémodynamiques (figures 2, 3). Sans accès vasculaire, ces mesures ne ont pas pu être faites. Le streaming en temps réel des formes d'onde permet la détection et l'analyse des changements sur un battement de battre base (figure 2). Comprimer l'échelle de temps des formes d'onde permet de quantifier les changements qui se produisent sur une plus longue durée (minutes à quelques jours) (Figure 3, supérieures quatre formes d'onde) qui peuvent être corrélées aux variations des taux de perfusion vasopresseur (Figure 3, inférieurs quatre formes d'onde).
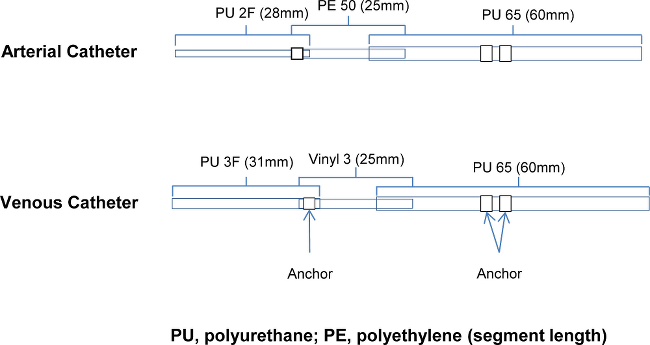
Figure 1. cathéter Design: Détails des composants des cathéters artériels et veineux PU, de polyuréthane;. PE, le polyéthylène (longueur de segment) Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
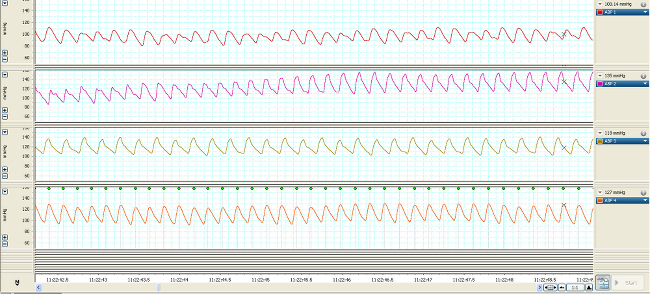
Figure 2. temps réel CARTE formes d'onde de 4 rongeurs typiques sept jours post-cathétérisme plus de 7 secondes. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
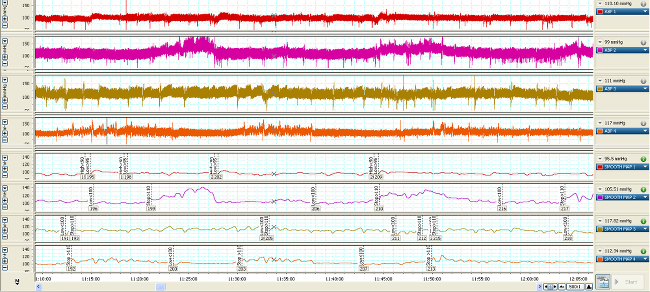
Figure 3. Temps-comprimé CARTE formes d'onde de 4 rongeurs typiques (supérieures quatre formes d'onde) sept jours post-cathétérisme plus de 1 h. Lorsque la carte est en moyenne plus faibles (4 formes d'onde), cette valeur est utilisée pour déclencher ADDS élevée (<90 mmHg) , faible (<100 mmHg) ou arrêter (> 110) Réponse de débit de la pompe de perfusion. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Enquête approches thérapeutiques à un modèle clinique de la maladie nécessite de la capacité d'exécuter avec précision surveillance hémodynamique, nécessitant ainsi l'accès vasculaire. Dans notre modèle de septicémie, le cathétérisme artériel assure la surveillance systémique de pression et cathétérisme veineux permet l'application de la thérapie clinique standard. La thérapie standard pour le sepsis comprend la perfusion d'antibiotiques pour traiter une infection bactérienne et la perfusion de liquides et de vasopresseurs pour maintenir la pression artérielle dans la plage souhaitée. Les cathéters sont utilisés pour le prélèvement sanguin. Dans cette conception, l'application de la perfusion programmable pompes à déclenchement automatique de la vitesse de perfusion de vasopresseur sur la base en temps réel artérielle moyenne est une avance sur le milieu clinique qui exige titrage manuel par le personnel médical et dans le cadre pré-clinique rend le l'utilisation de cette modalité de traitement possible d'étudier un grand nombre d'animaux.
. e_content "> Certaines complications ont été observées tôt dans le développement du modèle Ces inclus occlusion partielle des deux cathéters artériels et veineux de plus de resserrement des liens, sur PU2 et PU3 composants, (1-2%); mauvais placement d'un cathéter jugulaire dans un petite branche, (<1%), la mort subite inexpliquée après récupération (pas thrombus pulmonaire ou d'autres dommages d'organes évidente), (1-2%) résolu en gardant la concentration de 2 à 3,5% isoflurane avec un taux de 2 L / min de débit 2 O . D'autres complications chirurgicales courantes d'hémorragie, infection locale et des lésions auto-infligées ne ont pas été respectées. Une fois la compétence chirurgicale est atteint, chaque procédure devrait pouvoir être achevée en pas plus de 15 min. Le taux de réussite mesurée comme une reprise saine et cathéters de brevets, peuvent se attendre à dépasser 90% une fois entièrement formé. Un animal supplémentaire est inclus dans chaque étude afin de minimiser la perte de données et le nombre total d'animaux nécessaires et représentent un cathéter qui peut être échoué »dansfusion seulement »ou la mortalité due à des complications.L'étape la plus critique de ce procédé est la conception et la mise en place des cathéters. Les matériaux doivent être doux à la pointe afin de ne pas percer la paroi du vaisseau sans sertissage trop facilement. Le corps du cathéter doit être plus rigide (à la pointe) pour pouvoir avancer dans le récipient suffisamment et être fixé en place. La figure 1 montre les trois diamètres de tubes qui sont connectés pour le cathéter artériel et deux tubes de diamètre différent connecté pour les cathéters veineux. Ces composants sont glissés à l'intérieur de l'autre pour réduire le diamètre du cathéter à l'extrémité et sont collées ensemble avec des ancrages supplémentaires pour assurer le placement du cathéter dans le vaisseau ou le coeur est maintenue.
Une fois récupéré et relié à l'émerillon et attache, la carte et CVP formes d'onde doivent être similaires aux données représentées sur la figure 2. Pour maintenir artérielle patenc de cathétery lors de la surveillance, un rinçage héparine saline horaire (0,05 ml) doit être effectuée. Perfusion continue maintient la perméabilité d'un cathéter veineux. Lors de la connexion de la ligne et chasse d'eau, une attention particulière doit être accordée à assurer qu'il n'y ait pas de bulles d'air dans la ligne. Une bulle d'air de ≥0.1ml peut conduire à une embolie dans les poumons, le cerveau ou d'autres organes. Les formes d'onde hémodynamiques sont enregistrées et analysées au cours de l'étude. Lors de la compression du temps dans l'axe x, figure 3 montre les changements dans le PAM et le CVP au cours de 1 h ainsi que les changements dans le taux et l'effet de la perfusion de vasopresseur.
La procédure comporte plusieurs limites potentiels. Dans nos études, les cathéters restent brevet pour un maximum de 11 jours. On ne sait pas combien de temps les cathéters resteraient brevet au-delà de cette période. Pour monter les cathéters comme décrit, il ya une taille minimale vasculaire, qui correspond à peu près avec le poids des rongeurs, obligeant les animaux inscrits dans cette étude soit supérieur à200 g. L'utilisation d'un plus petit diamètre du cathéter se traduirait par l'augmentation des résistances à l'écoulement en réduisant la perméabilité. Atteindre les mesures de la pression veineuse centrale nécessite un placement précis du cathéter dans l'atrium suffisante pour tenir compte de la taille et de la croissance au cours de la période d'étude et peut être un défi.
Une fois maîtrisé, cathétérisme artériel et vasculaires peuvent servir de base à une grande variété de modèles de rongeurs nécessitant une surveillance hémodynamique, le prélèvement de sang, et l'infusion de fluides ou de thérapies tout en minimisant la douleur et la détresse durant l'instrumentation ou de la manipulation, une fois récupéré. En fait, en conjonction avec un précédente publication de cathétérisme décrivant JOVE 10 de la veine fémorale, on a effectué avec succès avec ce modèle trois cathéters implantés.
Déclarations de divulgation
The authors have no potential conflicts of interest.
Remerciements
Intramural NIH program supported the development of this model. Publication support was provided by Harvard Apparatus Inc. and ADInstruments Inc. The work by the authors was done as part of US government–funded research; however, the opinions expressed are not necessarily those of the National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Straight micro dissecting forceps | Roboz | RS-8102 | surgical instrument |
| Delicate straight hemostatic forceps | Roboz | RS-7114 | surgical instrument |
| Delicate curved hemostatic forceps | Miltex | 7-4 | surgical instrument |
| Serrefine curved, very delicate micro clamp | Roboz | RS-5471 | surgical instrument |
| Micro dissecting hook | Miltex | 19-220 | surgical instrument |
| Angled on edge micro dissecting spring scissor | Roboz | RS-5618 | surgical instrument |
| Light operating scissor | Roboz | RS-6750 | surgical instrument |
| Scalpel handle and blade (#10) | Cincinnati Surgical | RS-9843 | surgical instrument |
| Pack of 4-0 silk suture with curved needle | Ethicon | FS-2 | surgical instrument |
| Straight micro suturing needle holder | Roboz | RS-6410 | surgical instrument |
| Wound clip | Stoelting | 59027 | surgical instrument |
| Sterile gauze 2"x2" | Dynarex | 3362 | consumable |
| Gauze 4"x4" | Covidien | 2556 | consumable |
| Anesthesia vaporizer | Surgivet | V703001 | equipment |
| Lucite box | Custom | equipment | |
| Isoflurane | Baxter | equipment | |
| Downdraft Table | Airscience | equipment | |
| Table top surgical platform | Custom | equipment | |
| Arterial Catheter | Custom - Scientific Commodities Inc. | consumable | |
| Venous Catheter | Custom - Scientific Commodities Inc. | consumable | |
| Data acquisition system | ADInstruments | Powerlab 16/30 | equipment |
| Data analysis software | ADInstruments | LabChart v7.3 | equipment |
| Programmable infusion pumps | Harvard Apparatus | PHD Ultra | equipment |
Références
- Buckingham, R. E. Indwelling catheters for direct recording of arterial blood pressure and intravenous injection of drugs in the conscious rat. J Pharm. Pharmacol. 28 (5), 459-461 (1976).
- Buckle, J. W., Nathaniels, P. W. Proceedings: A dual catheter system for the simultaneous infusion and sampling of the vascular system of the unrestrained rat. J. Physiol. 242 (2), 55P-56P (1974).
- Solomon, S. B., et al. Effective dosing of lipid A analogue E5564 in rats depends on the timing of treatment and the route of Escherichia coli infection. J. Infect. Dis. 193 (5), 634-644 (2006).
- Cui, X., et al. Bacillus anthracis cell wall produces injurious inflammation but paradoxically decreases the lethality of anthrax lethal toxin in a rat model. Intensive Care Med. 36 (1), 148-156 (2010).
- Quezado, Z. M., Natanson, C. Systemic hemodynamic abnormalities and vasopressor therapy in sepsis and septic shock. Am. J. Kidney Dis. 20 (3), 214-222 (1992).
- Perdue, P. W., Kazarian, K. K., Nevola, J., Law, W. R., Williams, T. The use of local and systemic antibiotics in rat fecal peritonitis. J. Surg. Res. 57 (3), 360-365 (1994).
- Qiu, P., et al. The individual survival benefits of tumor necrosis factor soluble receptor and fluid administration are not additive in a rat sepsis model. Intensive Care Med. 37 (10), 1688-1695 (2011).
- Cui, X., et al. Severity of sepsis alters the effects of superoxide anion inhibition in a rat sepsis model. J. Appl. Physiol. 97 (4), 1349-1357 (2004).
- Karzai, W., et al. Protection with antibody to tumor necrosis factor differs with similarly lethal Escherichia coli versus Staphylococcus aureus pneumonia in rats. Anesthesiology. 99 (1), 81-89 (2003).
- Jespersen, B., Knupp, L., Northcott, C. A. Femoral Arterial and Venous Catheterization for Blood Sampling, Drug Administration and Conscious Blood Pressure and Heart Rate Measurements. J. Vis. Exp. (59), e3496 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon