Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Quantitative Imagerie par résonance magnétique de la maladie du muscle squelettique
Dans cet article
Résumé
Les maladies neuromusculaires présentent souvent un variant temporellement, pathologie spatialement hétérogène et multi-facettes. L'objectif de ce protocole est de caractériser cette pathologie en utilisant des méthodes d'imagerie par résonance magnétique non-invasives.
Résumé
Quantitative magnetic resonance imaging (qMRI) describes the development and use of MRI to quantify physical, chemical, and/or biological properties of living systems. Neuromuscular diseases often exhibit a temporally varying, spatially heterogeneous, and multi-faceted pathology. The goal of this protocol is to characterize this pathology using qMRI methods. The MRI acquisition protocol begins with localizer images (used to locate the position of the body and tissue of interest within the MRI system), quality control measurements of relevant magnetic field distributions, and structural imaging for general anatomical characterization. The qMRI portion of the protocol includes measurements of the longitudinal and transverse relaxation time constants (T1 and T2, respectively). Also acquired are diffusion-tensor MRI data, in which water diffusivity is measured and used to infer pathological processes such as edema. Quantitative magnetization transfer imaging is used to characterize the relative tissue content of macromolecular and free water protons. Lastly, fat-water MRI methods are used to characterize fibro-adipose tissue replacement of muscle. In addition to describing the data acquisition and analysis procedures, this paper also discusses the potential problems associated with these methods, the analysis and interpretation of the data, MRI safety, and strategies for artifact reduction and protocol optimization.
Introduction
imagerie par résonance magnétique quantitative (QMRI) décrit le développement et l'utilisation de l'IRM pour quantifier physiques, chimiques et / ou des propriétés biologiques des systèmes vivants. QMRI exige que l'on adopte un modèle biophysique pour le système constitué par le tissu d'intérêt et une séquence d'impulsions d'IRM. La séquence d'impulsions est conçu pour sensibiliser les intensités de signal des images au paramètre d'intérêt dans le modèle. Propriétés des signaux d'IRM (d'amplitude du signal, la fréquence et / ou phase) sont mesurés et analysés selon le modèle. L'objectif est de produire une estimation non biaisée, quantitative d'un paramètre physique ou biologique ayant distribué en continu, les unités de mesure physiques. Souvent, les équations décrivant le système sont analysés et ajustés sur une base pixel par pixel, en produisant une image dont les valeurs de pixel directement refléter les valeurs de la variable. Une telle image est appelée une carte paramétrique.
Une utilisation courante de QMRI est le développement et l'application de biomarqueurs. Les biomarqueurs peuvent être utilisés pour étudier un mécanisme de la maladie, d'établir un diagnostic, de déterminer un pronostic, et / ou d'évaluer une réponse thérapeutique. Ils peuvent prendre la forme des concentrations ou des activités de molécules endogènes ou exogènes, un spécimen histologique, une quantité physique, ou une image interne. Certaines exigences générales de biomarqueurs sont qu'ils mesurent objectivement une variable distribuée en continu en utilisant des unités de mesure physiques; avoir une relation bien compris claire avec la pathologie de l'intérêt; sont sensibles à l'amélioration de et l'aggravation de l'état clinique; et peut être mesurée avec exactitude et de précision adéquate. biomarqueurs non-invasives ou minimalement invasives sont particulièrement souhaitables, car ils favorisent le confort du patient et peu perturber la pathologie d'intérêt.
Un but de développer des biomarqueurs basés sur l'image pour la maladie du muscle est de refléter la maladie du muscle de façons qui sont complementary à, plus spécifique que, plus spatialement sélectif que, et / ou moins invasive que les approches existantes. Un avantage particulier de QMRI à cet égard est qu'il a le potentiel d'intégrer plusieurs types d'informations et donc de caractériser de nombreux aspects du processus de la maladie potentiellement. Cette capacité est très important dans les maladies musculaires, qui présentent souvent une pathologie complexe variable dans l'espace qui comprend l'inflammation, de la nécrose et / ou l'atrophie de remplacement de matière grasse, la fibrose, la perturbation du réseau de myofilaments ( "Z-disque en continu») et les dommages causés à membrane . Un autre avantage des méthodes QMRI est que des descriptions qualitatives ou semi-quantitatives des images IRM à base de contraste reflètent non seulement la pathologie, mais aussi des différences dans les paramètres d'acquisition d'image, du matériel, et de la perception humaine. Un exemple de cette dernière question a été démontrée par Wokke et al., Qui ont montré que les évaluations semi-quantitatives de l' infiltration de graisse sont très variables et souvent incorrectes, wpoule par rapport quantitative IRM graisse / eau (FWMRI) 1.
Le protocole décrit ici comprend des séquences d'impulsions pour la mesure de la direction longitudinale (T 1) et transversale (T 2) , des constantes de temps de relaxation, le transfert quantitatif de l' aimantation (MTQ) des paramètres, des coefficients de diffusion de l' eau à l' aide du tenseur de diffusion IRM (DT-IRM) et la structure musculaire en utilisant images structurelles et FWMRI. T 1 est mesurée à l'aide d' une séquence de récupération d'inversion, dans lequel le vecteur d'aimantation nette est inversée et son amplitude est prélevé en tant que le système retourne à l' équilibre. T 2 est mesurée par un recentrage à plusieurs reprises aimantation transversale en utilisant un train d'impulsions de recentrage, telles que la méthode Carr-Purcell Meiboom-Gill (CPMG), et l' échantillonnage des spin-échos résultant. T 1 et T 2 données peuvent être analysées en utilisant des méthodes d'ajustement de courbe non-linéaire qui soit supposent un certain nombre de Exponential composants a priori (typiquement entre une et trois) ou en utilisant une approche linéaire inverse qui correspond aux données observées à la somme d'un grand nombre d'exponentielles en décomposition, conduisant à un spectre d'amplitudes de signal. Cette approche exige un carré non négatif moins (NNLS) solution 3, et comprend généralement la régularisation supplémentaire pour produire des résultats stables. T 1 et T 2 mesures ont été largement utilisés pour étudier les maladies musculaires et des blessures 4-9. T 1 valeurs sont généralement diminué dans les régions du muscle gras infiltré et élevés dans les régions enflammées 4-6; T 2 valeurs sont élevées dans les deux régions de graisse infiltrée et enflammées 10.
QMT-IRM caractérise les piscines de protons libres eau et solide comme macromoléculaires dans les tissus en estimant le rapport de macromoléculaire à protons de l'eau libre (le rapport de la taille de la piscine, PSR); intrinsèque détendreles taux de ation de ces piscines; et les taux de change entre eux. Approches QMT communs incluent la saturation pulsée 11 et les méthodes de 12,13 de récupération d'inversion sélectives. Le protocole ci-dessous décrit l'utilisation de l'approche de la saturation pulsée, qui exploite la grande largeur spectrale du signal du proton macromoléculaire, par rapport à la largeur de raie étroite du signal du proton de l'eau. En saturant le signal macromoléculaire à des fréquences de résonance suffisamment différent du signal de l'eau, le signal de l'eau est réduite en raison du transfert de magnétisation entre les pools de protons d'eau libres et solides. Les données sont analysées en utilisant un modèle biophysique quantitatif. QMT a été développée et appliquée dans les muscles sains 14,15, et un résumé récent paru décrivant sa mise en œuvre dans les maladies du muscle 16. BMQ a été utilisé pour étudier des modèles de petits animaux d'inflammation musculaire, dans lequel il a été montré que l' inflammation diminue le PSR 17. Etant donné que MTreflète le contenu à la fois macromoléculaires et de l' eau, les données MT peuvent également refléter la fibrose 18,19.
DT-IRM est utilisé pour quantifier le comportement de diffusion anisotrope de molécules d'eau dans les tissus des ordonnées, des cellules allongées. Dans DT-MRI, la diffusion de l'eau est mesurée en six ou plusieurs directions différentes; Ces signaux sont ensuite montés sur un modèle de 20 tenseur. Tenseur de diffusion, D, est diagonalisée pour obtenir trois valeurs propres (qui sont les trois principaux diffusivités) et trois vecteurs propres (qui indiquent les directions correspondant aux trois coefficients de diffusion). Ceux - ci et d' autres indices quantitatifs dérivés de D fournissent des informations sur la structure et l' orientation du tissu à un niveau microscopique. Les propriétés de diffusion de muscles, en particulier la troisième valeur propre de D et le degré de diffusion anisotropie reflètent l' inflammation du muscle 17 et des lésions musculaires dues à une lésion expérimentale 21, la souche 22 blessures et la maladie 23,24. D' autres influences potentielles sur les propriétés de diffusion du muscle comprennent les changements de diamètre des cellules 25 et l' évolution de la perméabilité de la membrane.
Enfin, l'atrophie musculaire, sans matière grasse ou sans infiltration macroscopique, est une composante pathologique de nombreuses maladies musculaires. L'atrophie musculaire peut être évaluée en utilisant des images structurelles pour mesurer muscle surface en coupe transversale ou du volume et FW-IRM pour évaluer l'infiltration graisseuse. L' infiltration de graisse peut être décrite qualitativement T 1 - T 2 et des images pondérées en 26, mais les signaux de graisse et l' eau sont les mieux en mesure de former des images qui exploitent les différentes fréquences de résonance de protons de graisse et d' eau 27-29. Méthodes de graisse / d'imagerie de l' eau quantitatives ont été appliquées dans les maladies musculaires telles que la dystrophie musculaire 1,30,31, et peuvent prédire la perte de la marche chez ces patients 31.
Le protocole QMRI décrit ici utilise l'ensemble de ces mesures pour caractériser l'état des muscles dans les auto-immunes inflammatoires myopathies dermatomyosite (DM) et polymyosite (PM). D' autres détails du protocole, y compris sa reproductibilité, ont été publiées antérieurement 32. Le protocole comprend des séquences d'impulsions standards ainsi que des radiofréquences (RF) et des objets de gradient de champ magnétique programmés spécifiquement sur nos systèmes. Les auteurs prévoient que le protocole est également applicable dans d'autres troubles neuromusculaires caractérisés par une atrophie musculaire, l'inflammation et l'infiltration de graisse (par exemple la dystrophie musculaire).Protocole
NOTE: Il est rappelé que toutes les recherches impliquant des sujets humains doit être approuvée par le comité local d'examen institutionnel (IRB) pour l'utilisation de sujets humains dans la recherche. participants à la recherche doivent être informés de l'objet, les procédures, les risques et les avantages de la recherche proposée; la disponibilité des traitements ou des procédures alternatives; la disponibilité de la rémunération; et de leurs droits à la vie privée et de retirer leur consentement et cesser leur participation. Avant la séance d'essais IRM, un enquêteur doit présenter un participant potentiel à la recherche d'informer un document de consentement CISR approuvé (ICD), expliquer le contenu, et de demander au participant potentiel à la recherche s'il / elle souhaite participer à l'étude. Si oui, le participant devra signer et dater la CIM avant de remplir l'une des étapes du protocole ici.
1. Les actions Avant la journée d'essais
- Restreindre habitudes de vie qui pourraient confondre les Dà
- Demander au participant de ne pas effectuer un exercice modéré ou lourd pendant 48 h avant le test. Demander au participant de s'abstenir de over-the-counter médicaments et la consommation d'alcool au cours des 24 h avant le test. Demander au participant de s'abstenir de l'usage du tabac ou la consommation de caféine pendant la 6 h avant le test.
- Avant l'essai, confirmer que le participant a été conforme à ces instructions.
- Préparation du système IRM
- Assurer la disponibilité de tous les équipements nécessaires, comme indiqué dans le tableau des matériaux et équipements.
- Définir un protocole d'IRM; paramètres proposés se trouvent dans les tableaux 1 - 5.
2. journée d'essais: Préparer pour l'acquisition de données IRM
- Dépistage conduite Sécurité
- Écran pour les dangers potentiels dans l'environnement IRM en ayant une IRM sécurité tplu travailleur de la santé présente le participant à la recherche d'une forme de sécurité IRM appropriée, telle que celle trouvée à www.mrisafety.com.
- Si des objets magnétiques ou magnétiquement sensibles implantés, veiller à ce qu'ils sont sans danger pour l'IRM.
- Préparation du système IRM
- Veiller à ce que l'ensemble du personnel ont enlevé tous les objets magnétiques et magnétiquement sensibles avant d'entrer dans la pièce où se trouve le système d'IRM. Effectuer cette vérification à chaque fois que quelqu'un entre dans la salle d'IRM.
- Préparer le système d'IRM en plaçant la bobine de réception sur le lit du patient du système IRM. Aussi, placer un matelas avec drap et oreiller avec taie sur le lit. Avoir des sangles disponibles à placer autour des cuisses et des traversins ou oreillers à placer sous les genoux.
- Démarrez l'interface du logiciel, entrez les données du patient, et d'ouvrir le protocole d'imagerie.
- Positionner la recherche Participant sur le scanner IRM Table
- Observer le participant à la recherche comme il / elle vérifie son / sa personne et des vêtements pour les objets sensibles aux champs magnétiques. Fixez ces objets en dehors de la salle d'IRM dans un récipient verrouillable. Entrez dans la salle IRM avec le participant à la recherche immédiatement après avoir terminé cette étape.
- Positionner le participant sur le lit du patient en position couchée, les pieds-premières. Placer la partie du corps à imager au plus près de la ligne médiane de la table comme pratique. La place traversins ou oreillers sous les genoux pour fournir la décharge de traction pour le bas du dos et placer un oreiller sous la tête. Pour limiter le mouvement, doucement mais assurer efficacement la cuisse, la jambe et les pieds et veiller à ce que le participant est confortable.
- Placez la bobine réceptrice RF autour des cuisses du participant et de le connecter au système d'IRM.
- Instruire le participant et complets dernières étapes de pré-test
- Donner des instructions sur la façon de communiquer avec les enquêteurs. Fournir le participant avec protection et un dispositif de signalisation qui peut être utilisé pour appeler l'attention si nécessaire auditive. Demander au participant de la nécessité de rester immobile pendant et entre toutes les séquences d'imagerie.
- Faire avancer le lit de patient dans l'appareil d'IRM de telle sorte que la partie du corps à imager est aligné sur le centre du scanner IRM.
- Après avoir quitté la salle d'IRM, vérifiez que le système de communication du patient fonctionne et voir que le participant est confortable. Tout au long du protocole, de communiquer régulièrement avec le participant pour assurer sa / son confort et le respect des consignes.
3. journée d'essais: Acquérir les données IRM
- étapes préparatoires
- Comme le système d' IRM détermine les paramètres instrumentaux et étalonnages avant chaque séquence d'imagerie (fréquence centrale, le calibrage de gain récepteur, etc.), superviser ces processus et veiller à ce que chaque étape est effectuée correctly.
- L'utilisation d'une interface logicielle appropriée, acquérir un ensemble d'images de radiophare (également connu en tant que pilote ou images scouts); en utilisant les paramètres proposés présentés dans le tableau 2.
- Déterminer où placer le centre tranche pour données QMRI acquisitions, en identifiant les zones de dommages et / ou en faisant référence à la position de tranche par rapport à des repères anatomiques reproductibles.
- Transmission et réception de bobines d' étalonnage Étapes
- Pour ces étapes, ainsi que toutes les étapes d'imagerie ultérieures, définir la région de l' anatomie dans lequel afin d' optimiser l'homogénéité du champ magnétique statique (B 0), un processus connu sous le nom «calant». Voir la figure 1A pour le positionnement typique du volume de calage d'intérêt (VOI) utilisé dans les présentes études.
- Si le scanner IRM a une bobine de transmission multi-éléments, d'acquérir un ensemble de données d'étalonnage RF.
- Si le scanner IRM a un multi-élément bobine de réception, acquérirune carte de sensibilité spatiale des bobines.
- Acquérir structurale IRM de données
- Acquérir une haute résolution, multi-coupes, T 1 images pondérées en utilisant un fast spin-écho (FSE) séquence; les paramètres d'imagerie utilisées dans les présentes études sont présentés dans le tableau 1.
- Acquérir une haute résolution, multi-coupes, T 2 images pondérées en utilisant une séquence de FSE; les paramètres d'imagerie utilisées dans les présentes études sont présentés dans le tableau 2.
- Acquérir des données pour le contrôle de la qualité en temps réel et faire des corrections de post-traitement
- Acquérir des données en trois dimensions (3D) de multiples gradient d' écho pour le calcul des cartes B 0 sur le terrain. Les paramètres d'imagerie utilisées dans les présentes études sont présentés dans le tableau 3.
- Examinez les cartes sur le terrain pour assurer qu'il n'y a aucun écart de plus de ± 60 Hz (environ 0,5parties par million à 3 Tesla) à travers l'image. S'il y a, d' adopter une approche alternative à calant (méthode différente, le placement différent de VOI, etc.).
- Acquérir des données 3D pour le calcul des cartes d'angle nutation. Les paramètres d'imagerie utilisées dans les présentes études sont présentés dans le tableau 2.
- Examinez les cartes sur le terrain pour assurer qu'il n'y a pas de zones qui dévient trop sous l'angle de nutation nominal. Pour les impulsions RF qui sont utilisés dans ce protocole, les écarts supérieurs à ± 30% de l'angle de nutation nominal sont considérés comme excessifs.
- Acquérir les données QMRI
- Acquérir des images 3D pour le calcul du T 1, en utilisant une séquence de récupération d'inversion. Les paramètres d'imagerie utilisées dans les présentes études sont présentés dans le tableau 3.
- Répéter la mesure T 1 en présence de la suppression du signal de la graisse (FS; ce paramètre est ABRÉVIAted T 1, FS).
- Acquérir des images à une seule tranche pour le calcul du T 2, en utilisant une séquence d'écho de spin multiple. Utilisez les paramètres d'imagerie présentés dans le Tableau 3.
- Répéter la mesure T 2 en présence de FS (T 2, FS).
- Acquérir des images 3D pour le calcul des paramètres MTQ, en utilisant une séquence d'impulsions de saturation avec les FS et les paramètres d'imagerie donnés dans le tableau 4.
- Acquérir des données multi-coupes pour le calcul des paramètres de diffusion-tenseur, en utilisant une série d'images pondérées en diffusion. Les paramètres d'imagerie utilisées dans ces études sont donnés dans le tableau 4.
- Acquérir des données 3D pour le calcul des images de graisse / eau, en utilisant une série de six images en écho de gradient. Les paramètres d'imagerie utilisées dans ces études sont donnés dans le tableau 5.
- Après achèvement du Protocole QMRI
- Veiller à ce quetoutes les images sont d'une qualité appropriée en les examinant des artefacts potentiellement corrigibles et en mesurant le rapport suffisant signal sur bruit.
- Pour chaque jeu de données QMRI, définir plusieurs régions d'intérêt (ROI) dans la série d'images et d' examiner le signal en fonction du paramètre concerné (par exemple, pour les T 1 données -dépendantes acquises dans les étapes 3.5.1 et 3.5.2, tracer le signal en fonction de TI et de veiller à ce que les données suivent la fonction inversion-récupération énumérés ci-dessous à l'étape 4.1.2).
- Après avoir terminé une projection personnelle pour les objets sensibles aux champs magnétiques, entrer dans la salle d'IRM. Retirez le participant de l'aimant, enlever toutes les bretelles et le rembourrage, et aider le participant à la sortie du scanner IRM et la salle d'IRM.
- Transférer les données, en utilisant des méthodes conformes aux lois sur la protection des renseignements personnels de santé locaux, à un poste de travail local pour le traitement; les données peuvent être exportées sous forme d'imagerie numérique de communication en médecine (DICOM) fichiers ou dans le fournisseurformat propriétaire "(la méthode utilisée dans ce protocole).
4. Analyser les données QMRI
- Calculer les Cartes paramétriques
- Utilisez un programme informatique conçu pour le calcul scientifique et l'analyse d'image. En examinant un histogramme des intensités de signal dans l'image, former un signal à seuil masque d'image qui délimite les zones de signal provenant de zones de bruit. Suivez les étapes ci-dessous pour chaque pixel dans les portions de signal des images.
- Analyser le T 1 données en mesurant l' intensité du signal S pour chaque temps d'inversion (TI). Ensuite, ajuster les valeurs de S à une inversion de récupération à une réduction de modèle de pré-retard:
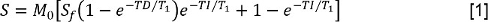
dans laquelle M 0 est l'intensité de signal représentant l'aimantation à l'état d'équilibre, S f est le rapport d'inversion,et TD est le temps de pré-delay. Ensuite, ajuster les données avec FS sur le même modèle, ce qui permet de déterminer le temps de relaxation longitudinale constante avec FS, T 1, FS. - Analyser le T 2 données en mesurant S à chaque TE. Ensuite, ajuster les données à un modèle de décroissance mono-exponentielle:

où N est le signal de décalage au niveau de référence. Le lecteur peut également décider d'ajuster les données à un modèle multi-exponentielle, comme celle ci-dessous:
où J est le nombre de composantes exponentielles et f et T 2, j sont la fraction de signal et T 2 valeurs associées à la j - ième composante. Ou, le lecteur peut utiliser une méthode 3 non-négatifs moindres carrés (NNLS). Dans le lcas de Atter, Multi-exponentielle Relaxation Analyse (MERA) boîte à outils 33 est disponible gratuitement; d'autres programmes sont également disponibles. Répétez ces analyses pour les données avec et sans FS. - Pour analyser les données QMT, mesurer S pour chaque puissance d'irradiation et de la fréquence de décalage. Corrigez les puissances d'irradiation nominales (représentés par ω 1 dans l'équation ci - dessous) en utilisant les cartes d'angle de nutation. Corriger les décalages de fréquence (Δ f dans l'équation ci - dessous) en utilisant le B 0 cartes pour régler les fréquences de décalage appliquées. Ensuite, ajuster les données au modèle 34,35 suivante
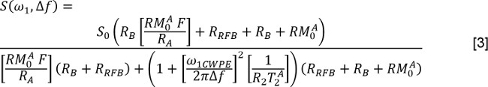
où est le taux de la piscine macromoléculaire à la piscine d'eau libre d'échange, est le taux de relaxation longitudinale de la piscine d'eau libre, est le taux de relaxation longitudinale de la piscine macromoléculaire (supposé être de 1 s -1), est le PSR, est T 2 de la piscine d'eau libre, et ω 1CWPE est la puissance moyenne de l'impulsion de saturation. Le taux de la magnétisation longitudinale de la piscine macromoléculaire de saturation, est décrite par un modèle de super-lorentzienne, comme décrit dans le travail par Henkelman et ses collègues 34,35. - Pour analyser les données DTI, utilisez d' abord un algorithme de transformation affine 36 pour enregistrer chaque image pondérée en diffusion à l'image pondérée non-diffusion correspondant. Ensuite, pour chaque pixel, mesurer les valeurs de S dans l'image pondérée non-diffusion et dans chaque direction de diffusion pondérée. Former une matrice composée des directions de codage de diffusion. Utilisation multivariée, pondérée régression des moindres carrés, la régression des données de signal sur la matrice de codage de diffusion et de la forme D. Diagonaliser D et effectuer une magnitude de tri des valeurs propres et leurs vecteurs propres. Calculez ensuite la diffusivité moyenne (MD) en tant que:

où λ 1, λ 2 et λ 3 sont les valeurs propres du tenseur de diffusion. calculer également l'anisotropie fractionnelle (FA) comme:
- Analyser les données FWMRI en utilisant une approche quantitative qui sépare les signaux d'eau et de matières grasses sur la base de déplacement chimique (tel que l'algorithme de FattyRiot, disponible en téléchargement gratuit à partir de https://github.com/welcheb/FattyRiot).
- Définir régions d'intérêt pour l' analyse
- Spécifiez ROIs sur les images anatomiques (en définissant les limites de chaque muscle d'intérêt). Un exemple est représenté sur la figure 1.
- Redimensionner les ROIs pour correspondre à la taille de la matrice des images QMRI. Si nécessaire, ajuster l'alignement des ROIs pour correspondre à la carte QMRI (par exemple, si le participant a déménagéentre les acquisitions, une traduction de la position de retour sur investissement peut être nécessaire pour éviter le chevauchement des limites musculaires).
- Examinez chaque ROI. Si nécessaire, veiller à ce qu'aucun des pixels sont inclus qui contiennent des artefacts partiels de volume, les tissus non contractile, et des artefacts de flux; s'il vous plaît voir la figure 1 pour des exemples.
- Calculer l'écart moyen et standard des valeurs QMRI dans tous les pixels dans les ROIs sélectionnés.
Résultats
La figure 1 montre des images anatomiques représentatives axiales acquises à la mi-cuisse d'un patient souffrant polymyosite. On voit également l'emplacement de la projection dans le plan du volume de la cale. Cartes de paramètres représentatifs pour chaque méthode QMRI, tous obtenus à partir de ce même patient, sont fournis à partir des figures 2 - 7.
Les figures 2A
Discussion
les maladies musculaires telles que les dystrophies musculaires et myopathies inflammatoires idiopathiques constituent des groupes de maladies qui sont hétérogènes dans l'étiologie et, en tant qu'entités individuelles, rares dans leur incidence. Par exemple, la myopathie de Duchenne - la forme la plus courante de dystrophie musculaire - a une incidence de 1 à 3500 naissances masculines vivantes 37,38; dermatomyosite, à laquelle ce protocole a été appliqué, a une incidence de 1 sur 100.000
Déclarations de divulgation
None of the authors has a financial conflict of interest to report.
Remerciements
We acknowledge grant support from the National Institutes of Health: NIH/NIAMS R01 AR050101 (BMD), NIH/NIAMS R01 AR057091 (BMD/JHP), NIH/NIBEB K25 EB013659 (RDD), and the Vanderbilt CTSA award RR024975. We also thank the reviewers for the comments and the subject for participating in these studies.
matériels
| Name | Company | Catalog Number | Comments |
| 3T human MRI system | Philips Medical Systems (Best, the Netherlands) | Achieva/Intera | |
| Cardiac phased array receive coil | Philips Medical Systems | ||
| Pillows, straps, bolsters, and other positioning devices | |||
| Computer with MATLAB software | The Mathworks, Inc (Natick, MA) | r. 2014 |
Références
- Wokke, B. H., et al. Comparison of Dixon and T1-weighted MR methods to assess the degree of fat infiltration in duchenne muscular dystrophy patients. J Magn Reson Imaging. 38 (3), 619-624 (2013).
- Carr, H., Purcell, E. Effects of diffusion on free precession in NMR experiments. Phys Rev. 94, 630-638 (1954).
- Whittall, K. P., MacKay, A. L. Quantitative interpretation of NMR relaxation data. Journal of Magnetic Resonance. 84 (1), 134-152 (1989).
- Park, J. H., et al. Dermatomyositis: correlative MR imaging and P-31 MR spectroscopy for quantitative characterization of inflammatory disease. Radiology. 177 (2), 473-479 (1990).
- Park, J. H., et al. Magnetic resonance imaging and p-31 magnetic resonance spectroscopy provide unique quantitative data useful in the longitudinal management of patients with dermatomyositis. Arthritis & Rheumatism. 37 (5), 736-746 (1994).
- Park, J. H., et al. Use of magnetic resonance imaging and p-31 magnetic resonance spectroscopy to detect and quantify muscle dysfunction in the amyopathic and myopathic variants of dermatomyositis. Arthritis & Rheumatism. 38 (1), 68-77 (1995).
- Huang, Y., et al. Quantitative MR relaxometry study of muscle composition and function in Duchenne muscular dystrophy. J Magn Reson Imaging. 4 (1), 59-64 (1994).
- Kim, H. K., et al. T2 mapping in Duchenne muscular dystrophy: distribution of disease activity and correlation with clinical assessments. Radiology. 255 (3), 899-908 (2010).
- Arpan, I., et al. T2 mapping provides multiple approaches for the characterization of muscle involvement in neuromuscular diseases: a cross-sectional study of lower leg muscles in 5-15-year-old boys with Duchenne muscular dystrophy. NMR in Biomedicine. 26 (3), 320-328 (2013).
- Fan, R. H., Does, M. D. Compartmental relaxation and diffusion tensor imaging measurements in vivo in λ-carrageenan-induced edema in rat skeletal muscle. NMR in Biomedicine. 21 (6), 566-573 (2008).
- Sled, J. G., Pike, G. B. Quantitative interpretation of magnetization transfer in spoiled gradient echo MRI sequences. J Magn Reson. 145 (1), 24-36 (2000).
- Gochberg, D. F., Gore, J. C. Quantitative magnetization transfer imaging via selective inversion recovery with short repetition times. Magn Reson Med. 57 (2), 437-441 (2007).
- Li, K., et al. Optimized inversion recovery sequences for quantitative T1 and magnetization transfer imaging. Magn Reson Med. 64 (2), 491-500 (2010).
- Louie, E. A., Gochberg, D. F., Does, M. D., Damon, B. M. Magnetization transfer and T2 measurements of isolated muscle: effect of pH. Magn Reson Med. 61 (3), 560-569 (2009).
- Sinclair, C. D. J., et al. Quantitative magnetization transfer in in vivo healthy human skeletal muscle at 3 T. Magn Reson Med. 64 (6), 1739-1748 (2010).
- Sinclair, C., et al. Multi-parameter quantitation of coincident fat and water skeletal muscle pathology. Proc 21st Ann Meeting ISMRM. , (2013).
- Bryant, N., et al. Multi-parametric MRI characterization of inflammation in murine skeletal muscle. NMR Biomed. 27 (6), 716-725 (2014).
- Aisen, A. M., Doi, K., Swanson, S. D. Detection of liver fibrosis with magnetic cross-relaxation. Magn Reson Med. 31 (5), 551-556 (1994).
- Kim, H., et al. Induced hepatic fibrosis in rats: hepatic steatosis, macromolecule content, perfusion parameters, and their correlations-preliminary MR imaging in rats. Radiology. 247 (3), 696-705 (2008).
- Basser, P. J., Mattiello, J., LeBihan, D. MR diffusion tensor spectroscopy and imaging. Biophys J. 66 (1), 259-267 (1994).
- Heemskerk, A., Strijkers, G., Drost, M., van Bochove, G., Nicolay, K. Skeletal muscle degeneration and regeneration following femoral artery ligation in the mouse: diffusion tensor imaging monitoring. Radiology. 243 (2), 413-421 (2007).
- Zaraiskaya, T., Kumbhare, D., Noseworthy, M. D. Diffusion tensor imaging in evaluation of human skeletal muscle injury. J Magn Reson Imaging. 24 (2), 402-408 (2006).
- Qi, J., Olsen, N. J., Price, R. R., Winston, J. A., Park, J. H. Diffusion-weighted imaging of inflammatory myopathies: polymyositis and dermatomyositis. J Magn Reson Imaging. 27 (1), 212-217 (2008).
- McMillan, A. B., Shi, D., Pratt, S. J., Lovering, R. M. Diffusion tensor MRI to assess damage in healthy and dystrophic skeletal muscle after lengthening contractions. J Biomed Biotech. , (2011).
- Scheel, M., et al. Fiber type characterization in skeletal muscle by diffusion tensor imaging. NMR Biomed. 26 (10), 1220-1224 (2013).
- Kaufman, L. D., Gruber, B. L., Gerstman, D. P., Kaell, A. T. Preliminary observations on the role of magnetic resonance imaging for polymyositis and dermatomyositis. Annalsrheumatic Dis. 46 (8), 569-572 (1987).
- Dixon, W. T. Simple proton spectroscopic imaging. Radiology. 153 (1), 189-194 (1984).
- Glover, G. H. Multipoint Dixon technique for water and fat proton and susceptibility imaging. J Magn Reson Imaging. 1 (5), 521-530 (1991).
- Berglund, J., Kullberg, J. Three-dimensional water/fat separation and T2* estimation based on whole-image optimization--application in breathhold liver imaging at 1.5 T. Magn Reson Med. 67 (6), 1684-1693 (2012).
- Gloor, M., et al. Quantification of fat infiltration in oculopharyngeal muscular dystrophy: Comparison of three MR imaging methods. J Magn Reson Imaging. 33 (1), 203-210 (2011).
- Fischmann, A., et al. Quantitative MRI and loss of free ambulation in Duchenne muscular dystrophy. J Neurol. 260 (4), 969-974 (2013).
- Li, K., et al. Multi-parametric MRI characterization of healthy human thigh muscles at 3.0 T - relaxation, magnetization transfer, fat/water, and diffusion tensor imaging. NMR Biomed. 27 (9), 1070-1084 (2014).
- Morrison, C., Stanisz, G., Henkelman, R. M. Modeling magnetization transfer for biological-like systems using a semi-solid pool with a super-Lorentzian lineshape and dipolar reservoir. J Magn Reson Series B. 108 (2), 103-113 (1995).
- Li, J. G., Graham, S. J., Henkelman, R. M. A flexible magnetization transfer line shape derived from tissue experimental data. Magn Reson Med. 37 (6), 866-871 (1997).
- Mangin, J. F., Poupon, C., Clark, C., Le Bihan, D., Bloch, I. Distortion correction and robust tensor estimation for MR diffusion imaging. Med Image Anal. 6 (3), 191-198 (2002).
- Moser, H. Duchenne muscular dystrophy: pathogenetic aspects and genetic prevention. Hum Genet. 66 (1), 17-40 (1984).
- van Essen, A. J., Busch, H. F., te Meerman, G. J., ten Kate, L. P. Birth and population prevalence of Duchenne muscular dystrophy in The Netherlands. Hum Genet. 88 (3), 258-266 (1992).
- Bendewald, M. J., Wetter, D. A., Li, X., Davis, M. P. Incidence of dermatomyositis and clinically amyopathic dermatomyositis: A population-based study in olmsted county, minnesota. Arch Dermatol. 146 (1), 26-30 (2010).
- Carlier, P. G. Global T2 versus water T2 in NMR imaging of fatty infiltrated muscles: different methodology, different information and different implications. Neuromuscul Disord. 24 (5), 390-392 (2014).
- Foley, J. M., Jayaraman, R. C., Prior, B. M., Pivarnik, J. M., Meyer, R. A. MR measurements of muscle damage and adaptation after eccentric exercise. J Appl Physiol. 87 (6), 2311-2318 (1999).
- Garrood, P., et al. MR imaging in Duchenne muscular dystrophy: quantification of T1-weighted signal, contrast uptake, and the effects of exercise. J Magn Reson Imaging. 30 (5), 1130-1138 (2009).
- Bratton, C. B., Hopkins, A. L., Weinberg, J. W. Nuclear magnetic resonance studies of living muscle. Science. 147, 738-739 (1965).
- Fleckenstein, J. L., Canby, R. C., Parkey, R. W., Peshock, R. M. Acute effects of exercise on MR imaging of skeletal muscle in normal volunteers. AJR Am J Roentgenol. 151 (2), 231-237 (1988).
- Williams, S., Heemskerk, A., Welch, E., Damon, B., Park, J. The quantitative effects of inclusion of fat on muscle diffusion tensor MRI measurements. J Magn Reson Imaging. 38 (5), 1292-1297 (2013).
- Hernando, D., et al. Removal of olefinic fat chemical shift artifact in diffusion MRI. Magn Reson Med. 65 (3), 692-701 (2011).
- Willcocks, R. J., et al. Longitudinal measurements of MRI-T2 in boys with Duchenne muscular dystrophy: effects of age and disease progression. Neuromuscul Disord. 24 (5), 393-401 (2014).
- Poon, C. S., Henkelman, R. M. Practical T2 quantitation for clinical applications. J Magn Reson Imaging. 2 (5), 541-553 (1992).
- Does, M. D., Gore, J. C. Complications of nonlinear echo time spacing for measurement of T2. NMR Biomed. 13 (1), 1-7 (2000).
- Poon, C. S., Henkelman, R. M. 180° refocusing pulses which are insensitive to static and radiofrequency field inhomogeneity. J Magn Reson. 99 (1), 45-55 (1992).
- Hollingsworth, K. G., de Sousa, P. L., Straub, V., Carlier, P. G. Towards harmonization of protocols for MRI outcome measures in skeletal muscle studies: consensus recommendations from two TREAT-NMD NMR workshops, 2 May 2010, Stockholm, Sweden, 1-2 October 2009, Paris, France. Neuromuscul Disord. 22, S54-S67 (2010).
- Underhill, H. R., Rostomily, R. C., Mikheev, A. M., Yuan, C., Yarnykh, V. L. Fast bound pool fraction imaging of the in vivo rat brain: Association with myelin content and validation in the C6 glioma model. Neuroimage. 54 (3), 2052-2065 (2011).
- Smith, S. A., et al. Quantitative magnetization transfer characteristics of the human cervical spinal cord in vivo: application to adrenomyeloneuropathy. Magn Reson Med. 61 (1), 22-27 (2009).
- Li, K. D. R., Dortch, R. D., Gochberg, D. F., Smith, S. A., Damon, B. M., Park, J. H. Quantitative magnetization transfer with fat component in human muscles. Proc. 20th Ann Meeting ISMRM. , (2012).
- Damon, B. M. Effects of image noise in muscle diffusion tensor (DT)-MRI assessed using numerical simulations. Magn Reson Med. 60 (4), 934-944 (2008).
- Damon, B. M., Buck, A. K. W., Ding, Z. Diffusion-tensor MRI-based skeletal muscle fiber tracking. Imaging Med. 3 (6), 675-687 (2011).
- Froeling, M., Nederveen, A. J., Nicolay, K., Strijkers, G. J. DTI of human skeletal muscle: the effects of diffusion encoding parameters, signal-to-noise ratio and T2 on tensor indices and fiber tracts. NMR in Biomedicine. 26 (11), 1339-1352 (2013).
- Basser, P. J., Pajevic, S. Statistical artifacts in diffusion tensor MRI (DT-MRI) caused by background noise. Magn Reson Med. 44 (1), 41-50 (2000).
- Anderson, A. W. Theoretical analysis of the effects of noise on diffusion tensor imaging. Magn Reson Med. 46 (6), 1174-1188 (2001).
- Saupe, N., White, L. M., Stainsby, J., Tomlinson, G., Sussman, M. S. Diffusion tensor imaging and fiber tractography of skeletal muscle: optimization of B value for imaging at 1.5 T. AJR Am J Roentgenol. 192 (6), W282-W290 (2009).
- Levin, D. I., Gilles, B., Madler, B., Pai, D. K. Extracting skeletal muscle fiber fields from noisy diffusion tensor data. Med Image Anal. 15 (3), 340-353 (2011).
- Sinha, U., Sinha, S., Hodgson, J. A., Edgerton, R. V. Human soleus muscle architecture at different ankle joint angles from magnetic resonance diffusion tensor imaging. J Appl Physiol. 110 (3), 807-819 (2011).
- Jones, D. K., Cercignani, M. Twenty-five pitfalls in the analysis of diffusion MRI data. NMR Biomed. 23 (7), 803-820 (2010).
- Hamilton, G., et al. In vivo characterization of the liver fat 1H MR spectrum. NMR Biomed. 24 (7), 784-790 (2011).
- Hernando, D., Kellman, P., Haldar, J. P., Liang, Z. P. Robust water/fat separation in the presence of large field inhomogeneities using a graph cut algorithm. Magn Reson Med. 63 (1), 79-90 (2010).
- Hernando, D., Hines, C. D., Yu, H., Reeder, S. B. Addressing phase errors in fat-water imaging using a mixed magnitude/complex fitting method. Magn Reson Med. 67 (3), 638-644 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon