Method Article
Multi-exon Sauter Utilisation Oligonucleotides Cocktail antisens dans la dystrophie musculaire Canine liée à l'X
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le saut d'exon est actuellement une option thérapeutique la plus prometteuse pour la dystrophie musculaire de Duchenne (DMD). Pour étendre l'applicabilité des patients atteints de DMD et d'optimiser la stabilité / fonction des protéines de la dystrophine tronquée résultant, un multi-saut d'exon approche utilisant des oligonucléotides antisens cocktail a été développé et nous avons démontré systémique sauvetage de la dystrophine dans un modèle de chien.
Résumé
La dystrophie musculaire de Duchenne (DMD) est une des maladies les plus courantes létaux génétiques dans le monde entier, causées par des mutations dans le dystrophine (DMD) gène. Le saut d'exon emploie / molécules d'ARN-like ADN court appelés oligonucléotides antisens (AON) qui restaurent le cadre de lecture et produisent des protéines plus courtes mais fonctionnelles. Cependant, la thérapie de sauter exon se heurte à deux obstacles majeurs: applicabilité limitée (jusqu'à seulement 13% des patients peuvent être traités avec un seul médicament AON), et la fonction incertaine des protéines tronquées. Ces questions ont été abordées avec une approche cocktail AON. Alors qu'environ 70% des patients atteints de DMD peut être traitée par un simple saut d'exon (tous les exons combinés), on pourrait potentiellement traiter plus de 90% des patients atteints de DMD si exon multiples sauter à l'aide cocktail médicaments antisens peut être réalisée. a été utilisé La canine liée à l'X dystrophie musculaire (CXMD) modèle de chien, dont le phénotype est plus semblable aux patients DMD humains, pour tester l'effic systémiquealpha- et de sécurité multi-saut d' exon des exons 6 et 8. Le modèle de chien CXMD héberge une mutation du site d'épissage dans l' intron 6, conduisant à un manque de l' exon 7 dans l' ARNm de la dystrophine. Pour rétablir le cadre de lecture dans CXMD nécessite multi-exon skipping des exons 6 et 8; par conséquent, CXMD est un bon modèle animal de taille moyenne, pour tester l'efficacité et la sécurité des multi-saut d'exon. Dans l'étude actuelle, un cocktail de morpholinos antisens ciblant l'exon 6 et l'exon 8 a été conçu et restauré l'expression de la dystrophine dans les muscles squelettiques du corps entier. Méthodes de transfection / injection d'oligos de cocktail et de l'évaluation de l'efficacité et la sécurité des multi-saut d'exon dans le modèle de chien CXMD sont présentés.
Introduction
Dystrophie musculaire de Duchenne (DMD) est une maladie musculaire récessive liée à l' X caractérisée par une faiblesse musculaire progressive, d' abord décrit par le Dr Guillaume-Benjamin-Amand Duchenne (de Boulogne) 1. DMD est une maladie génétique fréquente qui touche environ 1 à 3.500 garçons à travers le monde, avec environ 20 000 enfants touchés nés chaque année 2,3. Le développement moteur est retardée et troubles de la marche sont vus dans la petite enfance 4, suivie par fauteuil roulant dépendance à peu près au début de l' adolescence. La mort survient généralement entre les âges de 20 et 30 en raison d' une insuffisance respiratoire ou cardiaque 5-8. Il n'y a actuellement aucun remède pour DMD. Le traitement par glucocorticoïdes peut ralentir la progression de la dégénérescence musculaire à un certain degré , mais est associé à des effets secondaires importants, y compris l' obésité et le diabète sucré 2,7,8. DMD résulte de mutations dans le dystrophine Duchenne (DMD) , le gène, ce qui conduit à une perte de dystrophine fonctionnelle protein. DMD est un très grand gène avec plus de 2 millions de paires de bases et 79 exons 9,10. Délétion, non-sens, et de duplication des mutations conduisant à des mutations hors-cadre sont la cause la plus commune du phénotype DMD. Les régions des exons 3 - 9 exons et 45 - 55 sont appelés "points chauds de mutation» , comme la plupart des patients présentent des mutations de deletion dans ces parties du gène, ce qui conduit à la dystrophine non fonctionnelle chez les patients souffrant de DMD 3,9,11-16. les fonctions de la dystrophine dans le complexe dystrophine-glycoprotéine (DGC), qui a un rôle important dans la stabilisation de la membrane musculaire. N- et C-terminales sont les domaines les plus importants pour la fonction, alors que le domaine de la tige centrale joue un rôle moins important 3,9,17. Le respect d'un phénotype doux associé à dystrophie musculaire de Becker (BMD), qui résulte principalement de mutations en cadre dans le gène DMD, inspiré de l'application de saut d' exon pour le traitement de la DMD. patients BMD ont un raccourci, mais functional, protéine dystrophine qui maintient deux extrémités 3,6,18. Le saut d' exon, en théorie, peut restaurer le cadre de lecture, ce qui entraîne la dystrophine protéines fonctionnelles raccourcies mais-similaires à ceux observés dans la DMO 3,19.
Plusieurs types d'oligonucléotides antisens (AON) ont été testés dans des essais cliniques, y compris phosphorothioates 2'O-méthylés (2'OMePS) et oligomères phosphorodiamidate morpholino (PMO). Exons Sauter 51 et 53 à l' aide de ces AON ont été examinés et alors que les résultats sont prometteurs, un seul saut d' exon a limité l' applicabilité, comme il est de 3, 19, 20,21, 22-26 mutation spécifique. Des questions subsistent également quant à la stabilité des protéines de dystrophine raccourcie résultant produites à partir de simple saut d' exon 22,23. En outre, certains patients ont besoin de plus d'un seul exon à être ignorées afin de rétablir le cadre de lecture 3. Bien que techniquement plus difficile, multi-saut d'exon est une méthode quipourrait remédier à ces problèmes 3,19. Multi-saut d' exon a déjà été démontrée chez le chien dystrophique et des lignées de cellules humaines in vitro. En outre, mdx52 dystrophie musculaire (CXMD) modèles de chien liées à l'X de la souris et canines ont été utilisées pour les études in vivo 22, 24-27. Canine dystrophie musculaire liée à l' X Japon (CXMD J) beagles ont été utilisés ici, comme le cadre de lecture de CXMD J peut être restauré par le multi-exon skipping des exons 6 et 8, ou exons supplémentaires (par exemple, les exons 3-9) (Figure 1). CXMD à base de Beagle partage le même type de mutation que le modèle Golden Retriever dystrophie musculaire (DRG), mais beagles sont plus petits et moins coûteux à entretenir en raison de la taille de leur corps, fournissant ainsi un modèle utile pour DMD 28,29. Chiens CXMD imitent plus étroitement le phénotype DMD humain que les modèles animaux plus petits, comme les rongeurs, et sont plus fiables pour les évaluations toxicologiques 3,22,30,31 (figure 2). chiens CXMD afficher la décomposition musculaire progressive, troubles de la marche, et les problèmes cardiaques et respiratoires semblables à ceux observés dans la DMD. Par rapport à un seul saut d'exon, multi-saut d'exon est applicable à une plus grande proportion de patients. Parmi les trois types de mutations les plus courantes (suppressions, non - sens, et duplications), 80-98% des patients pourraient être traités par le biais multi-saut d' exon 14,32,33, alors que 45% de tous les patients atteints de DMD pourrait bénéficier d'exons sauter spécifiquement 45 - 55 3,19,22,34.
Avec le développement des morpholinos modifiés, l'efficacité des cocktails AON à faciliter l'exon skipping est améliorée. Riche en arginine peptide conjugué PMO de pénétration cellulaire (PPMOs) et in vivo-morpholinos (vPMOs) sont chimies AON qui ont considérablement amélioré la capacité et la stabilité 3,35-38 pénétrant dans les cellules. Des préoccupations demeurent quant à la toxicité à long terme AON; Cependant, des progrès significatifsa été fait. Les modifications chimiques apportées à morpholinos diminuent grandement les effets hors-cible et des études pré-cliniques ont rapporté aucun effet toxique significatif 3,22,39,40. Un autre défi pour le multi-saut d' exon est l'exigence actuelle pour chaque single AON à tester la toxicité seul, comme un seul médicament, au lieu d'ensemble comme un cocktail 3,19,22,41,42. Dans les études DMD impliquant à la fois simple et multi-saut d'exon ciblé sur le cœur, il y a eu peu d'amélioration dans le tissu cardiaque dystrophique. L'efficacité de morpholinos dans le cœur est considéré comme faible en raison de la capacité de pénétration cellulaire pauvres. PPMOs peptidiques conjugués ont permis d' améliorer la capacité d'AON de pénétrer les cellules cardiaques, augmentant ainsi la quantité de protéine de dystrophine fonctionnelle secourue au coeur 3,19,38.
Ici, notre approche cocktail AON est longuement discuté, y compris la conception de séquences AON en utilisant le logiciel ESEfinder 43. Protocols pour des expériences de chien avec multi-saut d'exon sont également décrits. CXMD J beagles ont été utilisés pour les exons 6 et 8 expériences à sauter. Multi-saut d'exon dans le modèle de chien CXMD montre des résultats prometteurs, mais des défis demeurent qui doivent être surmontés avant qu'ils ne soient cliniquement applicables.
Protocole
Tous les protocoles énumérés ci-dessous sont en conformité avec les directives de protection des animaux énoncées par le Centre national de neurologie et de psychiatrie (NCNP) au Japon. Toutes les expériences ont été approuvées par le soin et l'utilisation des animaux Commission institutionnelle du NCNP.
1. Conception d'antisens oligos
- Utilisez ESE de sauvetage et des programmes ESEfinder pour détecter les sites ESE 44, 45-47.
- Conception 25 paires de bases (pb), des séquences qui sont antisens par rapport à exons qui doivent être ciblés. Exons cibles 6 et 8 dans le modèle de chien (figure 1).
- Utilisez 25 - 30 séquences de pb pour PMO (tableau 1) ou 25 pb pour 2'OMePS. Pour concevoir des séquences de 25 pb, sélectionner des séquences qui se trouvent dans la région cible. Envisager une structure secondaire, l' évitement des hétérodimères, exon épissage motifs activateurs, et la teneur en GC pour créer des séquences stables 43. AONs doit cibler au moins l'un des sites ESE identifiés par le SOF susmentionnétware.
- Sélectionnez AONs avec une teneur en GC qui est inférieure à 65%, avec moins de 4 G, et ne contiennent pas de séquences consécutives »auto-complémentaires. Utilisez le logiciel Blast NCBI pour prédire les sites de recuit hors-cible 22,48,49.
- Sélectionnez une épine dorsale de la chimie AON appropriée. Pour les expériences in vitro utilisant des oligonucléotides 2'O-méthyle (2'OMePS) ou morpholinos. Pour les expériences in vivo, utilisez 2'OMePS, morpholinos ou vPMOs. 3,19,48,50
2. Dans les expériences in vitro (exons 6 et 8 à sauter dans le modèle CXMD)
- 2'OMePS Transfection de myoblastes Dog
- La culture des myoblastes CXMD dans 3 ml de milieu de culture dans des plaques 6 puits. Graine : 1 - 5 x 10 3 cellules / cm 2 à 0,5 ml / cm2 de milieu pour myoblastes. Pour le milieu de croissance, en utilisant Eagle modifié du milieu de Dulbecco (DMEM) avec 10% de sérum bovin fœtal (FBS) et 1%pénicilline / streptomycine (P / S) 40.
- Incuber à 37 ° C jusqu'à 60-80% de confluence. Cela prend environ 12 à 24 heures.
- Diluer un agent de transfection des liposomes cationiques à un total de 100 ul dans un milieu de sérum réduit (rapport 2: 1: Agent transfectant AONs, par exemple, 10 pi de lipofectine contre 5 ug AON). Laisser reposer le mélange à température ambiante pendant 30 - 45 min.
- Diluer AON (ou 2'OMePS Morpholinos) jusqu'à un volume final de 100 ul dans un milieu de sérum réduit.
- Combinez l'agent transfectant dilué avec AONs dilué et incuber à température ambiante pendant 10 à 15 min.
- Alors que l'agent de transfection / mélange AON est assis à la température ambiante, enlever les vieux médias de cellules par aspiration et laver les cellules avec les médias.
- Ajouter 0,8 ml de milieu à l'agent de transfection / mélange AON, puis ajouter la solution complète aux cellules fraîchement lavées. Incuber pendant 3 heures à 37 ° C.
- Après incubation, remplacer le support avec differentiatmédias ion (DM); la différenciation peut prendre jusqu'à 10 jours. Vérifiez si la différenciation est produite à partir de la journée autour de 3. Les médias de différenciation est DMEM avec du sérum de cheval à 2%, 200 U / ml de pénicilline, 200 mg / ml de streptomycine et 10 pg / ml d'insuline.
- Morpholino Transfection de myoblastes Dog
- Culture CXMD myoblastes dans un milieu de croissance tel que décrit à l'étape 2.1.
- Passez au milieu de différenciation (DM), et ajouter 0,1 mM morpholino à chaque puits pour rendre la concentration finale 1 uM. morpholinos cocktail thermique à 65 ° C pendant 10 min avant la transfection ou par injection afin d'éviter l'agrégation AON. Ajouter un réactif de délivrance peptidique 39,51 et ajuster à une concentration finale de 3-6 uM.
- Après 16-48 heures d'incubation, prélever des cellules pour l'extraction de l'ARN. Ajouter 1 ml d'acide de thiocyanate de guanidinium-phénol-chloroforme aux cellules pour détacher les cellules de la plaque. Effectuer l'ARN extraction après cette étape.
- Vous pouvez également ajouter de la trypsine afin qu'il couvre toutes les cellules et incuber pendant 2 min à 37 ° C.
Remarque: Si l'intention de réaliser l'immunochimie, utiliser des lunettes de diapositives chambré pour la culture. Après différenciation, les cellules peuvent être fixées à l'aide de paraformaldehyde (PFA) (4% pendant 10 minutes).
- Vous pouvez également ajouter de la trypsine afin qu'il couvre toutes les cellules et incuber pendant 2 min à 37 ° C.
- Extraction de l' ARN polymerase de transcription inversée et la réaction en chaîne (RT-PCR)
- Une fois que les cellules sont différenciées en myotubes, éliminer le milieu et ajouter 1 ml d'acide guanidinium thiocyanate-phénol-chloroforme; laisser incuber pendant 10 min à température ambiante.
- Transfert à tubes de 1,5 ml. Combiner avec 200 ul de chloroforme et on incube à température ambiante pendant 2 min jusqu'à ce que trois couches distinctes peuvent être vues. Les trois couches de haut en bas sont les suivantes: une couche d'ARN, une couche d'ADN, et une couche de protéine.
- Centrifugeuse à 12000 × g pendant 15 min à 4 ° C. Enlever la partie supérieure de la couche surnageant et placer dans un tube avec 500 & #181; l isopropanol (si l'arrêt ici, stocker le surnageant à -80 ° C). Centrifuger le surnageant à 12 000 xg pendant 10 min à 4 ° C; après centrifugation, garder le culot d'ARN et éliminer le surnageant.
- Laver le culot avec de l'éthanol et centrifuger à 8000 xg pendant 5 min à 4 ° C. Evaporer l'éthanol résiduel en inversant le tube pendant 15 min, puis ajouter 15 - 30 pi d'eau sans RNase. Quantifier concentration de l'ARN total en utilisant la spectroscopie US / VIS à 260 nm.
- Combiner les réactifs nécessaires à une réaction de RT-PCR: 1,5 ul de 10 uM d'amorce avant, 1,5 ul de 10 uM d'amorce inverse, 1 ul de dNTP, 5 ul d'une étape tampon de kit de PCR, un inhibiteur de la RNase 0,7 ul, 1 ul de mélange enzymatique à partir de un étape kit PCR, et 200 ng d'ARN. Une fois que ceux-ci ont été mélangés, ajouter de l'eau à un volume final de 25 ul.
- Placer le mélange dans un thermo-cycleur. Exécuter un cycle de 30 min à 50 ° C, 15 min0; cycle à 95 ° C, puis 35 cycles de 94 ° C pendant 1 min, 60 ° C pendant 1 min et 72 ° C pendant 1 min. Enfin, lancer un cycle de 10 min à 72 ° C. Magasin de produit de PCR dans un réfrigérateur à 4 ° C ou -20 ° C
- ADN complémentaire (ADNc) Séquençage
- Identifier exon 6 - 9-bandes sautées en utilisant une électrophorèse sur gel d'agarose. Charge 5 ul de chaque échantillon dans les puits d'un gel d'agarose à 1,5%, course 135 V à travers le gel pendant 5 min, puis 120 V pendant 20 min. Ensuite, laisser incuber le gel dans un gel d'ADN tache à température ambiante pendant 30 min. Visualisez les bandes en utilisant un logiciel d'imagerie.
- Exciser la bande d'intérêt en utilisant un kit d'extraction de gel.
- Exciser le fragment d'ADN et solubiliser la tranche de gel en utilisant / 100 gel 200 pi de NTI mg. Laissez reposer pendant 5 à 10 min dans un bain-marie à 50 °. Puis transfert à la silice tube de membrane.
- Centrifugeuse à 11.000 xg pendant 30 sec. Laver deux fois avec 700 tampon NT3 ul avant CEntrifuging à nouveau à 11 000 xg pendant 30 sec.
- Sécher la membrane de silice par centrifugation à 11 000 x g pendant 1 min.
- Ajouter 15 - tampon NE 30 pi et laisser reposer à température ambiante pendant 1 min. Puis, centrifuger à 11 000 xg pendant 1 min. Retirer le gel de silice et de garder le contenu dans le tube.
- En utilisant un kit de séquençage pour déterminer la séquence selon le protocole du fabricant.
3. Injections intramusculaires ou Ouvrir Muscle Biopsie
- Pour le maintien de conditions stériles lors de la chirurgie de survie, enlever les poils en utilisant une tondeuse dans la zone entourant le site de la chirurgie (le membre postérieur). Utiliser la chlorhexidine ou iodophores comme désinfectant. Utiliser des champs stériles sur le site chirurgical en plaçant et en les fixant sur l'ensemble des animaux et la table d'opération.
- Porter des gommages propres, masques, couvre-chef, des gants stériles, et des chaussures spéciales pour la salle d'opération 52,53.
- Injecter chiens CXMD avec 20 mg / kg de thiopental sodique pour les anesthésier. Utilisez vétérinaire pommade sur les yeux pour éviter les yeux de se dessécher.
- Utilisez 2 - 3% d' isoflurane inhalation pour maintenir l' anesthésie générale (Figure 3). Vérifiez les réflexes musculaires et surveiller le rythme cardiaque et la respiration pour évaluer la profondeur de l'anesthésie. Le taux normal de la respiration (RR), la fréquence cardiaque (HR), et SpO 2 sous anesthésie générale sont les suivants: RR: 10 - 20 respirations / min; SpO 2: 95 - 100%, HR: 80 - 120 battements par minute (bpm).
- L'utilisation d'un scalpel, couper la peau sur le tibial cranial (CT), également connu sous le jambier antérieur (TA), et de faire une seule coupe environ 5 cm longitudinalement (pour les jeunes chiens adultes). Pour marquer les sites d'injection, le point le fascia profond à l'aide d'une aiguille chirurgicale et le fil chirurgical et faire deux marqueurs de points à intervalles de 2 cm.
- Injecter la concentration souhaitée AON dans le muscle avec une aiguille 27G. La concen souhaitéetration varie entre les conditions de traitement. Pour CT, donner deux injections de 1 ml de volume chacune, pour un total de 1,2 mg de PMO de cocktail (0,4 mg chaque PMO) ou 0,4 mg de vPMOs cocktail (0,13 mg chaque vPMO). Pour l'extenseur ulnaire du carpe (ECU) forelimb musculaire, injecter deux volumes de 0,5 ml chacune, pour un total de 1,2 mg de PMO de cocktail (0,4 mg chaque PMO) ou 0,4 mg de vPMOs cocktail (0,13 mg chaque vPMO). Laissez l'aiguille pendant 1 min. Utilisez une quantité égale de chaque AON pour le cocktail.
- Effectuer ouverte biopsie musculaire en retirant un morceau de tissu musculaire d'environ 2 cm de longueur du muscle CT à l'aide d'un scalpel chirurgical.
- Passez à l'étape 6.5 pour la préparation des échantillons de muscle.
- À l'aide d'une aiguille, d'administrer une injection intramusculaire de 0,02 mg / kg de chlorhydrate de buprénorphine avant le réveil de l'anesthésie générale. Lay fascia des muscles et de la peau en arrière sur le muscle et coudre ces utilisant un fil 3-0 de fil résorbable et 3-0 en nylon pour fascia du muscle et la fermeture de la peau, respectively.
- Tout en maintenant la bouche ouverte, déterminer si le réflexe nauséeux est de retour; lorsque le réflexe nauséeux est de retour, extuber le chien.
- Administrer 15 à 30 mg / kg céfazoline ou céphalexine (antibiotiques) pour jusqu'à 3 jours par injection intraveineuse ou intramusculaire pour prévenir l'infection.
- Retirer les sutures dans les sept jours. Ne pas laisser le chien sans surveillance jusqu'à ce qu'il ait repris connaissance suffisante pour maintenir décubitus sternale et ne permettent pas le chien à interagir avec d'autres animaux jusqu'à un rétablissement complet est effectué. Gardez les tubes endotrachéaux en place aussi longtemps que possible et de les retirer lorsque l'animal commence à mâcher ou avaler. Surveiller la fréquence cardiaque, la respiration, et l'hydratation de l'animal pour vous assurer qu'ils sont stables et dans les limites normales.
- Pour les soins post-opératoires, une analgésie pendant 3 jours (par exemple, buprénorphine 0,01 mg / kg) et le soutien des soins infirmiers, y compris un endroit calme, sombre repos, blessure appropriée et l' entretien de bandage, une doucesurface de repos, réhydratation avec des fluides par voie orale ou parentérale, et un retour à une alimentation normale grâce à l'utilisation d'aliments hautement agréables au goût ou des friandises. Si tous les animaux ont besoin des médicaments supplémentaires, une injection intramusculaire de 0,3 mg / kg de tartrate de butorphanol en fonction des symptômes de la douleur.
Remarque: Les chiens dans la douleur peuvent mordre, zéro, ou gardent des régions douloureuses, et si elles sont manipulées, peuvent être exceptionnellement inquiets ou agressifs. En outre, la douleur dans un membre se traduit généralement par boitant ou maintien du membre affecté aux tentatives de l'utiliser. Dans de telles situations, une injection intramusculaire de 0,02 mg / kg de chlorhydrate de buprénorphine tous les 6-8 h.
4. Injections systémiques
Remarque: Cette procédure peut être répétée hebdomadaire ou bihebdomadaire pour le nombre désiré de semaines.
- Retiens chiens manuellement et doucement en obtenant le chien à se coucher, puis draper les bras sur les épaules et les hanches pour tenir le chien en place tout au long de tprocédure il.
- Injecter AONs; 120 - PMO 240 mg / kg de cocktail (40 - 80 mg de chaque AON) à l'aide d'une aiguille de inhabitation veineuse dans une veine du membre (connu comme un céphalique ou une veine saphène). La quantité de AON injecté dépend de la condition expérimentale. Utilisez une quantité égale de chaque AON pour le cocktail.
- Utiliser une pompe à perfusion ou d'entraînement de seringue pour injecter 50 ml au total à un débit de 2,5 ml / min pendant 20 min, en suivant les instructions du fabricant. Répéter les injections hebdomadaires ou toutes les deux semaines (toutes les deux semaines) au moins 5 fois, comme expression de la dystrophine accumulera avec des injections répétées.
- Effectuer des tests sanguins hebdomadaires pour examiner la toxicité.
- En utilisant une aiguille, collecter 3 ml de sang - 0,5 ml pour la numération globulaire complète (CBC) et 2,5 ml pour les autres - de l'une des veines sous-cutanées de l'avant ou hindlimb. Inclure CBC, gamma-glutamyl transférase (GGT), aspartate aminotransférase (AST), l'urée sanguine (BUN), aminotra alaninensferase (ALT), la créatine kinase (CK), et les évaluations de la créatinine lors du test du sang collecté, en suivant les instructions du fabricant de kits de test sanguin 40,54.
5. Le classement clinique des chiens
- Mettre en place une caméra vidéo et le comportement du chien enregistrement et de la démarche. Enregistrez toute la rencontre avec le chien, car cela servira de référence lors de la notation du chien; cela signifie chaque vidéo sera une longueur différente en fonction des capacités et de la volonté du chien. Utilisez les paramètres d'enregistrement par défaut. Le tournage crée un enregistrement de la notation afin qu'il puisse être examiné à une date ultérieure.
- Etat de la marche et le mouvement des perturbations.
- Pour la marche et le mouvement des perturbations, utilisez les grades suivants:
grade 1 = none, grade 2 = assis avec des membres postérieurs étendu, grade 3 = lapin houblon avec les membres postérieurs, = marche aléatoire de grade 4, et 5 e année = incapable de marcher. - Pour la mobilité des perturbations, utilisez les grades suivants: qualité 1 = none, grade 2 = couché plus que la normale, grade 3 = ne peut pas sauter sur les membres postérieurs, grade 4 = augmentation de difficulté à se déplacer, et de grade 5 = incapable de se lever et de se déplacer.
- Pour la marche et le mouvement des perturbations, utilisez les grades suivants:
- Combien de temps il prend le chien de courir 15 m. Mesurer 15 m, placer le chien à la ligne de départ et l'encourager à courir jusqu'à ce que la marque des 15 m.
- Déterminer l'atrophie musculaire du membre en utilisant l'échelle de notation suivante:
grade 1 = aucun, 2 = dureté suspect de grade, de grade 3 = peut sentir la dureté ou semble mince, de grade 4 = entre les grades 3 et 5, et le grade 5 = extrêmement mince ou dur. - Niveau bavant en utilisant l'échelle suivante: grade 1 = none, grade 2 = dribble parfois la salive en position assise, grade 3 = un peu baver quand manger et boire, grade 4 = chaînes de bave quand manger ou de boire, et le grade 5 = bave continue.
- Niveau hypertrophie de la langue (macroglossie) en utilisant l'échelle suivante: grade 1 = none, grade 2 = légèrement agrandie, grade 3 = outsi prolongéede dentition, grade 4 = élargie et légèrement épaissi, et le grade 5 = élargie et épaissie.
- Niveau de de capacité du chien à avaler en utilisant l'échelle suivante: grade 1 = aucune difficulté, de grade 2 = prend du temps et d'efforts dans la prise de nourriture, de grade 3 = difficulté à prendre de la nourriture à partir d'une plaque, grade 4 = difficulté à mâcher, avaler, ou de boire et grade 5 = incapable de manger.
- Calculer teneur totale en additionnant les scores de chaque catégorie (sauf pour le test de roulage de 15 m) 55.
Note: Les études devraient être aveuglés afin de ne pas introduire de biais.
6. imagerie par résonance magnétique (IRM),
- Utilisez un 3 Tesla (3T) IRM et 18 cm de diamètre / 18 cm de longueur bobine d'extrémité humaine pour obtenir des images pondérées en T2 de membres postérieurs.
- Anesthésier les animaux par injection chiens CXMD avec 20 mg / kg de thiopental. Utilisez vétérinaire pommade sur les yeux pour éviter les yeux de se dessécher. Utilisez 2-3% inhalation isoflurane pour maintenir l'anesthésie générale.
- Vérifiez les réflexes musculaires et surveiller le rythme cardiaque et la respiration pour évaluer la profondeur de l'anesthésie. Le taux normal de la respiration (RR), la fréquence cardiaque (HR) et SpO 2 sous anesthésie générale sont les suivants: RR: 10 - 20 respirations / min, SpO 2: 95 - 100%, HR: 80 - 120 battements par minute (bpm ).
- Utilisez les paramètres suivants pour obtenir T2 images: TR / TE = 4000/85 msec, épaisseur de coupe = 6 mm, tranche gap = 0 mm, champ de vision = 18 cm x 18 cm, taille de la matrice = 256 x 256, et nombre d'acquisitions = 3 au cours d' écho de spin rapide (Figure 4).
7. Muscle Échantillonnage et préparation (nécropsie)
Remarque: Les muscles doivent être échantillonnés une ou deux semaines après la dernière injection AON.
- Injecter chiens avec 20 mg / kg de thiopental sodique pour les anesthésier. Utilisez vétérinaire pommade sur les yeux pendant l'anesthésie pour éviter le dessèchement des yeux.
- Utilisez 2 - 3% inhalation isoflurane pour maintenir anessie. Vérifiez les réflexes musculaires et surveiller le rythme cardiaque et la respiration pour évaluer la profondeur de l'anesthésie. Le taux normal de la respiration (RR), la fréquence cardiaque (HR) et SpO 2 sous anesthésie générale sont les suivants: RR: 10 - 20 respirations / min; SpO 2: 95 - 100%, HR: 80 - 120 bpm.
- Euthanasier chiens par exsanguination sous anesthésie générale (pour la nécropsie seulement). Utilisez exsanguination sous anesthésie générale profonde pour éviter les effets causés par des facteurs dérivés du sang dans l'analyse moléculaire (par exemple, les muscles cardiaques).
- Disséquer les muscles suivants (figure 5): CT, extensor digitorum longus (EDL), femoris gastrocnémien, soléaire, biceps fémoral, rectus, biceps brachial, triceps brachial, deltoïdes, ECU, extenseur radial du carpe (ECR), fléchisseur ulnaire du carpe (FCU ), palmaire (RTCE), gracile, intercostal, muscles abdominaux, le diaphragme, dorsi latéral, de l'œsophage, sternocléidomastoïdien, et le cœur. Pour examiner la toxicité, de recueillir les reins et liéchantillons ver. Utilisez Evans et Alexander de Lahunta (2009) comme une référence pour la technique de dissection 56.
- Couper le CT, EDL, gastrocnémien, soléaire, biceps fémoral, droit fémoral, biceps brachial, triceps brachial, deltoïde, ECU, ECR, FCU, RTCE, gracile, intercostal, muscles abdominaux, dorsaux latérale, de l'œsophage, sternocleidomastoid, coeur, rein, et dans le foie en petites sections d'environ 1 à 1,5 cm de longueur. Rouler la membrane et puis le couper en 1 - 1,5 cm 56 sections.
- Placer la gomme adragante de sorte qu'il est d'environ 0,5 - 1 cm d'épaisseur sur des disques en liège. Les disques d'étiquettes d'identification indiquant le nom du muscle de l'animal sur le côté opposé de la gomme adragante.
- Placer les muscles avec leur axe longitudinal perpendiculaire au liège dans la gomme adragante.
- Placer les bouchons dans un récipient d'isopentane qui est assis dans l'azote liquide. Déplacez-constamment avec des pincettes pendant 1 minute ou jusqu'à ce que complètement gelé. muscles du magasin sur les bouchonsdans des flacons à -80 ° C. Lors du transport, mettre les flacons sur glace sèche.
- Préparer des lames de verre marquées avec l'identification des animaux / nom et la date musculaire.
- Dans un cryostat refroidi à -25 ° C, fixer le bouchon sur le support. Régler l'épaisseur de coupe au niveau souhaité. Utilisez 8 pm pour l'immunohistochimie et 12 um pour hématoxyline et l'éosine (HE) coloration. Utilisez 15 um pour les échantillons de Western blot. Coupez environ un quart du muscle pour obtenir un muscle plat pour le prélèvement musculaire approprié.
- Couper une section du muscle à la fois, placez chaque section 6 e sur la même lame de verre si vous prévoyez d'utiliser des échantillons pour l' immunohistochimie ou coloration HE. Si vous utilisez des échantillons pour Western blots, mettre 30 - 40 sections dans un tube et conserver à -80 ° C.
- Après la préparation de diapositives, laissez diapositives sécher pendant 1,5 heure à température ambiante. Magasin glisse à -80 ° C.
8. immunohistochimie
- Retirer les lames préparées à partir de stockage et de les placer dansune chambre d'humidité pour garder les lames séparées et maintenir l'humidité. Remplir la chambre d'humidité, de sorte que le fond est juste recouverte d'eau (environ 1 mm d'eau).
- Sécher à l'air pendant 0,5 heure. Dessinez un carré entourant l'échantillon de muscle sur la diapositive à l'aide d'un stylo à barrière hydrophobe.
- Ajouter du sérum de chèvre à 15% dans du tampon phosphate salin (PBS) et incuber pendant 2 heures à température ambiante dans un réactif de blocage.
- Ajouter domaine anti-dystrophine tige (DYS-1) souris anticorps primaire monoclonal, ou un anticorps monoclonal C-terminal (DYS-2) pour chien dystrophine coloration (1: 150 dilution). Diluer à l'aide d'un agent bloquant dans 1,25 ml de PBS. Incuber O / N dans un réfrigérateur à 4 ° C.
- Laver avec du PBS pendant 5 min, répétée trois fois. Ajouter un anticorps secondaire Alexa anticorps 594 de chèvre contre IgG1 de souris (pour DYS-2) ou IgG2 (pour DYS-1) (1: 2500). Diluer avec un réactif de blocage dans du PBS contenant 0,1% éthoxylate d'octylphénol. Incuber pendant 0,5 heure à température ambiante.
- Laver avec du PBS pendant 5 min, trois times. Laisser lame sécher. Ajouter 1 - 2 gouttes (3 ng / ml) de 4 ', 6-diamidino-2-phénylindole (DAPI), la solution de montage. En utilisant des pinces, placez un feuillet de verre au-dessus des sections, en évitant les bulles.
- Voir dystrophin- (DYS-1 / DYS-2) des fibres positives sous un microscope à fluorescence à 594 nm à un grossissement de 20x.
9. Western blot
- Ajouter sections musculaires collectées à partir de cryo-sectionnant à 150 pi de tampon d'échantillon sur la glace.
- L'utilisation d'un homogénéisateur à main, homogénéiser brièvement les échantillons de protéines. Des échantillons de la chaleur dans un tube de 1,5 ml dans un incubateur à bloc chauffant à 95 ° C pendant 3 à 5 min. Centrifuger à 16 500 x g pendant 15 minutes et recueillir le surnageant.
- aliquotes de magasins du surnageant à -70 ° C. Utiliser de l'eau distillée pour diluer à 100x.
- Déterminer la concentration en protéine à l'aide d'un kit commercial en suivant le protocole du fabricant. Ajouter un tampon Laemmli SDS-chargement 2x à des échantillons et de la chaleur pendant 3 min &# 160; à 95 ° C.
- Charger les échantillons dans 3-8% de gel Tris-acétate avant de l' exécuter pendant 3 heures à 150 V. Inclure plusieurs échantillons de type sauvage dilué (WT) (par exemple, 1%, 10% et 50%) pour la quantification. Moins de 1% des niveaux de dystrophine WT doivent être détectés par cette méthode.
- Placer le gel dans un tampon de cathode pendant 20 min. Pendant ce temps, prendre neuf morceaux de papier filtre et les mettre dans les tampons de transfert (3 papiers dans le tampon de cathode [de +], le tampon d'anode ([-], et le tampon d'anode concentré [-], respectivement) Ce. décrit un procédé semi-sec transfert qui augmente la sensibilité (figure 6).
- Faire tremper une membrane de PVDF dans du methanol pendant 20 secondes, puis placer dans le tampon d'anode.
Mettre en place le gel avec la membrane pour le transfert semi-sec et lui permettre de fonctionner 1,5 h à 400 mA en RT ou dans une chambre froide. - Laver la membrane avec du PBS. Incuber la membrane dans un mélange de PBS avec du Tween 20 (PBST) et 5% de lait en poudre pendant 2 heures.
- Diluer DYS-1 (anticorps primaire) dans PBST et on mélange le lait en poudre 5% à une dilution de 1: 100. Ajouter à la membrane et laisser incuber pendant au moins 1 h. Laver trois fois avec 100 ml de PBST pendant 15 minutes chacun.
- Ajouter 65 pl / voie de HRP anticorps secondaire conjugué (anti-souris IgG2a pour DYS1) à 1: 5000 dilution pendant 1 heure à température ambiante dans un endroit sombre. Puis, lavez à trois reprises avec 200 ml de PBST pendant 20 min. Mélanger des solutions à partir d'un kit de détection comme indiqué. Incuber pendant 1 min.
- Développer le film pour détecter des bandes et d' analyser avec le logiciel ImageJ 48,57,58.
Résultats
Des expériences in vitro
Les myoblastes ont été transfectées avec diverses conditions de traitement des 2'OMePS afin de comparer l'efficacité de chaque AON. traitements AON simples avec 600 nM chacune des Ex6A, Ex6B, Ex8A ou Ex8B ont été réalisées, ainsi qu'un traitement de cocktail avec 600 nM chacune des 4 séquences AON. Des échantillons d'ARN ont été prélevés quatre jours après la transfection. Après la RT-PCR, les échantillons pour chaque traitement ont été effectués sur un gel avec (NT) des échantillons non traités. Les bandes plus élevées sur le gel représentent out-of-frame produits DMD; ces bandes ont été observées chez NT, Ex8A et Ex8B myoblastes traités. Ex6A, Ex6B, Ex8A, et les myoblastes cocktail traités ont montré des produits en cadre. Le cocktail et Ex6A / B ont montré des produits 100% en cadre, tandis que Ex8A a montré que 30% des produits en cadre (figure 7). Pour confirmer le saut d'exon et la restauration desle cadre de lecture, le séquençage d'ADNc a été réalisée; les résultats indiquent que les exons 6-9 avaient en effet été ignorés (figure 7). L' immunohistochimie a montré que les chiens traités par AON avaient augmenté de fibres dystrophine positives par rapport aux échantillons NT (figure 8).
Des expériences in vivo
Pour comparer l'efficacité des différentes conditions de traitement AON, chiens CXMD (0,5 - 5 ans) ont été injectés une fois avec 1,2 mg Ex6A ou un cocktail de Ex6A, Ex6B et Ex8A à diverses doses. Deux semaines après l'injection, des échantillons de muscles ont été prélevés et colorés avec DYS-1 à comparer le nombre de fibres dystrophine positives. Tous les échantillons de cocktail-traités ont montré une expression accrue de la dystrophine par rapport aux échantillons NT. Fibres dystrophine positives augmentent avec AON dosage (figure 9). système Suiteinjection ic, de type sauvage (WT), NT, et CXMD échantillons de muscle cocktail traités ont été colorés avec DYS-1 (figure 10). chiens CXMD Cocktail traités ont montré une augmentation expression de la dystrophine par rapport aux chiens NT CXMD, tant en CT et des échantillons du muscle cardiaque. Cependant, le muscle squelettique AON-traitée (CT) a montré une expression beaucoup plus élevé de dystrophine par rapport au muscle cardiaque traitée. Un immunoblot comparant WT, NT, et divers muscles cocktail traités morpholino a conduit à la même conclusion. Il y avait aussi une large gamme d'expression de la dystrophine dans les échantillons de muscles squelettiques traités (figure 10). Hématoxyline et éosine (HE) ont révélé que la coloration traité CXMD les chiens ont montré une amélioration histopathologie, avec une diminution significative des fibres au centre nucléés (CNF) par rapport aux chiens NT CXMD (figure 11). Cela indique qu'il ya plus de dégénérescence / régénération survenant chez le chien NT, un signe de pathologie dystrophique musculaire. En outre, les chiens traités ont rapidementles temps et les scores améliorés en cours d'exécution sur l'échelle de notation clinique. Chiens CXMD traités ont montré de meilleurs scores que les chiens NT CXMD dans toutes les catégories (figure 12).
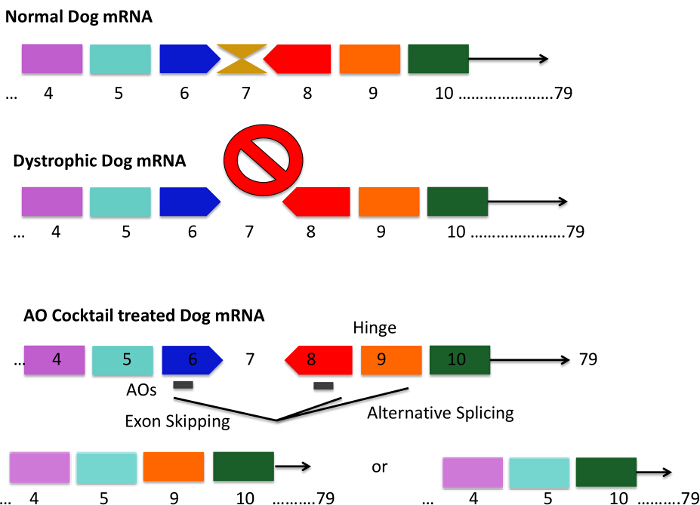
Figure 1. Mutation Motif du Chien CXMD et exons 6 -. 8 Stratégies Skipping Utilisation d' un cocktail antisens chiens CXMD ont une mutation ponctuelle dans l' exon 6 conduisant à une perte de l' exon 7 dystrophique chien ARNm. Il en résulte l'ARNm étant hors de trame et la production de protéine dystrophine est perdue. séquences AON courtes sont conçues pour se lier à l'exon 6 et 8, qui se traduit par épissage de l'ARNm sauter efficacement exons 6 - 8. La barre grise dans les chiens de cocktail traités AON représente de courtes séquences AON. Exon 9 code pour un domaine de charnière et est parfois spontanément épissé avec AONs contre exon 6 et 8. Les codes d'ARNm résultant de la dystrophine protéines qui sont plus courtes, mais la fonctional. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
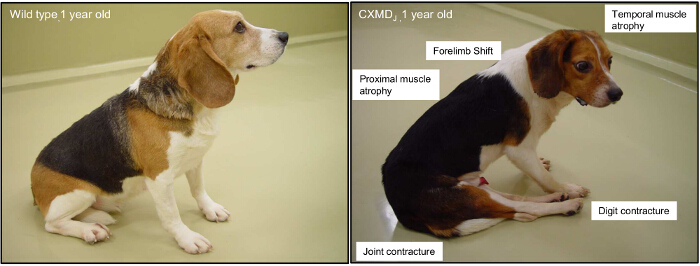
Figure 2. Les symptômes cliniques majeures d'un 1-year-old Canine X-linked Dystrophie musculaire (CXMD) des animaux. A 1-year-old beagle de type sauvage et un chien de CXMD sont présentés. L'implication des proximal, des membres et des muscles temporaux sont généralement observés à partir de 2 mois d'âge. Contracture commune et un déplacement du bassin sont manifestes à partir de 4 mois. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
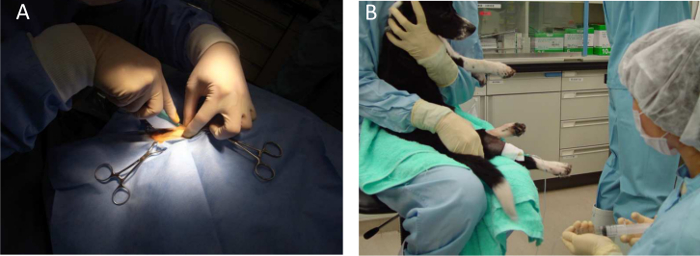
Figure 3. anesthésie générale pour un chien. A) Intramusculinjections ar et biopsies musculaires sont réalisées sous anesthésie générale avec de l'isoflurane. B) La tenue de l'animal pour des injections systémiques. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
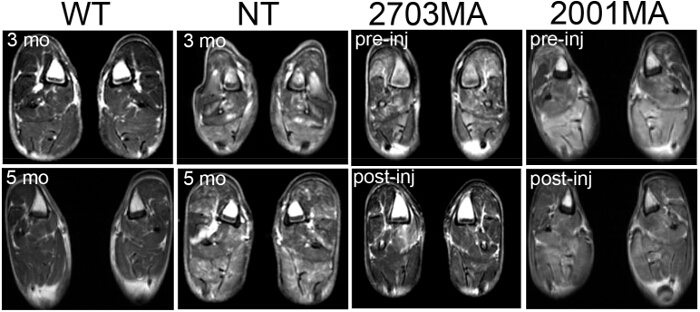
Figure 4. Imagerie par résonance magnétique (IRM) de type sauvage, non-traitée CXMD et traitée CXMD. IRM du membre postérieur à 3 mois et 5 mois dans WT et NT CXMD chiens. Deux exemples d'images de traités de derrière CXMD Limb IRM (1 semaine avant la première injection) et post-injection de AON sont présentés. 2703MA a été traité par semaine 7x avec 200 mg / kg morpholinos cocktail. 2001MA a été traité avec 5 fois par semaine par injection intraveineuse de 120 mg / kg de cocktail morpholinos. Contrôle et chiens traités ont été appariés selon l'âge. Les chiens traités montrent une diminution des signaux T2. Les images sont adap ted avec la permission de Yokota et al. (copyright 2009, John Wiley & Sons) 40 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
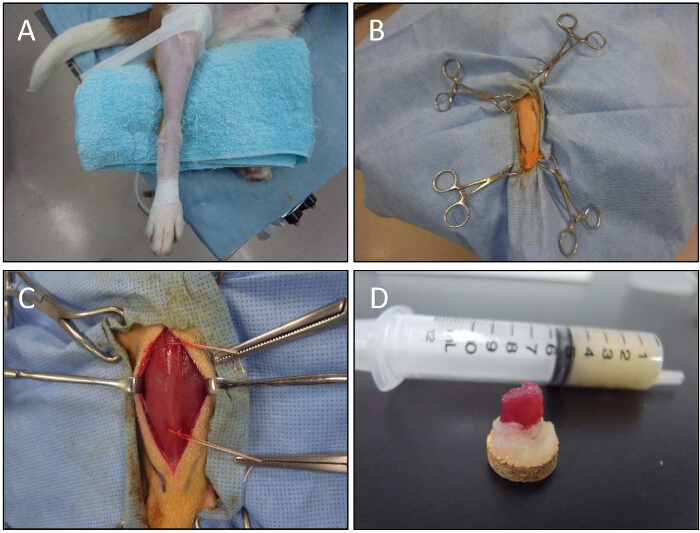
Figure 5. Muscle Biopsie pour un chien. A) Un membre inférieur est fixé pour la biopsie musculaire. B) Avec l'aide de pinces, le membre inférieur est maintenu. C) Le muscle CT est exposé. technique de biopsie ouverte est utilisée pour obtenir des échantillons de muscle de sites injectés. Les fils sont utilisés pour contenir des échantillons de biopsie. Échantillons D) Muscle sur la gomme adragante après dissection. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
/53776/53776fig6.jpg "/>
Figure 6. Méthode de transfert semi-sec. Une représentation de la méthode semi-sèche transfert pour Western blot est présentée. Trois papiers imbibés dans un tampon d'anode concentré sont fixées à la borne négative; 3 papiers imprégnés dans le tampon d'anode sont empilées au-dessus de ce produit. Le papier Mb PVDF est trempée dans un tampon d'anode méthanol, puis avant d'être mis au-dessus des 6 papiers. Le gel, qui a été trempée dans du tampon de cathode, est posé doucement sur le papier de PVDF. Enfin, 3 papiers imprégnés dans le tampon de cathode sont disposées au-dessus du gel. La borne positive est fixée sur le dessus. Pour 1 heure, 400 mA est géré par le système. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
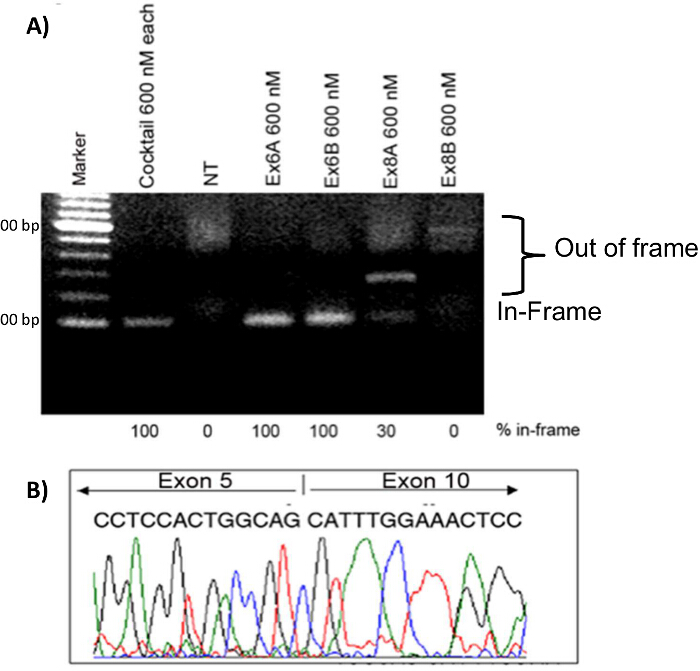
Figure 7. Exon Skipping dans CXMD myoblastes. myoblastes CXMD ont été transfectées avec Ex6A, Ex6B, Ex8A ou Ex8B seul, ou un cocktail de quatre. Un total de 600 nm a été utilisée pour les séquences individuelles et pour le cocktail 600 nM de chaque séquence a été utilisée. A) 2'OMePS traitement dans CXMD myoblastes de chien. Ex6A, Ex6B, et les échantillons de cocktail traités montrent des bandes fortes à la position attendue de transcrits en cadre exon-sautée. Ex8A montre une bande intermédiaire, Ex8B montre une bande faible, et NT ne montre pas une bande à la position dans le cadre. B) le séquençage de l'ADNc à partir Ex6A seul 4 jours après la transfection. Les images sont adaptés avec la permission de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Dystrop figure 8. Augmentationhin Expression dans 2'O-méthylés phosphorothioate (2'OMePS) transfectées CXMD myoblastes. myoblastes CXMD ont été transfectées avec Ex6A seul ou avec 2'OMePS cocktails. DYS-2 (rouge) et DAPI (bleu) coloration sont présentés. Les myoblastes traités sont comparés au type sauvage (WT) et (NT) myoblastes non traités. Les images sont adaptés avec la permission de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Bar = 50 pm. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
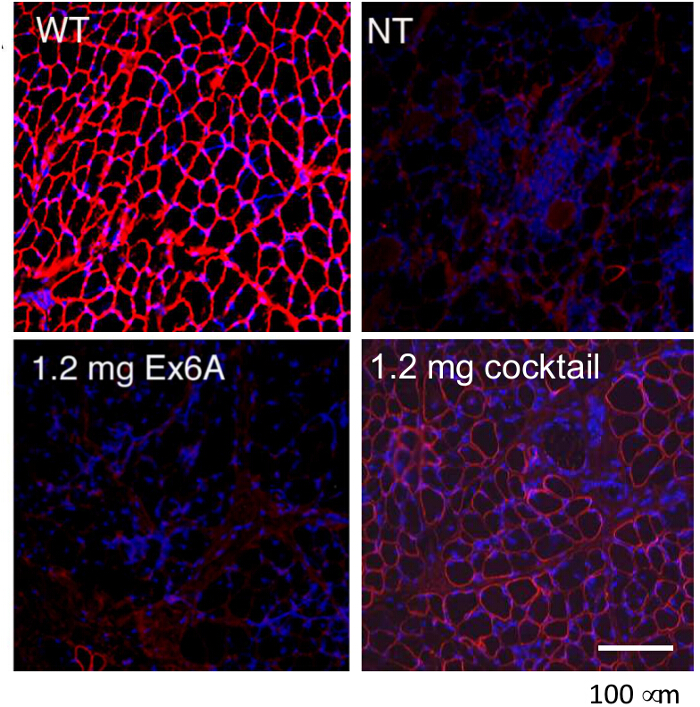
Figure 9. Expression de sauvetage de la dystrophine avec des injections intramusculaires Morpholinos dans CXMD chiens. Soit Ex6A seul ou un cocktail de Ex6A, Ex6B et Ex8A ont été injectés dans les muscles des chiens CT CXMD. Dystrophine (DSY-1) coloration de type sauvage(WT), non-traités (NT), et les chiens CXMD traités sont présentés. Les chiens ont été soit traités avec 1,2 mg Ex6A seul ou 1,2 mg cocktail. Les images sont adaptés avec la permission de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Bar = 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 10. Augmentation de la dystrophine Expression Après Cocktail systémique Traitement morpholino dans CXMD Chiens. Dystrophine (DYS-1) coloration a été utilisé pour comparer l' expression de la dystrophine dans le type sauvage (WT) (contrôle positif), non traité (NT) (contrôle négatif), et les chiens CXMD traités avec 120 mg / kg de cocktail morpholino (40 mg / kg de chaque AON). Le cocktail morpholino contenait Ex6A, Ex6B et Ex8A. Les chiens ont été injectés par voie intraveineuse 5 fois nousekly avec ce cocktail. A) Une comparaison de l'expression de la dystrophine dans tibial cranial (CT) muscles du WT, NT, et les chiens traités. B) Une comparaison de l'expression de la dystrophine dans le tissu cardiaque entre NT et morpholino chiens cocktail traité. C) Immunoblot pour dystrophine avec desmine comme un contrôle de chargement est indiqué pour WT, NT, et morpholino chiens cocktail traité. Les muscles suivants sont présentés pour les chiens traités: triceps brachial (TB), biceps brachial (BB), le diaphragme (DIA), de l'œsophage (ESO), CT, adductor (ADD), extensor digitorum longus (EDL), masséter (MAS), et le cœur. Les images sont adaptés avec la permission de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Bar = 200 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
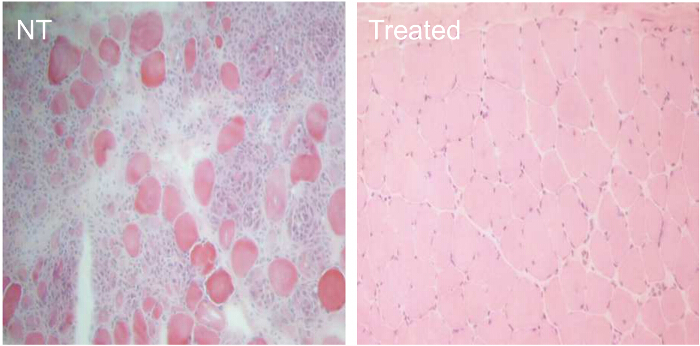
Figure11. Amélioration de l' histopathologie en CXMD chiens traités pendant 7 semaines avec 240 mg / kg morpholino Cocktail. Chiens CXMD allant d'une demi - année à l' âge de cinq ans ont été injectés par voie intraveineuse avec 240 mg / kg morpholino cocktail (Ex6A, Ex6B et Ex8A) une fois semaine pendant 7 semaines. Quatorze jours après la dernière injection, les muscles de l'œsophage ont été prises et hématoxyline et l'éosine (HE) coloration a été fait. HE coloration des muscles de l' œsophage de non-traités (NT) et morpholino cocktail traité (traité) chiens CXMD (40X objectif). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
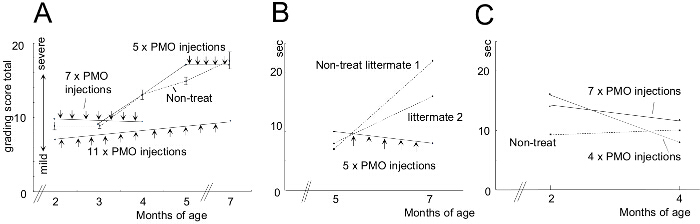
Figure 12. Scores amélioré classement clinique et 15 m Temps de marche Après les chiens Traitement morpholino. Morpholino-traités ont été comparés aux non-traités (NT) littermates. Les barres d'erreur dans le graphique indiquent SEM. A) Le score total sur l'examen de classement clinique a été calculé avant et après le traitement et les animaux traités ont été comparés avec les congénères NT. B) Une comparaison de 15 m temps de course de chiens traités et NT. C) similaires à B; Cependant, les jeunes chiens ont été utilisés. Les images sont adaptés avec la permission de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| oligonucléotide antisens | Nucleotide Sequence |
| Ex6A | GTTGATTGTCGGACCCAGCTCAGG |
| Ex6B | ACCTATGACTGTGGATGAGAGCGTT |
| Ex8A | CTTCCTGGATGGCTTCAATGCTCAC |
Tableau 1. Conception Oligonucléotide anti - sens.
Discussion
Le saut d'exon thérapeutique est une technique prometteuse pour le traitement de la DMD. In vitro et in vivo ont montré que le multi-saut d' exon est réalisable. Ici, l'utilisation du modèle de chien CXMD est discuté. Tout d' abord, AON ont été conçus à l' aide des programmes de sauvetage-ESE et ESEfinder pour cibler les exons de la dystrophine 6 - 8. La composition chimique 2'OMePS AON a été utilisée pour la transfection et CXMD myoblastes le squelette chimique morpholino AON a été choisi pour les expériences in vivo. vPMOs sont plus efficaces que les PMO non modifiés, mais en raison de leur toxicité plus élevée, ils ne sont pas appropriés pour les injections systémiques. extraction de l'ARN, une RT-PCR et séquençage d'ADNc ont été réalisées sur les myoblastes CXMD. Chiens injectés avec le cocktail PMO étaient cliniquement graduée pour évaluer toute amélioration des symptômes cliniques. Après les chiens ont été euthanasiés sans cruauté, des échantillons de muscles ont été prélevés et préparés pour cryo-tronçonnage. La demi-vie de la protéine dystrophine induite par unNRO est censé être environ 1 - 2 mois. chiens jeunes adultes ont été utilisés dans cette étude, bien que ces expériences peuvent être faites avec des chiens néonatales et les chiens âgés (> 5 ans). Sections musculaires préparées ont été utilisés pour évaluer l' histopathologie et évaluer protéine dystrophine sauvetage par Western blot et immunohistochimie 48.
Il est important de veiller à ce que le volume de la solution CPM est correcte avant les injections; à défaut de le faire aura des effets significatifs sur les résultats. Pendant les injections intramusculaires, une pression suffisante est nécessaire pour entrer dans les fibres musculaires. Surveillance de la santé et l'inspection du site de la chirurgie chien sont importants pour le dépannage. Pour surveiller la santé des animaux, des tests sanguins hebdomadaires et de pesage doivent être effectués. Après l'euthanasie de l'animal et la préparation des échantillons de muscle, une étape essentielle pour assurer la sensibilité dans la détection de la protéine dystrophine est d'utiliser à la fois le gel Tris-acétate et méthode de transfert semi-seclors de la procédure par Western Blot.
Comme on le voit dans les résultats représentatifs myoblastes traités avec Ex6A, Ex6B, Ex8A et le cocktail (contenant Ex6A, Ex6B, Ex8A et Ex8B) réalisé en cadre produits DMD. Depuis Ex8B produit aucun produit exon-sautée, il n'a pas été utilisé dans la suite des expériences in vivo. séquençage d'ADNc a montré que les exons 6-9 saut a eu lieu et immunocytochimie avec DYS-2 coloration a montré restauré l'expression de la dystrophine dans les échantillons traités. AON chiens traités ont montré une augmentation significative des fibres dystrophine positives. Cela indique que les exons 6-8 ont été ignorés et une protéine raccourcie a été produit. La quantité de fibres dystrophine positives augmenté quand un cocktail d'AON a été utilisé et est proportionnelle à la dose AON. Immunotransferts a montré une expression de la dystrophine a augmenté chez les chiens systémiques morpholino traités. Le muscle squelettique a des niveaux variables de fibres dystrophine; Cependant, le tissu cardiaque morpholino traité a montré peul'amélioration de l'expression de la dystrophine. Etant donné que la dystrophine présente un poids moléculaire élevé (427 kDa), la détection de faibles quantités de la dystrophine peut être difficile. Pour les meilleurs résultats, gel Tris-acétate et la méthode de transfert semi-sec ont été utilisés. HE coloration a montré l'amélioration de l'histopathologie chez les chiens morpholino-traités. fibres centre-nucléés (CNFS) sont un signe de muscle malsain et représentent des cycles de dégénérescence musculaire et la régénération. chiens CXMD morpholino-traités ont montré une diminution du pourcentage de CNF par rapport aux chiens CXMD non traités. classement clinique a révélé une amélioration des symptômes, tels que l'augmentation marche et la capacité en cours d'exécution, chez les animaux morpholino traités. La dureté des muscles est censé refléter l' atrophie musculaire, donc, il a été inclus dans le système de classement 59. La dureté de la cuisse (membres postérieurs) muscles a été évaluée; cependant, nous avons exclu les muscles sartorius crâniens parce qu'ils ont tendance à présenter une hypertrophie plutôt que dans l'atrophie CXMD. Les chiens traités montrented scores de classement inférieurs et avait fois plus rapide sur le test de roulage de 15 m. Amélioration fois sur le test de 15 m sont indicatifs de l' amélioration de la fonction musculaire 40. scores de classement globaux plus élevés indiquent une mauvaise santé et une augmentation de l'atrophie musculaire.
Bien que ces résultats sont prometteurs, multi-exon skipping présente encore de nombreux défis qui devront être surmontés avant que la technique a une applicabilité clinique. tissu cardiaque affiche toujours l'absorption réduite de AON, probablement en raison de la différence dans le trafic cellulaire entre le tissu cardiaque et squelettique. Aucun effet toxique n'a été observé chez les animaux de moins de posologies en cours; Cependant, plus de travail doit être fait pour évaluer la toxicité à long terme avant l'utilisation de cocktails AON peut se déplacer à des essais cliniques. Il est difficile d'obtenir l'approbation de médicaments AON cocktail parce que les organismes de réglementation définissent chaque séquence AON comme un médicament unique. Cela signifie que chaque séquence dans un cocktail devra être testé individuellement pour safety, ce qui nécessite plus de temps et plus d'argent. Un autre obstacle à l'utilisation de la multi-saut d'exon dans un environnement clinique est une grande quantité de produits protéiques produits intermédiaires avec des fonctions inconnues. Ces protéines peuvent potentiellement conduire à des effets secondaires imprévisibles, en fonction de la mutation individuelle 22. En outre, les profils de mutation disponibles dans les modèles actuels de chien dystrophiques sont limitées. Il existe peu de mutations naturelles, et non pas toutes les mutations sont utiles pour étudier plusieurs saut d'exon. Le modèle dystrophique de porc promet d'être une bonne alternative pour l' avenir DMD saut d' exon études 33, 34.
Les modèles de chiens DMD présentent certains avantages par rapport aux autres modèles de DMD. Être un plus grand modèle animal, le classement clinique et l'IRM sont possibles, ce qui permet une analyse plus détaillée. Puisque les chiens sont de grands animaux, ils sont également plus adapté pour les études toxicologiques et représentent plus étroitement la maladie humaine par rapport au modèle de la souris. Chien modèles ont aussi des séquences de gènes DMD qui sont plus semblables aux humains 23, 34, 45.
Bien que techniquement difficile, l'approche de saut multi-exon pourrait finalement bénéficier> 90% des patients atteints de DMD 24. Cela en fait une bien meilleure alternative à un seul saut d'exon, comme un seul saut d'exon est applicable uniquement à un petit sous-ensemble de patients. En outre, multi-exon skipping nous permettra de sélectionner les motifs de suppression qui optimisent la fonctionnalité des protéines de la dystrophine raccourcie. Par exemple, la suppression de la DMD exons 45 - 55 est associée à des symptômes exceptionnellement doux ou individus asymptomatiques 14,19,60-63. Le saut multi-exon des exons 45 - 55 a déjà été démontré dans un modèle de souris de la DMD avec un exon 52 délétion (mdx52) en utilisant des injections systémiques de vPMOs 22,26. L'utilisation de cocktails vPMOs a également été démontrée dans d'autres formes de dystrophie musculaire,comme Fukuyama dystrophie musculaire congénitale (FCMD). FCMD est provoquée par le piégeage d'exon, dans lequel l'épissage aberrant est provoquée par l'insertion de rétrotransposon. vPMOs ont été montrés pour délivrer le motif d'épissage dans les deux un modèle de souris FCMD et dans des lignées cellulaires humaines 64. La nouvelle génération AON chimies présentant une efficacité élevée et une toxicité plus faible faciliterait la traduction effective de l'approche de saut multi-exon dans l'application clinique. En outre, multi-saut d' exon pourrait être appliquée à d' autres troubles génétiques, tels que la dysferlinopathies 24, 65.
Déclarations de divulgation
Open access fees for this article were provided by, Gene Tools, LLC.
Remerciements
This work was supported by The University of Alberta Faculty of Medicine and Dentistry, The Friends of Garrett Cumming Research Chair Fund, HM Toupin Neurological Science Research Chair Fund, Muscular Dystrophy Canada, Canada Foundation for Innovation (CFI), Alberta Advanced Education and Technology (AET), Canadian Institutes of Health Research (CIHR), Jesse's Journey - The Foundation for Gene and Cell Therapy, and the Women and Children's Health Research Institute (WCHRI).
matériels
| Name | Company | Catalog Number | Comments |
| 2'OMePS Transfection of Dog Myoblasts | |||
| 3 ml 6-well plates | IWAKI | 5816-006 | |
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 11965-092 | |
| Fetal bovine serum (FBS) | HyClone | SH30071.01 | |
| Penicillin | Sigma-Aldrich | P4333 | 200 U/ml |
| Lipofectin | Invitrogen | 18292-011 | Total volume of 100 ml in opti-MEM media at a ratio of 2:1 for lipofectin. 10 ml lipofectin for 5 mg RNA. |
| 2’OMePS | Eurogentec | Ex6A (GUU GAUUGUCGGACCCAGCUCAGG), Ex6B (ACCUAUGA CUGUGGAUGAGAGCGUU), and Ex8A (CUUCCUGG AUGGCUUCAAUGCUCAC). | |
| Horse Serum | Gibco | 16050-114 | 2% |
| streptomycin | Sigma-Aldrich | P4333 | 200 μg/ml |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418 | |
| Insulin | |||
| Morpholino transfection of dog myoblasts All material from MePS Transfection of Dog Myoblasts for culturing | |||
| Antisense morpholinos | Gene-tools | Ex6A(GTTGATTGTCGGACCCAGC TCAGG), Ex6B(ACCTATGACTGTGGATGAG AGCGTT), Ex8A(CTTCCTGGATGGCTTCAAT GCTCAC) Dilute to a final volume of 100 L in opti-MEM media. 120–200 mg/kg of morpholinos at 32 mg/ml in saline | |
| Endo-Porter | Gene-tools | ||
| guanidinium thiocyanate-phenol-chloroform | Invitrogen | 15596-018 | 1 ml/plate |
| RNA Extraction and Reverse Transcription Polymerase Chain Reaction (RT-PCR) | |||
| guanidinium thiocyanate-phenol-chloroform | Invitrogen | 15596-018 | 1 ml/plate |
| Chloroform | Sigma-Aldrich | P3803 | 200 μl |
| 1.5 ml Tubes | Eppendorf | 22363204 | |
| Centrifuge | Beckman-Coulter | ||
| 75% Ethanol | Sigma-Aldrich | 34852 | |
| UV Spectrometer | |||
| Forward primer in exon 5 | Invitrogen | CTGACTCTTGGTTTGATTTGGA 1.5 μl 10 μM | |
| Reverse primer in exon 10 | Invitrogen | TGCTTCGGTCTCTGTCAATG 1.5 μl 10 μM | |
| dNTPs | Clontech | 3040 | |
| One-Step RT-PCR kit | Qiagen | 210210 | |
| Thermo-cycler | Scinco | ||
| Complementary DNA (cDNA) Sequencing | |||
| Gel extraction kit | Qiagen | 28704 | |
| Centrifuge | |||
| Terminator v3.1 Cycle Sequencing Kit | Applied Biosystems | 4337454 | |
| Intramuscular injections or open muscle biopsy | |||
| Surgical Tools | Scissors, scalpel, needle, surgical thread | ||
| Vet Ointment | |||
| Iodophors | webtextiles | 12190-71-5 | |
| chlorohexidine | Peridex | 12134 | |
| Surgical Drapes | |||
| Scrubs | |||
| Facial Mask | |||
| Surgical Gloves | |||
| Head Covering | |||
| Thiopental sodium | Mitsubishi Tanabe Pharma | 20 mg/kg | |
| Isoflurane | Abbott laboratories | 05260-05 | 2-3% |
| Antisense morpholinos | Gene-tools | Ex6A(GTTGATTGTCGGACCCAGC TCAGG), Ex6B(ACCTATGACTGTGGATGAG AGCGTT), Ex8A(CTTCCTGGATGGCTTCAAT GCTCAC) Dilute to a final volume of 100 L in opti-MEM media. 120–200 mg/kg of morpholinos at 32 mg/ml in saline | |
| 27 G Needles | TERUMO | SG3-2325 | |
| 50 ml syringe | TERUMO | SG2-03L2225 | |
| buprenorphine hydrochloride | |||
| Tongue Depressor | |||
| cephalexin | 15 to 30 mg/kg | ||
| cefazolin | 15 to 30 mg/kg | ||
| buprenorphine | 0.01 mg/kg | ||
| buprenorphine hydrochloride | 0.02 mg/kg | ||
| Systemic Injections | |||
| Syringe infusion pump | Muromachi | ||
| 22 G Indwelling needles | TERUMO | SG3-2225 | |
| 27 G Needles | TERUMO | SG3-2325 | |
| 50 ml syringe | TERUMO | SG2-03L2225 | |
| Saline | Ohtsuka-Pharmaceutical | 28372 | |
| Clinical Grading of Dogs | |||
| Video Camera | |||
| Stop watch | |||
| Magnetic resonance imaging (MRI) | |||
| 3 Tesla MRI l | |||
| 18 cm diameter/18 cm length human extremity coil | |||
| Muscle sampling and preparation (necropsy) | |||
| Thiopental sodium | Mitsubishi Tanabe Pharma | 20 mg/kg | |
| Isoflurane | Abbott laboratories | 05260-05 | 2-3% |
| Tragacanth gum | 10-20 ml | ||
| Liquid Nitrogen | |||
| Cork Discs | Iwai-kagaku | 101412-806 | |
| Dry Ice | |||
| Tweezers | |||
| Poly-L-lysine–coated slides | Fisher | 22-037-216 | |
| Cryostat Microsystem | Leica | cm1900 | |
| Immunohistochemistry | |||
| DYS1 | Novocastra | NCL-DYS1 | 1:150 dilutions |
| DYS2 | Novocastra | NCL-DYS2 | 1:150 dilutions |
| Alexa 594 goat antimouse IgG1 | Invitrogen | A-21125 | 1:2,500 dilutions |
| Alexa 594 goat antimouse IgG2 | Invitrogen | A-11005 | 1:2,500 dilutions |
| DAPI | Invitrogen | D1306 | Contains mounting agent |
| Goat Serum | Invitrogen | 10000C | 15% |
| PBS | |||
| Moisture chamber | Scientific Devise Laboratory | 197-BL | |
| Chamber slide | Lab-tek | 154453 | |
| Cover Glasses | Fisher | 12-540A | |
| Hydrophobic barrier pen | |||
| Fluorescent microscope | 594 nm at 20X magnification. | ||
| Western Blotting | |||
| Distillied Water | |||
| Hand Homogenizer | |||
| 2× Laemmli SDS-loading buffer | 0.1 M Tris–HCl (pH 6.6), 2% (w/v) SDS, 2% (0.28 M) beta-mercaptoethanol, 20% glycerol, 0.01% bromophenol blue | ||
| SDS gels | Bio-Rad | 161-1210 | 5% resolving |
| SDS gels | Invitrogen | Invitrogen, WG1601BOX | 3-8% |
| PVDF membrane | GE | 10600021 | |
| Methanol | |||
| Running buffer (10×) | 250 mM of Tris-Base, 1,920 mM of Glycine | ||
| Running buffer (1×) | 10% 10× buffer, 20% methanol | ||
| 0.05% PBS/Tween 20 (PBST) | 2,000 ml 3× 200 ml for washing | ||
| PBST/5% milk powder | 100 ml | ||
| Protein Assay Kit | BCA | T9650 | |
| Tween 20 | Sigma | P5927 | |
| Urea | Sigma | U5378 | |
| Beta Mercaptoethanol | Millipore | ES-007-E | |
| SDS | Sigma | L3771 | |
| Tris-Acetate | Sigma | ||
| Tris HCl | Sigma | T3253 | |
| Glycerol | Sigma | G8773 | |
| Loading/sample buffer for Western blotting | NuPage Invitrogen | NP007 | |
| NaCl | Sigma | S3014 | |
| PMSF | Sigma | P7626 | |
| Protease cocktail inhibitor | Roche | 11836153001 | |
| Cathode Buffer | 0.025 M Tris base + 40 mM 6-aminocaproic acid + 20% Methanol | ||
| Anode Buffer | 0.03 M Tris Base + 20% Methanol | ||
| Concentred Anode Buffer | 0.3 M Tris base + 20% Methanol | ||
| desmin antibody | Abcam | ab8592 | |
| DYS1 | Novocastra | NCL-DYS1 | 1:150 dilutions |
| ImageJ Software | |||
Références
- Duchenne, A. The Pathology of Paralysis with Muscular Degeneration (Paralysie Myosclerotique), or Paralysis with Apparent Hypertrophy. Br Med J. 14 (2), 541-542 (1867).
- Zellweger, H., Antonik, A. Newborn screening for Duchenne muscular dystrophy. Pediatrics. 55 (1), 30-34 (1975).
- Echigoya, Y., Yokota, T. Skipping multiple exons of dystrophin transcripts using cocktail antisense oligonucleotides. Nucleic Acid Ther. 24, 57-68 (2014).
- Bushby, R. F., Birnkrant, D. J., et al. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and pharmacological and psychosocial management. The Lancet Neurology. 9 (1), 77-93 (2010).
- Eagle, M., Baudouin, S. V., Chandler, C., Giddings, D. R., Bullock, R., Bushby, K. Survival in Duchenne muscular dystrophy: improvements in life expectancy since 1967 and the impact of home nocturnal ventilation. Neuromuscul. Disord. 12 (10), 926-929 (2002).
- Heald, A., Anderson, L. V., Bushby, K. M., Shaw, P. J. Becker muscular dystrophy with onset after 60 years. Neurology. 44 (12), 2388-2390 (1994).
- Stöllberger, C., Finsterer, J. Worsening of heart failure in Becker muscular dystrophy after non-steroidal anti-inflammatory drugs. Med. J. 98 (4), 478-480 (2005).
- Passamano, L., et al. Improvement of survival in Duchenne Muscular Dystrophy: retrospective analysis of 835 patients. Acta Myol. 31 (2), 121-125 (2012).
- Hoffman, E. P., Brown, R. H., Kunkel, L. M. Dystrophin: the protein product of the Duchenne muscular dystrophy locus. Cell. 51 (6), 919-928 (1987).
- Koenig, M., et al. Complete cloning of the Duchenne muscular dystrophy (DMD) cDNA and preliminary genomic organization of the DMD gene in normal and affected individuals. Cell. 50 (3), 509-517 (1987).
- Takeshima, Y., et al. Mutation spectrum of the dystrophin gene in 442 Duchenne/Becker muscular dystrophy cases from one Japanese referral. JHG. 55 (6), 379-388 (2010).
- White, S. J., et al. Duplications in the DMD gene. Hum. Mutat. 27, 938-945 (2006).
- Yokota, T., Duddy, W., Echigoya, Y., Kolski, H. Exon skipping for nonsense mutations in Duchenne muscular dystrophy: too many mutations, too few patients. Expert Opin. Biol. Ther. 12 (9), 1141-1152 (2012).
- Yokota, T., Duddy, W., Partridge, T. Optimizing exon skipping therapies for DMD. Acta Myol. 26 (3), 179-184 (2007).
- Magri, F., et al. Genotype and phenotype characterization in a large dystrophinopathic cohort with extended follow-up. J Neurol. 258 (9), 1610-1623 (2011).
- Yoshida, H. H., Ishikawa-Sakurai, M. Biochemical evidence for association of dystrobrevin with the sarcoglycan- sarcospan complex as a basis for understanding sarcogly- canopathy. Hum. Mol. Genet. 9 (7), 1033-1040 (2000).
- Bies, R. D., Caskey, C. T., Fenwick, R. An intact cysteine-rich domain is required for dystrophin function. J. Clin. Invest. 90 (2), 666-672 (1992).
- Monaco, A. P., Bertelson, C. J., Liechti-Gallati, S., Moser, H., Kunkel, L. M. An explanation for the phenotypic differences between patients bearing partial deletions of the DMD locus. Genomics. 2 (1), 90-95 (1988).
- Aoki, Y., Yokota, T., Wood, M. J. Development of multiexon skipping antisense oligonucleotide therapy for Duchenne muscular dystrophy. Biomed Res Int. 2013 (402369), (2013).
- Cirak, V. A. -. G., Guglieri, M., et al. Exon skipping and dystrophin restoration in patients with Duchenne muscular dystrophy after systemic phosphorodiamidate morpholino oligomer treatment: an open-label, phase 2, dose-escalation study. The Lancet. 378 (9791), 595-605 (2011).
- Goemans, N. M., et al. Systemic administration of PRO051 in Duchenne's muscular dystrophy. N Engl J Med. 364 (16), 1513-1522 (2011).
- Echigoya, Y., et al. Long-term efficacy of systemic multiexon skipping targeting dystrophin exons 45-55 with a cocktail of vivo-morpholinos in mdx52 mice. Mol Ther Nucleic Acids. 4, (2015).
- Hoffman, E. P., et al. Restoring dystrophin expression in Duchenne muscular dystrophy muscle progress in exon skipping and stop codon read through. Am J Pathol. 179 (1), 12-22 (2011).
- Aartsma-Rus, A., et al. Antisense-induced multiexon skipping for Duchenne muscular dystrophy makes more sense. Am J Hum Genet. 74 (1), 83-92 (2004).
- Aartsma-Rus, A., Kaman, W. E., Weij, R., Tden Dunnen, J., van Ommen, G. J., van Deutekom, J. C. Exploring the frontiers of therapeutic exon skipping for Duchenne muscular dystrophy by double targeting within one or multiple exons. Mol. Ther. 14 (3), 401-407 (2006).
- Aoki, Y., et al. Bodywide skipping of exons 45-55 in dystrophic mdx52 mice by systemic antisense delivery. Proc Natl Acad Sci U S A. 109 (34), 13763-13768 (2012).
- McClorey, G., Iversen, P. L., Moulton , H. M., Fletcher, S., Wilton, S. D. Antisense oligonucleotide-induced exon skipping restores dystrophin expression in vitro in a canine model of DMD. Gene Ther. 13 (19), 1373-1381 (2006).
- Sharp, N. J., et al. An error in dystrophin mRNA processing in golden retriever muscular dystrophy, an animal homologue of Duchenne muscular dystrophy. Genomics. 13 (1), 115-121 (1992).
- Shimatsu, Y., et al. Canine X-linked muscular dystrophy in Japan (CXMDJ). Exp Anim. 52 (2), 93-97 (2003).
- Nguyen, F., Cherel, Y., Guigand, L., Goubault Leroux, I., Wyers, M. Muscle lesions associated with dystrophin deficiency in neonatal golden retriever puppies. J Comp Pathol. 126 (2-3), 100-108 (2002).
- Nakamura, A., Takeda, S. Mammalian models of Duchenne Muscular Dystrophy: pathological characteristics and therapeutic applications. J Biomed Biotechnol. 2011 (184393), (2011).
- Yokota, T., et al. A renaissance for anti-sense oligonucleotide drugs in neurology: Exon-skipping breaks new ground. Arch. Neurol. 66, 32-38 (2009).
- Aartsma-Rus, A., et al. Theoretic applicability of antisense-mediated exon skipping for Duchenne muscular dystrophy mutations. Hum. Mutat. 30 (3), 293-299 (2009).
- Yu, X., Bao, B., Echigoya, Y., Yokota, T. Dystrophin-deficient large animal models: translational research and exon skipping. Am. J. Transl. Res. 7 (8), 1214-1231 (2015).
- Yin, H., Moulton, H., Betts, C., Wood, M. CPP-directed oligonucleotide exon skipping in animal models of Duchenne muscular dystrophy. Methods Mol Biol. 683, 321-338 (2011).
- Moulton, H. M., Moulton, J. D. Morpholinos and their peptide conjugates: therapeutic promise and challenge for Duchenne muscular dystrophy. Biochim. Biophys. Acta. 1798 (12), 2296-2303 (2010).
- Morcos, P. A., Li, Y., Jiang, S. Vivo-Morpholinos: a non-peptide transporter delivers Morpholinos into a wide array of mouse tissues. BioTechniques. 45 (6), 613-614 (2008).
- Betts, C., et al. A New Generation of Peptide-oligonucleotide Conjugates With Improved Cardiac Exon Skipping Activity for DMD Treatment. Mol Ther Nucleic Acids. 14 (1), e38 (2012).
- Saito, T., et al. Antisense PMO found in dystrophic dog model was effective in cells from exon 7-deleted DMD patient. PLoS One. 5 (8), e12239 (2010).
- Yokota, T., et al. Efficacy of systemic morpholino exon-skipping in Duchenne dystrophy dogs. Ann Neurol. 65 (6), 667-676 (2009).
- Melacini, P., et al. Cardiac and respiratory involvement in advanced stage Duchenne muscular dystrophy. Neuromuscul. Disord. 6 (5), 367-376 (1996).
- Guncay, A., Yokota, T. Antisense oligonucleotide drugs for Duchenne muscular dystrophy: how far have we come and what does the future hold. Future Med. Chem. 7 (13), 1631-1635 (2015).
- Fairbrother, W. G., Yeh, R. F., Sharp, P. A., Burge, C. B. Predictive identification of exonic splicing enhancers in human genes. Science. 297, 1007-1013 (2002).
- Cartegni, L., Wang, J., Zhu, Z., Zhang, M. Q., Krainer, A. R. ESEfinder: A web resource to identify exonic splicing enhancers. Nucleic Acids Res. 31, 3568-3571 (2003).
- Yokota, T., Hoffman, E., Takeda, S. Antisense oligo-mediated multiple exon skipping in a dog model of duchenne muscular dystrophy. Methods Mol Biol. 709, 299-312 (2011).
- Jenuth, J. P. The NCBI. Publicly available tools and resources on the Web. Methods Mol Biol. 132, 301-312 (2000).
- Yokota, T., et al. Extensive and Prolonged Restoration of Dystrophin Expression with Vivo-Morpholino-Mediated Multiple Exon Skipping in Dystrophic Dogs. Nucleic Acid Ther. , (2012).
- Summerton, J. E. Endo-Porter: a novel reagent for safe, effective delivery of substances into cells. Ann. N. Y. Acad. Sci. 1058, 62-75 (2005).
- Mangram, A. J., et al. Guideline for Prevention of Surgical Site Infection. Am J Infect Control. 27, 97-134 (1999).
- Reichman, D. E., Greenberg, J. A. Reducing Surgical Site Infections. A Review . Rev Obstet Gynecol. 2, 212-221 (2009).
- Mizuno, H., Nakamura, A., Aoki, Y., Ito, N., Kishi, S., Yamamoto, K., Sekiguchi, M., Takeda, S., Hashido, K. Identification of muscle-specific microRNAs in serum of muscular dystrophy animal models: promising novel blood-based markers for muscular dystrophy. PloS one. 6, (2011).
- Shimatsu, Y., et al. Major clinical and histopathological characteristics of canine X-linked muscular dystrophy inJapan, CXMDJ. Acta Myol. , 145-154 (2005).
- Evans, H., de Lahunta, A. Guide to the Dissection of the Dog. SAUNDERS. , (2009).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41 (47), (2004).
- Bearer, E. L., et al. Overview of image analysis, image importing, and image processing using freeware. Current protocols in molecular biology. 14, (2003).
- Shimatsu, Y., et al. Major clinical and histopathological characteristics of canine X-linked muscular dystrophy inJapan, CXMDJ. Acta Myol. 24, 145-1454 (2005).
- Beroud, C., et al. Multiexon skipping leading to an artificial DMD protein lacking amino acids from exons 45 through 55 could rescue up to 63% of patients with Duchenne muscular dystrophy. Hum Mutat. 28, 196-202 (2007).
- Ferreiro, V., et al. Asymptomatic Becker muscular dystrophy in a family with a multiexon deletion. Muscle Nerve. 39, 239-243 (2009).
- Nakamura, A., et al. Follow-up of three patients with a large in-frame deletion of exons 45-55 in the Duchenne muscular dystrophy (DMD) gene. J Clin Neurosci. 15, 757-763 (2008).
- Yokota, T., Pistilli, E., Duddy, W., Nagaraju, K. Potential of oligonucleotide-mediated exon-skipping therapy for Duchenne muscular dystrophy. Expert Opin Biol Ther. 7, 831-842 (2007).
- Taniguchi-Ikeda, M., et al. Pathogenic exon-trapping by SVA retrotransposon and rescue in Fukuyama muscular dystrophy. Nature. 478, 127-131 (2011).
- Lee, J. J., Yokota, T. Antisense therapy in neurology. J Pers Med. 3, 144-176 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon